辐照红细胞输注对急性淋巴细胞白血病化学治疗患者血清IL-10、IL-6、TNF-α及IFN-γ的影响
王 坤,赵学涛,任晓亮,魏媛媛
辐照红细胞输注对急性淋巴细胞白血病化学治疗患者血清IL-10、IL-6、TNF-α及IFN-γ的影响
王 坤,赵学涛,任晓亮,魏媛媛
目的 观察急性淋巴细胞白血病(acute lymphoblastic leukemia, ALL)患者化学治疗(化疗)期间输注辐照红细胞对血清白细胞介素-10(IL-10)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)及干扰素-γ(IFN-γ)的影响。方法 收集2013年1月—2015年6月在河北医科大学第四医院血液科治疗的初治诱导缓解治疗阶段的ALL 60例,随机分为观察组和对照组,每组30例。两组均在常规化疗同时输注去白悬浮红细胞2单位,观察组给予经137Cs辐照去白悬浮红细胞,对照组给予未经辐照去白悬浮红细胞。输血前及输血后1、7 d检测比较两组血清IL-10、IL-6、TNF-α及IFN-γ水平。结果 观察组输血前后各观察指标比较差异均无统计学意义(P>0.05)。对照组输血后1、7 d IL-10、IL-6水平较输血前有显著上升(P<0.01);输血后1 d TNF-α水平较输血前显著下降(P<0. 01),输血后7 d恢复至输血前水平;输血后1、7 d IFN-γ水平较输血前明显下降(P<0.01)。观察组输血后1、7 d IL-10和IL-6水平均低于对照组相同时点,TNF-α和IFN-γ水平高于对照组相同时点,差异均有统计学意义(P<0.01)。结论 辐照红细胞输注对ALL患者免疫功能抑制较轻,有助于改善患者免疫调节能力,减少化疗相关并发症发生。
红细胞输注;γ射线;前体细胞淋巴母细胞白血病淋巴瘤;贫血
急性淋巴细胞白血病(acute lymphoblastic leukemia, ALL)是造血干细胞再分化过程中于某一阶段发生分化、阻滞、凋亡障碍的恶性增殖性疾病[1-2],由于其正常造血系统功能受到了抑制,常伴发贫血。ALL多采用化学治疗(化疗),化疗药物在抗肿瘤治疗期间亦会对正常细胞造成损伤,从而进一步加重贫血[3],因而红细胞输注成为本病重要的辅助治疗措施。有研究显示,输血能使机体抗肿瘤免疫系统主要为T淋巴细胞及某些细胞因子受到抑制,而应用γ射线照射血液制品可灭活血液中残存的少量具有免疫活性的淋巴细胞,避免其在受血者体内增殖,并对血细胞功能不产生影响[4-7]。本研究旨在观察ALL并贫血患者化疗期间输注辐照红细胞对患者免疫功能的影响,以期为辐照血临床应用提供理论依据。
1 资料与方法
1.1 一般资料 收集河北医科大学第四医院血液科2013年1月—2015年6月确诊的初治诱导缓解治疗阶段的ALL 60例,所有患者均经骨髓、免疫组织化学免疫染色及病理等检查确诊。所有患者均行常规化疗,化疗前有头晕、乏力及胸闷等贫血症状,查血红蛋白呈中度贫血。将60例采用随机数字表法随机分为观察组和对照组两组各30例。两组性别及年龄等一般资料比较差异均无统计学意义(P>0.05),见表1,具有可比性。
1.2 治疗方法 观察组在化疗同时输注经137Cs照射去白悬浮红细胞2单位,采用德国Biobem GM 2000辐照仪,辐照剂量为25 Gy,辐照时间12 min;对照组在化疗同时输注未经辐照去白悬浮红细胞2单位。血液制品均来源于河北省血液中心。
1.3 观察指标 2组均于输血前及输血后1、7 d采取外周静脉血2 ml,3500 r/min离心5 min后取上清液2 ml。采用酶联免疫吸附法(ELISA)测定血清白细胞介素-10(IL-10)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)及γ-干扰素(IFN-γ)含量,并对两组进行比较。检测试剂为深圳晶美生物公司产品,操作步骤按试剂说明书进行。
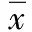
表1 化学治疗期间输注不同红细胞的急性淋巴细胞白血病2组一般资料比较(±s)
注:观察组为化学治疗期间输注辐照红细胞的急性淋巴细胞白血病患者,对照组为化学治疗期间输注未经辐照红细胞的急性淋巴细胞白血病患者
2 结果
输血前2组各观察指标比较差异无统计学意义(P>0.05)。观察组输血前后各观察指标比较差异亦无统计学意义(P>0.05)。对照组输血后1、7 d IL-10、IL-6水平较输血前有显著上升(P<0.01);输血后1 d TNF-α水平较输血前显著下降(P<0. 01),输血后7 d恢复至输血前水平;输血后1、7 d IFN-γ水平较输血前明显下降(P<0.01)。观察组输血后1、7 d IL-10和IL-6水平均低于对照组相同时点,TNF-α和IFN-γ水平高于对照组相同时点,差异均有统计学意义(P<0.01)。见表2。
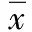
表2 化学治疗期间输注不同红细胞的急性淋巴细胞白血病2组输血前后各观察指标比较(±s,pg/L)
注:观察组为化学治疗期间输注辐照红细胞的急性淋巴细胞白血病患者,对照组为化学治疗期间输注未经辐照红细胞的急性淋巴细胞白血病患者;与本组输血前比较,bP<0.01;与对照组相同时点同一指标比较,dP<0.01
3 讨论
3.1 异体血输注对ALL患者免疫功能影响 尽管红细胞输注可缓解ALL患者贫血症状,但输血亦会给受血者带来免疫调节方面影响。近年肿瘤患者化疗期间输血受到较高重视,输血与免疫功能关系越来越引起关注。目前血液输注以成分输血为主,红细胞输注以去白悬浮红细胞为主,输注过滤掉白细胞的血液制品能极大降低受血者的致病风险[8]。去白悬浮红细胞液中淋巴细胞去除率为99.9%,但仍有一小部分淋巴细胞残存并对受血者的免疫反应起抑制作用[9]。既往研究经过临床试验及基础科学实验证实,异体血输注对研究对象免疫系统有着重要的影响,包括炎症反应及固有免疫失调,导致机体对微生物易感性增加及受血者细胞(T细胞及自然杀伤细胞)对肿瘤防御能力下调,并能引起癌症的复发及术后并发症的发生[10-11]。接受骨髓移植后患者在输注普通去白悬浮红细胞后并发症、细菌感染、移植物抗宿主反应均增加[12]。
血液制品引起免疫抑制机制比较复杂,输入去白悬浮红细胞后会引发IL-6、IL-10及TNF-α的释放,且降低脂多糖诱发TNF-α释放,并导致调节性T细胞(regulatory cell, Treg)活化[13]。Treg可以抑制抗肿瘤免疫反应,从而发挥促癌作用。正常人体内Treg细胞约占CD4+T细胞总量的5%~10%,CD4+T辅助细胞与高浓度白细胞介素-2(IL-2)受体共表达,阻断IL-2产生,并导致辅助性T淋巴细胞(Th)1功能障碍。非特异性抗原如脂多糖可激活Treg细胞,并使之活化,通过Toll样受体4信号通路使机体产生免疫抑制。除残存淋巴细胞以及生物活性细胞因子外,普通的去白悬浮红细胞液中还包含非极性脂肪酸、类花生酸、促炎性溶血磷脂酰胆碱等物质,这类物质可调整自然杀伤细胞(NK细胞)与T细胞活性,并起着NK细胞趋化因子的作用。NK细胞为正向免疫调节的淋巴样细胞,可杀伤肿瘤细胞[14-15]。IFN-γ可通过多种途径直接或间接增加NK及巨噬细胞的杀伤毒性[16],且供血者的免疫系统内包括IgE在内的免疫球蛋白抗体会随着血液进入受血者体内,IgE可与机体嗜碱粒细胞及肥大细胞等结合,并进一步引起相应的变态反应[17]。
同种异体血输入,受血者以Th2免疫应答为主,相应的Th1免疫应答进一步下调,进而受血者的细胞免疫受到抑制。输血可抑制Th1细胞增生,使Th1类细胞因子的合成下降,免疫活性被抑制[18]。INF-γ、TNF-α细胞因子由Th1细胞产生,介导抗肿瘤免疫反应。IL-10及IL-6细胞因子由Th2细胞产生,是一类具有多样活性的细胞因子,由淋巴细胞以及单核-巨噬细胞等产生,可进一步诱导B型淋巴细胞进行分化,进而参与机体的免疫应激过程[19],促进肿瘤生长。有研究显示,IL-10及IL-6细胞因子表达与组织损伤程度呈正相关,是组织损伤早期较为敏感的标志物,与临床继发的严重并发症密切相关[20]。本研究结果提示,对照组输注未经辐照的红细胞后,血清中IL-10及IL-6水平均有所上升,而抑制肿瘤生长的INF-γ及TNF-α水平有所下降。提示ALL患者化疗同时输注异体未辐照红细胞对机体抗肿瘤免疫反应可能产生负性调节作用。
3.2 辐照红细胞输注治疗原理 辐照红细胞是利用放射性同位素137Cs在衰变过程中产生的γ射线,穿透有核细胞,使细胞核产生不可逆的DNA损伤,并干预其正常修复,进而使淋巴细胞有丝分裂的活性丧失,停止增殖。γ射线辐照作用在瞬间发生,辐照后杀伤作用消失,血液成分并无放射活性,因此对受血体无任何放射杀伤作用。本研究中所用的辐照红细胞经γ射线照射,对血液中残存的淋巴细胞进行灭活,受血者不会对其产生进一步免疫排斥。本研究结果显示,观察组输血前后血清IL-10、IL-6、INF-γ及TNF-α水平无明显改变,说明辐照红细胞输注对ALL患者免疫功能影响较小。辐照血输注已在国外得到广泛应用,但在我国尚未得到普及。临床上对造血干细胞、实体器官移植以及恶性肿瘤、免疫缺陷、年龄偏大或幼小等体弱患者进行血液输注时均应考虑输注经辐照后的血液[21]。
总之,辐照红细胞输注对ALL患者免疫功能抑制较轻,有助于改善患者免疫调节能力,减少化疗相关并发症发生。
[1] Burkc M J, Bhatla T. Epigenetic modifications in pediatric acute lymphoblastic leukemia[J].Front Pediatr, 2014,14(2):42-45.
[2] Mullighan C G. Genomic characterization of childhood acute lymphoblastic leukemia[J].Semin Hematol, 2013,50(4):314-324.
[3] 姚蓓,张引亮,陈旭昕,等.参芪扶正注射液对急性淋巴细胞白血病化疗患者造血和免疫功能的影响[J].现代生物医学进展,2015,15(5):808-811.
[4] Benson D, Barnett C C Jr. Perioperative blood transfusions promote pancreas cancer progression[J].J Surg Res, 2011,166(2):275-279.
[5] Shiba H, Ishida Y, Wakiyama S,etal. Negative impact of blood transfusion on recurrence and prognosis of hepatocellular carcinoma after hepatic resection[J].J Gastrointest Surg, 2009,13(9):1636-1642.
[6] Kneuertz P J, Patel S H, Chu C K,etal. Effects of perioperative red blood cell transfusion on disease recurrence and survival after pancreaticoduodenectomy for ductal adenocarcinoma[J].Ann Surg Oncol, 2011,18(5):1327-1334.
[7] Bernard A C, Davenport D L, Chang P K,etal. Intraoperative transfusion of 1 U to 2 U packed red blood cells is associated with increased 30-day mortality, surgical-site infection, pneumonia, and sepsis in general surgery patients[J].J Am Coll Surg, 2009,208(5):931-937.
[8] Kacker S, Ness P M, Shirey R S,etal. The future of red blood cell alloimmunization risk reduction[J].Transfusion, 2015,55(1):222-224.
[9] Cata J P, Wang H, Gottumukkala V,etal. Inflammatory response, immunosuppression, and cancer recurrence after perioperative blood transfusions[J].Br J Anaesth, 2013,110(5):690-701.
[10]Lannan K L, Sahler J, Spinelli S L,etal. Transfusion immunomodulation--the case for leukoreduced and (perhaps) washed transfusions[J].Blood Cells Mol Dis, 2013,50(1):61-68.
[11]Vamvakas E C. Allogeneic blood transfusion and cancer recurrence: 20 years later[J].Transfusion, 2014,54(9):2149-2153.
[12]Jaime Perez J C, Villarreal Villarreal C D, Salazar Riojas R,etal. Increased bacterial infections after transfusion of leukoreduced non-irradiated blood products in recipients of allogeneic stem cell transplants after reduced-intensity conditioning[J].Biol Blood Marrow Transplant, 2015,21(3):526-530.
[13]Karam O, Tucci M, Toledano B J,etal. Length of storage and in vitro immunomodulation induced by prestorage leukoreduced red blood cells[J].Transfusion, 2009,49(11):2326-2334.
[14]Janelle V, Lamarre A. Role of the complement system in NK cell-mediated antitumor T-Cell responses[J].Oncoimmunology, 2014,3(1):e27897.
[15]Alvarez M, Bouchlaka M N, Sckisel G D,etal. Increased antitumor effects using IL-2 with anti-TGF-β reveals competition between mouse NK and CD8 T cells[J].J Immunol, 2014,193(4):1709-1716.
[16]徐利强,李建华,倪修文,等.细胞因子诱导的杀伤细胞(CIK)培养方案的优化[J].中国输血杂志,2015,28(8):1030-1033.
[17]Glaumann S, Nilsson C, Asarnoj A,etal. IgG4 antibodies and peanut challenge outcome in children IgE-sensitized to peanut[J].Pediatr Allergy Immunol, 2015,26(4):386-389.
[18]杨秀华,黄丽惜.术中输注红细胞对消化道肿瘤患者术后免疫功能的影响[J].现代医院,2014,14(3):15-17.
[19]万岁桂,郑程程,韩旭,等.中性粒细胞CD64指数在血液病合并细菌感染诊断中的价值[J].中国实验血液学杂志,2014,22(3):797-800.
[20]Simsek E, Karapinar K, Buqra O,etal. Effects of albumin and synthetic polypeptide-Coated oxygenators on IL-1, IL-2, IL-6, and IL-10 in open heart surgery[J].Asian J Surg, 2014,37(2):93-99.
[21]何兆英,陈秀娟,王述明.γ-射线辐照对血液质量的影响及辐照血液临床应用[J].中国医学工程,2014,22(3):161.
河北省卫生厅课题(ZD20140345)
050000 石家庄,河北医科大学第四医院输血科
R457.1
B
1002-3429(2017)02-0102-04
10.3969/j.issn.1002-3429.2017.02.030
2016-09-22 修回时间:2016-10-21)

