峨眉金线莲种子无菌苗组培快繁体系的建立
鲁 松,熊铁一
(1.四川省自然资源科学研究院,四川 成都 610015;2.峨眉山生物资源实验站,四川 峨眉山 614201)
峨眉金线莲种子无菌苗组培快繁体系的建立
鲁 松,2*,熊铁一1,2
(1.四川省自然资源科学研究院,四川 成都 610015;2.峨眉山生物资源实验站,四川 峨眉山 614201)
以野生峨眉金线莲(AnoectochilusemeiensisK.Y.Lang.)的蒴果为外植体,采用正交设计进行组织培养的优化试验,以期建立峨眉金线莲种子组织培养体系。结果表明:外植体最佳消毒方案是75%酒精浸泡30 s,0.1% HgCl2浸泡消毒15 min;峨眉金线莲最佳原初培养基为:MS+10%香蕉浸提液;最佳原球茎诱导和增殖培养基为:MS+10%香蕉+6-BA2 mg·L-1+NAA0.5 mg·L-1+活性炭(AC)3 g·L-1;最佳生根壮苗培养基为1/2MS+10%香蕉+ NAA 2 mg·L-1+6-BA 0.5 mg·L-1+活性炭1 g·L-1。
峨眉金线莲;种子;组织培养;无性繁殖
峨眉金线莲(Anoectochilus.roxburghiiK.Y.Lang.)与其它种金线莲(Anoectochilus)一道统称金线莲,别名金线兰、金丝草,为兰科开唇兰属多年生珍稀中草药[1]。金线莲我国有20种,两变种,主要分布西南部至南部。金线莲作为药用植物盛于闽台,在当地有“药中之王”的美称,民间治疗范围极广,多用于治疗小儿急惊风、高烧不退、肾炎、膀胱炎、高血压、糖尿病、心脏病、风湿性关节炎、肝脾病、肺痨肺病、咳嗽血虚、血热吐血、小儿发育不良及毒蛇咬伤等。目前金线莲的开发种类主要为常被称作福建金线莲的花叶开唇兰(A.roxburghii)、台湾开唇兰(A.formosanus),台湾开唇兰因其叶面具白色网脉常被称为台湾银线莲。经调查部分地方野生种群也有被开发销售,如福建武平、广西、贵州、广东、云南、浙江等地的金线莲,而对峨眉金线莲的开发未见报道。
野生峨眉金线莲的蒴果11月份以后成熟,成熟后果实沿纵缝开裂,开裂后种子随风飘落于枯枝落叶层中、沟谷旁、山涧河谷石壁及草丛中等处。由于11月份以后峨眉金线莲分布地温度下降较大,温度较低则种子不易萌发。据之前相关报道,金线莲种子在低温储藏后种子活力下降较大,4℃条件下储藏4个月后萌发率几乎为零,因此野生峨眉金线莲的种子在翌年春天温度回升后萌发率极低。
金线莲除了有较高的药用价值外,由于其具有金色或白色网状脉,是观赏价值极高的室内观叶珍品[2]。由于该植物自然生态条件独特,繁殖率低,生长缓慢,加上虫类、鸟类嗜食,特别是近年来对其需求量猛增,当地人们过度采挖,使得金线兰野生资源日渐枯竭[3]。种子离体培养是兰科野生资源保护的重要手段之一。金线莲种子发育不完全,在自然条件下极难萌发,需由某种真菌侵入,将种子胚细胞中的淀粉转化为糖,才能促进萌芽[4],但在人工培养下,可通过非共生萌发形成原球茎,原球茎是快速繁殖提高繁殖系数的核心,一旦形成原球茎,就可以在无菌条件下取出切成小块,转到新鲜的培养基中继代增殖,这样可以通过原球茎途径得到大量植株。关于金线莲种子组培的研究报道较少,黄慧莲等[5]研究了基本培养基对种子萌发的影响;周伟香等[6]也曾报道了植物生长物质、蔗糖浓度和培养方式等因素对种子非共生萌发的影响。邱玥等[7]研究了蒴果的成熟度、冷藏时间、种子预处理等对其萌发的影响。关于金线莲原球茎的培养,有少量文献报道[8],但原球茎在培养过程中边增殖边分化,同步性差,极大地限制了原球茎的应用范围。金线莲的组织培养有报道的有福建金线莲、台湾金线莲、滇越金线莲(A.chapaensis)、浙江金线莲(A.roxburghii)、白马山地区金线莲等,但对峨眉金线莲种子的组织培养报道较少。
正交设计是多因素分析的有利工具,可以用较少的试验次数得到较多的信息,从而选出主要因素及其最优水平[9]。本文拟通过正交设计的方法研究几种因素对峨眉金线莲种子组培快繁的影响,建立人工快繁技术体系,为保护、开发和利用这一资源提供具有实用价值的资料。
1 材料与方法
1.1 实验材料
峨眉金线莲(AnoectochilusemeiensisK.Y.Lang.)蒴果2014年9月~11月采自峨眉山海拔1 000 m林区,果实为自然授粉或人工授粉结实的成熟蒴果,种子颜色金黄色。
1.2 实验方法
1.2.1 果实成熟度与种子无菌苗诱导
摘取自然开花授粉成功或人工辅助授粉成功后(以花瓣萎蔫为起始日)100日~120日的成熟未开裂蒴果为实验材料。
1.2.2 果实处理及原初培养
1.2.2.1 种子消毒试验设计:75%酒精棉擦拭干净表面,剪去果蒂残留,洗衣粉溶液中浸泡30 min,小流水冲洗2 h后采用两因素3水平完全随机试验设计,设置75%酒精(处理时间30 s、45 s、60 s)、0.1% HgCl2(处理时间8 min、10 min、15 min)各3个水平,共9个处理。每处理5颗蒴果,无菌解剖针将果实剖开,用无菌镊均匀撒播于MS培养基上,每个果实接5瓶,每处理3个重复。统计14 d内的污染率。
1.2.2.2 原初培育:选取成熟未开裂蒴果,消毒后将种子接种于原初培养基上,培养基为:MS,1/2MS,MS+10%香蕉,MS+10%土豆,1/2MS+10%香蕉,1/2MS+10%土豆,MS+3 g·L-1花宝一号,pH5.8。培养条件为30 d暗培养+30 d光培养(12 h·d-1),温度23℃±2℃,60 d后解剖镜下统计萌发率。
1.2.3 丛生芽的诱导、增殖
试验选用L16(45)表进行正交实验设计,选择基本培养基、6-BA、NAA、活性炭(AC)4因素,浓度各设4水平,共有16个试验组合,每组合接种10瓶,每瓶10个原球茎,60 d后统计丛生芽增殖数,计算增殖率。
1.2.4 生根壮苗
将2 cm~3 cm健壮的丛生芽接种于生根壮苗培养基上,选择基本培养基、NAA、6-BA、活性炭(AC)4因素,浓度各设4水平,共有16个试验组合,每组合接种10瓶,每瓶10个丛生芽,150 d后取出植株洗净培养基后统计根数、叶片数、株高及单株重。芽诱导增殖及生根壮苗培养的培养条件都为光照16 h·d-1,光强为15 μmol·m-2·s-1~30 μmol·m-2·s-1,温度23℃±2℃。
1.3 数据统计分析
采用SPSS22.0数据分析系统和Microsoft Excel对试验观察数据资料进行方差分析、LSD多重比较等。在结果统计中所涉及的测定项目计算公式如下:污染率(%)=污染的外植体数/接种的外植体数×100;萌发率(%)=萌发的种子数/接种的种子数×100;成苗率(%)=长出丛生芽的外植体数/萌发的外植体数×100;增殖倍数=丛生芽个数/接种的外植体数;生根数=每处理生根的总数/诱导出根的试管苗数;叶片数(%)=叶片总数/接种的丛生芽数×100。
2 实验结果
2.1 不同灭菌处理对外植体灭菌效果的影响
峨眉金线莲蒴果灭菌试验的结果表明(表1),酒精灭菌时间30 s,45 s,60 s处理下种子的污染率无显著差异。而0.1%HgCl2灭菌时间对污染率的影响达到显著水平,8 min处理下的污染率显著高于其他水平下的污染率。综合分析表明,处理3、6、9的灭菌效果较好,且三者之间的差异并不显著,因此峨眉金线莲蒴果的灭菌效果以75%酒精灭菌30 s、0.1%HgCl2灭菌15 min最好,外植体污染率较低为7%。
表1 不同消毒处理对蒴果灭菌效果的影响
Tab.1 Effect of different sterilization on explants sterilizing
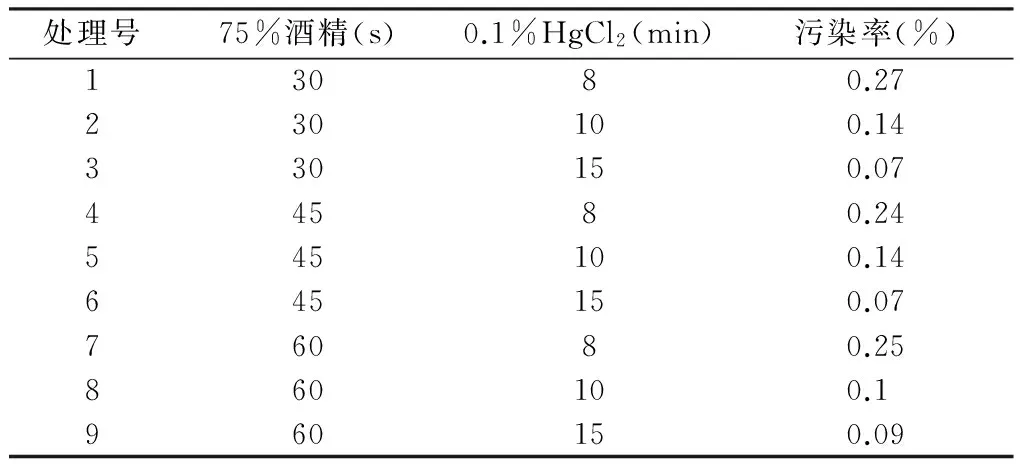
处理号75%酒精(s)0.1%HgCl2(min)污染率(%)13080.27230100.14330150.0744580.24545100.14645150.0776080.25860100.1960150.09
2.2 不同培养基对峨眉金线莲种子萌发的影响
峨眉金线莲在7种培养基上都能萌发,接种于除第2及第7组培养基上的部分种子在第一周就可以萌发形成白色的原球茎,该两组的种子萌发时间要比其余5种培养基晚3周到一个月。每种培养基上的原球茎外在形状在各组内无明显差异,表现出良好的均一性,3,4,5,6组的较其余3组要粗壮一些。综上所述,在发育形态方面,3,4,5,6组萌发效果最好,4组培养基萌发率无显著差异,MS+10%香蕉浸提液的组合效果最好。
7种培养基对峨眉金线莲种子萌发率与幼苗成苗率的影响见表2,添加了香蕉或土豆浸提液的组在2个月后种子的萌发率显著高于未添加的组,萌发率最高的组MS+10%香蕉浸提液的组合比最低的MS组的种子萌发率高24.2%。暗培养一个月后转入光培养,原球茎继续生长,并开始出现叶的形态,形成小的幼苗,7种组合培养基的成苗率都较高,都在95%左右及以上,在成苗率上7种组合未见显著差异。转入光下10 d左右,峨眉金线莲的种子苗逐渐开始转绿,而部分1和7组的原球茎基部出现褐化死亡的现象。
表2 不同培养基对峨眉金线莲种子萌发率的影响
Tab.2 Effect of different medium on seed germination
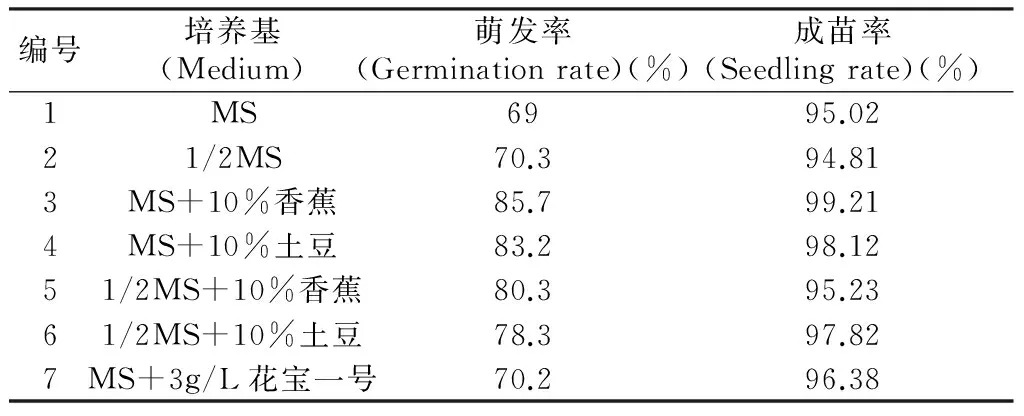
编号培养基(Medium)萌发率(Germinationrate)(%)成苗率(Seedlingrate)(%)1MS6995.0221/2MS70.394.813MS+10%香蕉85.799.214MS+10%土豆83.298.1251/2MS+10%香蕉80.395.2361/2MS+10%土豆78.397.827MS+3g/L花宝一号70.296.38
2.3 不同培养基种类对丛生芽诱导的影响
将由种子萌发形成的原球茎转入丛生芽诱导、增殖培养基后,约2周的时间基部略有膨大,进而分化为白色原球茎,继续生长可分化出丛生芽。从表3可以看出,不同组合对原球茎增殖影响很大,由极差分析可知,6-BA和NAA对原球茎增殖影响显著,其中6-BA影响最大,4种因素作用强弱依次是:6-BA>NAA>基础培养基>AC。在本实验设计范围内得到的峨眉金线莲丛生芽诱导及增殖的最佳组合为A1B3C2D4,即MS+10%香蕉+6-BA2 mg·L-1+NAA0.5 mg·L-1+活性炭3 g·L-1。
表3 原球茎增殖正交试验结果
Tab.3 Determination of orthogonal test on protocorm multiplication
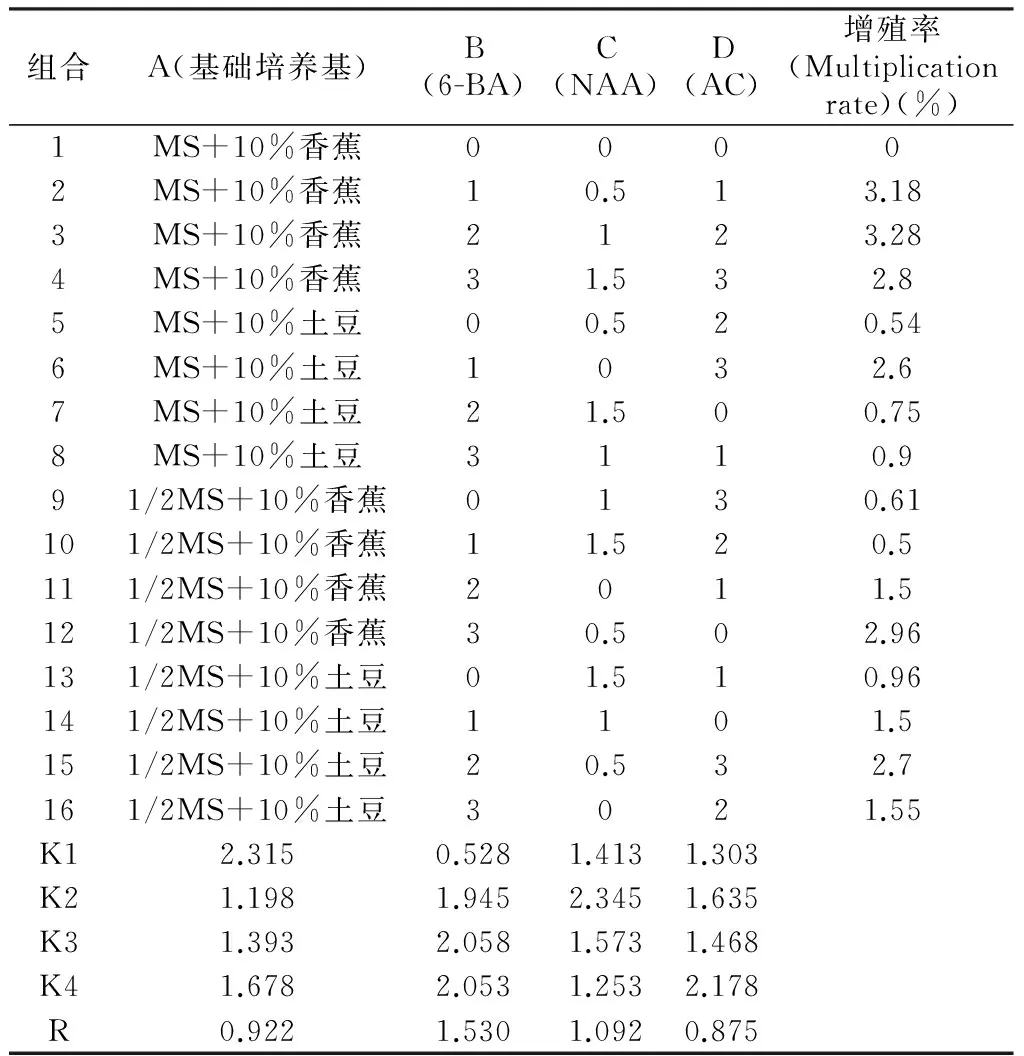
组合A(基础培养基)B(6-BA)C(NAA)D(AC)增殖率(Multiplicationrate)(%)1MS+10%香蕉00002MS+10%香蕉10.513.183MS+10%香蕉2123.284MS+10%香蕉31.532.85MS+10%土豆00.520.546MS+10%土豆1032.67MS+10%土豆21.500.758MS+10%土豆3110.991/2MS+10%香蕉0130.61101/2MS+10%香蕉11.520.5111/2MS+10%香蕉2011.5121/2MS+10%香蕉30.502.96131/2MS+10%土豆01.510.96141/2MS+10%土豆1101.5151/2MS+10%土豆20.532.7161/2MS+10%土豆3021.55K12.3150.5281.4131.303K21.1981.9452.3451.635K31.3932.0581.5731.468K41.6782.0531.2532.178R0.9221.5301.0920.875
把原球茎接种于组合A1B3C2D4的培养基后,4周后原球茎的平均增值率达到了3.31,比正交实验中的任何一个组合都要高,从而证实了我们正交筛选的结果。
2.4 不同培养基种类对生根壮苗的影响
将经继代增殖,长度大于2 cm的丛生芽转入生根壮苗培养基,通过分析不同组合的促根结果可知(表4),不同组合对生根及苗的生长影响很大,就本实验设计而言,由极差分析可知,NAA对生根及苗的生长影响显著,4种因素作用强弱依次是:NAA>基础培养基>6-BA>AC。在本实验设计范围内得到的峨眉金线莲生根壮苗的最佳组合为A3B4C2D2,即1/2MS+10%香蕉+ NAA 2 mg·L-1+6-BA 0.5 mg·L-1+活性炭1 g·L-1。
表4 生根壮苗正交试验结果
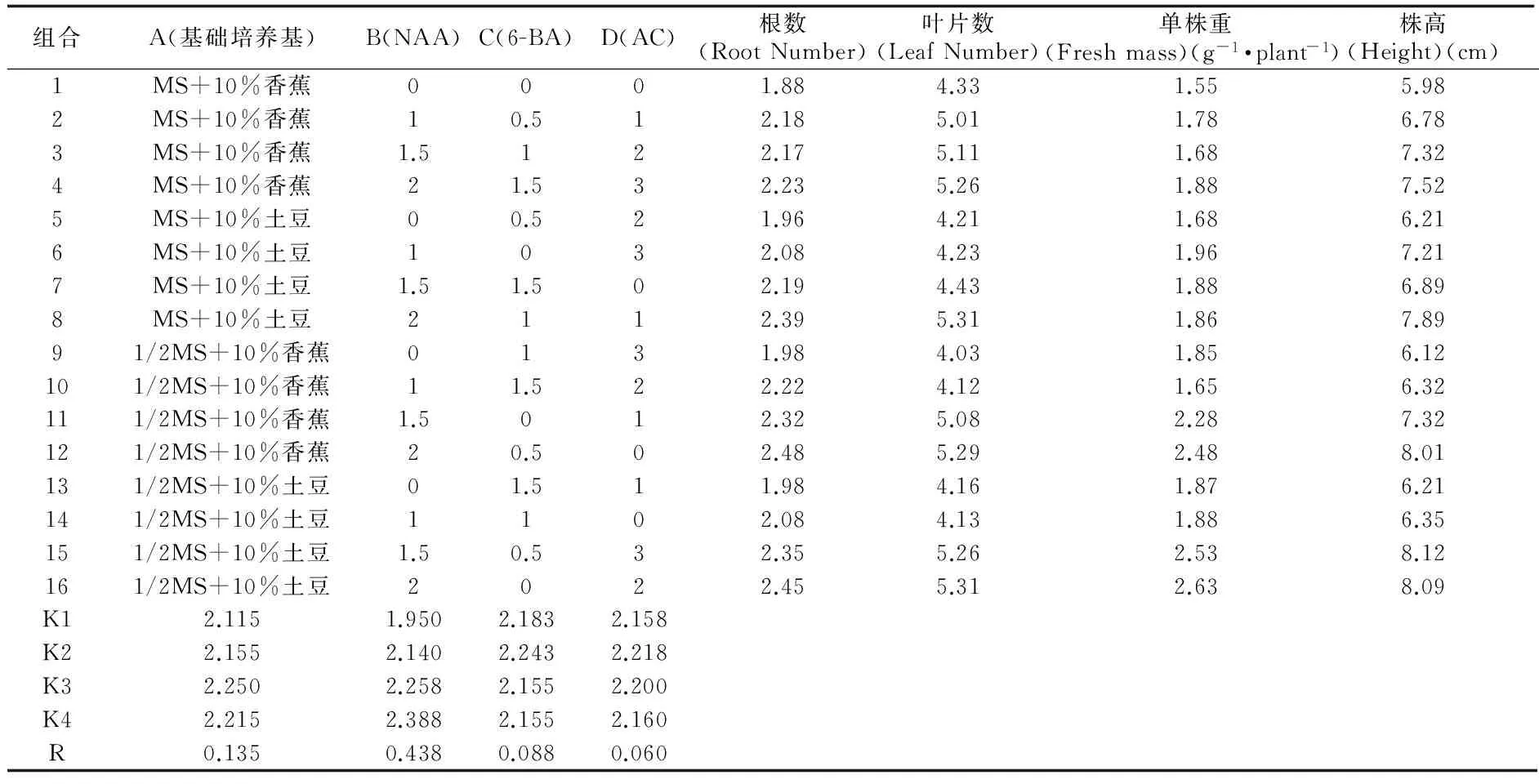
Tab.4 Determination of orthogonal test on rooting and strong seedling culture
将2 cm~3 cm高的丛生芽100株,每株10瓶转入A3B4C2D2组合配制的培养基中,经过150 d的培养统计,平均生根率2.45%,平均叶数5.33,平均株重2.65 g,平均株高8.10 cm,整体长势比正交设计中的组合都要高,证实了正交筛选的结果。
3 讨论
一颗峨眉金线莲的蒴果有成千上万粒种子,以种子为材料进行无菌体系的构建在峨眉金线莲种质资源的保护及开发利用上有重要的意义。由于其生境湿润,腐殖质丰富,因此蒴果上霉菌易生。在进行无菌体系构建时无菌外植体的获得尤为重要,常因灭菌不彻底从而造成污染,最终影响种子原球茎的获得及培养。对于种子的灭菌,前人采用了不同的方法来达到有效的灭菌目的,但由于材料的不同而得出的灭菌方法也各不相同。因此,在本实验中,对蒴果进行了预处理消毒后,通过不同消毒剂组合的不同时间处理来控制污染。实验发现75%酒精灭菌30 s、45 s、60 s对灭菌的结果影响不大,无显著差异,选择30 s更为便捷,同时由于有果皮的保护,不会出现酒精导致种子脱水死亡的现象。而HgCl2对污染率的影响达到显著水平,以灭菌15 min为好。
在进行种子萌发实验中,邱玥等的实验表明生长期为150 d的金线兰蒴果其种子萌发率最高,开始萌发时间早,形成的原球茎粗大、整齐。说明金线兰的种子萌发率与蒴果的成熟度呈正相关。本实验的结果与他的结果一致,此时的峨眉金线莲种子金黄色,萌发率及成苗率都比较高。另外,本实验的结果也发现添加一定的有机添加物能显著提高种子的萌发率。
峨眉金线莲种子萌发后长成的幼苗转绿后,原来的小叶会长成嫩叶,随着幼苗的不断生长,会出现新的茎段及新叶,在靠近根部的茎节基部处,会长出不定根,形成一完整的的植株,4个月后会形成具有多个小叶,部分有2个~3个侧根,株高2 cm~3 cm的植株,经分瓶继代后可获得健壮的植株。一颗峨眉金线莲的蒴果有上万粒种子,通过合适的培养可获得大量的峨眉金线莲的幼苗,为峨眉金线莲种质资源的保护提供了有力的支持。在无添加激素的培养基中可一直不分化而长成一完整植株。
丛生芽的诱导及增殖培养中6-BA和NAA及6-BA和NAA的组合使用比较常见[10~11]。而生长调节物对金线莲的原球茎的增殖有影响,而且有报道在诱导培养时,6-BA的最佳浓度为0.2 mg·L-1,高于该浓度则其诱导能力下降,但本实验的结果显示峨眉金线莲的种子在原球茎及丛生芽的诱导及增殖时对6-BA有一定的耐受力,在6-BA2.0 mg·L-1时增殖效果最好,增殖的倍率最高,这与周伟香等人的结果一致。而张菊野等[12]的实验认为6-BA能促进春兰原球茎的发生与分化,NAA有利于原球茎增殖与根的形成。林丛发等[13]认为在铁皮石斛类中6-BA不利于类原球茎的增殖,而NAA则有利于类原球茎的增殖。邱玥[7]等的试验证明NAA对福建金线莲原球茎的增殖有显著作用。而陈永快等[14]人的实验则表明福建金线莲在6-BA 4 mg·L-1台湾金线莲在5 mg·L-1时增殖效果最佳,由此可见不同的物种,不同的产地来源对生长调节物的适应最佳剂量差异较大。
许多的实验表明,1/2MS培养基有利于生根[15][16],即降低了无机盐的浓度。而不同的有机添加物在生根壮苗实验中也常采用。因此,本实验除验证了MS培养基外还验证了低盐培养基下的生根实验,并附加不同浓度的NAA和6-BA诱导根的形成,同时添加了不同的有机物。在本实验中,NAA在峨眉金线莲生根壮苗中影响显著,而MS及1/2MS培养基之间在本实验中并未显现出显著差异,这与陈永快等实验结果一致[14]。另外活性炭在植物的组织培养中常被用作吸附剂以清除培养基中的有害物质,但在本试验中,活性炭在原球茎丛生芽的诱导增殖及生根壮苗实验中并未显现出显著影响。峨眉金线莲为我国峨眉山特有的珍稀濒危物种,本文建立了以峨眉金线莲蒴果种子无菌苗为起始外植体的组培快繁体系,为该物种的保护提供了技术参考。
[1] 中国科学院中国植物志编辑委员会.中国植物志.第17卷[M ].北京:科学出版社,2000:223.
[2] 范子南,肖华山,范晓红,等.金线莲的组织培养研究[J].福建师范大学学报:自然科学版,1997,13(2):82~87.
[3] 于雪梅,郭顺星.金线莲与内生真菌共生培养体系的建立[J].中国中药杂志,2000,25(2):81.
[4] 陈裕,林坤瑞,管其宽.金线莲生物学特性及生境特点的研究[J].亚热带植物通讯,1994,23(1):19.
[5] 黄慧莲,刘贤旺,吴祥松.金线莲种子诱导成苗的研究[J].中药材,2002,25(1):3~.
[6] 周伟香,龚宁,李光.花叶开唇兰种子非共生萌发的研究[J].中草药,2007a,38(4):610~613.
[7] 邱玥,龚宁,张奎一.金线兰种子萌发及其原球茎的增殖培养[J].广西植物,2010,30(4):555~559.
[8] 杨柏云,高荫榆,李春华.金线莲原球茎的诱导与快速繁殖[J].安徽农业科学,2008,36(10):3999~4001.
[9] 徐晓峰,黄学林.应用正交设计建立青花菜植株的再生体系[J].广西植物,2002,22(6): 513~516.
[10] Al Malki AAHS, Elmeer KMS.Infl uence of auxin and cytokinine on in vitro multiplication ofFicusanastasia.Afr J Biotechnol,2010,9(5):635~639.
[11] Rehana S,Alam MS,Islam KS,Samad MA.Influence of growth regulators on shoot proliferation and plantlet production from shoot tips of banana.Prog Agric,2013,20 (1-2):9~16.
[12] 张菊野,俞玲凤,连宏坤.几种影响春兰原球茎生长与分化的因素[J].植物生理学通讯,1993,29(3):175~178.
[13] 林丛发,钟爱清,林云斌.铁皮石斛类原球茎增殖和分化的研究[J].江西农业学报,2007,19(1):84~86.
[14] 陈永快,林一心,邹晖.福建金线莲和台湾金线莲的组培快繁技术[J].现代园艺,2008,9~12.
[15] 程云清,刘剑锋,王占武,等.鞍杂杨组培快繁技术[J].东北林业大学学报,2011,39(2):11~12,20.
[16] 邓建军,李芳东,乔杰,等.白花泡桐优树试管嫁接幼化及组培快繁技术研究[J].林业科学研究,2011,24(5):646~650.
Establishment of Rapid Propagation for sterile Seedlings of Anoectochilus emeiensis by Tissue Culture
LU Song1,2*XIONG Tie-yi1,2
(1.Sichuan Natural Resources Science Academy,Chengdu 610015,Sichuan,China;2.Emei Mountain Biotic Resource Experimental Station,Mount Emei 614201,Sichuan,China)
Culture in Vitro and propagation were carried out with capsules ofAnoectochilusemeiensisby using orthogonal design with 4 levels of 5 factors.The result showed that the best explants disinfection method was to immerse 30 s in 75% alcohol plus 0.1%HgCl2;the best medium for primary culture was MS+10% banana juice;MS+10% banana+6-BA 2 mg·L-1+NAA 0.5 mg·L-1+AC 3g·L-1was the most suitable for bud induction and multiplication and the optimum medium for rooting and strong seedling culture was 1/2MS+10% banana+ NAA 2 mg·L-1+6-BA 0.5 mg·L-1+ AC 1g·L-1.
AnoectochilusemeiensisK.Y.Lang.,Seeds,Tissue culture,asexual propagation
10.16779/j.cnki.1003-5508.2017.01.001
2016-12-21
国家自然科学基金项目(31470479);四川省基本科研业务费项目。
鲁松(1979-),男,博士,副研究员,从事珍稀濒危植物保护工作。E-mail:lusong06718@126.com,*为通讯作者。
S722.3
A
1003-5508(2017)01-0001-05

