原发性胆汁性胆管炎血清代谢物组的氢谱核磁共振初步研究*
杨 婧 段 德 吴华美 杨黎宏 李 艳 杨晋辉#
昆明医科大学第二附属医院消化内科二病区1(650101) 大理白族自治州人民医院消化内科2
原发性胆汁性胆管炎血清代谢物组的氢谱核磁共振初步研究*
杨 婧1△段 德2△吴华美1杨黎宏1李 艳1杨晋辉1#
昆明医科大学第二附属医院消化内科二病区1(650101) 大理白族自治州人民医院消化内科2
背景:氢谱核磁共振(1H-NMR)技术为代谢组学常用方法,用于肝炎肝硬化、肝癌等疾病的研究,但关于原发性胆汁性胆管炎(PBC)患者血清代谢物组的研究较为少见。目的:探讨1H-NMR筛选PBC血清代谢物的能力。方法:采用1H-NMR对20例PBC、20例乙型肝炎肝硬化和20例对照组进行检测并获得1H-NMR图谱,结合主成分分析(PCA)、正交偏最小二乘法判别分析(OPLS-DA)法创建诊断模型。根据OPLS-DA模型的相关系数P(corr)、VIP值和非配对t检验,筛选出对照组与两组肝硬化组的血清差异性代谢物。结果:OPLS-DA模型能有效区分对照组与PBC患者,模型解释率和预测率分别为81.9%和44.8%(P=0.029 3),谷氨酰胺、叶酸、尿刊酸和4-乙基苯甲酸为两组的差异性代谢物。OPLS-DA模型能有效区分对照组与乙型肝炎肝硬化患者,尿刊酸、1-甲基组胺、1-甲基腺嘌呤、葡萄糖、L-乙酰肉毒碱为两组的差异性代谢物。OPLS-DA模型不能区分PBC和乙型肝炎肝硬化患者。结论:血清谷氨酰胺、叶酸可能为PBC潜在的特异性生物标记物,可能与PBC的免疫损伤机制和预后有关。1H-NMR技术结合OPLS-DA诊断模型有望成为一种研究肝硬化的新方法。
氢谱核磁共振; 肝硬化,胆汁性; 诊断; 谷氨酰胺; 尿刊酸
原发性胆汁性胆管炎(primary biliary cholan-gitis, PBC),即原发性胆汁性肝硬化,是一种起病隐匿、发病机制不明、自身免疫介导的慢性炎性胆汁淤积性肝病,病理学上分为Ⅰ期(胆管炎期)、Ⅱ期(胆管增生期)、Ⅲ期(纤维化期)和Ⅳ期(肝硬化期),主要表现为肝内中小胆管非化脓性炎症、门静脉炎伴门管区及其周围炎症和纤维化。近年PBC患病率和发病率均呈上升的趋势[1]。血清抗线粒体抗体(AMA)为诊断PBC的特异性指标,尤其AMA-M2亚型的阳性率高达90%~95%,但5%~10%的AMA阴性PBC患者极易漏诊[2],确诊需行肝穿刺活检,但该方法具有高风险性、创伤性的缺点。因此,寻找更便捷、安全可靠的PBC诊断手段成为目前迫切的研究目标和挑战。
核磁共振光谱(NMR)作为代谢组学的常用方法,通过比较健康状态与疾病状态下小分子代谢物表达的差异,从而寻找疾病的生物标记物[3]。该方法具有特异性强、无损伤、无辐射,样品需要量少、几乎无需前期处理[4],几乎对所有含氢化合物有响应,错误率低于1%[5]等优势。目前国内外对代谢组学的研究多集中于肝炎肝硬化、肝癌等疾病,深入探讨PBC患者血清代谢物组的研究较为少见。本研究通过采用氢谱核磁共振(1H-NMR)技术检测并比较PBC、乙型肝炎(HBV)肝硬化和对照组的血清代谢物,旨在探索能早期诊断PBC的特异性血清代谢物,从而为PBC发病机制的研究提供重要的科学依据。
材料与方法
一、资料来源
选取2015年4月—2016年1月昆明医科大学第二附属医院消化科的20例PBC、20例HBV肝硬化患者,均由临床、影像学、实验室检查确诊(部分患者经肝活检确诊),PBC患者依据美国肝脏病协会2010年制定关于PBC实验研究若干问题准则的标准纳入[4,6],HBV肝硬化患者符合《慢性乙型肝炎防治指南》[7]纳入标准。排除标准:①HBV肝硬化合并酒精性肝硬化的患者;②合并丙型病毒等其他病毒性肝炎的患者;③合并药物性肝炎、非酒精性脂肪肝、Budd-Chiari综合征、Wilson病、血色病的患者;④合并肝癌等恶性肿瘤的患者;⑤妊娠和哺乳期妇女;⑥合并HIV抗体阳性的患者;⑦合并甲状腺功能亢进、痛风等代谢性疾病的患者。选取同期20名健康志愿者作为对照组。所有受试者均签署知情同意书,本研究方案通过昆明医科大学第二附属医院伦理委员会批准。
二、主要材料与试剂
Bruker Ascend 800M核磁共振谱仪(18.8T)购自德国Bruker公司;ST500-7 5 mm核磁管购自美国Norell公司;ST16R台式低温高速离心机购自美国Thermal Scientific公司;氘代甲醇(99.8 atom % D)购自萨恩化学技术(上海)有限公司;甲醇购自四川西陇化工有限公司。
三、方法
1. 血样收集和血清制备:晨起6:00~8:00空腹状态下采集受试者外周血8 mL,4 ℃保存静置,1 600×g离心15 min。取2 mL上层血清,加入5 μL 4%叠氮化钠溶液,混匀,取400 μL分装于离心小管中,-80 ℃冰箱储存。
2. NMR样品制备条件比较(预实验):采用随机数字表法选择1名受试者的血清样品2 mL,分别与0.9% NaCl溶液、血清缓冲液、260 μL氘代甲醇、520 μL氘代甲醇混合,比较上述4种处理方式的一维1H-NMR图谱变化,以确定最佳的NMR样品制备方式。
3. NMR样品制备和图谱采集:根据NMR样品制备条件的比较结果,为进一步获得较高浓度的代谢物和质量更好的谱图,对样品制备方式进行适当调整。每份血清样品经液氮速冻、甲醇提纯、氘代甲醇溶解、离心等处理,转移至标准5 mm NMR核磁样品管中,4 ℃保存待测。上核磁共振谱仪行1H-NMR检测,获取一维图谱,每个谱图采集64 k数据点,扫描累加64次,谱宽为20.02 ppm。
4. 数据处理分析:采用TopSpin 3.2软件,通过自动相位校正、基线校正后导出为txt数据文件,并导入加载mvapack[8]的Octave软件中,完成定标、对齐、去除溶剂信号和无信号区域、智能划框[9]和归一化操作。智能划框后获得含281个变量的简化数据,导入Excel表格中,然后导入模式识别分析(SIMCA-P)软件包进行多变量分析。无监督模式识别采用主成分分析(PCA)法,首先用于分析NMR数据以观察样品的分布和分离趋势。有监督模式识别采用正交偏最小二乘法判别分析(OPLS-DA),模型算术式为X=TpPpT+ToPoT+E;Y=TpCpT+F(T:X的得分矩阵;P:X的荷载系数矩阵;上标T:矩阵转置;下标p:预测;下标o:正交;C:Y的荷载系数矩阵;E和F分别表示X、Y的残差矩阵)。随后用于改善分离和提高数据的解释能力。
5. 模型验证:采用7-fold交叉验证(CV)-单因素方差分析(ANOVA)法对OPLS-DA模型的可靠性进行验证,CV的Q2>0.4表示模型成立,ANOVA的P<0.05表示模型成立。
6. 生物标记物的初步鉴定:差异性代谢产物需同时满足下述三个条件:①相关系数P(corr)大于临界值时,表示代谢物含量差异有统计学意义;②变量重要性投影(VIP)值>1的代谢物被认为与各组间判定有关[10];③非配对t检验的P<0.05时,该代谢物含量的差异有统计学意义(采用Octave软件statistics包完成非配对t检验)。在人类代谢组数据库(HMDB)中根据代谢物的化学位移值搜索可能的生物标记物。
结 果
一、NMR样品制备方式比较
预实验结果显示,血清经冻干后加520 μL氘代甲醇的样品制备方式最佳,其谱图基线平稳、除大分子效果好、信号丢失少(图1),故选择该方式处理其他受试者血清样品。
二、NMR谱图和总体数据概览
1H-NMR图谱中存在4个异常观测值,分别为H7、P3、P4、P7(图2A),与正常观察值(图2B)相比,其残留的甲醇峰(3.471 ppm)异常升高,强度高于氘代甲醇(3.434 ppm, 五重峰)溶剂峰。为不影响
后续建模分析,去除这4个异常观测值。
三、对照组与PBC组多变量分析
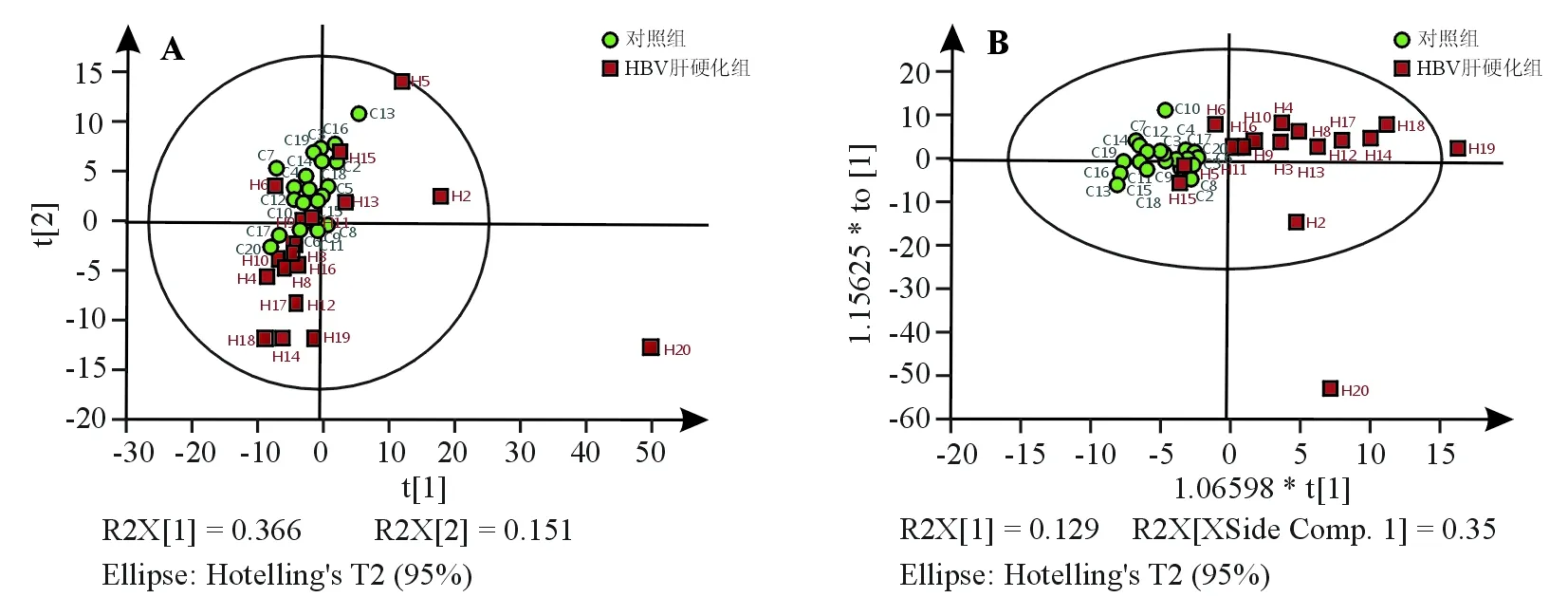
1. PCA:对照组与PBC组(去除异常观测值P3、P4、P7)无明显的分离趋势(图3A),PCA累积解释率为60.8%。

图1 第四种样品制备方式的1H-NMR图谱(520 μL氘代甲醇方式)
2. OPLS-DA:对照组与PBC组沿着t1轴具有明显的分离趋势(图3B),CV-ANOVA双验证结果显示OPLS-DA模型解释率81.9%,预测率44.8%(P=0.029 3),表明OPLS-DA模型有统计学意义,能显著区分PBC组与对照组受试者。根据OPLS-DA模型的相关系数、VIP值(图4)和非配对t检验,谷氨酰胺(Gln)、叶酸、尿刊酸(UCA)和4-乙基苯甲酸为两组的差异性代谢物(表1),与对照组相比,PBC组Gln浓度显著降低,叶酸、UCA和4-乙基苯甲酸浓度显著升高。
四、对照组与HBV肝硬化组多变量分析
1. PCA:对照组与HBV肝硬化组沿着t2轴有一定的分离趋势(图5A),另有一个显著的逸出观测值(H20),该异常值主要在t1轴表现与其他观测值有显著区别。PCA累积解释率为60.0%。

C:对照组;B:HBV肝硬化组;P:PBC组;MeOD:氘代甲醇;MeOH:甲醇

A:PCA;B:OPLS-DA

图4 对照组与PBC组的P(corr)和VIP散点图
2. OPLS-DA:对照组与HBV肝硬化组有明显的分离趋势(图5B),模型解释率59.3%,预测率为49.3%(P=1.69×10-4),表明OPLS-DA模型有统计学意义,能显著区分两组受试者。根据OPLS-DA模型的相关系数、VIP值(图6)和非配对t检验,UCA、1-甲基组胺、 1-甲基腺嘌呤、葡萄糖、L-乙酰肉毒碱为两组的差异性代谢物(表2),与对照组相比,HBV肝硬化组1-甲基腺嘌呤浓度显著降低,UCA、1-甲基组胺、葡萄糖、L-乙酰肉毒碱浓度显著升高。
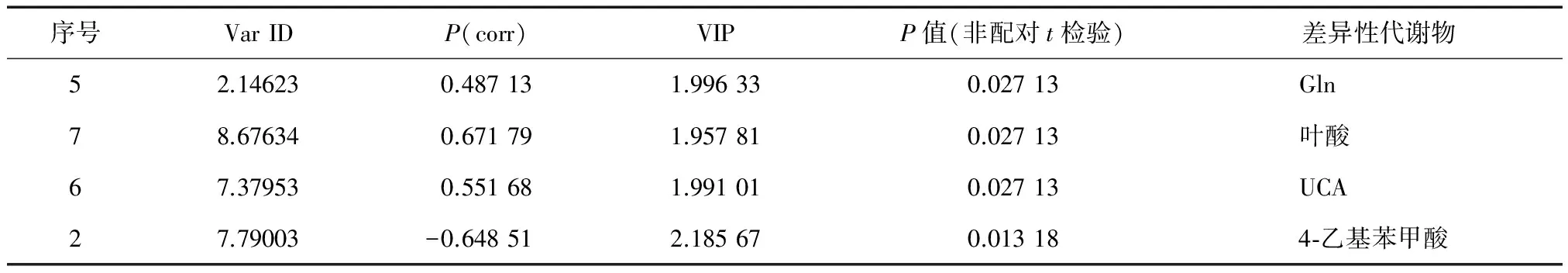
表1 对照组与PBC组的差异性代谢物
A:PCA;B:OPLS-DA

序号VarIDP(corr)VIPP值(非配对t检验)差异性代谢物177.379530.750731.935626.57×10-10UCA202.88221-0.701601.891895.33×10-121⁃甲基组胺213.957730.596821.888445.33×10-121⁃甲基腺嘌呤225.215130.617611.854835.33×10-12葡萄糖235.56406-0.762711.853365.33×10-12L⁃乙酰肉毒碱

图6 对照组与HBV肝硬化组的P(corr)和VIP散点图
五、HBV肝硬化组与PBC组的多变量分析
PCA法显示HBV肝硬化组与PBC组之间无分离趋势(图7)。OPLS-DA模型分析显示两组未能计算出正交组分,CV-ANOVA结果表明OPLS-DA模型无效,不能显著区分两组受试者。

图7 PBC组与HBV肝硬化组的PCA分析(去掉异常值H7、P3、P4、P7)
讨 论
肝脏发生免疫应答和损伤时,会导致肝脏病理生理改变而相应出现各类血清代谢物的显性表达,代谢组学技术为临床疾病的诊断、发病机制的研究提供了新的途径和思路。本研究采用1H-NMR技术结合模式识别方法发现,OPLS-DA模型可筛选出PBC和对照组的差异性代谢物,其中PBC组血清Gln浓度较对照组明显下降,叶酸、UCA、4-乙基苯甲酸浓度明显升高。OPLS-DA模型亦能筛选出对照组与HBV肝硬化患者的5个差异性代谢物,其中HBV肝硬化组血清1-甲基腺嘌呤浓度较对照组明显降低,而1-甲基组胺、葡萄糖、L-乙酰基肉碱、UCA浓度明显升高。
Gln是一种非必需氨基酸,可参与多种肝脏生化代谢途径[11]。大量研究表明,Gln对急慢性肝损伤有一定的保护作用。王伟强等[12]的研究发现,Gln能降低大鼠血清ALT、AST水平,抑制肝组织NF-κB和肿瘤坏死因子(TNF)-α表达,对急性肝损伤有明确的保护作用。闫静[13]的研究表明Gln可通过抑制活性氧自由基的产生而提高抗氧化能力,能抑制炎症反应并减少肝细胞凋亡等。同时,Gln还具有一定的免疫调节功能,可调节细胞因子的合成,促进淋巴细胞、单核巨噬细胞的增生和分化,是免疫反应的重要物质[14]。体外实验[15]发现,Gln含量降低,单核巨噬细胞的抗原呈递功能降低并直接影响巨噬细胞的特异性免疫功能,导致机体特异性免疫监视和应答能力下降,提示单核巨噬细胞的抗原呈递功能依赖于Gln含量。亦有研究[16]发现Gln缺乏使肝脏Kupffer细胞的吞噬功能受阻,导致内毒素不能及时被清除;补充Gln可增强肝脏Kupffer细胞的吞噬功能,加速肝脏对细菌和内毒素的清除。郑毅等[17]的研究发现,添加Gln的全胃肠外营养患者的血清CD3、CD4/CD8比例明显升高,NK细胞明显下降,提示Gln可调节机体免疫,具有免疫增强的功能。
目前PBC的发病机制尚不明确,可能是机体对自身抗原的耐受性被打破,一系列始动因素诱发自身免疫应答,致使肝内中小胆管上皮细胞不断受到免疫系统的攻击而引起炎性胆汁淤积最终发病。树突细胞(DC)有免疫监视、诱导免疫耐受的作用,PBC患者CD83+DC细胞数量减少[18],提示DC对维持自身免疫耐受具有重要作用。血清Gln含量显著减少,可导致DC增生分化减少,诱导免疫耐受机制削弱,导致PBC的发生。本研究中,PBC患者血清Gln浓度较对照组降低,提示Gln可能参与了PBC的发病并影响患者预后,可能为PBC潜在的特异性生物标记物。
血清叶酸具有免疫调节的作用。Courtemanche等[19]发现叶酸缺乏可导致CD8+T细胞增殖明显降低。有研究[20]发现PBC患者门管区和胆管周围区域混合性炎症反应多以CD8+T细胞浸润为主,表明CD8+T细胞的超反应性可能参与肝脏损害,而且CD4+和CD8+T细胞的免疫应答靶向抗原为自身PDC-E2,与PBC患者的免疫靶向抗原相同。动物实验亦表明胆管损害程度与T细胞对自身PDC抗原被攻击的程度一致[21]。上述研究提示CD8+T细胞的致病性在PBC发病机制中发挥重要作用。血清叶酸主要储存于肝脏中,PBC患者存在肝细胞受损,尤其PBC失代偿期广泛的肝细胞坏死、纤维化时,叶酸贮存水平降低,导致转化为活动性储备型的四氢叶酸减少,叶酸有效利用率减少使血清叶酸含量升高[22]。本研究发现PBC患者血清叶酸浓度较对照组增高,可能促进了CD8+T细胞的增殖,使PBC患者胆管损伤进行性加重,这可能与PBC的免疫损伤机制有关,但具体作用机制仍需进一步研究。由此可见,血清叶酸有可能成为PBC潜在的重要生物标记物。
4-乙基苯甲酸对人体具有低毒性,在肝脏中与甘氨酸结合生成马尿酸并随尿液排出体外,少量可与葡萄糖醛酸化合通过尿液排出[23]。4-乙基苯甲酸的解毒代谢主要在肝脏中进行,肝硬化患者的解毒代谢过程需较长时间完成,或不能使其变为马尿酸随尿液排泄,血清苯甲酸升高,加重肝脏负担[24]。本研究中,PBC患者血清4-乙基苯甲酸较对照组明显升高,考虑该代谢物与肝硬化可能有一定联系,但尚需进一步研究证实。
目前认为UCA作为一种类细胞因子,具有免疫抑制的作用。Beissert等[25]认为顺式UCA通过破坏Langerhans细胞的细胞骨架而降低抗原呈递功能,Langerhans细胞属于DC群体,具有启动初次免疫应答和诱导免疫耐受的功能。Wille等[26]认为顺式UCA可诱导释放肥大细胞脱颗粒因子,进而刺激IL-10等抑制性细胞因子的产生,诱导免疫耐受。本研究中PBC患者血清UCA浓度明显增高,使抗原递呈功能减弱,破坏免疫监视和免疫耐受机制,可能与PBC的发病有一定相关性。此外,UCA可导致内毒素不能及时被清除,导致慢性内毒素血症,增加感染风险。本研究显示,UCA为PBC和HBV肝硬化组患者血清中的共同代谢物,均较对照组明显升高,表明UCA并非PBC的特异性生物标记物,但可能参与肝脏免疫反应,在肝损伤、肝硬化的进展中可能有密切联系。
总之,1H-NMR技术结合模式识别方法可有效区分对照组与PBC或HBV肝硬化患者,但由于暂未收集其他原因,如酒精、血吸虫、非酒精性、药物性肝损伤等造成的肝硬化患者的相关数据,其与正常受试者构建的OPLS-DA模型是否会出现类似情况尚未可知。本研究鉴定出Gln、叶酸可能是PBC的特异性生物标记物,两者与PBC的发病机制和预后可能有关,但具体作用机制仍需进一步深入研究。后续研究将扩大样本量,严格筛选病例,进而增加研究的可靠性和可信度。
致谢 感谢中国科学院昆明植物研究所的胡凯峰博士、李兴在读博士在本研究中给予的大力帮助。
1 Boonstra K, Beuers U, Ponsioen CY. Epidemiology of primary sclerosing cholangitis and primary biliary cirrhosis: a systematic review[J]. J Hepatol, 2012, 56 (5): 1181-1188.
2 Lindor KD, Gershwin ME, Poupon R, et al; American Association for Study of Liver Diseases. Primary biliary cirrhosis[J]. Hepatology, 2009, 50 (1): 291-308.
3 Hohenester S, Oude-Elferink RP, Beuers U. Primary biliary cirrhosis[J]. Semin Immunopathol, 2009, 31 (3): 283-307.
4 Zhang H, Jia J, Cheng J, et al. 1H NMR-based metabonomics study on serum of renal interstitial fibrosis rats induced by unilateral ureteral obstruction[J]. Mol Biosyst, 2012, 8 (2): 595-601.
5 Barding GA Jr, Salditos R, Larive CK. Quantitative NMR for bioanalysis and metabolomics[J]. Anal Bioanal Chem, 2012, 404 (4): 1165-1179.
6 Crockford DJ, Holmes E, Lindon JC, et al. Statistical heterospectroscopy, an approach to the integrated analysis of NMR and UPLC-MS data sets: application in metabonomic toxicology studies[J]. Anal Chem, 2006, 78 (2): 363-371.
7 中华医学会肝病学分会, 中华医学会感染病学分会. 慢性乙型肝炎防治指南(2015年更新版)[J]. 临床肝胆病杂志, 2015, 31 (12): 1941-1960.
8 Worley B, Powers R. MVAPACK: a complete data handling package for NMR metabolomics[J]. ACS Chem Biol, 2014, 9 (5): 1138-1144.
9 De Meyer T, Sinnaeve D, Van Gasse B, et al. NMR-based characterization of metabolic alterations in hypertension using an adaptive, intelligent binning algorithm[J]. Anal Chem, 2008, 80 (10): 3783-3790.
10 Jansson J, Willing B, Lucio M, et al. Metabolomics reveals metabolic biomarkers of Crohn’s disease[J]. PLoS One, 2009, 4 (7): e6386.
11 Renga B, Mencarelli A, Cipriani S, et al. The nuclear receptor FXR regulates hepatic transport and metabolism of glutamine and glutamate[J]. Biochim Biophys Acta, 2011, 1812 (11): 1522-1531.
12 王伟强, 任成山. 谷氨酰胺对急性肝损伤的保护作用及临床意义[J]. 第三军医大学学报, 2006, 28 (11): 1184-1187.
13 闫静. 谷氨酰胺在肝损伤中的应用//中国营养学会. 第十二届全国营养科学大会论文汇编, 北京, 2015: 178.
14 宋怀宇, 杨建荣. 肝病患者肠黏膜屏障功能的变化及谷氨酰胺干预的研究进展[J]. 世界华人消化杂志, 2009, 17 (27): 2798-2802.
15 Spittler A, Winkler S, Götzinger P, et al. Influence of glutamine on the phenotype and function of human monocytes[J]. Blood, 1995, 86 (4): 1564-1569.
16 杨艳萍, 许瑞龄. 谷氨酰胺对库普弗细胞吞噬功能的影响[J]. 山西医药杂志, 2005, 34 (10): 827-828.
17 郑毅, 刘俊. 谷氨酰胺对重症患者术后应激反应和免疫功能的调节作用[J]. 上海医学, 2004, 27 (10): 753-755.
18 仲人前, 钱琤. 原发性胆汁性肝硬化发病机制研究及展望[J]. 中国实验诊断学, 2008, 12 (5): 691-694.
19 Courtemanche C, Elson-Schwab I, Mashiyama ST, et al. Folate deficiency inhibits the proliferation of primary human CD8+ T lymphocytesinvitro[J]. J Immunol, 2004, 173 (5): 3186-3192.
20 Yeaman SJ, Kirby JA, Jones DE. Autoreactive responses to pyruvate dehydrogenase complex in the pathogenesis of primary biliary cirrhosis[J]. Immunol Rev, 2000, 174: 238-249.
21 王静, 王震宇. 原发性胆汁性肝硬化发病机制及治疗进展[J]. 中国慢性病预防与控制, 2009, 17 (1): 105-108.
22 张春霞. 68例肝硬化患者血清叶酸水平和脂联素水平的相关性分析[J]. 国际检验医学杂志, 2014, 35 (24): 3453-3454.
23 Wu Y, Tao Y, Liang L, et al. Metabonomic profile of rats with acute liver rejection[J]. OMICS, 2009, 13 (2): 81-91.
24 Serkova NJ, Zhang Y, Coatney JL, et al. Early detection of graft failure using the blood metabolic profile of a liver recipient[J]. Transplantation, 2007, 83 (4): 517-521.
25 Beissert S, Rühlemann D, Mohammad T, et al. IL-12 prevents the inhibitory effects of cis-urocanic acid on tumor antigen presentation by Langerhans cells: implications for photocarcinogenesis[J]. J Immunol, 2001, 167 (11): 6232-6238.
26 Wille JJ, Kydonieus AF, Murphy GF. cis-urocanic acid induces mast cell degranulation and release of preformed TNF-alpha: A possible mechanism linking UVB and cis-urocanic acid to immunosuppression of contact hypersensitivity[J]. Skin Pharmacol Appl Skin Physiol, 1999, 12 (1-2): 18-27.
(2016-07-20收稿;2016-09-03修回)
Preliminary Study on Serum Metabolites of Primary Biliary Cholangitis by Hydrogen Spectrum Nuclear Magnetic Resonance
YANGJing1,DUANDe2,WUHuamei1,YANGLihong1,LIYan1,YANGJinhui1.
1DepartmentofHepatobiliaryandPancreaticMedicine,theSecondAffiliatedHospitalofKunmingMedicalUniversity,Kunming(650101);2DepartmentofGastroenterology,DaliBaiAutonomousPrefecturePeople’sHospital,Dali,YunnanProvince
YANG Jinhui, Email: yangjing_dl@163.com
Hydrogen Spectrum Nuclear Magnetic Resonance; Liver Cirrhosis, Biliary; Diagnosis; Glutamine; Urocanic Acid
10.3969/j.issn.1008-7125.2017.02.003
云南省医疗卫生单位内设研究机构科研项目(No. 2014NS110)
△本文共同第一作者,杨婧,Email: yangjing_dl@163.com; 段德,Email: 782056206@qq.com
#本文通信作者,Email: yangjing_dl@163.com
Background: Hydrogen spectrum nuclear magnetic resonance (1H-NMR) is a commonly used method for metabolomics and has been applied in the study of liver cirrhosis and liver cancer, however, study on serum metabolites in patients with primary biliary cholangitis (PBC) is rare. Aims: To investigate the capability of1H-NMR for screening serum metabolites of PBC. Methods: Twenty PBC patients, 20 HBV-related cirrhosis patients and 20 healthy controls were detected by1H-NMR. The1H-NMR spectra data were processed by principal component analysis (PCA) and orthogonal partial least squares-discriminant analysis (OPLS-DA) so as to create the diagnostic model. Based on the correlation coefficientP(corr), VIP value and non-pairedttest of OPLS-DA model, the differential metabolites between normal group and the two cirrhosis groups were screened. Results: OPLS-DA model could effectively distinguish healthy controls and PBC patients, model interpretation ability and prediction ability were 81.9% and 44.8%, respectively (P=0.029 3), glutamine, folic acid, urocanic acid, 4-ethylbenzoic acid were differential metabolites. OPLS-DA model could also effectively distinguish healthy controls and HBV-related cirrhosis patients, urocanic acid, 1-methylhistamine, 1- methyladenine, glucose, L-acetylcarnitine were differential metabolites. OPLS-DA model could not effectively distinguish PBC patients and HBV-related cirrhosis patients. Conclusions: Serum glutamine and folic acid may be the potential biomarkers of PBC, which may be closely related to the immune damage mechanism and prognosis of PBC;1H-NMR combined with OPLS-DA diagnostic model are expected to become a new method for studying liver cirrhosis.

