木薯环指蛋白基因MeRFP8克隆及表达
薛晶晶, 陈松笔
(中国热带农业科学院热带作物品种资源研究所/农业部木薯种质资源保护与利用重点实验室,海南 儋州 571737)
木薯环指蛋白基因MeRFP8克隆及表达
薛晶晶, 陈松笔
(中国热带农业科学院热带作物品种资源研究所/农业部木薯种质资源保护与利用重点实验室,海南 儋州 571737)
采用RT-PCR方法,首次从木薯华南8号(SC8)克隆一个环指蛋白RFP基因家族成员MeRFP8.该基因cDNA包含1 059 bp的开放阅读框,编码一个由352个氨基酸残基组成的蛋白质.该蛋白质分子质量为39.23 ku,理论等电点为4.84,C末端含有保守的结构域RING finger domain (Ring-H2 zinc finger),属于C3H2C3型环指蛋白.利用实时荧光定量PCR分析MeRFP8基因在木薯SC8及其同源四倍体叶片的表达水平,结果显示:5 ℃低温胁迫24 h内,SC8和其四倍体MeRFP8基因先下调表达,后上调表达,呈“V”字型.而且MeRFP8基因在SC8的表达变化水平比其同源四倍体大.推测MeRFP8基因可能参与木薯的低温响应.
木薯; 环脂蛋白;MeRFP8; 基因克隆; 冷胁迫
环境胁迫如高温、低温、干旱以及盐胁迫等对植物生长,发育以及生物产量和品质特性产生很大影响[1,2].为响应环境胁迫,植物会促使某些生理机制和代谢通路发生改变,以适应新的环境变化[3,4].许多转录因子,如AP2/EREBP,bZIP,WARKY,MYB和一些锌指蛋白,已有报道在植物应对环境胁迫中起着重要作用[5].
锌指蛋白是真核生物中较丰富的一类蛋白质,在生物体生长发育的各个阶段起着重要作用,包括激活转录,调控细胞凋亡,蛋白质折叠和组装等[6].环指蛋白(ring finger protein, RFP)是一类特殊的锌指蛋白,一般包含40~60残基,结合2个锌原子[7],含有1个C-X2-C-X(9-39)-C-X(1-3)-H-X(2-3)-(N/C/H)-X2-C-X(4-48)C-X2-C的“交叉”模型;可能参与介导蛋白-蛋白互作,存在2个变种,C3HC4型和C3H2C3 (RING-H2 finger) 型,具有不同的半胱氨酸/组氨酸模式[8].含有环指特征的基因RING1[9]在16年前首次在人类中发现,随后,大量含有环指特征的蛋白被报道[10],迄今为止,环指的特定功能还不清楚.目前,许多含有环指结构的蛋白质主要参与转录调控和蛋白-蛋白互作等[7,11,12],最新研究表明,大部分环指蛋白具有E3泛素连接酶活性,能特异地与E2泛素结合酶相互作用,从而促进泛素化[13],通过泛素化降解蛋白质是植物在许多逆境信号途径中的重要环节.因此,推测环指蛋白主要对环境刺激的反应起重要作用.例如,它们参与光系统建成的负调控[14,15],非生物胁迫等[16,17].研究发现拟南芥COP1基因编码一个抑制光形态建成和光调控发育分子的环指蛋白[18,19];沙蒿AdZFP1编码环锌指锚蛋白基因,在干旱胁迫中起重要作用[20];拟南芥HOS1基因属于C3HC4型环指蛋白,具有E3泛素连接酶活性,主要在低温信号转导中起作用[16].野生型番茄ShATL78L基因编码C3H2C3型环指蛋白,主要在低温胁迫下起作用,同时也对干旱、盐、热和渗透性应激等非生物胁迫起作用[21].马铃薯SbRFP1属于C4HC4型环指蛋白,能够在低温胁迫下对马铃薯块茎的糖分积累进行负调控[22].木薯MeRZF基因属于C3H2C3型环指蛋白,从木薯块根中获得,主要在干旱胁迫中起重要作用[23].
木薯(ManihotesculentaCrantz)是大戟科(Euphorbiaceae)木薯属(ManihotP. Mill.)的多年生植物[24,25],原产南美洲热带,是世界三大薯类作物之一.木薯贮藏根淀粉含量在27%~34%之间,被誉为“淀粉之王”,是世界热带地区继水稻、玉米、高粱之后的第四大粮食作物,为热带、亚热带近8亿人口提供了基本食粮,是我国重要的工业淀粉和生物质能源原料,也是我国潜在的粮食作物[26].低温是限制植物自然分布和栽培区域的主要因素,寒害使木薯北移扩大种植受到较大影响.因此,改良木薯品种,发掘耐寒基因,选育耐寒种质,扩大木薯北移种植面积成为木薯研究的重要方面.目前关于木薯环指蛋白基因(RFP)与低温胁迫相关的研究还未见报道.本研究从木薯叶片中克隆了环指蛋白基因MeRFP8,研究在低温胁迫下该基因在木薯SC8及其同源四倍体的表达水平,为开展木薯抗寒性分子标记辅助育种提供依据.
1 材料与方法
1.1 材料
木薯(ManihotesculentaCrantz)华南8号(SC8)及其同源四倍体组培苗,南植199(NZ199)及其同源四倍体组培苗.RNAprep Pure多糖多酚植物总RNA提取试剂盒,Dnase Ⅰ,DNA凝胶回收试剂盒购自天根公司.反转录试剂盒RevertAidTMFirst Strand cDNA Synthesis Kit购自Ferments公司.PrimeSTAR Max DNA Polymerase,实时荧光定量PCR试剂SYBR Premix Ex TaqⅡ(TliRNaseH Plus)购自大连宝生物公司.pEASY-Blunt Simple Cloning Kit购自北京全式金公司.其它生化试剂均为进口或国产分析纯试剂.引物合成和DNA测序由Invitrogen公司完成.
1.2 方法
1.2.1 材料处理 对生长约50 d的SC8及其同源四倍体组培苗进行5 ℃低温处理,在处理0、2、4、8和24 h后,一部分叶片用于酶活性测定;另一部分叶片经液氮速冻后,用于RNA提取.每个处理时间进行3次重复.
对生长约50 d的NZ199及其同源四倍体组培苗进行5 ℃低温处理,在处理0、4和8 h后,取叶片经液氮速冻后用于RNA提取.每个处理时间进行3次重复.
1.2.2 生理指标测定 植物丙二醛(MDA)测试盒,过氧化氢(H2O2)测试盒,过氧化氢酶(CAT)测试盒,过氧化物酶(POD)测试盒均购自南京建成生物工程研究所,测试方法按照说明书进行.

表1 引物序列Table 1 List of primer sequences
1.2.3 总RNA提取与cDNA合成 木薯叶片RNA的提取参照RNAprep Pure多糖多酚植物总RNA提取试剂盒的操作说明进行,用DnaseⅠ柱上消化RNA样品中残留的微量DNA.cDNA第一链的合成参照Ferments公司试剂盒的说明书进行.
1.2.4MeRFP8基因全长cDNA扩增 从木薯低温胁迫处理后的MSAP分析中分离到一段包含Ring-finger domain结构域的序列,将该序列比对Phytozome11中Manihotesculentav6.1(Cassava)数据库,以比对获得的DNA序列设计引物(表1), 采用PrimeSTAR Max DNA Polymerase进行序列的克隆.用1 μg叶片RNA,20 μL反应体系,逆转录合成第一链cDNA.全长cDNA的扩增体系含PrimeSTAR Max Premix (2×) 25 μL、RFP8-F (10 μmol·L-1) 2.5 μL、RFP8-R (10 μmol·L-1) 2.5 μL、cDNA模板0.5 μL、灭菌水补足50 μL.扩增程序为:95 ℃预变性4 min;94 ℃变性30 s、60 ℃退火30 s、72 ℃延伸90 s、共30个循环;72 ℃延伸10 min.0.8%的琼脂糖凝胶电泳分离PCR扩增产物,回收纯化目的条带,克隆至pEASY-Blunt Simple Cloning Vector载体上测序.利用BLAST检索GenBank数据库,进行同源性分析.
1.2.5 生物信息学分析 利用DNAMAN软件对MeRFP8全长cDNA序列进行比对分析,NCBI网站ORF Finder软件进行开放阅读框(ORF)预测,同时翻译成蛋白序列.ProtParam软件分析该蛋白的分子质量与等电点;NCBI在线软件CDD分析蛋白的保守结构域;TMHMM Server v. 2.0在线软件进行跨膜结构域分析;PSORT在线软件对该蛋白进行亚细胞定位预测;ProtScale在线软件预测该氨基酸序列的疏水性/亲水性;SOPMA SECONDARY STRUCTURE PREDICTION METHOD在线软件预测蛋白的二级结构.从NCBI数据库下载其它植物的RFP蛋白序列,首先用Clustal W进行序列多重比对,再利用MEGA 4.0软件,选择neighbour-joining(NJ)模型,并进行1 000次bootstrap统计学检验,构建包括MeRFP8蛋白序列在内的植物RFP蛋白的系统进化树.
1.2.6 实时荧光定量PCR分析 采用Bio-Rad公司的CFX实时荧光定量PCR系统,实验操作按仪器使用说明书进行.取1 μg RNA,逆转录合成第一链cDNA,稀释10倍后作为实时定量PCR分析的模板.20 μL反应体系中,包含1 μL模板、10 μL 2×SYBR Premix、10 μmol·L-1QPCR-RFP8-F和QPCR-RFP8-R引物(表1)各0.6 μL、灭菌水补足20 μL.PCR反应程序为:95 ℃预变性30 s;95 ℃变性10 s、60 ℃退火20 s、72 ℃延伸20 s、共40个循环,循环完后进行产物溶解曲线分析.以MeActin作为内参基因(表1),利用CFX manager 3.0软件自动进行基线和Cq值分析,以2-△△Cq算法进行基因的相对定量表达.采用Duncan多重比较对对照和处理样品的相对定量结果进行统计分析.

*标示终止密码子.图1 MeRFP8核苷酸序列和推导的氨基酸序列Fig.1 Nucleotide and derived amino acid sequences of MeRFP8
1.2.7 分析方法及数据处理 采用GraphPad Prifm 5.0软件进行数据分析和作图,采用SPSS 18.0软件进行差异性等相关统计分析.
2 结果与分析
2.1MeRFP8基因全长cDNA克隆及蛋白质结构特性
通过RT-PCR扩增及测序,获得MeRFP8基因编码框序列1 059 bp,编码352个氨基酸(图1),分子质量为39.23 ku,理论等电点为4.84,不稳定系数为55.50,属于不稳定类蛋白.通过NCBI在线软件CDD分析发现,该蛋白在C末端含有植物RFP基因共有的保守结构域RING finger domain (Ring-H2 zinc finger),属于C3H2C3型环指蛋白.TMHMM Server v. 2.0在线软件预测显示,该蛋白无跨膜结构域;PSORT分析显示,MeRFP8定位于细胞核的可能性为65.2%;ProtScale预测表明,MeRFP8蛋白属于疏水性蛋白;SOPMA分析显示,MeRFP8蛋白二级结构由24.72% α-螺旋、21.31%延伸链、7.39% β-转角和46.59%无规则卷曲组成.
2.2MeRFP8推导的氨基酸序列比对及进化树构建
采用DNAMAN软件对MeRFP8推导的氨基酸序列与其它植物中的RFP蛋白序列进行比对(图2),结果显示,MeRFP8蛋白序列与麻风树RING-H2 finger protein ATL52-like (Jatrophacurcas,XP_012070295.1)、杨树POPTR_0013s07100g (Populustrichocarpa,XP_002319229.2)、可可RING/U-box superfamily protein, putative (Theobromacacao,XP_007029812.1)、胡杨RING-H2 finger protein ATL52 (Populuseuphratica,XP_011011235.1)、甜橙hypothetical protein CISIN_1g036833mg (Citrussinensis,KDO46830.1)、金钱橘CICLE_v10031956mg (Citrusclementina,XP_006437376.1)、梅RING-H2 finger protein ATL52-like (Prunusmume,XP_008232120.1)蛋白相似性分别为60.15%、58.17%、55.20%、55.69%、53.71%、53.22%、47.52%.

下划线表示Ring-finger domain结构域;*表示特征序列中保守的氨基酸残基.图2 MeRFP8推导氨基酸序列与其它植物RFP蛋白序列比对Fig.2 Amino acid alignment of MeRFP8 with RFPs from other plant species
选取NCBI数据库中与MeRFP8蛋白较相似序列7条以及低温响应的RFP蛋白序列4条,利用软件MEGA 4.0构建系统进化树.聚类结果显示,木薯MeRFP8与麻疯树Jatrophacurcas,XP_012070295.1聚为一类,亲缘关系最近(图3).
2.3 低温胁迫对SC8及其同源四倍体生理指标的影响
5 ℃低温处理4 h后,SC8组培苗的叶片开始出现萎缩现象,而SC8四倍体的组培苗叶片直到24 h才出现局部萎缩.同时,低温胁迫会使植物体内产生大量活性氧,进而对植物细胞形成氧化胁迫伤害.CAT、POD是酶促防御系统中重要的保护酶,可以有效地清除膜脂过氧化物对植物造成的伤害.低温处理下,MDA含量的变化可以作为衡量植物抗寒性的重要生理指标.
5 ℃处理下,SC8及其四倍体组培苗的MDA含量均有所增加,但是SC8增加的幅度大于其四倍体,与抗寒能力越强,MDA含量增加越慢是一致的.CAT是对H2O2分解的活力单位,5 ℃处理达到24 h时,SC8中CAT的活力达到了最大值,而SC8四倍体在整个处理过程中CAT的变化没有显著差异.POD的活力在整个处理过程中呈现先下降后上升的趋势,而SC8四倍体的上升幅度大于SC8.结合5℃处理后的表型观察,推测SC8四倍体的耐寒性比SC8强.
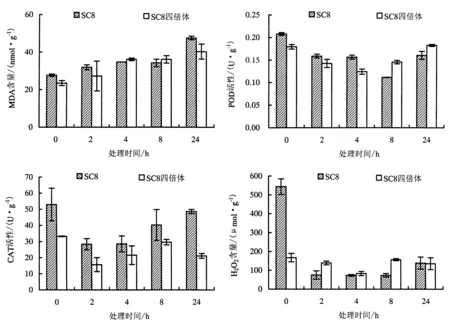
图4 低温(5 ℃)胁迫下生理指标的变化趋势Fig.4 Variation tendency of physiological indexes under low-temperature treatments (5 ℃)
2.4MeRFP8基因表达分析
采用实时荧光定量PCR技术对MeRFP8基因在5 ℃低温胁迫下的基因表达水平进行分析.将SC8组培苗5 ℃低温处理24 h,结果表明,与0 h相比,MeRFP8基因在5 ℃低温处理2 h表达量开始下降,4 h时表达水平最低,表达量是对照的0.27倍;处理8h后表达量开始上升,处理24 h后基因表达上调至最高,但表达量依然低于对照,是对照的0.6倍.而SC8同源四倍体组培苗中MeRFP8基因表达在5 ℃低温处理4 h下调幅度达到最大,8 h后基因表达量逐渐上升,24 h时表达量与对照相同,且整个低温处理过程中表达量变化幅度较小,没有显著性差异.在5个处理时间点,SC8组培苗MeRFP8基因的表达变化比四倍体明显(图5).
NZ199及其四倍体组培苗5 ℃低温处理0 、4和8 h后,表达结果显示:MeRFP8在NZ199及其四倍体中的表达趋势与SC8一致(图5).结合SC8及其四倍体5 ℃低温胁迫下生理指标结果以及已报道的文献[27,28],即四倍体比二倍体耐寒性强,推测MeRFP8基因可能参与木薯的低温响应.
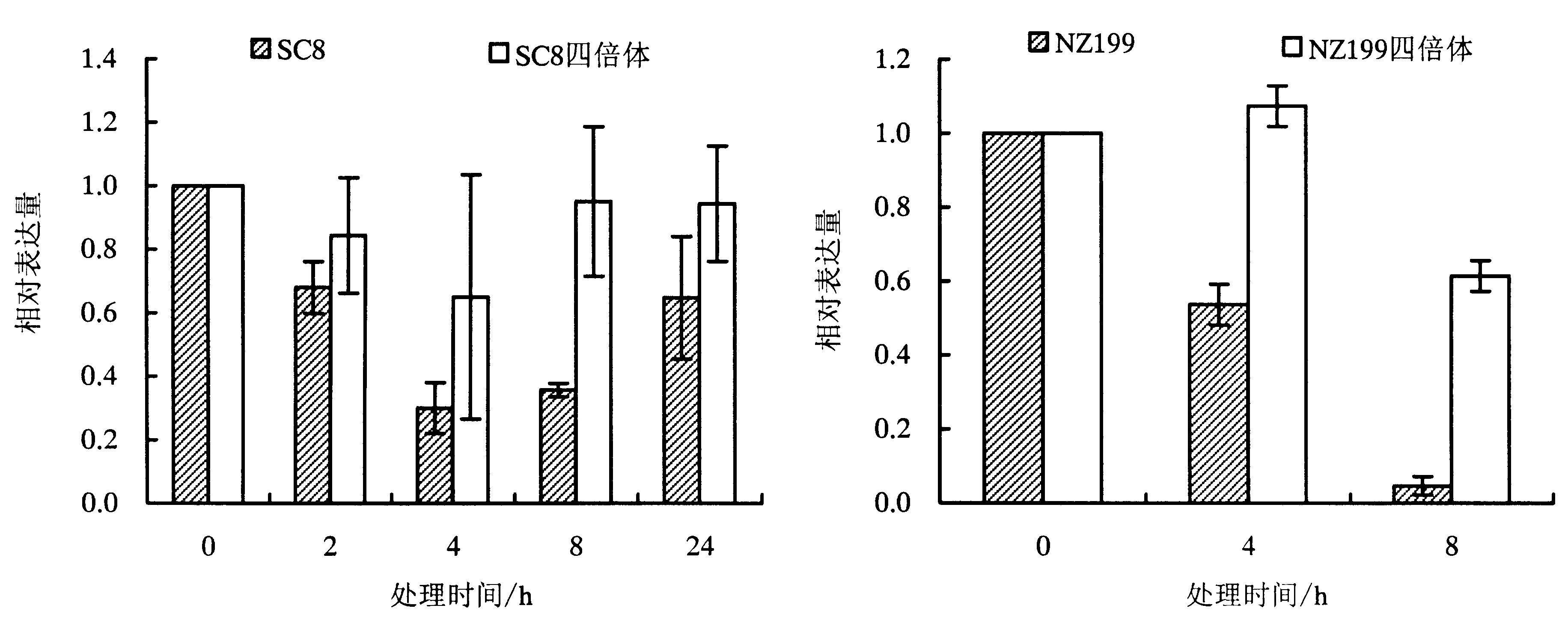
图5 低温(5 ℃)胁迫下MeRFP8基因的表达Fig.5 MeRFP8 expression in response to low-temperature treatments (5 ℃)
3 讨论
低温胁迫是影响木薯生长发育和产量提高的重要限制性因素,培育耐低温品种是促进木薯北移的重要手段之一.植物多倍体具有植株粗壮、叶片增大、花器官增大和抗逆性强等特点,因而倍性育种具有很大的潜在商业价值[29,30,31].An et al[32]研究表明,木薯多倍体表现出植株粗壮、块根增大、叶片变厚、叶色变深,叶绿素含量和CAT、POD等酶活性均显著优于二倍体,在木薯耐寒育种中具有显著优势.
环指蛋白是一类重要的锌指蛋白,在应对环境刺激中起关键作用.木薯具有RFP特征结构的家族基因报道较少,而与低温胁迫相关的RFP家族基因的研究还未见报道.本研究从低温胁迫的木薯SC8组培苗中克隆到一个含C3H2C3-type Ring Finger基因MeRFP8.CDD分析显示MeRFP8氨基酸序列具有保守结构域Ring finger motif,属于植物RFP基因家族成员.聚类分析结果显示,木薯MeRFP8蛋白与麻疯树(XP_012070295.1)蛋白聚为一类,进一步验证了木薯与麻风树同属于大戟科,具有较近的亲缘关系.基因表达结果显示,SC8叶片中MeRFP8基因表达受5 ℃低温诱导4 h时表达水平最低,表达量是对照的0.27倍;随着处理时间的延长,表达量逐渐升高,但比对照时的表达水平低.这与硬粒小麦的低温响应基因TdRF1[33]表达模式相似,而与拟南芥AtAIRP1[34],玉米ZmRFP1[35]和芜菁BrRZFP1[36]的低温响应基因表达模式相反(表达量先升高,随着处理时间的延长,表达量降低);大豆GmRFP1基因在低温胁迫时则下调表达[37].而马铃薯SbRFP1基因在耐低温植株中的表达水平明显高于低温敏感型植株[22].本研究中MeRFP8在SC8及其同源四倍体,NZ199及其四倍体中先下调表达,后上调表达,且表达模式是一致的,但SC8中MeRFP8的表达受低温胁迫诱导的程度比SC8四倍体强.因此,推测木薯MeRFP8可能与马铃薯SbRFP1基因具有相似的功能,在低温响应中发挥作用.而从木薯块根中克隆的木薯MeRZF(AEQ20638.1)基因[23],也含有RING-H2 zinc finger protein特征结构,但其氨基酸序列比本研究中的MeRFP8短,两个基因的同源性也很低,且MeRZF基因主要在干旱胁迫中起作用,推测MeRFP8和MeRZF虽然都含有RING-H2特征结构,但两者属于不同的家族,因此两者的同源性较低,且对不同的逆境起主要作用.
在后续研究中,将着重分析不同逆境处理下,SC8及其同源四倍体的生理参数以及MeRFP8蛋白的活性变化,采用酵母双杂交鉴定与MeRFP8互作的ABA和Glc信号通路;并试图通过转化MeRFP8活性形式验证MeRFP8的功能,希望建立木薯低温响应的泛素化信号途径,为开发抗寒分子标记辅助木薯抗寒种质的选育提供依据.
[1] CHINNUSAMY V, ZHU J, ZHU J-KANG. Gene regulation during cold acclimation in plants[J]. Physiol Plant, 2006,126(1):52-61.
[2] AHIN-C S, EVIK M, MOORE G A. Isolation and characterization of a novel RING-H2 finger gene induced in response to cold and drought in the interfertileCitrusrelativePoncirustrifoliata[J]. Physiol Plant, 2006,126(1):153-161.
[3] BRAY E A. Molecular responses to water deficit[J]. Plant Physiol, 1994,103(4):1 035-1 040.
[4] BOHNERT H J, NELSON D E, JENSEN R G. Adaptation to environmental stresses[J]. Plant Cell, 1995,7(7):1 099-1 111.
[5] CHEN B J, WANG Y, HU Y L, et al. Cloning and characterization of drought-inducible MYB gene fromBoeacrassifolia[J]. Plant Sci, 2005,168(2):493-500.
[6] LAITY J H, LEE B M, WRIGHT P E. Zinc finger proteins: new insights into structural and functional diversity[J]. Curr Opin Struct Biol, 2001,11(1):39-46.
[7] FREEMONT P S. The RING finger: a novel protein sequence motif related to the zinc finger[J]. Ann N Y Acad Sci, 1993,684(6):174-192.
[8] BORDEN K L B, FREEMONT P S. The RING finger domain: a recent example of a sequence-structure family[J]. Curr Opin Struct Biol, 1996,6(3):395-401.
[9] FREEMONT P S, HANSON I M, TROWSDALE J. A novel cysteine rich sequence motif[J]. Cell, 1991,64(3):483-484.
[10] FREEMONT P S. Ubiquitination: RING for destruction?[J]. Curr Biol, 2000,10(2):84-87.
[11] BORDEN K, BODDY M N, LALLY J, et al. The solution structure of the RING finger domain from the acute promyelocytic leukaemia proto-oncoprotein[J]. PML EMBO J, 1995(14):1 532-1 541.
[12] SATIJN D P, GUNSTER M J, VAN DER VLAG J, et al. RING1 is associated with the polycomb group protein complex and acts as a transcriptional repressor[J]. Mol Cell Biol, 1997,17(7):4 105-4 113.
[13] JOAZEIRO C A P, WEISSMAN A M. RING finger proteins: mediators of ubiquitin ligase activity[J]. Cell, 2000,102(5):549-552.
[14] HARDTKE C S, OKAMOTO H, STOOP-MYER C, et al. Biochemical evidence for ubiquitin ligase activity of theArabidopsisCOP1 interacting protein 8 (CIP8)[J]. Plant J, 2002,30(4):385-394.
[15] SEO H S, WATANABE E, TOKUTOMI S, et al. Photoreceptor ubiquitination by COP1 E3 ligase desensitizes phytochrome A signaling[J]. Genes Dev, 2004,18(6):617-622.
[16] LEE H, XIONG L, ZHU J K, et al. TheArabidopsisHOS1 gene negatively regulates cold signal transduction and encodes a RING finger protein that displays cold-regulated nucleocytoplasmic partitioning[J]. Genes, 2001,15(7):912-924.
[17] DONG C H, AGARWAL M, ZHU J K, et al. The negative regulator of plant cold responses, HOS1, is a RING E3 ligase that mediates the ubiquitination and degradation of ICE1[J]. Proc Natl Acad Sci, 2006,103(21):8 281-8 286.
[18] MCNELLIS T W, ARNIM A G, DENG X W. Overexpression ofArabidopsisCOP1 results in partial suppression of light mediated development: evidence for a light-inactivable repressor of photo morphogenesis[J]. Plant Cell, 1994,6(10):1 391-1 400.
[19] MCNELLIS T W, TORII K U, DENG X W. Expression of an N-terminal fragment of COP1 confer a dominant-negative effect on light-regulated seedling development inArabidopsis[J]. Plant Cell, 1996,8(9):1 491-1 503.
[20] YANG X H, SUN C, LIN Z P, et al. Molecular cloning and characterization of a gene encoding RING zinc finger ankyrin protein from drought-tolerantArtemisiadesertorum[J]. J Biosci, 2008,33(1):103-112.
[21] SONG J W, XING Y L, SHOAIB M, et al. An ATL78-like RING-H2 finger protein confers abiotic stress tolerance through interacting with RAV2 and CSN5B in tomato[J/OL]. Frontiers in Plant Science, 2016, 7 (e50785), doi: 10.3389/fpls. 01305.
[22] ZHANG H L, LIU X, LIU J, et al. A novel RING finger gene, SbRFP1, increases resistance to cold-induced sweetening of potato tubers[J]. FEBS Letters, 2013,587(6):749-755.
[23] REIS S P, TAVARES L S, COSTA C N, et al. Molecular cloning and characterization of a novel RING zinc-finger protein gene up-regulated under in vitro salt stress in cassava[J]. Mol Biol Rep, 2012,39(6):6 513-6 519.
[24] FAO. Food and agricultural organization of the United Nations (http://www.fao.org/search/zh/)[EB/OL]. Production year book, Rome, 2014.
[25] ROGERS D J. Studies onManihotesculentaCrantz (cassava) and related species[J]. Bull Torrey Bot, 1963,90(1):42-54.
[26] GU B, YAO Q Q, LI K M, et al. Change in physicochemical traits of cassava roots and starches associated with genotypes and environmental factors[J]. Starch/Starke, 2013,65(3-4):253-263.
[27] 商宏莉,郭启高,宋明,等.生姜四倍体抗热性与抗寒性的初步研究[J].西南农业大学学报,2003,25(3):210-211,233.
[28] LIU S Y, CHEN S M, CHEN Y, et al.Invitroinduced tetraploid of Dendranthema nankingense (Nakai) Tzvel. shows an improved level of abiotic stress tolerance[J]. Sci Hort-Amsterdam, 2011,127(3):411-419.
[29] HUANG H P, GAO S L, CHEN L L.Invitroinduction and identification of autotetraploids ofDioscoreazingiberensis[J]. In Vitro Cell Dev Biol-Plant, 2008,44(5):448-455.
[30] GU X F, YANG A F, MENG H, et al.Invitroinduction of tetraploid plants from diploidZizyphusjujubeMill cv. Zhanhua[J]. Plant Cell Rep, 2005,24(11):671-676.
[31] ALLUM J F, BRINGLOE D H, ROBERTS A V. Chromosome doubling in aRosarugoseThunb hybrid by exposure ofinvitronodes to oryzalin the effects of node length, oryzalin concentration and exposure time[J]. Plant Cell Rep, 2007,26(11):1 977-1 984.
[32] AN F F, FAN J, CHEN S B, et al. Comparison of leaf proteomes of cassava (ManihotesculentaCrantz) cultivar NZ199 diploid and autotetraploid genotypes[J/OL]. PLOS ONE, 2014,9(4):e85991. doi:10.1371/journal.pone.0085991.
[33] GUERRA D, MASTRANGELO A M, LOPEZ-TORREJON G, et al. Identification of a protein network interacting with TdRF1, a wheat RING ubiquitin ligase with a protective role against cellular dehydration[J]. Plant Physiol, 2012,158(2):777-789.
[34] MOON Y R, SEOKKEUN C, WOO T K. TheArabidopsisC3H2C3-Type RING E3 ubiquitin ligase AtAIRP1 is a positive regulator of an abscisic acid-dependent response to drought stress[J]. Plant Physiol, 2010,154(4):1 983-1 997.
[35] XIA Z L, LIU Q J, DING J Q, et al. ZmRFP1, the putative ortholog of SDIR1, encodes a RING-H2 E3 ubiquitin ligase and responds to drought stress in an ABA-dependent manner in maize[J/OL]. Gene, 2012,495(2):146-153.
[36] JUNG Y J, LEE I H, NOU I S, et al. BrRZFP1 aBrassicarapC3HC4-type RING zinc finger protein involved in cold, salt and dehydration stress[J]. Plant Biol (Stuttg), 2013,15(2):274-283.
[37] DU Q L, CUI W Z, ZHANG C H, et al. GmRFP1 encodes a previously unknown RING-type E3 ubiquitin ligase in soybean (Glycinemax)[J]. Mol Biol Rep, 2010,37(2):685-693.
(责任编辑:吴显达)
Cloning and expression of aMeRFP8 gene in cassava (ManihotesculentaCrantz)
XUE Jingjing, CHEN Songbi
(Tropical Crops Genetic Resources Institute, Chinese Academy of Tropical Agricultural Sciences/Key Laboratory of Conservation and Utilization for Cassava Germplasm Resources, Danzhou, Hainan 571737, China)
To investigate the role of ring finger protein in plant′s response to cold, a full-length cDNA sequence ofMeRFP8 was firstly cloned from cassava SC8 by RT-PCR. The results showed thatMeRFP8 gene contained a 1 065 bp open reading frame (ORF), and encoded 352 amino acid residues, with a predicted molecular mass of 39.23 ku and theoretical isoelectric points (pI) of 4.84. It had a conserved RING finger domain (Ring-H2 zinc finger) at the C-terminal region, which belonged to C3H2C3 type ring finger protein. Then expression levels ofMeRFP8 gene in cassava SC8 and its autotetraploid genotypes were analyzed using real-time RT-PCR. The results showed that the expression ofMeRFP8 in SC8 and its autotetraploid was firstly down-regulated and then up-regulated, presenting a “V” pattern during 24 h at 5 ℃. Moreover, expression level ofMeRFP8 gene was higher in SC8 than its autotetraploid. To summarize,MeRFP8 is likely to be involved in the low temperature response of cassava.
cassava; ring finger protein;MeRFP8; gene clone; cold-resistant
2015-10-22
2016-07-04
国家自然科学基金(31271776);中央级公益性科研院所基本科研业务费专项资助项目(1630032013005).
薛晶晶(1983-),女,助理研究员,博士.研究方向:木薯基因克隆和表观遗传学.Email:xuetao608@163.com.通讯作者陈松笔(1966-),男,博士,研究员.研究方向:木薯蛋白质组学.Email:songbichen@hotmail.com.
S533
A
1671-5470(2017)01-0073-08
10.13323/j.cnki.j.fafu(nat.sci.).2017.01.012

