复发性腹膜后多发去分化脂肪肉瘤一例
杨鸿国 王知非 陶亮 陆逸庭 吴伟顶 胡智明
复发性腹膜后多发去分化脂肪肉瘤一例
杨鸿国 王知非 陶亮 陆逸庭 吴伟顶 胡智明⋆
脂肪肉瘤为常见的软组织肿瘤之一,发病率仅次于恶性纤维组织细胞瘤(MFH),而在腹膜后居发病率第1位。去分化脂肪肉瘤(DL)作为脂肪肉瘤的一种特殊亚型,属于高度恶性肿瘤。2013年作者收治1例复发性腹膜后脂肪肉瘤1例。现报道如下。

图1 增强CT
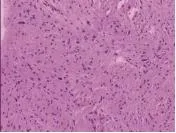
图2 术后病理检查

图3 增强CT
1 临床资料
患者男性,44岁,因“腹腔肿块切除术后3年”于2013年4月8日收入浙江省人民医院。患者3年前体检时B超检查发现右侧腹部一巨大肿块,约12cm×10cm,无畏寒发热,无恶心呕吐,无呕血黑便,无腹痛腹胀腹泻,无腹部痛反跳痛。于2010年4月在当地医院行“腹腔肿块切除术”,术后病理诊断:后腹膜炎性脂肪肉瘤。术后7个月患者再次发现右腹部肿块,并伴有腹胀、反酸,进食后上述症状加重。体格检查:右侧腹部触及巨大包块,质地偏硬,上至肋缘,下达脐下2cm,包块边界尚清,活动度尚可,无明显触痛;辅助检查:白细胞计数 14.19×109/L,中性粒细胞分类 82.6%,血红蛋白132.0g/L,血小板计数297×109/L;白蛋白39.0g/L,AST 44U/L,ALT 50U/ L,总胆红素10.7μmol/L;CEA 0.6μg/L,CA199 3.59U/ ml。乙肝表面抗原阳性,乙肝表面抗体阴性,乙肝E抗原阳性,乙肝E抗体阴性,乙肝核心抗体阳性。B超检查显示腹腔内可见约209mm×91mm×155mm中低回声团块,位于左肝下方至脐下40mm,腹主动脉前方,两侧达腋前线,边界欠清,内回声不均。增强CT:腹腔内可见两个类圆形巨大占位,大小分别为:165mm×96mm×200mm、37mm×35mm×50mm,呈等低密度,密度不均匀,与腹腔内脏器分界模糊(见图1)。于2010年12月行腹腔肿块切除术,术中见腹腔被一巨大肿瘤占据,约200mm×170mm大小,黄色、质硬、分叶状,有包膜,与周围脏器粘连明显,包绕侵犯十二指肠,周围可及直径30~100mm不等相同性状肿块,予以完整切除,并将粘连的十二指肠水平部做部分肠壁切除。术后病理均诊断“腹腔去分化脂肪肉瘤,多灶。免疫组化IHC:S-100(-),CD68(+),HMB45(-),ALK-1(-),SMA可疑阳性,CD34(-),Vim(+),Ki-67(+)”。(见图2)术后9个月,患者再次发现右腹部肿块约拳头大小,性状同前,无伴不适,未治疗,后肿块逐渐增大,无伴不适。体格检查:右上腹部可及约100mm×80mm大小肿块,性状同前。辅助检查:胸片、心电图、血常规、生化、肿瘤指标等未见明显异常。腹部增强CT见腹腔内巨大肿块,大小约180mm×84mm,密度不均匀,边界尚清,增强扫描可见片状不均匀强化。右侧腹膜后肾内下缘可见巨大囊实性肿块,较大截面约123mm×87mm。(见图3)完善术前准备后于2012年4月23日行腹腔巨大肿块切除术,术中见腹腔内巨大肿瘤约200mm×250mm,性状同前次手术,同时于后腹膜肾前、胃后及胰周探及50~100mm不等相同性状肿块,包膜尚完整,予以沿包膜完整切除肿块后送病理,病理诊断:去分化脂肪肉瘤(见图4)。术后患者无不适。手术后11个月患者复查B超检查发现腹腔内多个大小不等等回声及低回声团,最大约83mm×65mm,边界尚清。体格检查无特殊。辅助检查:血常规、X线胸片、心电图、生化、肿瘤指标等未见明显异常。于2013年4月15日再次行腹腔去分化脂肪肉瘤切除术,术中见肝十二指肠韧带及十二指肠外侧缘60mm×55mm大小质软肿块,边界不清,下腹部肠系膜内40mm×40mm大小性状相同肿块,右侧肾包膜外侧,腰大肌后缘可及多发鱼肉样肿块,予以切除肝十二指肠韧带、十二指肠及周围组织,沿肿块边缘1cm附带部分肠系膜切除,腰大肌后缘肿块沿包膜切除。术后病理诊断:腹腔去分化脂肪肉瘤(肾周),脂肪肉瘤(十二指肠周围及肠系膜)(见图5)。随访发现手术后2个月CT再次提示后腹膜处肿块复发。

图4 术后病理检查
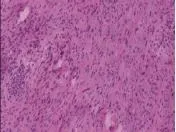
图5 术后病理检查
2 讨论
脂肪肉瘤共分为5个亚群:分化较好,黏液样,圆细胞,多形性,和去分化。脂肪肉瘤从分子遗传学角度分为3类:(1)高分化脂肪肉瘤。(2)黏液性和圆形脂肪肉瘤。(3)多形性脂肪肉瘤。其中以高分化脂肪肉瘤多见,且能进展为去分化脂肪肉瘤[1]。去分化脂肪肉瘤(DL)是脂肪肉瘤的一个特殊亚型,属高度恶性肿瘤,约占脂肪肉瘤的10%~15%[2-3]。手术切除是治疗去分化脂肪肉瘤的首选治疗方式,然而,去分化脂肪肉瘤容易复发,特别是局部复发,其特点为原位复发、多次复发,如本例为右肾周围多次复发,同时常伴周围脏器浸润,如本例中侵犯十二指肠壁等。去分化脂肪肉瘤的生长和发展一般为离心式球形生长,周围软组织常受压至细胞萎缩,使肿瘤呈现出一个似有边界的肿块。同时,受压组织水肿、新血管增生与正常组织之间形成一层“假包膜”,有些肉瘤细胞可穿过假包膜进入正常组织,因此肉眼观察下完整切除并非真正做到完全切除。进入正常组织的肉瘤细胞进一步发展为“卫星结节”,如与主瘤相互融合则肿瘤表现为多结节性即堆积性,未融合者表现为分离较远性[4]。该病例中肿瘤有包膜,虽然也沿包膜切除,但肿瘤部分已穿透十二指肠壁等周围脏器,且部分肿瘤相互融合成多节结。因此手术时很难做到“完整”切除。而手术未能清扫的肉瘤细胞将是肿瘤复发的主要原因之一。由于上述因素,肿瘤联合周围粘连的脏器切除,可以更好地清除肉眼无法观测到的肿瘤,延长肿瘤复发的时间间隔,提高患者的生存率。故该病例选择行十二指肠部分切除。迄今,对于复发病例多数学者仍然倾向于争取再次手术切除,以缓解症状,延长生存期[5]。该患者已多次手术切除,随访近期肿块复发增大,准备再次行手术切除。
本病例中发现早期肿块中有脂肪细胞,晚期切除的肿块中以梭形细胞为主,少见脂肪细胞,呈现完全去分化的趋势发展,提示去分化脂肪肉瘤的预后较差。免疫组化:去分化区域CD68(+)、vim(+);高分化区域S-100(-),SMA(阳性可疑);血管CD34(-);Ki-67(+)。S-100在分化好的脂肪肉瘤区域明显表达,而在分化差的区域低表达;CD68 和vim则与之相反,提示该病例分化较差。
预后:约40%~60%的去分化脂肪肉瘤术后仍有局部复发倾向,在15%~20%的病例中存在远处转移,且总体5年病死率达30%~40%,其预后不甚理想。关于DDL的放化疗,目前仍存在争议。刘静等[6]学者认为对于肿瘤不能切除者可先行化疗或放疗,再行Ⅱ期手术,以争取做全切除或部分切除,较多学者认为放化疗对DDL作用有限[7~9]。考虑该患者腹腔内多发,所需放化疗剂量较大,故未予以行放化疗治疗。目前有研究显示,靶向药物如:MDM2 拮抗剂 、CDK4 抑制剂、ASK1 拮抗剂 等可能对去分化脂肪肉瘤的治疗有良好的疗效,提供新的治疗前景[10]。
[1] Yusuke A,Kazuo Y,Hitomi K,et al. Huge retroperitoneal dedifferentiated liposarcoma presented as acute pancreatitis : Report of a case. The Journal of Medical Investigation, 2013,60(1-2):164-168.
[2] Hara R. A Retroperitoneal Dedifferentiated Liposarcoma Producing Granulocyte Colony-Stimulating Factor Accompanied by Spontaneous Rupture: PET/CT Imaging of a G-CSF Producing Tumor. Case Rep Oncol, 2011,4(1):236-241.
[3] 张忻平,吴国强,吕晨光. 腹膜后巨大去分化脂肪肉瘤一例.解放军医药杂志,2011,23(6):84.
[4] 汤钊猷.现代肿瘤学. 上海: 上海医科大学出版社, 1993: 1034.
[5] Erzen D,Scncar M,Novak J. Retrosperitoneal sarcoma:25 years of experience with aggressive surgical treatment at the institute of oncology,Ljubljana. J Surg oncol,2005, 91(1):1-9.
[6] 刘静,白艳春,张艳霞,等. 腹膜后多发巨大脂肪肉瘤1例. 实用医药杂志,2012, 29(4):292.
[7] 许咏冬,孙伟燕,赵纯,等.罕见纵膈脂肪肉瘤1例诊治体会及文献复习. 实用肿瘤杂志,2009,24(3): 288-290.
[8] 澎涛,徐莹莹,鲁种,等. 腹膜后脂肪肉瘤的生物学特性及其诊断和治疗. 中国实用外科杂志,2007, 27(4): 289-291.
[9] 师英强. 腰背部伴腹膜后肿瘤8次手术治疗讨论.中国实用外科杂志,2008, 28(4):304-312.
[10] 杨韵, 舒晔, 谢宇. 罕见皮下组织去分化脂肪肉瘤1例报道. 中国普外基础与临床杂志, 2011, 18(6):582.
310053 浙江中医药大学(杨鸿国)
314408 浙江省海宁市中心医院(陶亮 陆逸庭)
310014 浙江省人民医院(王知非 吴伟顶 胡智明)
*通信作者

