氯化铵受热分解实验再改进

一、课本实验的缺陷
苏教版高中化学教材必修一第99页“活动与探究”通过加热氯化铵晶体,让学生感知“铵盐受热易分解”这一性质。课本原有的设计如图1,加热试管中氯化铵晶体,很快就能观察到:试管底部的固体越来越少,产生大量的白烟,一段时间后试管口附近出现大量白色固体,经检验仍为氯化铵。对于这一现象,所涉及反应原理为NH4Cl [△]NH3+HCl,NH3+HCl=NH4Cl。
按照圖1装置进行实验,存在如下两点不足之处:(1)试管中产生的气体无法检验其性质,更不能证明产生了两种气体;(2)因为加热固体碘也会看到同样的现象,所以在此学生会类比、联想、猜测氯化铵固体由底部转移至试管上部,首先“升华”而后“凝华”,老师虽然明白这是一个错误的结论,但却不能通过巧妙的实验设计呈现明显的实验现象揭示其中的奥秘。
二、现有的改进方案
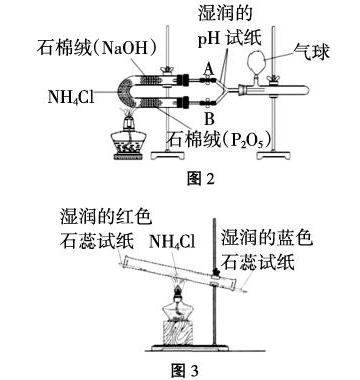
笔者教学中也曾遇到同样的问题,通过文献检索,发现多数实验均围绕上述两点不足进行改进,如图2、图3。
采用图2装置进行实验,试纸有明显颜色变化,可观察到Y型管、具支试管中白色固体的出现,但整套装置过于复杂,有悖实验的微型化发展方向,且Y形管易被氯化铵固体堵塞;利用HCl、NH3密度差异,有老师设计了图3装置分离两种气体并进行气体性质的检验,但实际实验的效果并不明显,上端红色试纸稍稍变蓝但下端蓝色试纸几乎看到变红,说明利用密度自主分离效果不佳,而且看不到白烟的再现。
三、实验的创新设计
1.实验仪器与药品
铁架台、3个直角玻璃管、酒精灯、石棉绒、红色石蕊试纸、蓝色石蕊试纸、NH4Cl晶体、碱石灰、P2O5、蒸馏水。
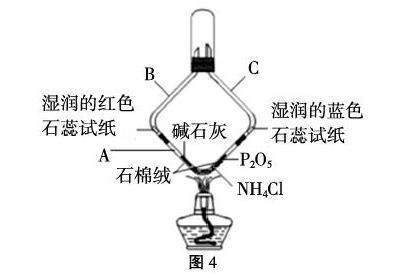
2.实验装置(右图4)
3.实验步骤和现象
(1)向直角A中填装NH4Cl固体置于直角处(填料约1.5~2cm长),再在两侧装入少许石棉绒(约0.5cm长),用小玻璃棒推至NH4Cl固体处,最后再在石棉绒的上面分别添加碱石灰及P2O5固体少许(约0.5cm长),具体过程如图5。
(2)在B、C两管内放入用蒸馏水湿润的蓝色石蕊试纸、红色石蕊试纸。
(3)将装置按图进行连接,并用铁夹夹住试管口处,将整套装置固定在铁架台上。然后点燃酒精灯,先预热,再对准氯化铵固体加热,观察实验现象。
(4)实验现象:直管A中固体越来越少,湿润的红色石蕊试纸变蓝,蓝色石蕊试纸变红,上方的大试管中充满了白烟。
4.实验注意事项
(1)实验中所用药品(碱石灰、P2O5)及三个直角玻璃管要预先烘干。
(2)填装药品时因P2O5干燥效率极高,故可先装入碱石灰,再装P2O5。
(3)填料应疏松多孔,保证气体可以快速被两边的吸收剂吸收,剩余气体能接触到试纸,确保能观察到试纸颜色变化。
四、实验创新之处
1.装置简单,构思巧妙,直角玻璃管自制而成,实验所需药品少,符合微型化发展方向。
2.操作简单,现象明显,成功率高,可推广性强。
3.在整套装置中完成了NH4Cl的分解;HCl、NH3的检验;HCl、NH3重新反应生成NH4Cl三个实验,整个实验过程没有任何污染,充分体现了化学实验的绿色化要求。
4.通过对实验过程的分解,有助于学生认识氯化铵分解和碘的升华的本质区别,并加深了学生对可逆反应概念的理解。
作者简介:张宝军(1972.8—),男,汉族,江苏如皋,学士学位,化学教研组长,中学高级教师,研究方向:高中化学学生核心素养的培养。
编辑 张珍珍
新课程·教师2017年12期
