一种通用高效液相色谱测定植物叶片内源激素水杨酸的方法
林文芳, 张 虹, 洪庄玉, 缪 颖, 林文雄
(福建农林大学生命科学学院,福建 福州 350002)
一种通用高效液相色谱测定植物叶片内源激素水杨酸的方法
林文芳, 张 虹, 洪庄玉, 缪 颖, 林文雄
(福建农林大学生命科学学院,福建 福州 350002)
以3-羟基-苯甲酸为内标,利用甲醇提取拟南芥叶片水杨酸,然后用三氯乙酸和盐酸溶解,再用乙酸乙酯∶环己烷(1∶1)萃取浓缩,高效液相色谱法测定.结果表明流动相0.2 mol·L-1醋酸钠∶甲醇(9∶1)pH为6.0时,水杨酸独立出峰,分离效果最好.用水稻及水仙叶片验证该提取及测定方法,效果良好,说明该方法在植物中具有一定的通用性.
水杨酸; 高效液相色谱; 3-HBA; 植物叶片
水杨酸(salicylic acid, SA)是广泛存在于植物体内的一类小分子酚类物质.它在植物新陈代谢、生长发育过程和免疫应答中发挥重要作用[1-3].同时作为天然信号因子,SA提高许多植物的生物及非生物胁迫抗性[4],例如臭氧胁迫[5]、UV-B胁迫[6]、干旱胁迫[7]、冷害[8]、盐和渗透压胁迫[9],提高重金属耐受性[10]等.准确测定植物的SA含量是深入研究其功能的必要前提.但是,SA在植物体内含量甚微,长期以来,为了探索出灵敏准确且简单易行的测定方法,国内外学者做了很多研究.
早期,基于专一抗体的放射免疫法和酶联免疫法常被用于激素的测定,这两种方法对激素提取液的纯度要求不高,但准确性低,重复性差[11].高效液相色谱法(high performance liquid chromatography, HPLC)及气相色谱质谱联用仪(gas chromatograph-mass spectrometer, GC-MS)是目前测定SA的两种常用方法[12-15].GC-MS主要用于定性定量分析沸点较低、热稳定性好的化合物。GC-MS测定SA时需经过甲基化、吸附剂吸附、有机溶剂洗脱提纯后再测试[15-16],增加了试验的复杂性,且大批量检测会随着有机溶剂的挥发出现较大误差。 HPLC作为一种高效分离纯化技术,灵敏度高、专一性强、重复性好,被广泛用于植物激素测定(乙烯除外)[17-20].由于SA自发荧光,HPLC荧光检测SA具有灵敏度高、分离效果好,检出限低等优点,是应用最广泛的SA测定方法,而国内外学者也针对样品研究更合适的提取及测试技术.
本试验以双子叶模式植物拟南芥为供试材料,探讨以3-羟基-苯甲酸(3-hydroxy benzoic acid, 3-HBA)[14,21]为内标提取拟南芥叶片中的SA 及HPLC测定SA的最佳条件,以单子叶模式植物水稻及叶片中次生物质较多的水仙作为供试材料,验证本方法的适用性,以构建植物通用的SA提取及测定方法.
1 材料与方法
1.1 材料
拟南芥种植于蛭石小钵中,在人工气候室条件下培养(恒温22 ℃,昼夜时长比13/11).用0.1%花多多浇灌.取材部位为莲座叶时期的叶片,每份样品取3株拟南芥混合,重复3次.液氮速冻后移至-80 ℃冰箱待用.水稻室外土培,种子萌发后苗期用Hoagland[22]营养液培育,移栽入土后施复合肥;水仙采用室内沉淀过夜后的自来水水培.
1.2 植物叶片水杨酸提取
参考Verberne et al建立的方法[18]:在液氮条件下充分研磨叶片,取少量转入2 mL离心管(如无特别说明,本试验所用的离心管规格均为2 mL),准确称量并记录每管样品重量(精确到0.000 1g),3个重复.多余干粉存于-80 ℃冰箱.每个离心管加入1 mL 90%甲醇,并加入内标3-HBA(Sigma-Aldrich,USA),涡旋1 min后,超声5 min,4 ℃下、12000 rpm离心5 min.转移上清液到新的离心管,下层沉淀加入0.8 mL甲醇,重复上述操作,混合两次上清液.在混合上清液中加入10 μL 0.2 mol·L-1的NaOH溶液,在真空离心浓缩仪上浓缩,待离心管中剩下约10 μL液体时加入250 μL 5%TCA,涡旋1 min;再加入0.8 mL乙酸乙酯∶环己烷(1∶1),涡旋1 min,充分萃取,4 ℃下、12000 rpm离心5 min,转移上层有机相到新的离心管;于下层水相中加入0.3 mL 8 mol·L-1HCl,放入80 ℃水浴锅温育1 h,让结合态SA充分被HCl提取.温育结束后于离心管中加入0.8 mL乙酸乙酯:环己烷(1∶1),重复上述操作,混合两次上层有机相.混匀后加入60 μL流动相 0.2 mol·L-1醋酸钠水溶液,真空干燥浓缩,待离心管中剩下约60 μL液体时取出加入940 μL 流动相醋酸钠水溶液,涡旋1 min,让其充分溶解于流动相.通过0.22 nm水相滤膜过滤至进样瓶,存于4 ℃冰箱待测.
1.3 回收率测定
相较于以往SA的HPLC和GC-MS检测,SA的提取回收率只有 25%~73%[12,23-25],而Verberne et al[18]方法自由态SA的回收率能达到71%~91%,结合态SA回收率能达到65%~79%,本试验按照其方法测定关键提取步骤回收率.
1.3.1 蒸发测试 离心管中加入1.5 mL 90%甲醇、2 μL 1 μg·μL-1SA 标准样品、2 μL 10 μg·μL-13-HBA,混匀后加入10 μL 0.2 mol·L-1的NaOH后于真空浓缩干燥仪上浓缩,剩余10 μL溶液时加入1 mL流动相,HPLC测定分析,重复3次.
1.3.2 升华测试 离心管中加入1.5 mL乙酸乙酯∶环己烷(1∶1)、2 μL 1 μg·μL-1SA 标准样品、2 μL 10 μg·μL-13-HBA.混匀后加入60 μL醋酸钠水溶液后放入真空浓缩干燥仪上浓缩,剩60 μL时加入940 μL流动相,用HPLC检测SA及3-HBA,重复3次.
1.3.3 SA和3-HBA回收测试 取2 μL 1 μg·μL-1SA、2 μL 10 μg·μL-13-HBA按照上述水杨酸提取过程操作,提取后过滤至进样瓶待检,做3个平行.
1.4 高效液相色谱测定水杨酸方法的优化
本试验采用日本岛津的高效液相色谱(LC-20A),岛津inertsil ODS-3液相色谱柱(5 μm,4.6 mm×150 mm),荧光检测器(RF-20A)检测.根据Verberne et al[18]设定测定参数:流动相0.2 mol· L-1醋酸钠(pH 5.5)∶甲醇=9∶1,流速0.8 mL·min-1,恒温40 ℃,20 μL进样.SA检测波长λex/λem=305 nm/407 nm.分别调整醋酸钠水溶液比例为85%及pH为5.65、5.75、6.0进行HPLC测定,确定最适检测条件.流动相醋酸钠水溶液用6 mol·L-1的 HCl和1 mol·L-1的NaOH水溶液调节相应pH,定容.
凡音乐材料来自剧种主调的单节型过腔,即为单节型主调性过腔。如“昆南”阳入声字“月”的唱调(《白兔记·养子》【锁南枝】“星月朗”,670),该单字唱调的过腔是该过腔的音乐材料来自“昆南”主调,故谓之单节型主调性过腔。
1.5 SA及3-HBA标准曲线及3-HBA回归曲线的制作
SA和3-HBA分别溶解在50%甲醇中配成母液备用.SA按照0.01、0.05、0.1、0.2、0.5、1、5 μg·mL-1浓度梯度,3-HBA按照0.2 、1、2、4、10、20、100 μg·mL-1浓度梯度制作标准曲线,重复3次.分别将5、10、20、50、100 μg·mL-1的3-HBA加入拟南芥干粉提取SA,测定3-HBA的含量,制作回归曲线,重复3次.根据检测得到的SA与3-HBA数值确定内标使用量.
1.6 其他植物水杨酸提取及测定
水稻及水仙按照上述方法进行水杨酸的提取及测定,检验该方法的通用性.
2 结果与分析
2.1 回收率测定
由表1可得,甲醇蒸发试验中SA和3-HBA的回收率均在85%以上且较相近,说明甲醇适用于SA的提取.乙酸乙酯∶环己烷(1∶1)升华试验中两者的回收率范围为80%~90%,说明乙酸乙酯∶环己烷(1∶1)适用于SA的提取及其内标的萃取.回收试验中二者回收率高且相近,说明此提取方案对SA和3-HBA损失小,可行性高,同时证实3-HBA适合作为SA含量测定时的内标.

表1 SA和3-HBA的回收率1)Table 1 Recovery of SA and 3-HBA
1)所有数值为平均值±标准差.
2.2 流动相最佳pH值的确定
通常认为SA测定时,流动相0.2 mol·L-1醋酸钠的最佳pH值为5.5[19,26].在本试验中,当pH值为5.5时,SA峰在后半段有1个凸起,推断是相邻2个峰叠加(图1A);内标3-HBA与相邻的物质叠加在一起,无法很好地分开.因峰叠加无法准确计算峰面积比例,即待测物的含量 .因此本试验对流动相的比例及pH进行调整.
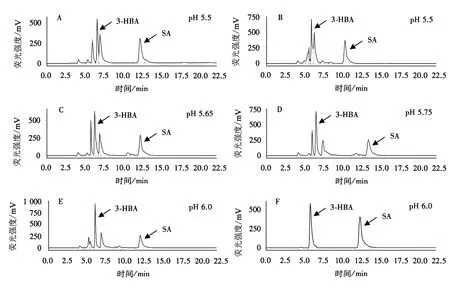
A和C-F:流动相分别为醋酸钠(pH 5.5、5.65、5.75、6.0、6.0)∶甲醇=9∶1;B:流动相为pH 5.5醋酸钠∶甲醇=85∶15图1 流动相醋酸钠水溶液在不同pH条件下SA的HPLC检测图Fig.1 HPLC detection images of SA in sodium acetate under different pH
2.3 SA、3-HBA标准曲线及3-HBA回归曲线
由图2可得,SA和3-HBA标准曲线的R值性在0.999以上,线性关系好.3-HBA回归曲线的R值也达到0.999以上,说明内标3-HBA不受植物本身物质及提取过程的影响,表明提取方案及内标选择的可行性.同时对比测得的SA与3-HBA含量,确定最适内标含量为20 μg·mL-1.
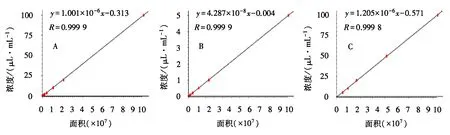
A:3-HBA标准曲线;B:SA标准曲线C:3-HBA回归曲线.图2 3-HBA、SA标准曲线及3-HBA回收曲线Fig.2 Standardization curve of 3-HBA and SA and recovery curve of 3-HBA
2.4 其他植物水杨酸含量的测定
按照以上优化后的条件,分别以醋酸钠pH 5.75和6.0对水仙及水稻叶片进行SA的提取及测定,检测结果如图3.
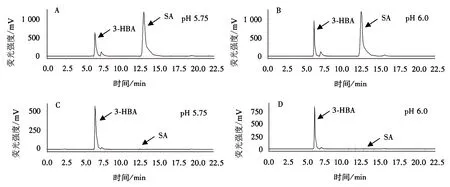
流动相为醋酸钠∶甲醇(9∶1)时水稻(A和B)和水仙(C和D)叶片SA检测HPLC图.图3 水稻和水仙叶片SA的HPLC检测图Fig.3 HPLC detection image of SA in rice and narcissus leaf
从图3看出,在水稻叶片中SA含量高,在水仙叶片中SA含量几乎检测不到,同时可以看出二者检测物与拟南芥相比比较单一,而且流动相醋酸钠pH为5.75或6.0时3-HBA和SA都显示为单峰,2个pH值都适合.这提示我们可以根据不同植物的提取物对流动相pH进行微调以获得最佳条件.
3 讨论
3.1 样品制备
浓缩蒸发是样品制备的重要环节.在浓缩过程中加入适量适当pH值的缓冲液,对保护SA在浓缩过程中不被破坏有一定作用;否则样品干燥后会随着放置时间延长,回收率逐渐降低甚至降至30%[18].本试验在浓缩过程中分别加入NaOH和醋酸钠水溶液检测获得的3-HBA和SA的回收率高,重复性好.
此外,性质稳定、检测波长与待测物质相近,且不受提取条件及植物自身物质的影响是内标选择的基本要求.邻甲氧基苯甲酸和3,4-HBA也可作为SA测定时的内标[18,25],但邻甲氧基苯甲酸的重复性较差,3,4-HBA的回收率低于SA[18].本试验采用的3-HBA和SA的回收率接近,回收曲线线性关系好,说明3-HBA不受提取过程及叶片自身提取物影响,适合作为SA的内标.
3.2 高效液相色谱检测条件的优化
色谱条件的选择对检测图谱的分析很重要.流动相对色谱峰图影响比较大,不合适的流动相导致色谱图峰形不好且拖尾严重,流动相的比例和种类应根据色谱柱的分离对象和检测器的情况综合考虑,尽可能地增大流动相和固定相的极性差别以得到最好的分离效果[26].流动相的pH影响分离效果,过酸将导致出峰错误,峰形不好,不同pH对准确区分各类物质尤其是待测物意义重大,本研究针对性地讨论不同pH流动相对SA检测的影响.
试验结果表明,流动相pH为6.0时拟南芥叶片SA检测效果最好;pH的改变对内标3-HBA的检测影响较大,对于SA影响较小;流动相pH为5.65~6.0时都能较好地分离SA.优化后的方法同时适用于水稻、水仙叶片SA检测,水稻、水仙叶片提取物检测到的峰图比较简单,流动相pH值的影响比较小,说明可针对不同样品及内标,调整流动相pH以获得最佳检测效果.
[1] KAWANO T, BOUTEAU F. Crosstalk between intracellular and extracellular salicylic acid signaling events leading to long-distance spread of signals[J]. Plant Cell Rep, 2013,32(7):1 125-1 138.
[2] AN C, MOU Z. Salicylic acid and its function in plant immunity[J]. J Integr Plant Biol, 2011,53(6):412-428.
[3] RIVAS-SAN VICENTE M, PLASENCIA J. Salicylic acid beyond defence: its role in plant growth and development[J]. J Exp Bot, 2011,62(10):3 321-3 338.
[4] HAYAT Q, HAYAT S, IRFAN M, et al. Effect of exogenous salicylic acid under changing environment: a review[J]. Environ Exp Bot, 2010,68(1):14-25.
[5] KOCH J R, CREELMAN R A, ESHITA S M, et al. Ozone sensitivity in hybrid poplar correlates with insensitivity to both salicylic acid and jasmonic acid. The role of programmed cell death in lesion formation[J]. Plant Physiol, 2000,123(2):487-496.
[6] NAWRATH C, HECK S, PARINTHAWONG N, et al. EDS5, an essential component of salicylic acid-dependent signaling for disease resistance in Arabidopsis, is a member of the MATE transporter family[J]. Plant Cell, 2002,14(1):275-286.
[7] CHINI A, GRANT J J, SEKI M, et al. Drought tolerance established by enhanced expression of the CCI-NBS-LRR gene, ADR1, requires salicylic acid, EDS1 and ABI1[J]. The Plant Journal, 2004,38(5):810-822.
[8] KANG H M, SALTVEIT M E. Chilling tolerance of maize, cucumber and rice seedling leaves and roots are differentially affected by salicylic acid[J]. Physiologia Plantarum, 2002,115(4):571-576.
[9] BORSANI O, VALPUESTA V, BOTELLA M A. Evidence for a role of salicylic acid in the oxidative damage generated by NaCl and osmotic stress inArabidopsisseedlings[J]. Plant Physiology, 2001,126(3):1 024-1 030.
[10] ZHANG Y, XU S, YANG S, et al. Salicylic acid alleviates cadmium-induced inhibition of growth and photosynthesis through upregulating antioxidant defense system in two melon cultivars (CucumismeloL.)[J]. Protoplasma, 2015,252(3):911-924.
[11] ALBRENT T, KEHLEN A, STAHL K, et al. Quantification of rapid, transient increases in jasmonic acid in wounded plants using a monoclonal antibody[J]. Planta, 1993,191(1):86-94.
[12]VERBERNEM C, BROUWER N, DELBIANCO F, et al. Method for the extraction of the volatile compound salicylic acid from tobacco leaf material[J]. Phytochem. Anal, 2002,13(1):45-50.
[13] SCHMELZE A, ENGELBERTH J, ALBORN H T, et al. Simultaneous analysis of phytohormones, phytotoxins, and volatile organic compounds in plants[J]. Proceedings of the National Academy of Sciences USA, 2003,100(18):10 552-10 557.
[14] ABOUL-SOUD M A M, COOK K, LOAKE G J. Measurement of salicylic acid by a high-performance liquid chromatography procedure based on ion-exchange[J]. Chromatographia, 2004,59(1-2):129-133.
[15] ENGELBERTH M J, ENGELBERTH J. Monitoring plant hormones during stress responses[J]. Journal of Visualized Experiments, 2009(28):e1127.
[16] 宋圆圆,徐建峰,梁笑婷,等.利用气相色谱法同时测定番茄叶片中的信号物质水杨酸和茉莉酸[J].江西农业大学学报,2010,32(5):1 056-1 060.
[17] ARTECA R N, POOVAIAH B W, SMITH O E. Use of high performance liquid chromatography for the determination of endogenous hormone levels inSolanumtuberosumL. subjected to carbon dioxide enrichment of the root zone[J]. Plant Physiol, 1980,65(6):1 216-1 219.
[18] VERBERNE M C, BROUWER N, DELBIANCO F, et al. Method for the extraction of the volatile compound salicylic acid from tobacco leaf naterial[J]. Phytochem Anal, 2002,13(1):45-50.
[19] XIONG X J, RAO W B, GUO X F, et al. Ultrasensitive determination of jasmonic acid in plant tissues using high-performance liquid chromatography with fluorescence detection[J]. J Agric Food Chem, 2012,60(20):5 107-5 111.
[20] LI G, LU S, WU H. Determination of multiple phytohormones in fruits by high-performance liquid chromatography with fluorescence detection using dispersive liquid-liquid microextraction followed by precolumn fluorescent labeling[J]. J Sep Sci, 2015,38(2):187-196.
[21] ESHITA S M. 3-hydroxybenzoic acid as an internal standard for the high-pressure liquid chromatography quantitation of salicylic acid in plants[J]. Analytical Biochemistry, 2001,289(1):99-102.
[22] HOAGLAND D R, ARNON D I. The water-culture method for growing plants without soil. Calif Agric Exp Stn Circ[J].1950, 347(5406):357-359.
[23] ENYEDI A J, YALPANI N, SILVERMAN P, et al. Localization, conjugation, and function of salicylic acid in tobacco during the hypersensitive reaction to tobacco mosaic virus[J]. Proc Natl Acad Sci USA, 1992,89(6):2 480-2 484.
[24] CHAERLE L, CAENEGHEM W V, MESSENS E, et al. Presymptomatic visualization of plant-virus interactions by thermography[J].Nat Biotechnol, 1999,17(8):813-816.
[25] MEUWLY P, METRAUX J P. Ortho-anisic acid as internal standard for the simultaneous quantitation of salicylic acidand its putative biosynthetic precursors in cucumber leaves[J]. Anal Biochem, 1993,214(2):500-505.
[26] 张卫,孙国新,徐玉新,等.植物体内水杨酸分析方法的探讨及其应用[J].生态毒理学报,2009,4(6):889-897.
(责任编辑:苏靖涵)
A general method for detecting the content of endogenous salicylic acid in plant leaf by HPLC
LIN Wenfang, ZHANG Hong, HONG Zhuangyu, MIAO Ying, LIN Wenxiong
(College of Life Sciences, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China)
To accurately determine salicylic acid (SA) level in plant, methanol was used to extract SA fromArabidopsisleaf, with 3-hydroxy benzoic acid being the internal standard. After acid hydrolysis, the hydrolysate was partitioned with ethyl acetate and hexane mixture (1∶1), and followed by high performance liquid chromatography (HPLC) analysis under different ratios and pH of the mobile phase. Results showed that SA was thoroughly separated from the complex mixture when methanol accounted for 10% of sodium acetate and methanol mixture under pH 6.0. Furthermore, rice and narcissus leaf was used to verify this method, whose results confirmed that this method was generally applicable for SA detection in plants.
salicylic acid; high performance liquid chromatography; 3-hydroxy benzoic acid; plant leaf
2016-04-02
2016-05-23
福建省自然科学基金项目(2016J01103).
林文芳(1981-),女,讲师,硕士.研究方向:植物生理与分子生物学.Email:ivy9940@sina.com.通讯作者林文雄(1957-),男,教授,博士生导师.研究方向:植物生理与分子生态学.Email:wenxiong181@163.com.
Q946.885;Q946.82+8.3
A
1671-5470(2017)01-0109-06
10.13323/j.cnki.j.fafu(nat.sci.).2017.01.017

