欧洲鹅耳枥试管苗生根培养及其生理生化反应
祝遵凌, 钱燕萍, 金建邦, 周 琦
(1.南京林业大学南方现代林业协同创新中心,江苏 南京 210037;2.南京林业大学艺术设计学院,江苏 南京 210037;3.南京林业大学风景园林学院,江苏 南京 210037;4.江苏省彩色植物多角度开发工程技术研究中心,江苏 靖江 214500)
欧洲鹅耳枥试管苗生根培养及其生理生化反应
祝遵凌1,2,3,4, 钱燕萍1,3,4, 金建邦1,3,4, 周 琦1,3,4
(1.南京林业大学南方现代林业协同创新中心,江苏 南京 210037;2.南京林业大学艺术设计学院,江苏 南京 210037;3.南京林业大学风景园林学院,江苏 南京 210037;4.江苏省彩色植物多角度开发工程技术研究中心,江苏 靖江 214500)
为了探究欧洲鹅耳枥试管苗的生根机理,对其生根过程中内源激素含量和酶活性的变化进行了研究.采用三因素三水平正交试验进行生根统计,结果表明,WPM+1.0 mg·L-1IBA+1.0 mg·L-1NAA (G3处理)是最适合欧洲鹅耳枥试管苗不定芽生根诱导的培养基.测定了G3、G5、G6处理(生根率分别为高、中、低)的试管苗生根过程中内源激素(ZR、GA3、IAA、ABA)含量的变化,结果表明,3个处理组试管苗的IAA、ZR含量呈“上升—下降”趋势,ABA含量、IAA/ZR呈“下降—上升—下降”趋势,GA3含量呈“下降—上升”趋势,IAA/ABA呈“上升—下降—上升”趋势.测定对照组、G3处理组过氧化物酶(POD)、多酚氧化酶(PPO)、吲哚乙酸氧化酶(IAAO)活性的变化,结果表明:两组试管苗的POD活性呈“上升—下降—上升—下降”趋势,PPO、IAAO活性呈“上升—下降”趋势;G3处理组的POD、PPO、IAAO活性均高于对照组.
欧洲鹅耳枥; 组织培养; 生根培养; 内源激素; 氧化酶活性
欧洲鹅耳枥(Carpinusbetulus)又名西洋千金榆,为桦木科鹅耳枥属落叶阔叶乔木,主要分布在欧洲及西亚.欧洲鹅耳枥枝叶浓密、株型紧凑、叶型秀丽、秋色叶金黄、果穗奇特,是颇为美观的景观树种;又因其抗寒性强、抗风力强、适应性广、病虫害少,为我国东部沿海城市园林绿化及荒山造林的理想树种.我国是鹅耳枥属植物的分布中心,引进欧洲鹅耳枥对完善鹅耳枥属种质资源、丰富我国色叶树种种类、增加园林观赏植物的多样性具有重要意义.目前我国对鹅耳枥属植物的研究主要集中在系统分类、起源与演化、形态解剖和群落生态学等方面,在对欧洲鹅耳枥进行大范围推广应用前,首先要解决的是幼苗培育问题.
目前,欧洲鹅耳枥主要通过种子繁殖,但种胚存在深度休眠而致使发芽率较低[1].Maynard et al[2-4]研究报道了欧洲鹅耳枥扦插生根率较低,属于较难生根的树种,制约种苗产业化进程.组织培养能快速繁殖林木,特别是能保持母株优良的性状.然而目前鲜有利用组织培养技术对鹅耳枥属植物进行快速繁殖的报道.许多研究表明,外植体内源激素含量及过氧化物酶(peroxidase, POD)、多酚氧化酶(polyphenol oxidase, PPO)、吲哚乙酸氧化酶(indoleacetic acid oxidase, IAAO)与不定根的生长和发育有着密切的关系[5-7].因此,本试验通过正交试验对欧洲鹅耳枥试管苗进行生根培养,研究激素种类及配比对试管苗生根的影响,测定试管苗在生根过程中内源激素含量及POD、PPO、IAAO活性的变化,旨在筛选出最适合欧洲鹅耳枥的最佳培养基,探索欧洲鹅耳枥试管苗的生根机理,为欧洲鹅耳枥组织培养的应用提供参考.
1 材料与方法
1.1 材料
试验材料为高5~8 cm的单株欧洲鹅耳枥不定芽,由带腋芽的茎段诱导而来.不定芽继代增殖培养基为:WPM+1.0 mg·L-1BA+2.0 mg·L-1KT+0.01 mg·L-1IBA,继代周期28 d,继代次数4~5代.
1.2 方法
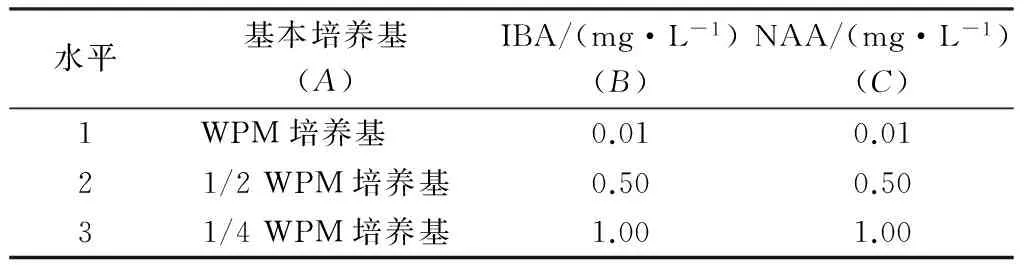
表1 正交试验因素水平表Table 1 Factors and levels of the orthogonal design
1.2.1 最佳生根培养基的筛选 将增殖得到的丛生芽切成单芽转入生根培养基中进行生根培养以获取完整植株,采用三因素三水平的正交试验(表1).培养基的pH为5.8,置于25~28 ℃,光照12 h·d-1,光照度2 000 lx的环境中培养,观察再生不定根的分化和生长情况.每瓶接种2个外植体,每个处理12瓶,3次重复,60 d后统计生根率.生根率/%=生根株数/诱导株数×100.
1.2.2 内源激素含量的测定 将生根G3、G5、G6培养基的植株每隔10 d取出进行内源激素含量的测定,取样时间分别为0、10、20、30、40、50、60 d.采用酶联免疫吸附测定法测定IAA、GA3、ABA、ZR等4种植物内源激素的含量,在中国农业大学作物化学控制实验室进行.
1.2.3 氧化酶活性的测定 将空白WPM培养基(对照组)和生根G3培养基(处理组)的植株每隔10 d取出进行POD、PPO、IAAO活性的测定,取样时间分别为0、10、20、30、40、50、60 d.剪取外植体基部2 cm范围内的皮层,剪碎混合均匀后进行测定.参照张志良等[8]的方法测定POD、IAAO的活性;参照李焕秀等[9]的方法并进行改进测定PPO活性.
1.2.4 数据处理 数据采用Excel 2003软件处理,采用SPSS 13.0、DPS 2000软件进行方差分析、Duncan多重对比.
2 结果与分析
2.1 不同生长调节剂配比对试管苗生根的影响
生长素是诱导试管苗生根最重要的影响因子,起到其他植物生长调节剂所不能代替的作用.将继代培养长势良好的试管苗接种到生根培养基中,20~25 d发现有白色的根从试管苗的皮部长出,待试管苗生长60 d时统计生根情况.结果(表2)显示,G3处理(A1B3C3)对试管苗不定芽的生根效果最好,即WPM+1.0 mg·L-1IBA+1.0 mg·L-1NAA处理的生根率最高,为90.28%,诱导出的不定根多,生长健壮,且试管苗基部的愈伤组织较少,多数不定芽为皮部生根,移栽容易成活.方差分析表明(表略),3个因素对试管苗不定芽生根率的影响均达到极显著水平(P<0.01),在一定范围内对试管苗根的诱导率、生根条数、根的长度有促进作用.极差分析表明,3个因素对试管苗不定芽生根率的影响程度大小为:NAA>培养基>IBA.多重比较(表3)显示:1/4 WPM培养基的生根率为63.43%,显著高于1/2 WPM培养基,然而与WPM培养基的差异不显著;1.0 mg·L-1IBA、1.0 mg·L-1NAA的生根率分别为67.59%、75.93%,显著高于其他水平.
2.2 试管苗生根内源激素含量的变化
2.2.1 IAA含量 IAA对植物生长和形态发生有着广泛的影响,IAA的一个重要生理功能就是促进不定根的形成.图1显示:G3、G5、G6处理的试管苗,其内源IAA含量呈“上升—下降”趋势,40 d时的IAA含量达到峰值;G3、G5处理的试管苗在整个生根过程中,IAA含量比G6处理高,这可能是G3、G5处理的生根率高于G6处理的原因.
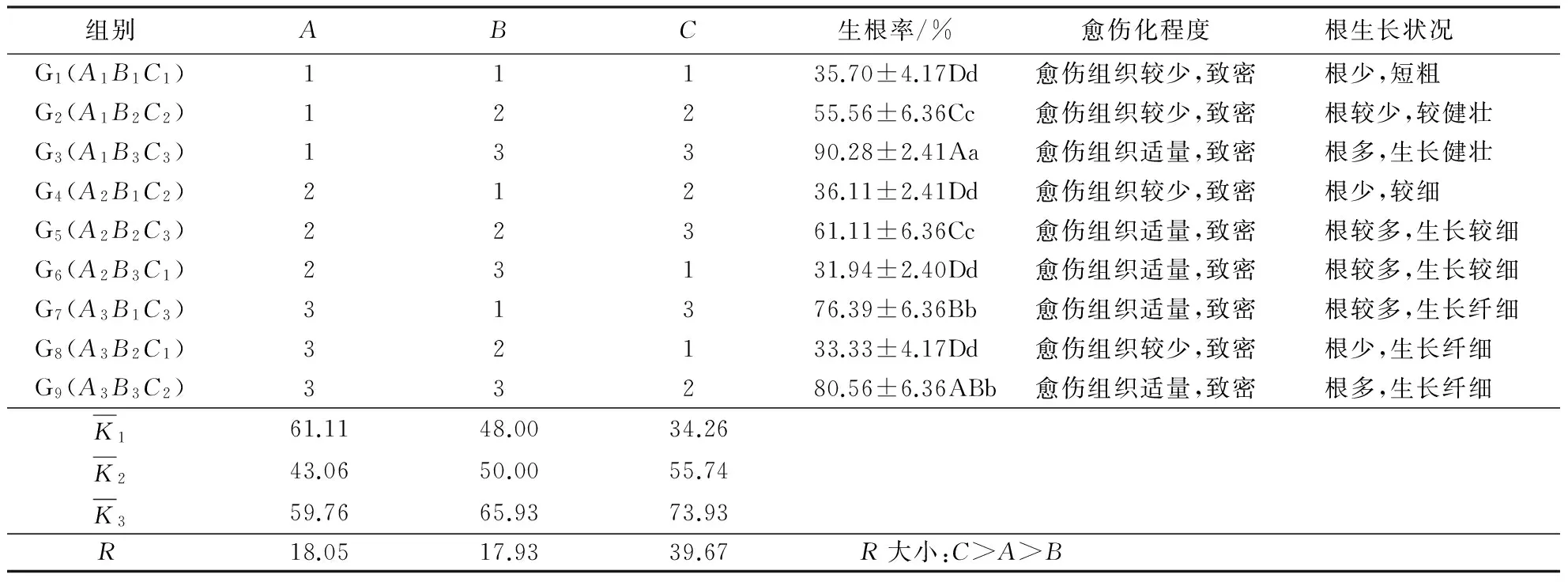
表2 生根培养结果的极差分析1)Table 2 Range analysis of different rooting medium
1)同列数据后附不同大写字母者表差异极显著(P<0.01),附不同小写字母者表差异显著(P<0.05),附相同字母者表差异不显著(P>0.05).
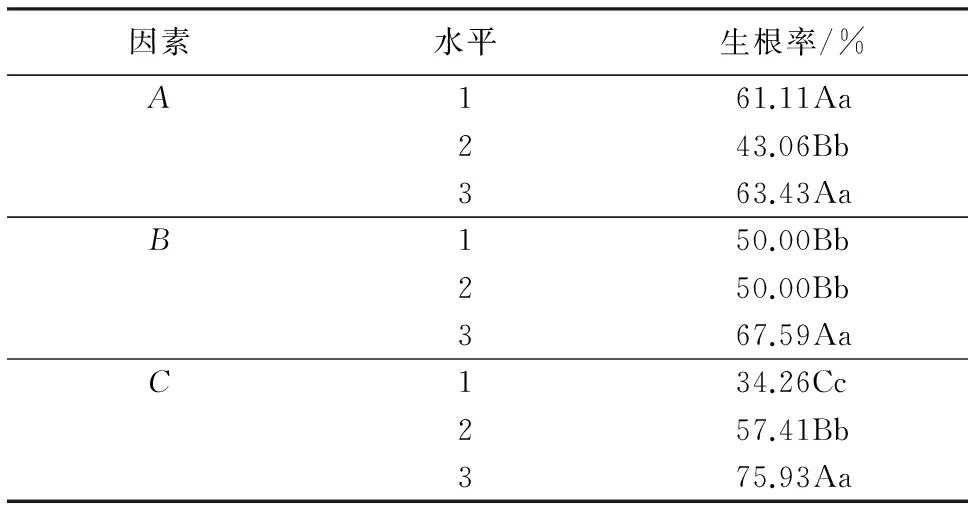
表3 三因素三水平间的多重比较结果1)Table 3 Multiple comparison on 3 factors at 3 levels
1)同列数据后附不同大写字母者表示差异极显著(P<0.01),附不同小写字母者表示差异显著(P<0.05),附相同字母者表示差异不显著(P>0.05).
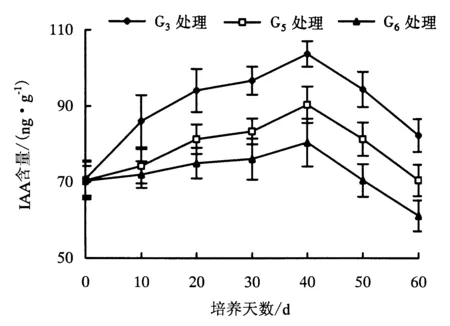
图1 欧洲鹅耳枥生根过程中IAA含量的变化Fig.1 Changes in IAA content in C.betulus during rooting
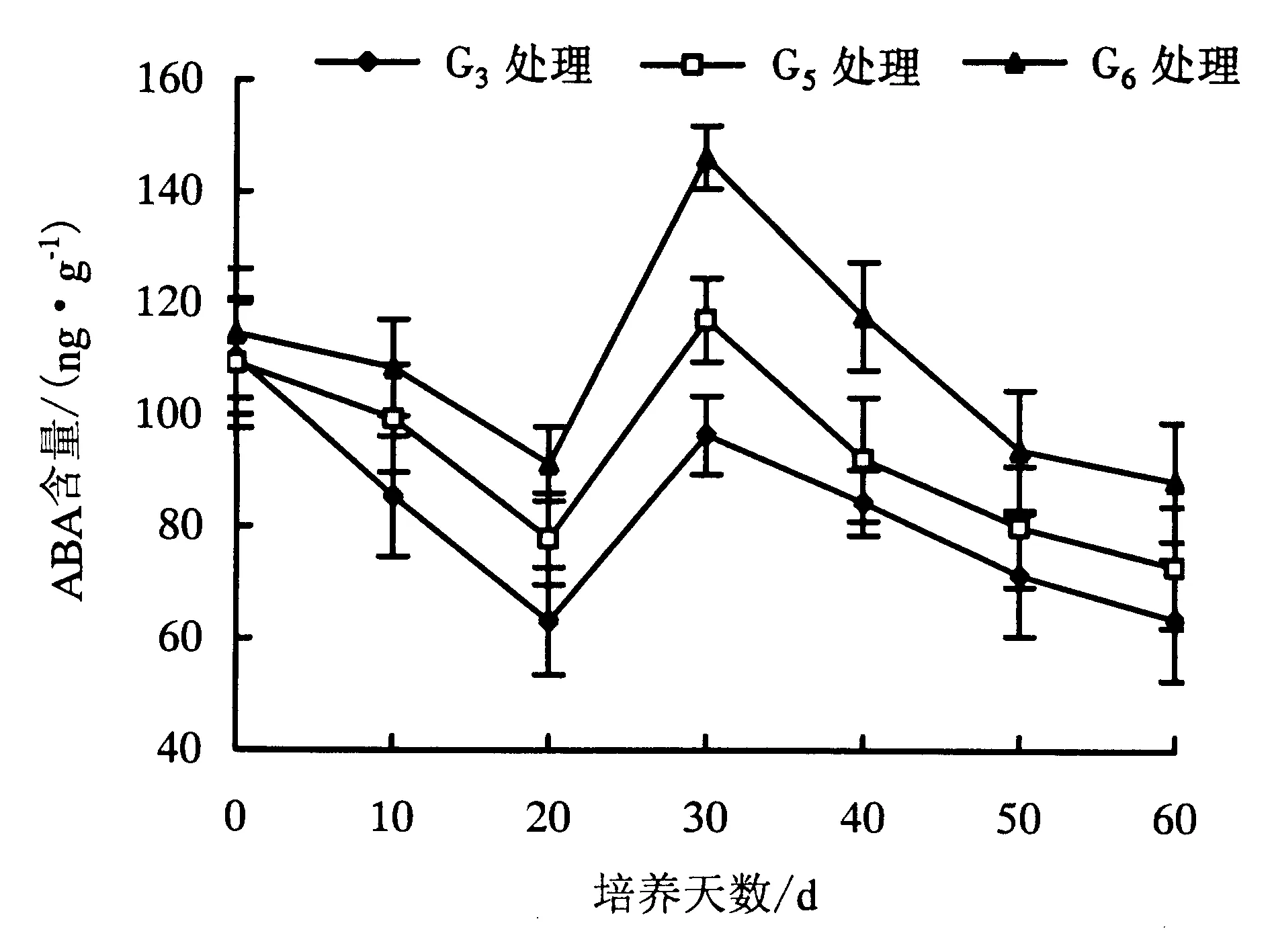
图2 欧洲鹅耳枥生根过程中ABA含量的变化Fig.2 Changes in ABA level in C.betulus during rooting
外源生长素作为一种信号物质,启动植物体产生一系列生理生化反应.但不同植物需要的生长素种类不尽相同.由G3、G5、G6处理添加的激素种类可知,NAA对试管苗内源IAA的含量影响较大,促使植物体启动生理生化反应,从而提高生根率.然而,G3处理与G5处理相比,IAA含量相差不大,而G3处理的生根率为90.28%,G5处理的生根率只有61.11%.因此,IAA含量对试管苗生根有很大的影响.
2.2.2 ABA含量 ABA作为植物天然的抑制性激素,对植物的生根起到关键作用.适量的ABA能促进试管苗不定根的发生,高含量的ABA则会抑制不定根的发生;另外,ABA与GA3产生拮抗作用,从而与GA3共同对试管苗不定根的发生产生影响.图2显示,G3、G5、G6处理的试管苗,其内源ABA含量均呈“下降—上升—下降”趋势.这可能是因为添加外源激素后,试管苗发生一系列生理生化反应致使ABA含量开始较低,20 d时各处理的ABA含量达到最低值,不定根完成诱导后,试管苗的ABA含量升高.G3处理的生根率高于G5、G6处理,而且生根时间较G5、G6处理短,培养20 d时就有大量试管苗生根,这可能是由于G5、G6处理的高含量ABA抑制了不定根的分化.在试管苗的生根过程中,可通过添加外源激素使植物内源激素含量发生改变,从而提高试管苗的生根率.G3、G5处理的ABA含量在整个生根过程中比G6处理低,这可能是G3、G5处理的生根率高于G6处理的原因.
2.2.3 ZR含量 适量的ZR在根原基形成及根伸长时能提高细胞数量及其分裂速度,从而促进根的纵向伸长生长和横向根径生长.图3显示,G3、G5、G6处理的试管苗,其内源ZR含量均呈“上升—下降”趋势,20 d时的ZR含量达到峰值,分别为9.62、11.62、16.92 ng·g-1.施用外源激素可导致内源细胞分裂素发生变化,因此,0~20 d时,试管苗的ZR含量较高.一定量的ZR能促进试管苗生根,ZR含量较高可能会抑制不定根的产生从而促进不定芽的分化.G3处理的ZR含量低于G5、G6处理,因此,G3处理的生根率高于G5、G6处理.
2.2.4 GA3含量 GA3能抑制植株生根培养起始期的细胞分裂,从而抑制根的分化和形成,在不定根完成分化后,则促进不定根的伸长生长;同时,GA3与ABA产生拮抗作用,从而与ABA共同对外植体不定根的发生产生影响.G3、G5、G6处理的试管苗,其GA3含量大致呈“下降—上升”趋势,直至最后达到稳定状态(图4).在生根过程中适量的外源激素可能会使试管苗内源GA3含量下降,从而促进生根.
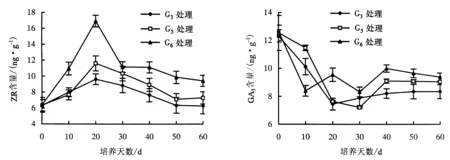
图3 欧洲鹅耳枥生根过程中ZR含量的变化Fig.3 Changes in ZR level in C.betulus during rooting
2.2.5 IAA/ABA、IAA/ZR 在外植体生根培养的过程中,不仅IAA、ABA、ZR的绝对量会对外植体的生根率产生影响,且IAA、ABA、ZR的相对量也会影响外植体不定根的发生.由图5、6可知,试管苗在生根的过程中无论是IAA/ABA还是IAA/ZR,G3处理均高于G5、G6处理.G3、G5、G6处理的IAA/ABA呈“上升—下降—上升”趋势,0~10 d缓慢上升,10~20 d急剧上升,20~30 d下降,30~60 d缓慢上升后趋于平稳状态.试管苗在生根的过程中,G3、G5、G6处理的IAA/ZR呈“下降—上升—下降”趋势.这可能是由于试管苗起初吸入大量细胞分裂素,导致IAA/ZR下降,而后试管苗开始吸入大量生长素类物质,从而使IAA/ZR上升.因此,生根培养基中试管苗IAA/ZR、IAA/ABA的提高,会促进了不定根的形成和生长.
2.3 试管苗生根酶活性的变化
2.3.1 POD活性 POD在植物的生长中起着重要作用,与插穗不定根的形成和发育存在着密切联系.在有酚类物质存在的条件下,POD还能参与生长素的代谢及促使细胞壁的木质化.图7显示,对照组试管苗的POD活性低于G3处理组,说明添加外源激素能提高试管苗的POD活性,从而提高生根率.对照组、G3处理组的POD活性均呈“上升—下降—上升—下降”趋势,第30、50天达到峰值.说明0~30 d可能是不定根的诱导期,POD活性上升有助于IAA的氧化,适量的内源IAA有利于根原基的诱导和发育.30~40 d,POD活性下降导致试管苗IAA含量升高,从而有利于不定根的诱导生成.POD活性在40~50 d再次呈上升趋势,50 d达到第2次峰值,从而促进不定根的伸长生长.
2.3.2 PPO活性 在试管苗的生根过程中,PPO能催化酚类物质与IAA结合形成“IAA—酚酸复合物”,从而促进愈伤组织的分化及不定根的形成[10].图8显示,对照组试管苗的PPO活性低于G3处理组,说明添加外源激素能提高试管苗的PPO活性,从而提高生根率.对照组、G3处理组的PPO活性均呈“上升—下降”趋势,30 d时达到峰值.说明0~30 d,PPO活性的上升促进试管苗合成大量的生根辅助因子,有利于根原基的发育及不定根的诱导,从而促进不定根的形成.根原基形成后,30~60 d时,PPO活性下降促进了不定根的表达及伸长.对照组试管苗不定根诱导初期PPO活性较低,可能导致合成的生根辅助因子少,从而使试管苗不定根的诱导率较低.
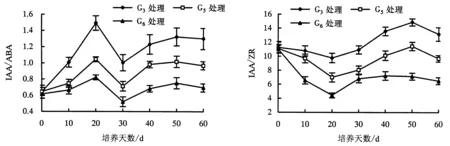
图5 欧洲鹅耳枥生根过程中IAA/ABA的变化Fig.5 Changes in IAA/ABA ratio in C.betulus during rooting
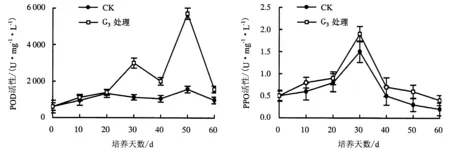
图7 欧洲鹅耳枥生根过程中POD活性的变化Fig.7 Changes in POD activity in C.betulus during rooting
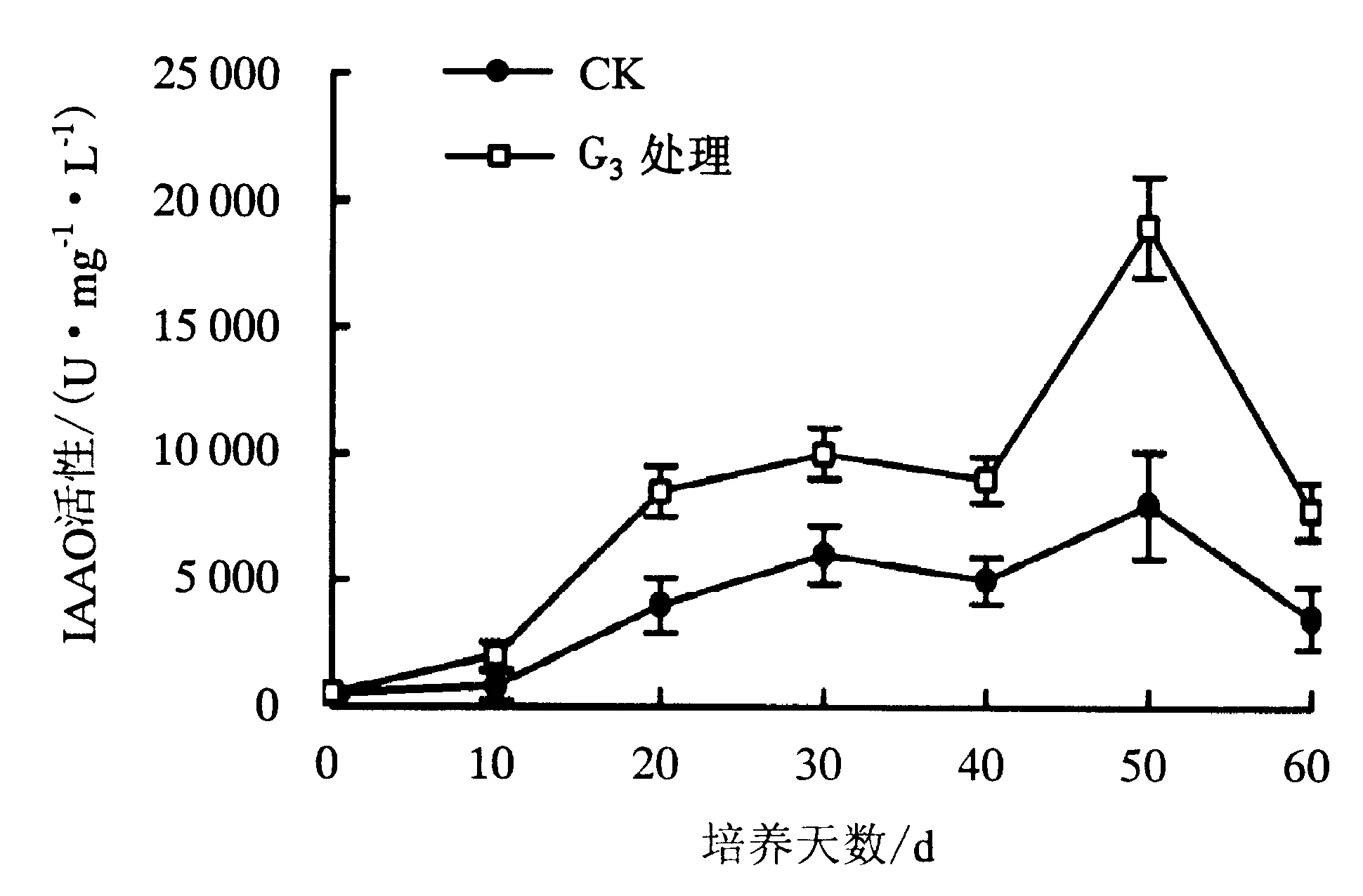
图9 欧洲鹅耳枥生根过程中IAAO活性的变化Fig.9 Changes in IAAO activity in C.betulus during rooting
2.3.3 IAAO活性 IAAO可以氧化IAA,因此,IAAO活性的高低与根的发生有重要关系[11].图9显示,对照组试管苗的IAAO活性低于G3处理组,说明添加外源激素能提高试管苗IAAO的活性,有利于不定根的诱导,从而提高生根率.对照组、G3处理组的IAAO活性均呈“上升—下降”趋势,50 d时达到峰值,使试管苗的内源IAA含量降低,从而有利于根原基的发育及不定根的诱导,促进不定根的形成.此后,IAAO活性下降,促进不定根的表达及伸长.
扈红军等[12]认为,不定根的形成初期可分为2个阶段,即生长素敏感阶段、生长素不敏感阶段.研究表明,在根的表达期要求较高浓度的IAA以促进根的生长,IAAO活性降低[13-14];但也有研究表明,根表达期的IAAO活性较高,使体内IAA含量下降,促进根的伸长[15].本试验结果显示,无论G3处理组还是对照组,IAAO的活性均只有一个峰值,而后呈下降趋势.
3 结论与讨论
3.1 试管苗生根
WPM+1.0 mg·L-1IBA+1.0 mg·L-1NAA最适合欧洲鹅耳枥试管苗不定芽生根诱导培养,试管苗基部的愈伤组织适量,诱导出的不定根数较多,生长健壮.樊军锋等[16]对秦美猕猴桃(Actinidiachinensis)的研究发现,单独使用NAA或IBA,诱导生根效果较二者混合使用的差.李毅等[17]研究报道,IBA较适合毛白杨(Populustomentosa)不定芽的生根诱导,而NAA较容易引起试管苗产生愈伤组织,因此不适合作为诱导生根的激素.邱璐等[18]对史密斯桉(Eucalyptussmithii)的研究发现,与IBA、IAA相比,NAA更适合试管苗不定根的诱导.本试验虽未对外源激素进行单因素试验,但正交试验表明,NAA比IBA更适合作为欧洲鹅耳枥不定根的诱导激素,至于二者的配合使用是否比单一使用NAA的效果更好,还需要做进一步研究.
在不定芽诱导生根的过程中,外植体一般对生长素类物质需求较多,而对细胞分裂素类物质需求较少.生长素类物质一般在外植体生根前期起刺激作用,后期反而可能会阻碍外植体不定根的形成.添加外源激素主要是通过改变植物内源激素的含量而促使器官分化.不同植物甚至同种植物不同品种外植体不定根的诱导对激素的需求都不尽相同.因此,通过不断试验从而掌握生长素的施用种类、浓度、时间对外植体的生根具有至关重要的作用.刘宝光等[19]研究发现,添加生长素反而会抑制红皮云杉(Piceakoraiensis)试管苗生根,而空白培养基却可大大提高生根率.本试验中,欧洲鹅耳枥的生根过程并未出现此类现象,可能是激素并未在试管苗中大量积累或者是欧洲鹅耳枥不定根的分化需要较高含量的生长素.
3.2 内源激素含量
李胜等[20]研究表明,在葡萄(Vtisvinifera)根系启动阶段,内源ZRs含量上升,IAA、ABA含量下降.肖关丽等[21]研究表明:外源激素的添加与内源激素的作用紧密相关,内源激素的含量、比例与实践中外源激素的配比及水平对甘蔗(Saccharumofficinarum)不定根的形成效果相一致;在根系启动阶段,内源ZRs含量上升,IAA、ABA含量下降,IAA/CTK高,有利于生根.陈伟等[22]研究表明,添加外源激素使得内源激素ZR、ABA、IAA、iPA含量的增加,从而对芽、根的形成、发育起到促进作用.贺丹等[14]研究表明,牡丹(Paeoniasuffruticosa)根原基诱导期的IAA含量下降,而生根后IAA含量升高;同时,ZR含量在根诱导期也大幅下降,而在根原基形成和根伸长期升高;IAA/ABA、IAA/ZR的变化趋势与IAA含量的基本相近,分别在根原基发生初期和根伸长生长前期出现峰值.常永健等[23]研究表明,苹果(Maluspumila)试管苗生根主要取决于IAA/ABA,比值高有利于根数量的增加及生长.陈凌艳等[24]对西洋杜鹃(Rhododendronhybridum)试管苗进行生根培养时发现,IAA含量、ABA含量、IAA/GA3、IAA/ZR呈“上升—下降”趋势,而GA3含量、ZR含量、IAA/ABA呈“下降—上升”趋势,ABA/GA3则保持在一个相对稳定的水平.本试验结果表明:较高含量的IAA有助于试管苗生根,ABA含量前期呈下降趋势,说明ABA在根原基的诱导阶段可能起抑制作用;ZR含量呈“上升—下降”趋势,GA3含量呈“下降—上升”趋势,直至最后达到稳定状态,与ABA含量的变化趋势大致相同,说明GA3、ABA含量可能对生根的影响不大;IAA/ABA呈“上升—下降—上升”趋势,IAA/ZR呈“下降—上升—下降”趋势,说明IAA含量可能是影响试管苗生根的主要因素.本试验结果与李胜等[20]、肖关丽等[21]、陈伟等[22]、陈凌艳等[24]的结果相反,而与贺丹等[14]、常永健等[23]的结果一致.试管苗外植体不定根的诱导和发育相当复杂,各种内源激素共同作用调控植物体生根.只有当各种激素的含量趋于平衡时才能得到较好的生根效果.
3.3 相关酶活性
本试验中,对照组、G3处理组试管苗的POD活性呈“上升—下降—上升—下降”趋势,而PPO、IAAO活性呈“上升—下降”趋势,对照组的POD、PPO、IAAO活性均低于G3处理组.Haissig[7]研究发现,生根素是在POD以及一些其他酶的作用下合成的.辜云杰等[25]研究报道,外源激素影响POD活性从而对内源IAA起作用,进而影响外植体不定根的分化.另外,POD在酚类物质存在时参与生长素的代谢及细胞壁的木质化[26].POD、PPO、IAAO的活性与生根密切相关,不同生根时期相关酶的活性不同.贺丹等[14]研究表明,在牡丹根原基诱导期和根突破表皮期,POD活性呈上升趋势,PPO、IAAO的活性在根原基诱导初期较低,IAA含量相对较高,而后PPO活性开始上升,IAA含量进一步下降,此结果与本试验结果一致,即根原基诱导需要较低活性的IAAO及较高活性的POD、PPO;根生长期需要较低活性的POD、IAAO及较高活性的PPO.POD、PPO、IAAO通常相互作用影响试管苗不定根的分化,对生根的影响相当复杂,可能因物种不同而不同,具体作用机制有待于进一步研究.
[1] 祝遵凌,许园园,王飒.欧洲鹅耳枥种子变温层积过程中结构的变化[J].东北林业大学学报,2013,41(7):1-5.
[2] MAYNARD B K, BASSUK N L. Stock plant etiolation and stem banding effect on the auxin dose-response of rooting in stem cuttings ofCarpinusbetulusL. ‘Fastigiata’ [J]. Plant Growth Regulation, 1991,10(4):305-311.
[3] MAYNARD B K, BUSSUK N L. Stock plant etiolation, shading, and banding effects on cutting propagation ofCarpinusbetulus[J]. Journal of the American Society for Horticultural Science, 1992,117(5):740-744.
[4] MAYNARD B K, BUSSUK N L. Effects of stock plant etiolation, shading, banding, and shoot development on histology and cutting propagation ofCarpinusbetulusL. ‘Fastigiata’ [J]. Journal of the American Society for Horticultural Science, 1996,121(5):853-860.
[5] 肖尊安,熊红.不定根发生机理的研究进展[J].生物技术通报,2002(3):31-34.
[6] 黄烈健,王鸿.林木植物组织培养及存在问题的研究进展[J].林业科学研究,2016,29(3):464-470.
[7] HAISSIG B E. Influence of auxins and auxin synergists on adventitious root primordia initiation and development [J]. New Zealand Journal of Forestry Science, 1973(4):311-323.
[8] 张志良,瞿伟菁.植物生理学实验指导[M].3版.北京:高等教育出版社,2003:123-124,188-189.
[9] 李焕秀,王乔春,李春秀.梨芽和茎尖多酚氧化酶活性和总酚含量的初步研究[J].四川农业大学学报,1994,12(2):218-222.
[10] 宋丽红,曹帮华.光叶楮扦插生根的吲哚乙酸氧化酶、多酚氧化酶、过氧化物酶活性变化研究[J].武汉植物学研究,2005,23(4):347-350.
[11] WIESMANN Z, RIOV J, EPSTEIN E. Comparison of movement and metabolism of indole-3-acetic acid and indole-3-butyric in mung bean cuttings [J]. Physiologia Plantarum, 1988,74(3):556-560.
[12] 扈红军,曹帮华,尹伟伦,等.不同处理对欧榛硬枝扦插生根的影响及生根过程中相关氧化酶活性的变化[J].林业科学,2007,43(12):70-75.
[13] MONCOUSIN C H, GASPAR T H. Peroxidase as a marker for rooting improvement ofCynarascolymusL. culturedinvitro1 [J]. Biochemie Und Physiologie Der Pflanzen, 1983,178(4):263-271.
[14] 贺丹,王政,何松林.牡丹试管苗生根过程解剖结构观察及相关激素与酶变化的研究[J].园艺学报,2011,38(4):770-776.
[15] NAG S, SAHA K, CHOUDHURI M A. Role of auxin and polyamines in adventitious root formation in relation to changes in compounds involved in rooting [J]. Journal of Plant Growth Regulation, 2001,20(2):182-194.
[16] 樊军锋,李玲,韩一凡,等.秦美猕猴桃叶片最佳再生系统的建立[J].西北植物学报,2002,22(4):907-912.
[17] 李毅,何明珠,马海芸.三倍体毛白杨组织脱分化培养与植株体再生[J].植物研究,2002,22(3):288-291.
[18] 邱璐,王波,苏开美,等.史密斯桉愈伤组织诱导与分化的进一步研究[J].西北农林科技大学学报(自然科学版),2007,35(9):103-109.
[19] 刘宝光,李成浩,张含国.红皮云杉的不定芽诱导和植株再生[J].东北林业大学学报,2010,38(8):4-7.
[20] 李胜,武季玲,李唯,等.初代和继代培养葡萄试管苗的内源IAA、ZRs和ABA含量变化及其与生根的关系[J].植物生理学通讯,2005,41(3):286-288.
[21] 肖关丽,杨清辉,李富生,等.甘蔗组培苗继代培养中内源激素与绿苗生根率关系研究[J].云南农业大学学报,2001,16(4):271-273.
[22] 陈伟,施季森,龙伟,等.光皮桦离体培养形态建成过程中内源激素含量的变化[J].南京林业大学学报(自然科学版),2006,30(3):67-70.
[23] 常永健,陈四维,马宝焜,等.苹果茎尖培养中植物激素与不定根形成关系的研究[J].河北农业大学学报,1991,14(4):1-4.
[24] 陈凌艳,郑宇,陈礼光,等.西洋杜鹃组培苗生根培养及其内源激素含量变化的研究[J].福建林学院学报,2011,31(2):131-135.
[25] 辜云杰,邓小敏,张建康,等.IBA及NAA对山杜英组培苗生根过程中POD、PPO活性的影响[J].亚热带植物科学,2004,33(2):8-9.
[26] ROUT G R. Effect of auxins on adventitious root development from single node cuttings ofCamelliasinensisL. Kuntze and associated biochemical changes [J]. Plant Growth Regulation, 2006,48(2):111-117.
(责任编辑:施晓棠)
Physiology and biochemistry dynamics inCarpinusbetulusduring rooting culture
ZHU Zunling1, 2, 3,4, QIAN Yanping1,3,4, JIN Jianbang1,3,4, ZHOU Qi1,3,4
(1.Collaborative Innovation Center of Sustainable Forestry in Southern China, Nanjing Forestry University, Nanjing, Jiangsu 210037, China; 2.College of Arts & Design, Nanjing Forestry University, Nanjing, Jiangsu 210037, China; 3.College of Landscape Architecture, Nanjing Forestry University, Nanjing, Jiangsu 210037, China; 4.Multi-angle Development Research Center of Colored Plants in Jiangsu Province, Jingjiang, Jiangsu 214500, China)
To investigate the rooting mechanism ofCarpinusbetuluswhen tissue culture seedling, basal medium, IBA, NAA at 3 levels were applied toC.betulusin orthogonal design. Variations in enzyme activities and endogenous hormones were studied during rooting. The result showed that the optimum medium for seed rooting was WPM+1.0 mg·L-1IBA+1.0 mg·L-1NAA. Then 4 endogenous hormones (ZR, GA3, IAA, ABA) from treatments G3, G5, and G6with rooting rates in an descending order were tested. Activities of peroxidase (POD), polyphenol oxidase (PPO), indoleacetic acid oxidase (IAAO) activities were determined in G3and CK. Results showed that IAA and ZR levels firstly increased and then dropped. ABA and IAA/ZR ratio started with a reduction, followed by a climb, and end up with a decrease. GA3level peaked in the middle of the rooting period while IAA/ABA ratio rose generally with a sharp drop in middle of the period. POD activity fluctuated all the period while PPO and IAAO increased first and then decreased. Averagely, activities of POD, PPO and IAAO of G3were higher in treatments than the CK.
Carpinusbetulus; tissue culture; rooting culture; endogenous hormones; oxidase activity
2015-11-09
2016-10-13
江苏省工程技术研究中心建设项目(BM2013478);江苏省科技计划项目(BY2015006-01);江苏省六大人才高峰项目(NY-029);江苏省“青蓝工程”资助项目(2012).
祝遵凌(1968-),男,教授,博士.研究方向:园林植物栽培及应用.Email:zhuzunling@aliyun.com.
S687.9
A
1671-5470(2017)01-0043-07
10.13323/j.cnki.j.fafu(nat.sci.).2017.01.008

