8种大花蕙兰抗寒性指标的筛选及评价
周桂英, 王四清, 陈卿然, 许建新, 王成聪
(1.北京林业大学园林学院,北京 100083;2.深圳市铁汉生态环境股份有限公司,广东 深圳 518040)
8种大花蕙兰抗寒性指标的筛选及评价
周桂英1,2, 王四清1, 陈卿然1, 许建新2, 王成聪2
(1.北京林业大学园林学院,北京 100083;2.深圳市铁汉生态环境股份有限公司,广东 深圳 518040)
以组培出瓶10个月的8个品种大花蕙兰植株为试材,观测在10 ℃/0 ℃(日温/夜温)低温胁迫、25 ℃/15 ℃(日温/夜温)适温恢复条件下寒害指数、初始荧光值(F0)、PSⅡ系统最大光化学量子产量(Fv/Fm)、相对电导率、丙二醛(MDA)含量、可溶性糖含量和可溶性蛋白含量的变化,并对其抗寒性进行评价.结果表明:(1)随着低温胁迫时间的延长,不同品种大花蕙兰的F0、Fv/Fm、MDA含量、相对电导率和可溶性蛋白含量显著上升,可溶性糖含量先上升后下降,且随着抗寒性品种的不同其变化幅度和速度有所不同;(2)Fv/Fm与F0、MDA含量、相对电导率、可溶性蛋白含量均呈极显著相关,与可溶性糖含量显著相关,尤其与寒害指数的相关系数达94.4%,可作为抗寒性筛选的可靠指标之一;(3)8个品种大花蕙兰抗寒性强弱为:‘金玉满堂’>‘天之骄子’>‘马可’>‘黄金岁月’>‘红梅’>‘红霞’>‘翠玉’>‘福娘’.
大花蕙兰; 抗寒性; 筛选; 评价
大花蕙兰(Cymbidiumhybridum)又称虎头兰、西姆比兰,主要原产地为热带、亚热带和温带森林地区,这一带气候湿润,温度和光照均较适宜大花蕙兰的生长发育[1].在我国,大花蕙兰主要原产在云贵等西南地区.大花蕙兰植株较高大,花大且多,花色极为丰富,花期较长且主要在春节前后开花,是市场上最畅销的年宵花之一[2].
大花蕙兰最适宜的生长温度为10~25 ℃,且需要一定的昼夜温差,夜温为10 ℃时最佳,不同生长阶段对温度的要求不同.在花芽生长期,如果夜间温度低于5 ℃,叶片受害发黄,花芽生长缓慢甚至不生长,开花质量差,花期推迟[3].
在我国大部分北方地区,冬季温度常低于0 ℃以下,温室生产需要采用加温系统来供暖,增加了生产成本,同时能源消耗对环境造成了二次污染.目前,对抗寒作物品种的筛选己有很多报道,但在观赏花卉上,尤其对大花蕙兰抗性品种的筛选报道很少.
本试验对市场上8种常见的大花蕙兰畅销品种进行低温胁迫试验,筛选出一批耐寒品种,并得出可靠、有效和快速的耐寒性筛选指标,旨在为实际生产中选择优良耐寒品种提供参考.
1 材料与方法
1.1 材料
8个大花蕙兰供试品种为‘金玉满堂’、‘红霞’、‘黄金岁月’、‘翠玉’、‘马可’、‘福娘’、‘天之骄子’和‘红梅’.选择株高、长势基本一致,出瓶10个月的组培苗为参试材料,株高8~12 cm,栽培基质为松树皮.植物材料购自北京林业科技固安花卉生产基地.
1.2 方法
1.2.1 低温处理 试验在北京林业大学实验楼RXZ-500D型人工气候培养箱(宁波江南仪器厂)中进行.首先将放在培养箱中的植株进行预处理,温度为25 ℃/15 ℃(日温/夜温),相对湿度60%~70%,光照强度110~120 μmol·m-2·s-1.预处理5 d后将植株低温10 ℃/0 ℃(日温/夜温)处理1、3和5 d后,适温25 ℃/15 ℃(日温/夜温)恢复1、3和5 d,其他环境条件一致.每个品种处理20棵,重复3次.
1.2.2 指标测定 寒害指数在试验结束后统计,寒害指数=∑(每个级别的植株数量×级别)/(植株总数×最高级别数).抗寒性分级标准为:0级,叶片完好,无明显寒害症状,叶片绿色;1级,叶片轻微受害,叶缘发黄;2级,叶片叶尖开始发黄,出现脱水症状;3级,叶片一半面积出现脱水症状;4级,叶片大部分面积发黄、脱水;5级,植株全株死亡[4].
叶绿素荧光动力学参数采用Yaxin1161叶绿素荧光仪测定,分别在低温胁迫1、3、5 d及适温恢复1、3、5 d的6:00—8:00进行.叶片经夜晚充分暗适应后测定初始荧光值(minimal fluorescence,F0)和PSⅡ系统最大光化学量子产量(maximal photochemistry efficiency,Fv/Fm).
相对电导率采用电导仪测量法[5]测定,丙二醛(malonaldehyde,MDA)含量采用硫代巴比妥酸法[6]测定,相对电导率和MDA含量分别在低温胁迫第1、3和5天的8:00取样检测.可溶性糖含量采用蒽酮提取法[7]测定,可溶性蛋白含量采用考马斯亮蓝G-250法[7]测定,可溶性糖和可溶性蛋白的含量分别在低温胁迫前、低温胁迫第5天、适温恢复第5天的8:00取样检测.
1.2.3 数据分析 采用SPSS 17.0和Excel 2010软件对数据进行统计分析,采用Duncan多重比较分析法进行方差分析,并用Excel 2010软件绘制图表.
此外,我们还发现,制曲进程中,细菌与真核微生物种类的变化趋势有差异(图9)。细菌微生物种类远比真菌丰富,细菌种类从入库(T0)到第1次翻曲(T1,≈65℃)和第2次翻曲(T2,≈59℃)阶段,增加近30%,在第3次翻曲(T3,≈43℃)阶段,与温度锐降趋势一致,其种类相比T2减少了近52%,在之后储存阶段(T4、T5,≈37℃),细菌种类略微增加。相反,在整个制曲进程中,真核微生物的变化趋势为种类持续减少。在第1次翻曲和第3次翻曲阶段种类分别锐减28%和59%,之后,微生物种类较为稳定。
2 结果与分析
2.1 大花蕙兰的寒害指数
低温胁迫第5天,8个品种大花蕙兰的叶片陆续出现寒害症状.从图1可见:寒害指数较高的是‘福娘’、‘红梅’、‘翠玉’和‘红霞’,为0.65~0.49,一半以上的植株受害,耐寒性较差;‘黄金岁月’和‘马可’的寒害指数在0.35左右;‘金玉满堂’和‘天之骄子’的寒害指数最小,仅为0.28和0.29,抗寒性最强.
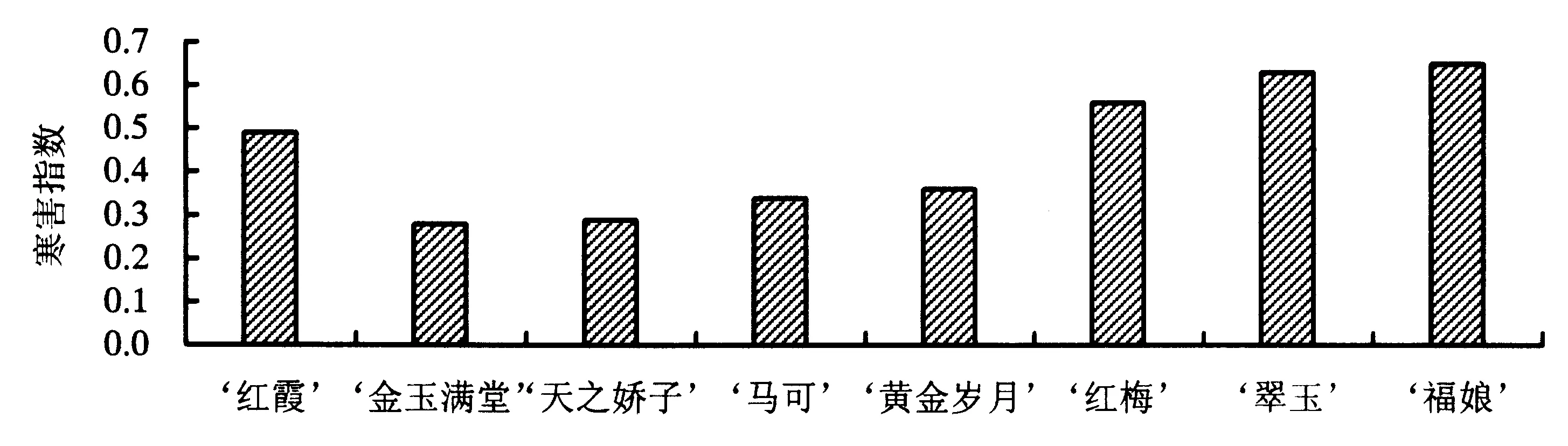
图1 8个品种大花蕙兰的寒害指数Fig.1 Chilling injury index of different C.hybridum cultivars
2.2 低温胁迫对大花蕙兰叶绿素荧光参数的影响
从表1可见:‘金玉满堂’的F0为15.93~22.10,变化较小,最高值为适温恢复3 d的22.10,显著低于其他品种;‘红霞’、‘天之骄子’和‘马可’的F0为19.70~29.52,对低温有较强的抗性;‘红梅’和‘黄金岁月’的F0为22.93~34.53;‘福娘’和‘翠玉’的F0随着低温胁迫时间的延长而上升,显著高于其他品种,在低温胁迫第5天分别上升到46.70和45.10,适温恢复1 d又迅速下降了32%左右,此后,‘翠玉’的F0缓慢上升到35.00,而‘福娘’在适温恢复3 d下降到了28.70后又迅速上升到40.50,变化幅度较大,这两个品种的F0受温度影响的波动很大,对低温敏感.
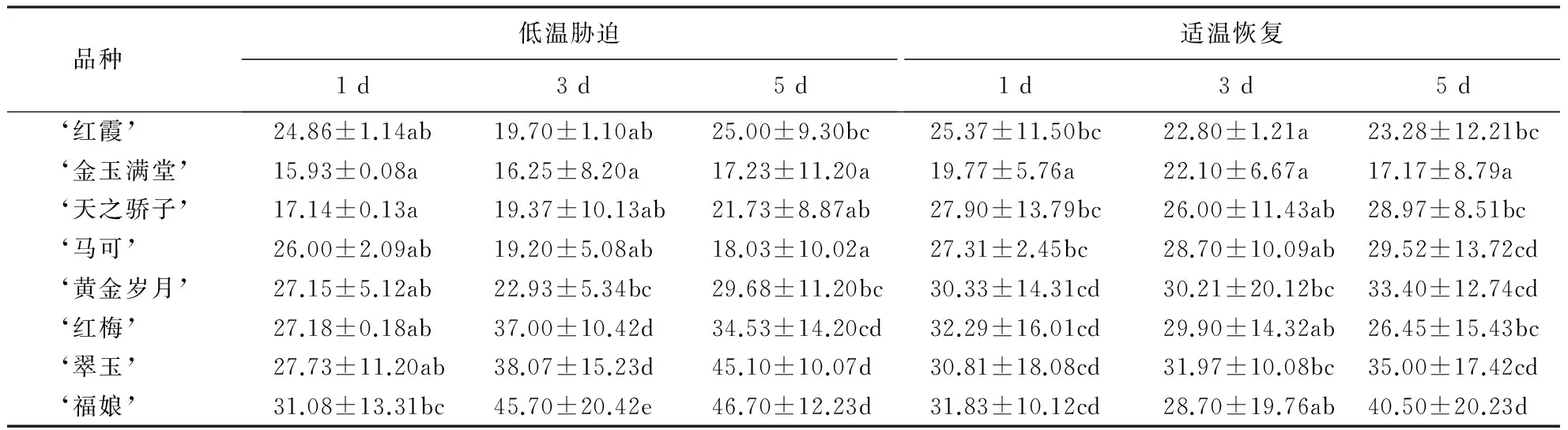
表1 低温胁迫下8个品种大花蕙兰叶片F0的变化1)Table 1 Changes in F0 of different C.hybridum cultivars under cold stress
1)同列数据后附不同小写字母者表示差异显著(P<0.05),附相同字母者表示差异不显著(P>0.05).
从表2可见,随着低温胁迫时间的延长,8个品种大花蕙兰叶片的Fv/Fm一直下降,在低温胁迫第5天达到最低值,随着适温的恢复,Fv/Fm呈不同程度的上升.‘金玉满堂’和‘天之骄子’的Fv/Fm显著高于其他品种,基本维持在0.7以上,低温胁迫5 d比胁迫1 d仅分别下降了0.2,且在适温恢复1 d就迅速恢复到0.77和0.74,最终恢复到第1天的80%以上;‘黄金岁月’、‘马可’、‘红梅’和‘红霞’的Fv/Fm为0.68~0.86,品种间的差异不显著,具有较强的抗寒性,其中,‘黄金岁月’低温胁迫第5天的Fv/Fm下降到0.66,且在适温恢复1 d后迅速恢复到0.7以上,最终达到0.75;‘福娘’和‘翠玉’的Fv/Fm最低,低温胁迫第3天比第1天显著下降了30%左右,低温胁迫第5天急剧下降到0.50~0.53,比第1天下降了35%左右,且无法随着适度的恢复而上升,Fv/Fm为0.50~0.56.
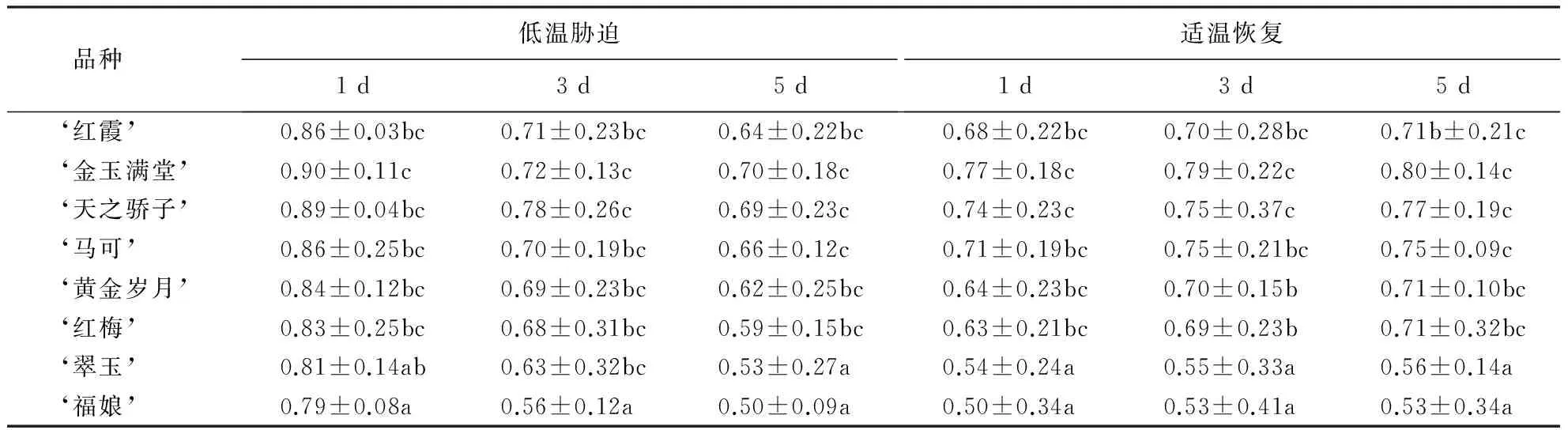
表2 低温胁迫下8个品种大花蕙兰叶片Fv/Fm的变化1)Table 2 Changes in Fv/Fm of different C.hybridum cultivars
1)同列数据后附不同小写字母者表示差异显著(P<0.05),附相同字母者表示差异不显著(P>0.05).
对大花蕙兰叶片的Fv/Fm进行邓肯多重比较,结果显示,8个品种间的差异显著.根据差异显著性将8个品种的抗寒性分为3级:在低温胁迫和适温恢复的环境下,‘福娘’和‘翠玉’的Fv/Fm显著低于‘天之骄子’和‘金玉满堂’,抗寒性最差;‘金玉满堂’和‘天之骄子’的Fv/Fm最高,显著高于‘福娘’和‘翠玉’,Fv/Fm随着温度下降的幅度最小且能随着适温的恢复而迅速升高,抗寒性最强.
2.3 低温胁迫对大花蕙兰生理指标的影响
2.3.1 相对电导率 从图2可见,8个品种大花蕙兰叶片的相对电导率在低温胁迫后均比胁迫前升高了,在适温恢复后有所下降但均比胁迫前的相对电导率高,说明叶片细胞膜已经受到了低温胁迫的损伤.低温胁迫5 d后,‘金玉满堂’和‘天之骄子’的相对电导率一直维持在较低水平,且在适温恢复后有所下降,比初始值仅升高了0.2和0.3;‘黄金岁月’、‘马可’、‘红霞’、‘红梅’和‘翠玉’的相对电导率在低温胁迫后上升到0.40~0.44,适温恢复后有小幅下降;而‘福娘’的相对电导率在低温胁迫5 d显著升高至0.50,为胁迫前的166%,细胞膜透性显著升高,在适温恢复后虽有显著下降但仍高于其他品种.
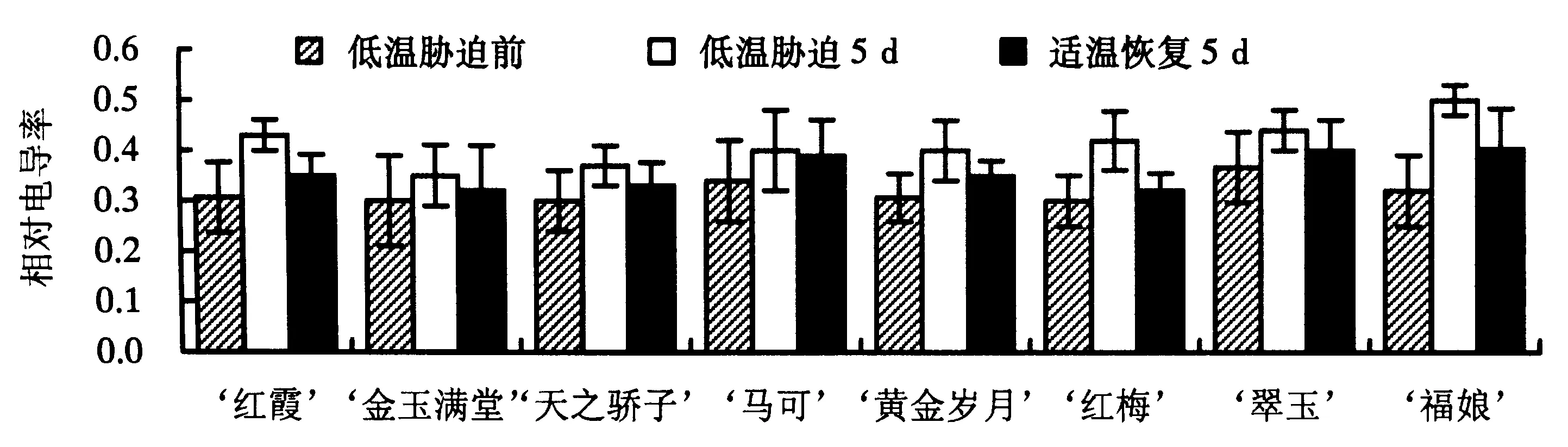
图2 低温胁迫下8个品种大花蕙兰叶片相对电导率的变化Fig.2 Changes in relative conductivity of different C.hybridum cultivars under cold stress
表3 低温胁迫下8个品种大花蕙兰叶片MDA含量的变化1)Table 3 Changes in MDA content of different C.hybridum cultivars under cold stress μmolg-1

表3 低温胁迫下8个品种大花蕙兰叶片MDA含量的变化1)Table 3 Changes in MDA content of different C.hybridum cultivars under cold stress μmolg-1
处理‘红霞’‘金玉满堂’‘天之骄子’‘马可’‘黄金岁月’‘红梅’‘翠玉’‘福娘’低温胁迫前 2.06±0.37a2.34±0.71a2.04±0.98a3.03±0.57ab2.49±0.53ab2.95±0.17ab1.94±0.87a3.61±0.48b低温胁迫5d4.70±0.53a4.74±0.60a4.39±0.55a7.87±0.86b5.04±0.74a8.06±0.15b7.24±2.98ab9.96±1.39b适温恢复5d3.27±0.45a3.51±0.48a2.66±0.52a5.46±0.57b3.03±0.22a5.1±0.26b4.06±1.36ab8.59±1.42c
1)同列数据后附不同小写字母者表示差异显著(P<0.05),附相同字母者表示差异不显著(P>0.05).
对大花蕙兰叶片的MDA含量进行多重比较,结果显示,8个品种间的差异显著.‘金玉满堂’、‘天之骄子’、‘红霞’和‘黄金岁月’的MDA含量显著低于‘福娘’、‘红梅’和‘马可’,与‘翠玉’的差异不显著;适温恢复后,‘马可’、‘翠玉’和‘红梅’的MDA含量显著低于‘福娘’;‘福娘’的MDA含量一直处于最高水平,显著高于其他品种,受低温损伤最严重.
2.3.3 可溶性糖含量 从图3可见,低温胁迫后,8个品种大花蕙兰叶片的可溶性糖含量均比低温胁迫前明显增加了,植株自身积累大量的可溶性糖来防止组织受寒害.
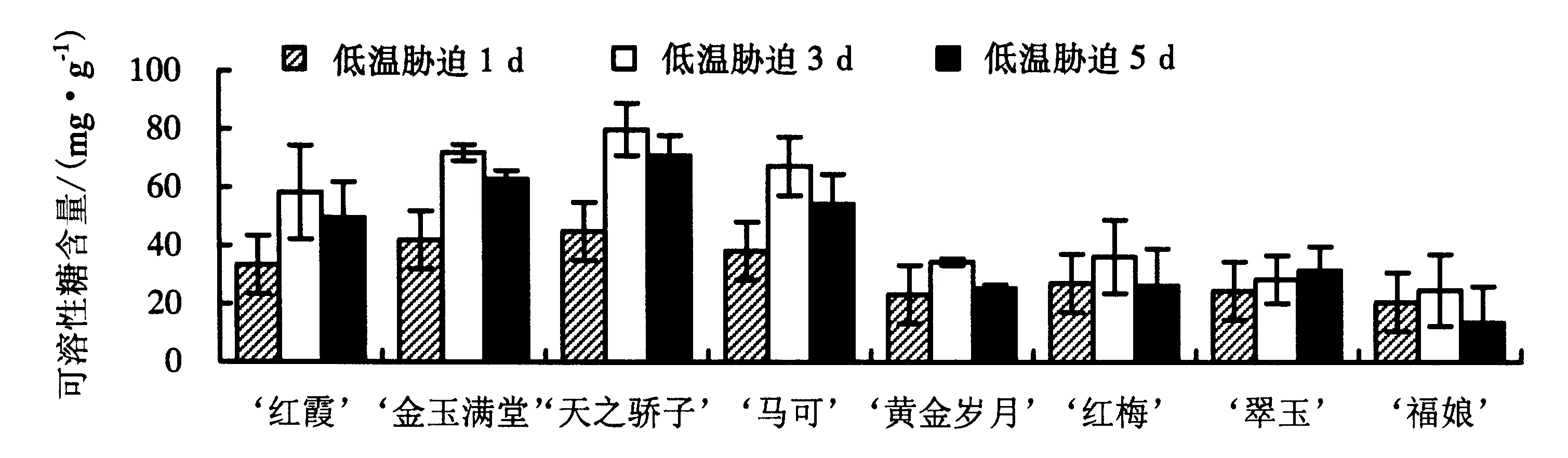
图3 低温胁迫下8个品种大花蕙兰叶片可溶性糖含量的变化Fig.3 Changes in soluble sugar content of different C.hybridum cultivars under cold stress
‘福娘’、‘黄金岁月’、‘翠玉’和‘红梅’的可溶性糖含量均较低,尤其是‘福娘’在低温胁迫3 d后仅上升至24.58 mg·g-1,且在低温胁迫5 d后下降到13.54 mg·g-1,反而比第1天下降了7.04 mg·g-1;‘红霞’和‘马可’的可溶性糖含量随着低温胁迫时间的延长显著增加,尤其在第3天,增加到58.28~67.32 mg·g-1,在第5天虽有所下降,但含量仍较高;‘天之骄子’和‘金玉满堂’的可溶性糖含量最高,在第3天增加到70 mg·g-1以上,显著高于其他品种,且在第5天仅小幅下降,仍在60 mg·g-1以上.
2.3.4 可溶性蛋白含量 从图4可见,随着低温胁迫时间的延长,8个品种大花蕙兰叶片的可溶性蛋白含量一直上升,第5天达到最大值.低温胁迫1 d,‘福娘’的可溶性蛋白含量显著低于其他品种,仅为4.08 mg·g-1,且在第3天无明显增加,仅在第5天急剧上升到17.15 mg·g-1,但仍显著低于其他品种,对低温的抗性最差;‘红梅’、‘红霞’、‘黄金岁月’、‘翠玉’和‘马可’的可溶性蛋白含量随着低温胁迫时间的延长一直上升,最终增加到30 mg·g-1左右;‘金玉满堂’和‘天之骄子’的可溶性蛋白含量随着胁迫时间的延长急剧上升,含量高于其他品种,胁迫5 d后分别为35.18和38.60 mg·g-1.
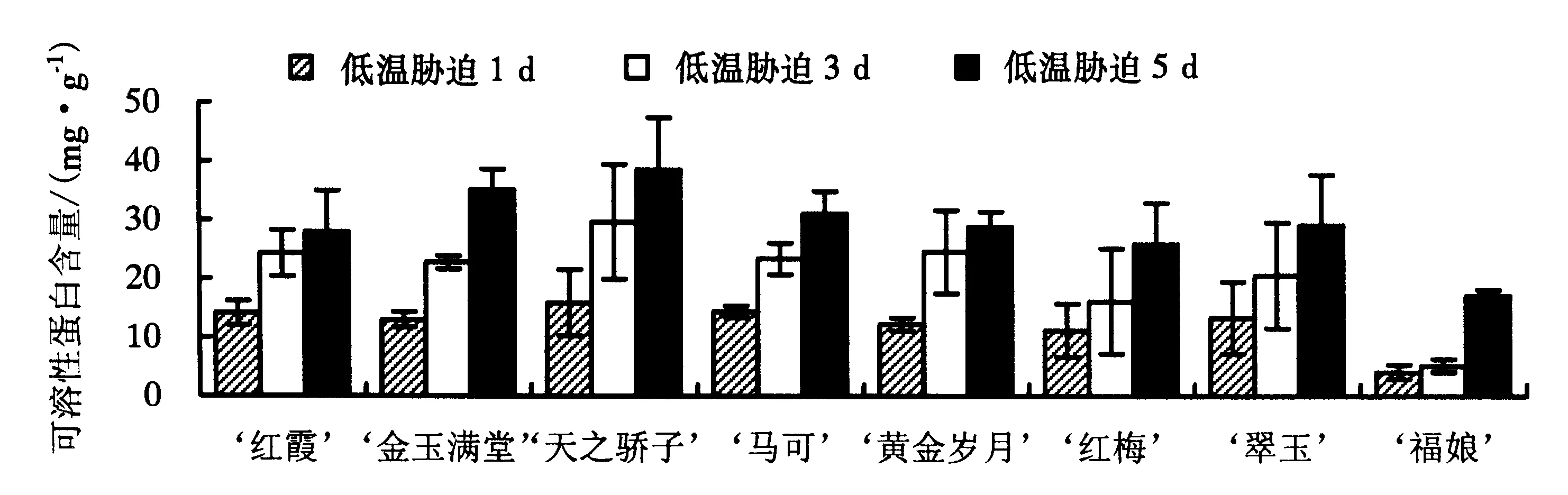
图4 低温胁迫下8个品种大花蕙兰叶片可溶性蛋白含量的变化Fig.4 Changes in soluble protein content of different C.hybridum cultivars under cold stress
2.4 大花蕙兰叶绿素荧光参数、生理指标与寒害指数的相关性
8个品种大花蕙兰叶片的Fv/Fm、可溶性糖含量、可溶性蛋白含量与寒害指数呈负相关关系.其中,Fv/Fm与寒害指数的相关系数达-0.944,可溶性糖含量、可溶性蛋白含量与寒害指数的相关系数分别为-0.739和-0.818,显著相关(表4).

表4 大花蕙兰寒害指数与其他指标的相关系数1)Table 4 Correlation coefficients between chilling injury index and other physiological indicators
1)**和*分别表示在0.01和0.05水平上显著相关.
F0、MDA含量、相对电导率与寒害指数呈正相关关系.其中,MDA含量与寒害指数的相关系数为0.893,极显著相关;相对电导率与寒害指数的相关系数为0.806,显著相关;而F0则与寒害指数无显著相关性,相关系数为0.656(表4).
进一步将Fv/Fm与其他指标进行相关性分析,结果(表5)显示,Fv/Fm与F0、MDA含量、相对电导率、可溶性蛋白含量均呈极显著相关,与可溶性糖含量显著相关.由表4可知,Fv/Fm与寒害指数的相关性达90%以上.因此,选用Fv/Fm作为筛选大花蕙兰的抗寒性指标是可行而且可靠的.

表5 大花蕙兰Fv/Fm与其他指标的相关系数1)Table 5 Correlations coefficients between Fv /Fm and other indicators
1)**和*分别表示在0.01和0.05水平上显著相关.
3 结论
(1)随着低温胁迫时间的延长,8个品种大花蕙兰叶片的Fv/Fm呈不同程度的下降;而MDA含量、相对电导率、可溶性蛋白含量和F0则显著上升;可溶性糖含量先上升后下降.恢复适温后,8个品种大花蕙兰叶片的Fv/Fm呈不同程度的回升,MDA含量、相对电导率和F0下降,但不同品种各项指标的变化幅度和速率有所不同.
(2)分别将F0、相对电导率、MDA含量、可溶性蛋白含量、可溶性糖含量与Fv/Fm进行相关分析.结果显示,Fv/Fm与F0、MDA含量、相对电导率、可溶性蛋白含量呈极显著相关,与可溶性糖含量显著相关,尤其与寒害指数的相关系数达0.944,可作为大花蕙兰抗寒性筛选的可靠指标之一.
(3)由Fv/Fm的变化最终得出8个品种大花蕙兰抗寒性由强到弱顺序为:‘金玉满堂’、‘天之骄子’、‘马可’、‘黄金岁月’、‘红梅’、‘红霞’、‘翠玉’和‘福娘’.
4 讨论
低温造成植株形态的变化是最有效和直观的,冷敏感植物对0 ℃下低温造成的寒害症状更为明显.大花蕙兰是亚热带原产的野生兰花的杂交种,对低温敏感,夜温为0 ℃时就会受害.品种之间由于其杂种亲本来源不一样,存在一定的抗寒性差异.
Salvucci et al[8]研究表明,植物叶片的Fv/Fm在没有光抑制的情况下一般为0.80~0.83,与物种和生长环境的关系不大.但受到低温等逆境胁迫后会显著降低,抗寒性强的品种比抗寒性弱的品种下降的少且慢,在适温恢复后抗寒性强的品种恢复的速度也比抗寒性弱的品种快,这一结论在水稻[9-10]、香蕉[11]等低温胁迫试验中均得到了验证,与本试验的结果一致.因此可以用不同品种Fv/Fm的大小和变化幅度的大小来判断品种的抗寒性.
王华荣等[12]研究表明,植物越冬前基本以淀粉的形式积累物质,贮存在茎、叶片等全株各处,低温胁迫后则转化为糖类和纤维素等物质来增强植物的抗逆性,可溶性糖含量越高,抗逆性越强.
受逆境胁迫后,植物细胞膜系统首先受到损伤,膜透性增大导致电解质外渗,电导率增大,细胞内产生大量自由基加速膜质过氧化反应,最终产物为MDA.相对电导率和MDA含量的变化可以反映植株细胞膜系统受损的程度,从而反映不同品种抗寒性的差异.蒋家月等[13]研究表明,相对电导率和MDA含量与植物的抗寒性呈负相关关系.
植物受逆境胁迫后,组织可以通过渗透调节物质来抵抗逆境伤害,其中,可溶性糖和可溶性蛋白是最常见的渗透调节物质.研究表明,抗寒性强的品种在低温胁迫后组织自身积累大量的可溶性糖来防止低温损伤.可溶性蛋白含量的变化比较复杂,与寒害指数的相关性不显著.
Fv/Fm与寒害指数、F0、MDA含量、相对电导率、可溶性蛋白含量均呈极显著相关,因此,不同品种间Fv/Fm在低温及适温下的变化可作为评价大花蕙兰品种抗寒性的快速、无损指标.
[1] 刘园.大花蕙兰花期调控技术的研究[D].北京:北京林业大学,2005.
[2] WIMBER D E. A clonal multiplication ofcymbidiumsthrough tissue culture of the shoot meristem [J]. Am Orchid Soc Bull, 1963,32:105-107
[3] 卢思聪,石雷.大花蕙兰[M].北京:中国农业出版社,2005.
[4] 李晓明.黄瓜耐冷指标的筛选及Ca2+在黄瓜耐冷中作用的研究[D].南京:南京农业大学,2006.
[5] 陈爱葵,韩瑞宏,李东洋,等.植物叶片相对电导率测定方法比较研究[J].广东教育学院学报,2010,32(5):88-91.
[6] 王学奎.植物生理生化实验原理和技术[M]:北京:高等教育出版社,2006.
[7] 李合生.植物生理生化实验原理与技术[M].北京:高等教育出版社,2000.
[8] SALVUCCI M E, CRAFTS-BRANDNER S J. Relationship between the heat tolerance of photosynthesis and the thermal stability of rubisco activase in plants from contrasting thermal environments [J]. Plant Physiology, 2004,134(4):1 460-1 470.
[9] 李平,李晓萍,陈贻竹,等.低温光抑制胁迫对不同抗冷性的籼稻抽穗期剑叶叶绿素荧光的影响[J].中国水稻科学,2000,14(2):88- 92.
[10] 李霞,戴传超,程睿,等.不同生育期水稻耐冷性的鉴定及耐冷性差异的生理机制[J].作物学报,2006,32(1):76-83.
[11] 习岗,陈厚彬.低温胁迫下香蕉叶片Chl a荧光动力学参量的变化及其品种差异性[J].光子学报,2002,31(11):1 326-1 329.
[12] 王华荣,王文举.低温胁迫对三个景观树种抗寒性生理指标的影响[J].北方园艺,2012(21):54-56.
[13] 蒋家月,金凤玲,王芸芳,等.冬季自然低温胁迫对茶树抗寒生理指标的影响[J].安徽农业大学学报,2012,39(3):394-396.
(责任编辑:施晓棠)
Cold resistance indexes identification and comprehensive evaluation of 8Cymbidiumhybridium
ZHOU Guiying1,2, WANG Siqing1, CHEN Qingran1, XU Jianxin2, WANG Chengcong2
(1. Landscape Architecture School, Beijing Forestry University, Beijing 100083, China; 2.Shenzhen Techand Ecology & Environment Limited Liability Company, Shenzhen, Guangdong 518040, China)
To screenCymbidiumhybridiumcultivar which adapts to cold climate in northern China, 8 varieties of 10-monthC.hybridiumwere subject to cold stress for 1, 3 and 5 d, with daytime temperature being 10 ℃ and night temperature being 0 ℃ (written as 10/0 ℃). After returning to growth cabinet temperature (25/15 ℃) for the same duration of cold treatment, respectively, cold injury index, minimal fluorescence (F0), maximal photochemistry efficiency (Fv/Fm), electric conductivity (EC), malonaldehyde (MDA), soluble sugar content and soluble protein content were monitored, and followed by correlation analysis for comprehensive evaluation. Results showed thatF0,Fv/Fm, MDA, EC and soluble protein content all increased as low-temperature treatment prolonged. While soluble sugar level firstly rose and then dropped. Magnitudes and rates of change varied among varieties. Furthermore,Fv/Fmwas significantly correlated withF0, EC, MDA and soluble protein content, and moderately correlated with soluble sugar. Correlation coefficient betweenFv/Fmand chilling injury index was -0.944, indicating thatFv/Fmcould be used as a reliable indicator of cold resistance ofC.hybridium. Hardiness of 8 types ofC.hybridiumfrom high to low wereC. ‘Golden Yellow’,C.‘Lihi Tabidachi’,C.‘Buddy Mark’,C. Lovely moon ‘Croscent’,C. ‘Honey Heart’,C. Royal Red Princess ‘Nobuko’,C. Plair ‘Days Memory’,C. ‘Fuku Musume’.
Cymbidiumhybridium; cold resistance; identification; comprehensive evaluation
2016-01-29
2016-06-13
广东省省级科技计划项目(2015B090904008);广东省软科学研究计划项目(2014B090903015);广东省生态环境建设与保护(铁汉)工程技术研究中心项目(粤科函政字[2013]1589号).
周桂英(1988-),女,硕士.研究方向:花卉栽培与育种.Email:Zgy0925@Foxmail.com.通讯作者王四清(1965-),男,教授,博士.研究方向:植物栽培生理.Email:wangsiqing547@sina.com.
S682.31
A
1671-5470(2017)01-0037-06
10.13323/j.cnki.j.fafu(nat.sci.).2017.01.007

