慢病毒介导的Cullin3沉默对人胶质瘤细胞的影响
秦彦昌,贾栋,于庆伟
慢病毒介导的Cullin3沉默对人胶质瘤细胞的影响
秦彦昌,贾栋,于庆伟
目的:探讨慢病毒介导特异性短发夹RNA(shRNA)干扰Cullin3表达对人胶质瘤细胞的影响。方法:RT-qPCR及Western blot检测Cullin3在人胶质瘤细胞系SW1783,U251及U87MG中的表达;构建靶向Cullin3的shRNA重组慢病毒,转染U251和U87MG细胞并测定转染效率。实验分为3组:Blank组(阴性对照组)、NC-shRNA组(空载慢病毒组)及Cullin3-shRNA组(慢病毒介导Cullin组)。MTT法和BrdU实验检测细胞活力和增殖能力;Transwell实验检测细胞迁移能力;流式细胞术检测细胞周期的变化。结果:与正常人星形胶质细胞相比,Cullin3在人胶质瘤细胞系SW1783,U251及U87MG中高表达。Cullin3-shRNA转染U251和U87MG细胞后,与Blank组及NC-shRNA组相比,Cullin3-shRNA组Cullin3表达水平下降(P<0.05),细胞活力和细胞增殖能力显著降低,侵袭能力下降,细胞周期被阻滞于G0/G1期。结论:Cullin3在胶质瘤细胞增殖和侵袭过程中发挥重要作用,提示Cullin3有望成为人脑胶质瘤基因治疗的候选靶点。
脑胶质瘤;Cullin3;短发夹RNA;慢病毒
脑胶质瘤是最常见的颅内恶性肿瘤之一,具有增殖能力强,易复发,预后差等特点[1]。其发病率约为颅内肿瘤的40%左右[2],中位生存期为15~19个月[3]。由于目前治疗方法(包括手术、放疗和化疗)的局限性,基因治疗成为研究热点[4-6]。既往研究表明Cullin 3参与胚胎发育、细胞周期调控和血压调节等生理过程[7]。Cullin3功能失调后导致原癌蛋白积累或过度降解肿瘤抑制蛋白,与肿瘤密切相关[8]。但Cullin3是否参与胶质瘤的发展尚不清楚。因而本研究通过构建Cullin3慢病毒载体并转染人胶质瘤U251及U87MG细胞,探讨其对胶质瘤细胞生长的影响。
1 材料与方法
1.1 主要材料与试剂
人胶质瘤细胞株SW1783,U251及U87MG购自中国科学院上海细胞生物科学研究所;胎牛血清和DMEM培养基购自美国HyClone公司;Lipofectamine-2000购自美国Invitrogen公司;慢病毒载体GV248及慢病毒包装质粒由上海吉凯基因化学公司提供。Cullin3,β-actin一抗及辣根过氧化物酶(horseradish peroxidase,HRP)标记的二抗购自美国Pierce公司。细胞周期检测试剂盒购自美国BD公司。
1.2 方法
1.2.1 慢病毒表达载体的构建 参考Gene-bank中人Cullin3核苷酸序列(序列号为:NM_ 001257197.1)设计3个Cullin3不同位点的特异shRNA靶点序列,并筛选出干扰效果最好的靶点序列(5’-ccggtGGTGCTCACGACAGGATATTGttcaagagaCAA TATCCTGTCGTGAGCACCttttttgatcc-3’);提取U251及U87MG细胞的总RNA,PCR扩增,Age I和BamH I双酶切PCR扩增产物,将其连接到GV248慢病毒载体后转入DH5α感受态细胞,鉴定并测序。最后用293T细胞包装病毒,滴度测定完成后转染目的细胞。
1.2.3 细胞培养与分组处理 人胶质瘤细胞株SW1783,U251及U87MG均培养于含10%胎牛血清的DMEM培养基中,培养条件为37°C,5%CO2。待细胞融合至80%~90%,随机分组进行试验。细胞分为3组:Blank组(阴性对照组),不做任何干预处理;NC-shRNA[空载体-短发夹RNA(short hairpin RNA,shRNA)]组;Cullin3-shRNA组。
1.2.4 实时定量逆转录PCR(RT-qPCR)检测mRNA表达 Trizol试剂提取各组细胞的总RNA,并用M-MLV逆转录酶合成cDNA。以cDNA为模板,RT-qPCR测定细胞中Cullin3 mRNA含量。反应体系(20 μl):SYBR Premix Ex Taq混合液12 μL,cDNA模板1 μL,上下游引物各1 μL(2.5 μmol/L),无RNA酶水5 μL。反应条件:94°C预变性10 min;95°C,40 s;61°C,40 s;72°C,45 s,40个循环;72°C延伸10 min。Cullin3的上游引物为:5’-GCCTTTCCGGTGCGAGAAG-3’,下游引物为5’-TACGACTTCTCCTTTCCGCT-3’。以β-actin作为内参基因,根据2-ΔΔCt计算方法计算基因相对表达水平。
1.2.5 蛋白免疫印迹法(Western blot)检测蛋白表达RIPA蛋白裂解液裂解细胞后,4°C,1 000 rpm离心10 min,吸取上清,BCA法测定总蛋白浓度。总蛋白以30 μg/孔上样,经10%SDS-PAGE凝胶电泳分离后,用电转移仪进行转膜;PVDF膜经PBS封闭液(含5%牛血清白蛋白)37°C封闭1 h后,加入Cullin3(1:1 000稀释)和β-actin(1:1 500稀释)一抗,4°C孵育过夜;随后加入相应的HRP标记的二抗,37°C孵育1 h。采用Image-Pro Plus图像分析软件测定目的蛋白的光密度值。
1.2.6 MTT检测细胞活力 将转染24 h的细胞接种到96孔板,每孔加入MTT溶液20 μL(5 g/L)。37°C条件下培养4 h,弃上清,每孔加入二甲基亚砜100 μL,震荡20 min,570 nm波长下测定各孔吸光光度值。
1.2.7 BrdU实验检测细胞增殖活性 将转染24 h的细胞接种到6孔板,每孔加入10 μmol/L的BrdU,继续培养24 h,再用40 g/L多聚甲醛固定30 min,血清封闭后加入抗BrdU抗体,4°C过夜,室温复温后加入罗丹明标记的荧光二抗,DAPI复染后,计数BrdU阳性细胞数,并进行统计学分析。
1.2.8 Transwell实验检测细胞的迁移能力 将转染24 h的细胞接种到Transwell上室中,下室中加入含10%胎牛血清的DMEM培养基(500 μL/孔)。37°C孵育24 h后,甲醇室温固定30 min,进行结晶紫染色。棉球小心擦去上室未穿膜的细胞,在倒置显微镜下随机取5个视野并计数穿过膜的细胞数。
1.2.9 流式细胞术检测细胞周期 将转染后的细胞以1×106细胞/孔接种于6孔板内,用0.25%胰酶消化细胞,待细胞开始浓缩变圆时立即用含10%胎牛血清的DMEM培养基终止消化。900 rpm离心5 min后,弃去培养基,收集细胞沉淀,用PBS洗涤2次。再次离心(900 rpm离心5 min),弃上清,加入75%乙醇2 mL,4℃过夜。1 200 rpm离心5 min后弃上清,PBS洗涤。加入400 μL的溴化乙锭(PI,50 μg/L)及100 μL RNA酶溶液(500 μg/mL),4℃避光孵育30 min。流式细胞仪检测细胞周期。
1.3 统计学处理
2 结果
2.1 不同胶质瘤细胞系中Cullin3表达
RT-qPCR及Western blot结果表明,与正常人脑星形胶质细胞相比,Cullin3在胶质瘤细胞系SW1783,U251及U87MG中表达均明显升高(P<0.05),且以U87MG中升高最为显著,其次为U251和SW1783,见图1。
2.2 慢病毒载体转染人脑胶质瘤U251及U87MG细胞
RT-qPCR及Western blot结果表明,与Blank组及NC-shRNA组相比,Cullin3-shRNA组细胞Cullin3 mRNA及蛋白表达显著降低,表明Cullin3-shRNA慢病毒载体成功转染至U251和U87MG细胞,见图2。
2.3 细胞活力及增殖力检测结果
与Blank组及NC-shRNA组相比,转染Cullin3-shRNA的U251和U87MG细胞的细胞活力显著下降,增殖能力显著降低(P<0.05),表明沉默Cullin3可显著抑制胶质瘤U251和U87MG细胞的细胞活力和增殖能力,见图3。
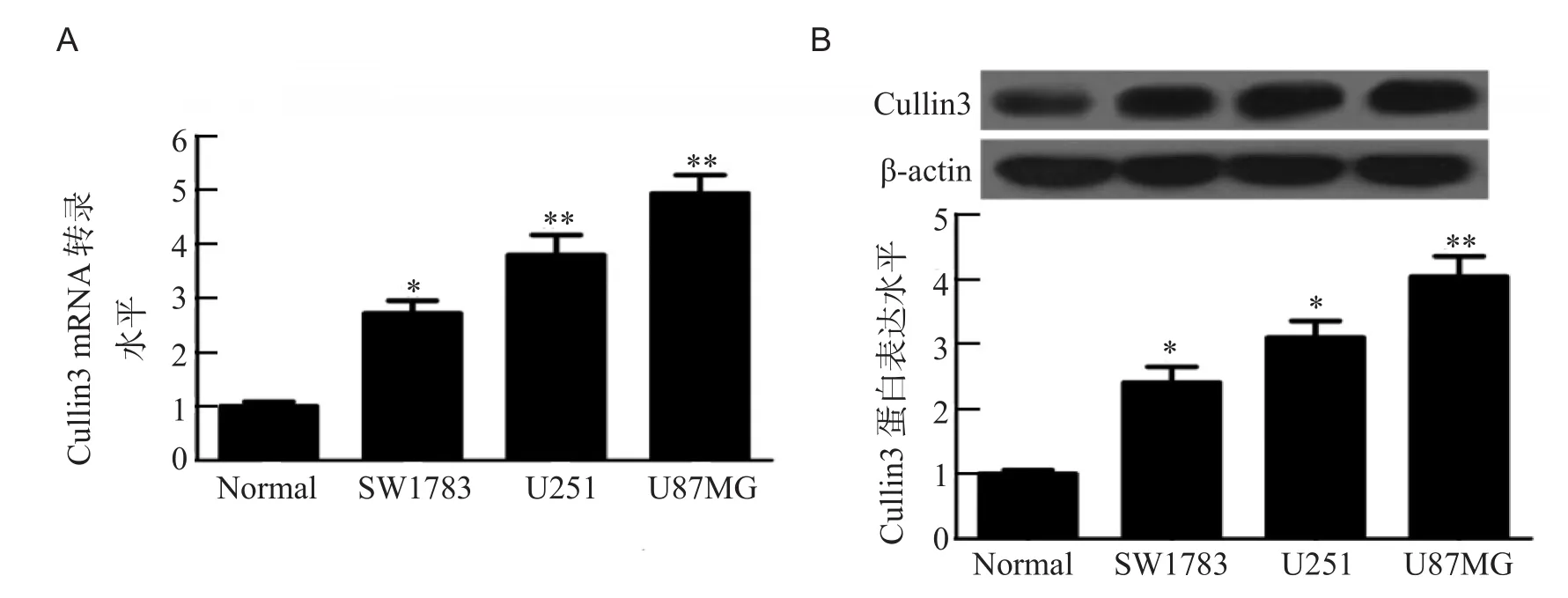
图1 胶质瘤细胞系中Cullin3 mRNA(A)及蛋白(B)表达水平
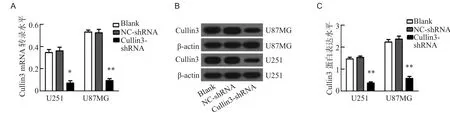
图2 U251及U87MG胶质瘤细胞中Cullin3 mRNA(A)及蛋白(B和C)表达水平
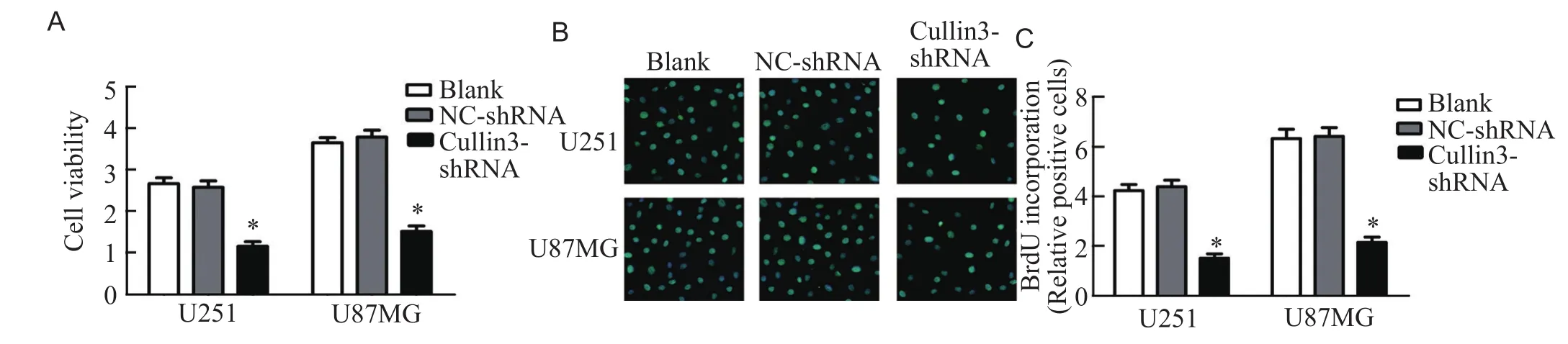
图3 U251及U87MG胶质瘤细胞细胞活力(A)和增殖能力(B)检测结果
2.4 Transwell实验检测细胞的迁移能力
与Blank组及NC-shRNA组相比,Cullin3-shRNA组U251和U87MG细胞的迁移能力明显下降,表明沉默Cullin3可显著抑制胶质瘤U251和U87MG细胞的细胞迁移能力,见图4。
2.5 Cullin3对U251和U87MG胶质瘤细胞周期的影响
以流式细胞术检测Cullin3沉默对细胞周期的影响,转染后48 h,与Blank组(57.46%)及NC-shRNA组(60.35%)相比,转染Cullin3-shRNA的U251细胞处于G0/G1期的细胞数明显增加,为74.54%,差异有统计学意义(P<0.05)。转染Cullin3-shRNA的U87MG细胞处于G0/G1期的细胞数为76.28%,显著高于Blank组(65.32%)及NC-shRNA组(67.89%)。以上结果表明Cullin3基因沉默显著引起U251和U87MG胶质瘤细胞的周期阻滞于G1期,从而抑制细胞增殖。
3 讨论
脑胶质瘤是中枢神经系统最常见的颅内恶性肿瘤,具有增殖能力强,易复发的特点[1]。然而,因为缺乏有效的分子标志物、药物靶点及治疗手段,其治疗一直困扰着人们。本文主要探讨了慢病毒介导shRNA干扰Cullin3表达对人胶质瘤细胞的影响并揭示出Cullin3在脑胶质瘤的增殖和迁移方面发挥了重要的作用。实验表明,与正常星形胶质细胞相比,Cullin3在脑胶质瘤细胞中过表达。沉默Cullin3能有效地抑制细胞的增殖和迁移并使细胞周期阻滞于G1期。
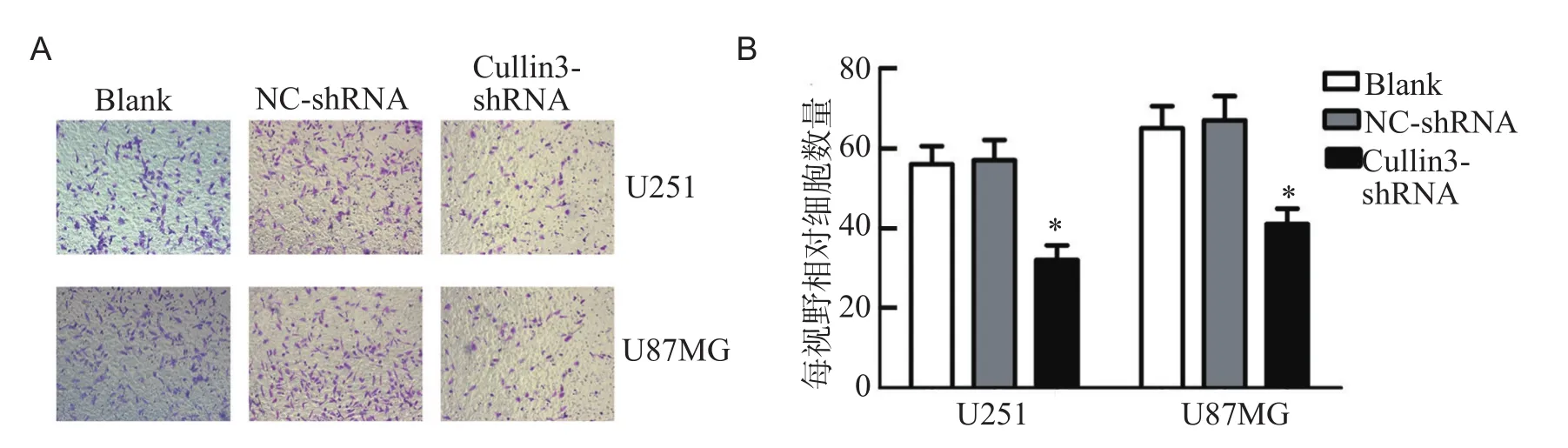
图4 U251及U87MG胶质瘤细胞细胞迁移能力检测结果
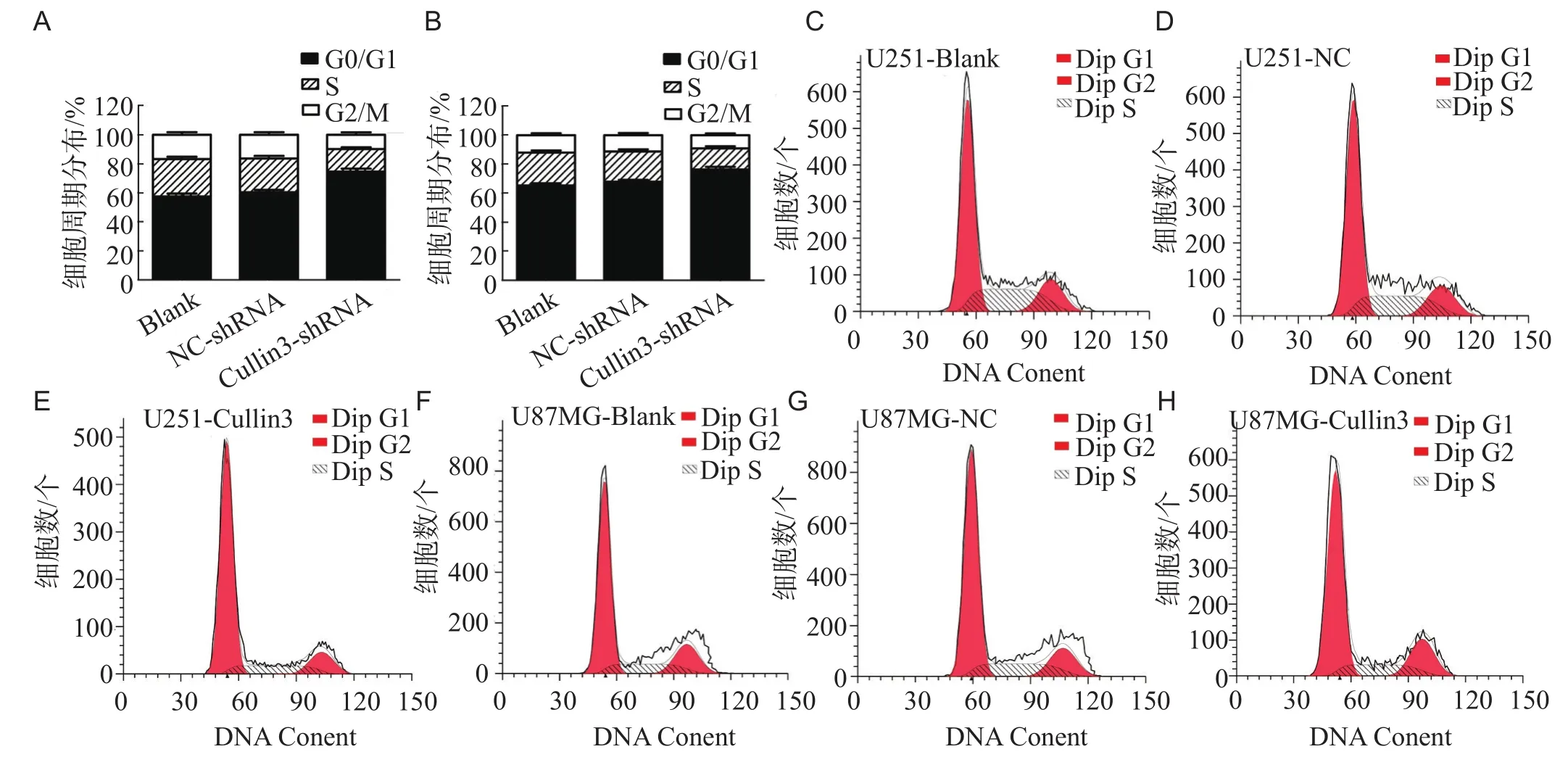
图5 流式细胞术检测细胞周期分布。U251(A)和U87MG(B)细胞周期的分布。U251 Blank组(C)、NC-shRNA组(D)及Cullin3-shRNA组(E)细胞周期分布。U87MG Blank组(F)、NC-shRNA组(G)及Cullin3-shRNA组(H)细胞周期分布。
Cullin蛋白为Cullin-Ring E3类泛素连接酶(CRLs家族)的一员,在人体中包括7个成员,即Cullin1、Cullin2、Cullin3、Cullin4A、Cullin4B、Cullin5及Cullin7,其在DNA复制、细胞周期、肿瘤抑制、生长发育及信号传到过程中发挥着重要的作用[9]。研究表明,过表达Cullin4A能够促进肺癌及垂体腺瘤的生长[10,11]。Cullin7缺失可诱导胰岛素信号途径异常并出现生长发育缺陷[12]。最近的一项研究发现Cullin1在胶质瘤组织中高表达,小RNA干扰其表达会抑制细胞的增殖和细胞周期的中断(G1)[13]。但Cullin3是否参与胶质瘤的发展尚不清楚。研究发现,Cullin3与代谢紊乱、神经退变及肿瘤等多种病症的发生发展有关[14]。Cullin3能够通过上调VEGF蛋白促进血管生成[15]。在乳腺癌细胞中,Cullin3上调并通过BRMS1促进细胞增殖及迁移[16]。在海马神经元和大脑皮质神经元中,Cullin3-KLHL20复合物促进轴突增生和分支[17]。这些研究提示Cullin3也有可能在神经相关疾病的发展进程中发挥了作用。本研究发现,在脑胶质瘤细胞中Cullin3在mRNA及蛋白水平过表达。慢病毒shRNA载体沉默Cullin3会抑制细胞的增殖和迁移。这与Huo等[16]的研究结果相似,即Cullin3能够促进乳腺癌细胞增殖和迁移。进一步研究表明,Cullin3是通过使细胞周期停滞在G0/G1期影响U251及U87MG胶质瘤细胞增殖。相关报道表明,Cullin3可以通过RhoA激酶调节血管平滑肌功能[18]并调节细胞周期[19],在脑胶质瘤中RhoA激酶是否也参与Cullin3对细胞的调控作用还有待验证。
综上所述,本研究表明Cullin3在脑胶质瘤细胞中过表达。沉默Cullin3能有效地抑制细胞的增殖和迁移并使细胞周期阻滞于G1期,提示Cullin3有望成为治疗脑胶质瘤的靶标分子。进一步研究将深入探讨及验证脑胶质瘤中Cullin3相关通路的调控作用机制,以期为胶质瘤的分子靶向治疗提供一个新的候选靶点。
[1]Ostrom QT,Gittleman H,Stetson L,et al.Epidemiology of gliomas[J]. Cancer Treat Res,2015,163:1-14.
[2]Omuro A,DeAngelis LM.Glioblastoma and other malignant gliomas: a clinical review[J].JAMA,2013,310:1842-1850.
[3]Stupp R,Mason WP,van den Bent MJ,et al.Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma[J].N Engl J Med, 2005,352:987-996.
[4]Castro MG,Candolfi M,Kroeger K,et al.Gene therapy and targeted toxins for glioma[J].Curr Gene Ther,2011,11:155-180.
[5]Murphy AM,Rabkin SD.Current status of gene therapy for brain tumors[J].Transl Res,2013,161:339-354.
[6]熊学华,邓健平,吕明学,等.CHOP在不同级别胶质瘤中的表达和意义[J].神经损伤与功能重建,2016,10:46-47.
[7]Genschik P,Sumara I,Lechner E.The emerging family of CULLIN3-RING ubiquitin ligases(CRL3s):cellular functions and disease implications[J].EMBO J,2013,32:2307-2320.
[8]Grau L,Luque-Garcia JL,Gonzalez-Peramato P,et al.A quantitative proteomic analysis uncovers the relevance of CUL3 in bladder cancer aggressiveness[J].PLoS One,2013,8:e53328.
[9]Bosu DR,Kipreos ET.Cullin-RING ubiquitin ligases:global regulation and activation cycles[J].Cell Div,2008,3:7-20.
[10]Wang Y,Zhang P,Liu Z,et al.CUL4A overexpression enhances lung tumor growth and sensitizes lung cancer cells to erlotinib via transcriptional regulation of EGFR[J].Mol Cancer,2014,13:252-265.
[11]Xu Y,Wang Y,Ma G,et al.CUL4A is overexpressed in human pituitary adenomas and regulates pituitary tumor cell proliferation[J].J Neurooncol,2014,116:625-632.
[12]Scheufele F,Wolf B,Kruse M,et al.Evidence for a regulatory role of Cullin-RING E3 ubiquitin ligase 7 in insulin signaling[J].Cell Signal, 2014,26:233-239.
[13]Fan YC,Zhu YS,Mei PJ,et al.Cullin1 regulates proliferation,migration and invasion of glioma cells[J].Med Oncol,2014,31:227-238.
[14]Yuan WC,Lee YR,Huang SF,et al.A Cullin3-KLHL20 Ubiquitin ligase-dependent pathway targets PML to potentiate HIF-1 signaling and prostate cancer progression[J].Cancer Cell,2011,20:214-228.
[15]Ohnuki H,Inoue H,Takemori N,et al.BAZF,a novel component of cullin3-based E3 ligase complex,mediates VEGFR and Notch cross-signaling in angiogenesis[J].Blood,2012,119:2688-2698.
[16]Huo X,Li S,Shi T,et al.Cullin3 promotes breast cancer cells metastasis and epithelial-mesenchymal transition by targeting BRMS1 for degradation[J].Oncotarget,2015,6:41959-41975.
[17]Lin MY,Lin YM,Kao TC,et al.PDZ-RhoGEF ubiquitination by Cullin3-KLHL20 controls neurotrophin-induced neurite outgrowth[J].J Cell Biol,2011,193:985-994.
[18]Pelham CJ,Ketsawatsomkron P,Groh S,et al.Cullin-3 regulates vascular smooth muscle function and arterial blood pressure via PPARgamma and RhoA/Rho-kinase[J].Cell Metab,2012,16:462-472.
[19]Lu A,Pfeffer SR.Golgi-associated RhoBTB3 targets cyclin E for ubiquitylation and promotes cell cycle progression[J].J Cell Biol,2013, 203:233-250.
(本文编辑:唐颖馨)
Effects of Lentivirus-mediated Cullin3 Silencing on Human Glioma Cells
QIN Yan-chang,JIA Dong,YU Qing-wei.Department of Neurosurgery,Tangdu Hospital,The Fourth Military Medical University,Xi’an 710038,China
Objective:To investigate the effects of Cullin3 gene silencing on the biological characteristics of human glioma cells.Methods:Cullin3 mRNA and protein levels in human glioma cells SW1783,U251 and U87MG were detected by RT-qPCR and Western blot.A lentiviral vector expressing Cullin3 shRNA was constructed and transfected into the U251 and U87MG cells and the transfection efficiency was confirmed.Cells were divided into three groups:the blank(negative control group),NC-shRNA(blank vector group)and the Cullin3-shRNA(Cullin3-shRNA vector group).The cell viability and cell proliferation were determined by MTT assay and BrdU incorporation assay respectively.Meanwhile,the cell migration was analyzed by Transwell assay. Flow cytometry was used to monitor the changes of cell cycle distribution.Results:The Cullin3 protein levels in SW1783,U251 and U87MG glioma cells were significantly higher than that in the normal astrocytes.Transfection of Cullin3-shRNA significantly abolished Cullin3 expression.Compared with the Blank and NC-shRNA groups,Cullin3-shRNA significantly inhibited the growth and proliferation of glioma cells U251and U87MG., In addtion,the migration rate was significantly decreased in Cullin3-shRNA group.Flow cytometry indicated that the cell cycle was arrested at G0/G1 phase in Cullin3-shRNA group.Conclusion:Cullin3 plays a critical role in gliomagenesis and development of glioma and it maybe a potential target for human glioma therapy.
glioma;cullin3;short hairpin RNA;lentivirus
R741;R739.41
ADOI10.16780/j.cnki.sjssgncj.2017.01.003
第四军医大学唐都医院神经外科西安 710038
2016-03-16
秦彦昌shidasda@163.com

