大麻素对星形胶质细胞谷氨酸释放的影响及机制研究
徐逸,韩静,王伟,朱舟
·论著·
大麻素对星形胶质细胞谷氨酸释放的影响及机制研究
徐逸1a,韩静2,王伟1b,朱舟1b
目的:观察人工合成大麻素HU210对体外培养中脑腹侧被盖(VTA)区星形胶质细胞谷氨酸释放的影响,并探讨抑制星形胶质细胞谷氨酸释放的药物治疗途径。方法:体外培养大鼠VTA脑区星形胶质细胞,RT-PCR及免疫荧光染色检测胶质纤维酸性蛋白(GFAP)及大麻素受体1(CB1R)的表达。将培养的星形胶质细胞分为4组:对照组(培养基中只加入0.2%DMSO),HU210组(培养基中加入3 μM HU210),HU210+ AM281组(培养基同时加入3 μM HU210及3 μM AM281)和HU210+Riluzole组(培养基同时加入3 μM HU210及3 μM Riluzole),各组4孔。干预30 min后,采用谷氨酸检测试剂盒观察各组星形胶质细胞培养基中谷氨酸浓度。再培养VTA脑区星形胶质细胞,分为对照组(培养基中只加入0.2%DMSO)和Riluzole组(培养基中加入3 μM Riluzole),干预30 min后,利用Western Blot印迹分析Riluzole干预后谷氨酸转运体-1(GLT-1)表达水平的变化。结果:RT-PCR及免疫荧光染色显示,星形胶质细胞内有广泛CB1R的表达。与对照组比较,HU210组星形胶质细胞谷氨酸的释放显著增加(P<0.01),HU210+AM281组及HU210+Riluzol组星形胶质细胞谷氨酸的释放较HU210组均显著降低(P<0.01);且HU210+Riluzol组星形胶质细胞的GLT-1表达较对照组升高(P<0.05)。结论:HU210可能通过激活星形胶质细胞的CB1R促进星形胶质细胞释放谷氨酸。Riluzole可能通过升高星形胶质细胞的GLT-1的表达,逆转HU210所致的谷氨酸释放。
星形胶质细胞;HU210;谷氨酸;大麻素受体1;利鲁唑
大麻是全球使用最广泛的成瘾物质[1,2],其成瘾机制尚不明确,暂无有效治疗方法。目前研究认为药物成瘾的机制与突触可塑性相关学习记忆机制有关[3,4]。突触可塑性改变包括长时程增强(long-term potentiation,LTP)和长时程抑制(long term depresion,LTD)。中脑腹侧被盖区(ventral tegmental area,VTA)的多巴胺神经元被认为是参与药物成瘾的重要脑区[5]。本课题组前期在大鼠脑片记录场兴奋性突触后电位(field excitatory postsynaptic potentials,fEPSCs),发现慢性大麻素暴露能导致VTA区的LTD,而利用TAT-谷氨酸受体(glutamic acid receptors,GluR)2阻断突触,能抑制人工合成大麻素HU210导致的条件位置偏爱(conditioned place preference,CPP),说明大麻诱导的LTD的确参与了大麻的成瘾行为[6]。LTD的产生依赖于谷氨酸释放增多及谷氨酸受体的激活[7,8],但目前研究认为大麻能减低突触前神经元的谷氨酸的释放[9],那么诱导LTD的谷氨酸从何而来?
在中枢神经系统中,除神经元外,星形胶质细胞上也广泛分布大麻素受体1(cannabinoid 1 receptor,CB1R),且可被外源大麻素激活[10],目前该受体对突触可塑性的调节作用仍不清楚。猜测大麻素能激活VTA区星形胶质细胞上的CB1R,促进星形胶质细胞释放谷氨酸,激活N-甲基-D-天冬氨酸受体(N-methyl-D-aspartic acid receptor,NMDAR)诱导VTA多巴胺神经元LTD的形成。为证实此猜想,本项目拟研究人工合成大麻素HU210对体外培养星形胶质细胞谷氨酸释放的影响,阐明大麻素诱导LTD产生的细胞分子机制。
1 材料与方法
1.1 主要试剂与材料
DMEM/F12培养基、小牛血清、胎牛血清购于Hyclone公司;MEM培养基购于Sigma公司;TRIzol reagent购于Life Technologies公司;小鼠胶质纤维酸性蛋白(glia fibrillary acidic protein,GFAP)单克隆抗体购于Chemicon公司,兔抗CB1R抗体、兔抗谷氨酸转运体-1(glutamate transporter-1,GLT-1)抗体购于 Santa Cruz Biotechnology公司,荧光二抗羊抗小鼠Alexa Fluor 488和羊抗兔Alexa Fluor 568购于Molecular Probes公司;逆转录试剂盒购于Fermentas公司;谷氨酸检测试剂盒购于Labor Diagnostika Nord公司;蛋白裂解试剂盒购于PIERCE公司。
1.2 方法
1.2.1 星形胶质细胞培养和鉴定 0~2 d的SD大鼠幼崽取大脑,剔除软脑膜,取大脑皮质,眼科剪剪成小块后吹打分散成细胞悬液,100目钢丝网筛过滤,制成密度为106/mL悬液,接种于涂有多聚赖氨酸的培养皿中,放置于37℃5%CO2培养箱培养。第2天更换培养基,以后每3天换1次培养基,培养第6天将培养瓶置于37℃恒温摇床振摇(150 rpm)2 h,弃上清。继而用0.125%的胰酶消化贴壁细胞,吹打成细胞悬液后以1∶2分散种于新的培养瓶,以种植密度106个/cm2接种于涂有多聚赖氨酸的盖玻片的6孔板。对星形胶质细胞进行特异性蛋白GFAP荧光标记和DAPI染核,取5张盖玻片,每张盖玻片计数互不重叠的4个视野,统计同一视野内GFAP阳性细胞占所有培养细胞的百分比,计算星形胶质细胞的培养纯度。
1.2.2 免疫荧光染色 取出培养皿中盖玻片,PBS冲洗3次后100%甲醇固定30 min,10%牛血清白蛋白封闭30 min,在不同的玻片上分别加入小鼠抗GFAP单克隆抗体(1:500)和兔抗CB1R抗体(1:300),4℃孵育过夜,PBS充分洗去一抗,加入羊抗小鼠Alexa Fluor 488(1: 500)和羊抗兔Alexa Fluor 568(1:500),PBS充分漂洗后在荧光显微镜(Zeiss,LSM510 META)下分别检测CB1R和GFAP的表达,阴性对照用PBS替代一抗。
1.2.3 逆转录 PCR(reverse transcription,RT-PCR)Trizol法提取星形胶质细胞RNA,紫外分光光度计测量总RNA的OD260和OD280值,调整为1 g/L,-70℃保存备用。按Fermentas逆转录试剂盒说明书进行操作。从Genebank中获取大鼠CB1R及GAPDH全长cDNA序列,应用Primer5.0软件自行设序,引物序列如下:CB1R 5’-GCCTATAAGAGGATCGTCACC-3’和5’-GTTCAGCAGGCAGAGCATACTG-3’;GAPDH 5’-CCTTCATTGACCTCAACTAC-3’和5’-GGAAGGCCATGCCAGTGAGC-3’。扩增片段长度为500 bp(CB1R)和594 bp(GAPDH)。配制1.5%琼脂糖凝胶,每孔加样5 μLPCR产物,以100 V恒压电泳50 min,SynGene凝胶成像系统拍照并进行电泳条带分析。
1.2.4 谷氨酸测定 12孔培养皿培养的融合的星形胶质细胞用D-hank’s液清洗后,换为不含谷氨酸的MEM培养基,分为4组:对照组(培养基中只加入0.2% DMSO),HU210组(培养基中加入3 μM HU210),HU210+AM281组(培养基同时加入3 μM HU210及3 μM AM281)和HU210+Riluzole组(培养基同时加入3 μM HU210及3 μM Riluzole),各组4孔。干预30 min后取培养基用谷氨酸检测试剂盒进行谷氨酸检测。
1.2.5 Western Blot检测 12孔培养皿培养的融合的星形胶质细胞用D-hank’s液清洗后,换为不含谷氨酸的MEM培养基,分为对照组(培养基中只加入0.2% DMSO)和Riluzole组(培养基中加入3 μM Riluzole),各组3孔。干预30 min后弃培养基,PBS洗3次,蛋白裂解试剂盒对细胞沉淀进行裂解,检测蛋白浓度,将等量煮沸变性蛋白质(30 μg/lane)在SDS聚丙烯酰胺凝胶(分离胶12%,积层胶5%)进行垂直电泳分离,然后全湿式电转法经电转移转至PVDF膜上,用含5%脱脂奶粉的TBS-T室温封闭2 h,加入一抗(GLT-1)(1:500)及actin(1:500)4℃慢摇过夜。第2天TBS-T充分漂洗后加入辣根过氧化物酶偶联二抗,在室温下摇动孵育2 h,TBS-T室温充分漂洗,加入Pierce试剂,用CCD数字成像系统拍照并进行条带分析,以测定目的基因的表达水平。
1.3 统计学处理
2 结果
2.1 星形胶质细胞的CB1表达
免疫荧光染色显示,纯化培养后星形胶质细胞百分率为(99.05±2.20)%,星形胶质细胞内有广泛CB1R的表达。见图1A-C。RT-PCR结果显示,VTA区星形胶质细胞内存在CB1R表达。
2.2 谷氨酸浓度检测
检测结果显示,与对照组比较,HU210组星形胶质细胞谷氨酸的释放显著增加(P<0.01),HU210+AM281组及HU210+Riluzol组星形胶质细胞谷氨酸的释放较HU210组均显著降低(P<0.01),见图3。
图2 RT-PCR扩增产物条带
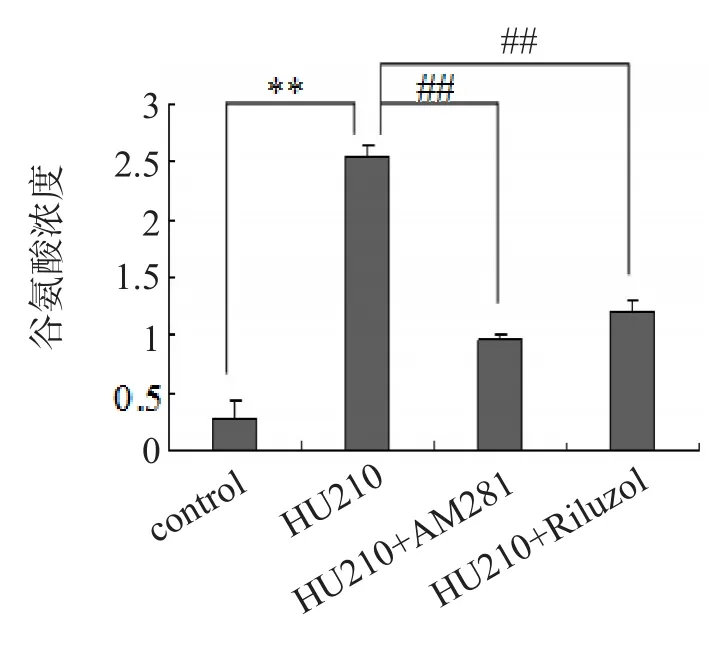
图3 各组星形胶质细胞谷氨酸释放浓度比较结果
2.3 Riluzole抑制星形胶质细胞GLT-1表达
Westen blot结果显示,干预后30 min,HU210+ Riluzol组星形胶质细胞的GLT-1表达较对照组升高(P<0.05),见图4。
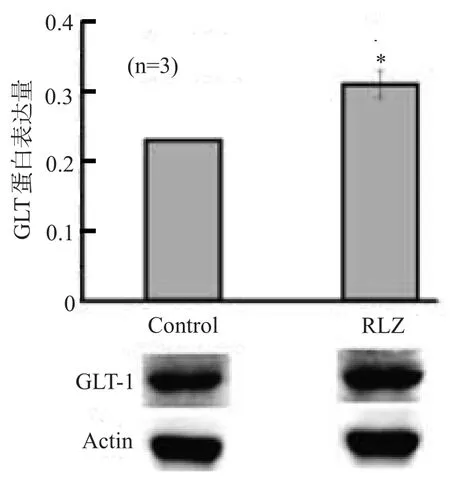
图4 Weston blot检测结果
3 讨论
桑科植物大麻是最早被人类认识的成瘾性植物之一,大麻素目前已被认为对多种神经系统疾病有治疗效果:如缺血性脑卒中、多发性硬化、帕金森病、阿尔茨海默病、睡眠障碍等[11,12]。但因大麻的成瘾性等不良影响,阻碍了医用大麻素的合法化使用。因此,探讨大麻的成瘾机制,找到有效途径阻止其不良影响将对大麻的合法治疗起到关键推动作用。
人工合成大麻素HU210的化学名为1,l-乙基庚基-1l-羟基四氢大麻酚(1,1-dimethylheptyl-11-hydroxytetrahydrocannabino1),是大麻素的活性成分四氢大麻酚(△9tetrahydrocannabinol,△9THC)的结构类似物,通过作用于CB1R发挥作用,且其与CB1R受体的亲和力较△9THC更强,作用持续时间更久。
本组前期实验已证实,慢性大麻暴露能诱导VTA区的LTD[6]。而LTD的产生依赖于NMDA受体的激活,这意味大麻能升高VTA区谷氨酸的释放。但目前研究认为大麻能减低VTA区突触前神经元谷氨酸的释放,导致中脑谷氨酸能神经元的突触前抑制。那么诱导LTD的谷氨酸从何而来?笔者猜测大麻素能激活VTA区星形胶质细胞CB1R,促进星形胶质细胞释放谷氨酸,激活NMDA受体诱导VTA多巴胺神经元LTD的形成。本研究证实体外培养VTA区星形胶质细胞有CB1R表达。
为本研究结果还证实HU210能显著促进星形胶质细胞谷氨酸释放,CB1R阻断剂AM281能逆转HU210所致的谷氨酸释放,表明HU210增高谷氨酸水平可能是通过激活星形胶质细胞的CB1R实现的。笔者推测大麻素激活了星形胶质细胞上的CBlR,导致谷氨酸大量释放。随后谷氨酸激活突触外含NR2B的NMDA受体引起突触后膜上AMPA受体的内吞[6],诱导了CBlR依赖的LTD,参与了大麻成瘾机制,下一步工作会对此推测进行证实。
本研究还进一步探讨了减少星形胶质细胞谷氨酸释放的治疗手段。Riluzole是市场上治疗肌萎缩侧索硬化症的药物,其作用机制尚不清楚,可能与其减少神经元突触前谷氨酸释放相关[13]。本研究发现Riluzole能显著逆转HU210所致的星形胶质细胞谷氨酸释放,Riluzole可能是通过升高星形胶质细胞GLT-1的表达,促进谷氨酸的转运,减少谷氨酸释放。进一步的实验中将探讨Riluzole对HU210在体内诱导LTD的抑制作用,为大麻成瘾的药物治疗找到新的策略。
[1]Elkashef A,Vocci F,Huestis M,et al.Marijuana neurobiology and treatment[J].SubstAbus,2008,29:17-29.
[2]Compton WM,Grant BF,Colliver JD,et al.Prevalence of marijuana use disorders in the United States:1991-1992 and 2001-2002[J].JAMA, 2004,291:2114-2121.
[3]Kalivas PW.The glutamate homeostasis hypothesis of addiction[J].Nat Rev Neurosci,2009,10:561-572.
[4]Hyman SE,Malenka RC,Nestler EJ.Neural mechanisms of addiction: the role of reward-related learning and memory[J].Annu Rev Neurosci, 2006,29:565-598.
[5]Kauer JA.Learning mechanisms in addiction:synaptic plasticity in the ventral tegmental area as a result of exposure to drugs of abuse[J].Annu Rev Physiol,2004,66:447-475.
[6]Liu Z,Han J,Jia L,et al.Synaptic Neurotransmission Depression in Ventral Tegmental Dopamine Neurons and Cannabinoid-Associated Addictive Learning[J].PLoS One,2010,5:e15634.
[7]Ahmadian G,Ju W,Liu L,et al.Tyrosine phosphorylation of GluR2 is required for insulin-stimulated AMPA receptor endocytosis and LTD[J]. EMBO J,2004,23:1040-1050.
[8]Liu L,Wong TP,Pozza MF,et al.Role of NMDA receptor subtypes in governing the direction of hippocampal synaptic plasticity[J].Science, 2004,304:1021-1024.
[9]Melis M,Pistis M,Perra S,et al.Endocannabinoids mediate presynaptic inhibition of glutamatergic transmission in rat ventral tegmental area dopamine neurons through activation of CB1 receptors[J].J Neurosci,2004, 24:53-62.
[10]Ge WP,Yang XJ,Zhang Z,et al.Long-term potentiation of neuron-glia synapses mediated by Ca2+-permeable AMPA receptors[J].Science,2006,312:1533-1537.
[11]Carlini EA.The good and the bad effects of(-)trans-delta-9-tetrahydrocannabinol(Delta 9-THC)on humans[J].Toxicon,2004,44:461-467.
[12]Hall W,Christie M,Currow D.Cannabinoids and cancer:causation, remediation,and palliation[J].Lancet Oncol,2005,6:35-42.
[13]Pittenger C,Coric V,Banasr M,et al.Riluzole in the treatment of mood and anxiety disorders[J].CNS Drugs,2008,22:761-786.
(本文编辑:唐颖馨)
Effect of Cannabinoids HU210 on Glutamate Release of Astrocytes and Its Mechanism
XU Yi1a,HAN Jing2,WANG Wei1b,ZHU Zhou1b.1.a.Department of Neurology,b.Department of Plastic Surgery,Tongji Hospital,Tongji Medical College,Huazhong University of Science and Technology,Wuhan 430030,China.2. Key Laboratory of Modern Teaching Technology of Ministry of Education,Shaanxi Normal University,Xian 710062
Objective:To investigate the effect of HU210 on glutamate release of cultured midbrain ventral tegmental area(VTA)astrocytes and its mechanism.Methods:VTA astrocytes were cultured.RT-PCR and immunostaining were used to detect the expression of glia fibrillary acidic protein(GFAP)and cannabinoid 1 receptor (CB1R).The cultured VTA astrocytes were randomly divided into 4 groups(n=4):control group(0.2%DMSO in medium),HU210 group(3 μM HU210 in medium),HU210+AM281group(3 μM HU210+3 μM AM281 in medium)and HU210+Riluzole group(3 μM HU210+3 μM Riluzole in medium).Concentration of glutamate in medium was detected using enzyme immunoassay of glutamate kit.And then the cultured VTA astrocytes were randomly divided into 2 groups(n=3):control group(0.2%DMSO in medium)and Riluzole group(3 μM Riluzole in medium).Western Bolt was used to detect the expression of glutamate transporter-1(GLT-1).Results:Abundant CB1R RNA and the protein were detected in astrocytes.HU210 increased glutamate release from cultured VTA astrocytes,which was suppressed by AM281.Riluzole suppressed HU210-induced glutamate release from cultured VTA astrocytes and increased the expression of astrocytic GLT-1 which served to remove the released glutamate.Conclusion:Cannabinoids HU210 probably activates VTA astrocytic CB1R to release glutamate and Riluzole probably increases the expression of GLT-1,thus suppressing HU210-induced glutamate release.
astrocyte;HU-210;glutamate;cannabinoid 1 receptor;Riluzole
R741;R971
ADOI10.16780/j.cnki.sjssgncj.2017.01.001
1.华中科技大学同济医学院附属同济医院a.整形外科,b.神经内科武汉 430030 2.陕西师范大学现代教学技术教育部重点实验室西安 710062
湖北省科技支撑计划(No.015BKA220)华中科技大学自主创新研究基金(No.2015ZHYX01 1)
2016-06-02
朱舟zhouzhu@medmail. com.cn

