丛枝菌根真菌对番茄生长、根际酶活和微生物数量的影响
祁红英,王其传,吴亚胜,赵政
(淮安柴米河农业科技发展有限公司,江苏,223001)
丛枝菌根真菌 (Arbuscular mycorrhizal fungi,AMF)对植物具有广泛的侵染性[1],土壤中的AMF与植物根系紧密结合,并依赖寄主植物的光合产物维持自身的生长和繁殖,同时以不同途径影响植物的代谢过程[2]。AMF在与宿主植物形成菌根会影响植物根际土壤的微生态环境,使土壤矿物质养分的存在形态及其化学有效性发生变化,进而影响到植株根系对养分含量的吸收和植株的生长。近年来,菌根效应研究己从AMF对植物营养的作用、对根系形态和代谢活性的影响、对植物生长的促进作用等方面向菌根对植物根际环境的作用和影响等方向拓展,并日益受到研究者的关注[3,4]。
本研究以番茄 (Lycopersicon esculentumMill.)品种苏粉11号为材料,通过在有机基质中添加丛枝菌根真菌,研究AMF对番茄幼苗生长的影响,探讨利用AMF增强有机基质的使用效果,为提高有机基质的应用效果提供试验依据。
1 材料与方法
1.1 试验材料
试验于2017年3~7月在淮安柴米河农业科技发展有限公司玻璃温室内进行。供试番茄品种为苏粉11号,由种子市场购得;菌根产品由捷克Symbiom公司研究院提供;育苗基质为蔬菜专用基质,由淮安柴米河农业科技发展有限公司提供。
1.2 试验方法
苗期试验设2个处理,分别为基质中不添加AMF的处理(CK);基质中添加AMF的处理(AMF)。
将丛枝菌根真菌菌剂(颗粒)与蔬菜育苗基质混配装到50孔穴盘,每盘50 g,每个处理装3盘,完全随机排列。基质装盘之前,穴盘用75%酒精擦洗消毒。
番茄种子用10%次氯酸钠溶液表面消毒5~10 min,在55℃温水中处理 15 min,然后在30℃的温水中浸种8 h,之后置于28℃的恒温箱中催芽,湿度80%,保持黑暗,直至发芽。待种子萌发,选取饱满、发芽整齐一致的种子播种于装有混配AMF基质的50孔穴盘中。育苗期间各处理于晴天9:00,用喷壶装清水均匀喷洒在育苗穴盘,以水刚从穴盘底部流出为宜。白天温度控制在22~28℃,夜间16~18℃,光合有效辐射(PPFD)为 400~800 μmol·m-2·s-1,相对湿度维持在60%~70%。待幼苗生长至30 d,测定生长指标、侵染率、根际酶活和微生物数量等指标。
1.3 测定指标与方法
①形态指标和干物质 株高:用直尺测定子叶节到生长点的高度(单位:cm);茎粗:用游标卡尺测量与子叶展开方向平行的子叶节或子叶节下0.5 cm处的粗度(单位:mm);植株用自来水洗净后用吸水纸擦干,分为地上部分和地下部分,测量鲜质量(单位:g);植株地上部分和地下部分置于烘箱中,105℃,杀青15 min,待温度降至75℃以下,烘干至恒重,测量干质量(单位:g)。
②菌根侵染率 每个处理需选取20条根段(减小因根样差异而造成的误差);将根样经20%KOH透明、酸化(5%醋酸)后,用5%醋酸墨水染色液(派克纯黑书写墨水Quink)染色,清水浸泡脱色后即可镜检。丛枝结构清晰可见,并能分辨AMF与其他未知真菌[5]。
根据根段侵染数量或程度分为0,10%,20%,30%,100%几种侵染等级,依下列公式计算该样品菌根侵染率。
侵染率(%)=∑(0%×根段数+10%×根段数+20%×根段数+30%×根段数+100%×根段数)/观察总根段数[6]。
③微生物数量 微生物数量采用稀释涂布平板法测定[7]。用千分之一的分析天平称取10 g基质加入盛有90 mL无菌水的三角瓶中,振荡10 min,使基质均匀分布在溶液中,成为基质悬浮液;吸取1 mL基质悬浮液于9 mL无菌水中振荡使稀释均匀,稀释成10-7~10-2浓度梯度的菌悬液。根据各类微生物在基质中数量多少选择适当浓度进行分离接种。本试验真菌采用10-3浓度,放线菌采用10-5浓度,细菌采用10-5浓度,各设3次重复。细菌菌落数用牛肉蛋白胨琼脂培养基平板计数法测定;真菌菌落数用马丁氏琼脂培养基平板计数法测定;放线菌菌落数用高氏1号琼脂培养基平板计数法测定[8]。
真菌、细菌和放线菌计数:每1 g基质中菌落数量=同一稀释度3次重复的平均菌落数×稀释倍数÷每10 g基质的干质量。
④根际酶活 过氧化氢酶活性采用高锰酸钾滴定法:取5 g根系基质,40 mL蒸馏水,5 mL 0.3 mol/L H2O2,37℃,20 min,5 mL 1.5 mol/L 硫酸溶液终止反应,过滤,取15 mL滤液,用0.1 mol/L高锰酸钾溶液滴定。
脲酶活性用苯酚钠比色法:5 g根系基质,加1 mL甲苯,加10 mL 10%尿素,20 mL pH值6.7柠檬酸盐缓冲液,过滤,取3 mL滤液,加4 mL苯酚钠溶液,3 mL 0.3%次氯酸钠溶液,定容到40 mL,显色20 min后于578 nm比色。
磷酸酶活性用磷酸苯二钠比色法测定:称取5 g根系基质,加入1 mL甲苯,15 min后加入20 mL的磷酸苯二钠(中性的柠檬酸缓冲液),37℃,24 h,蒸馏水定容到40 mL,过滤,取0.5 mL滤液,加入5 mL pH值9.0硼酸缓冲液,再加入3 mL 2.5%的铁氰化钾和3 mL 0.5 mol·L-1的4-氨基安替吡啉溶液,摇匀,蒸馏水定容到40 mL,稳定15 min,于570 nm比色。
蔗糖酶活性采用3,5-二硝基水杨酸比色法测定:称取5 g基质,置于 50 mL三角瓶中,注入15 mL 8%蔗糖溶液,5 mL pH值5.5磷酸缓冲液和5滴甲苯。摇匀混合物后,放入恒温箱,在37℃下培养24 h。到时取出,迅速过滤。从中吸取滤液1 mL,注入小试管中,加3 mL DNS试剂,在沸腾的水浴锅中加热5 min,随即将试管移至自来水流下冷却3 min。溶液因生成3-氨基-5-硝基水杨酸而呈橙黄色,最后将试管内液体转移至50 mL容量瓶中,并用蒸馏水定容稀释至50 mL。用分光光度计于508 nm处进行比色[9]。
1.4 数据处理
数据采用Office 2010统计,采用SPSS 20.0数据分析软件进行 Duncan's多重比较(P<0.05),采用Originpro进行作图。

表1 丛枝菌根真菌对番茄幼苗生长和菌根侵染率的影响
2 结果与分析
2.1 丛枝菌根真菌对番茄幼苗生长和菌根侵染率的影响
由表1可知,基质中添加AMF,番茄幼苗的叶片数、地上部干质量和地下部干质量没有受到明显影响,但其株高、茎粗、地上部鲜质量和地下部鲜质量均得到显著提高,提高幅度分别为 37.97% 、13.26% 、43.35% 和100.9%;而且,基质中添加AMF能够显著提高番茄幼苗的菌根侵染率。可见,基质中添加AMF可明显促进番茄幼苗的生长,显著提高幼苗的菌根侵染率。
2.2 丛枝菌根真菌对番茄幼苗根际微生物数量的影响
由图1可知,在混配基质中添加AMF,与对照相比较,番茄幼苗根际细菌数量、放线菌数量和细菌/真菌比值均显著提高,真菌数量显著下降。结果表明,基质中添加AMF能够有效地提高番茄根际细菌数量和放线菌数量,降低真菌的数量,从而增加细菌/真菌比值。

图1 丛枝菌根真菌对番茄幼苗根际微生物数量的影响
2.3 丛枝菌根真菌对番茄幼苗根际酶活性的影响
如图2所示,在混配基质中添加AMF,与对照相比较,番茄幼苗根际过氧化氢酶活性没有明显影响,但蔗糖酶活性、中性磷酸酶活性和脲酶活性都有显著的提高。结果表明,混配基质中添加AMF可显著改善番茄幼苗根际酶活性有利于有机质的转化,促进番茄幼苗的生长。
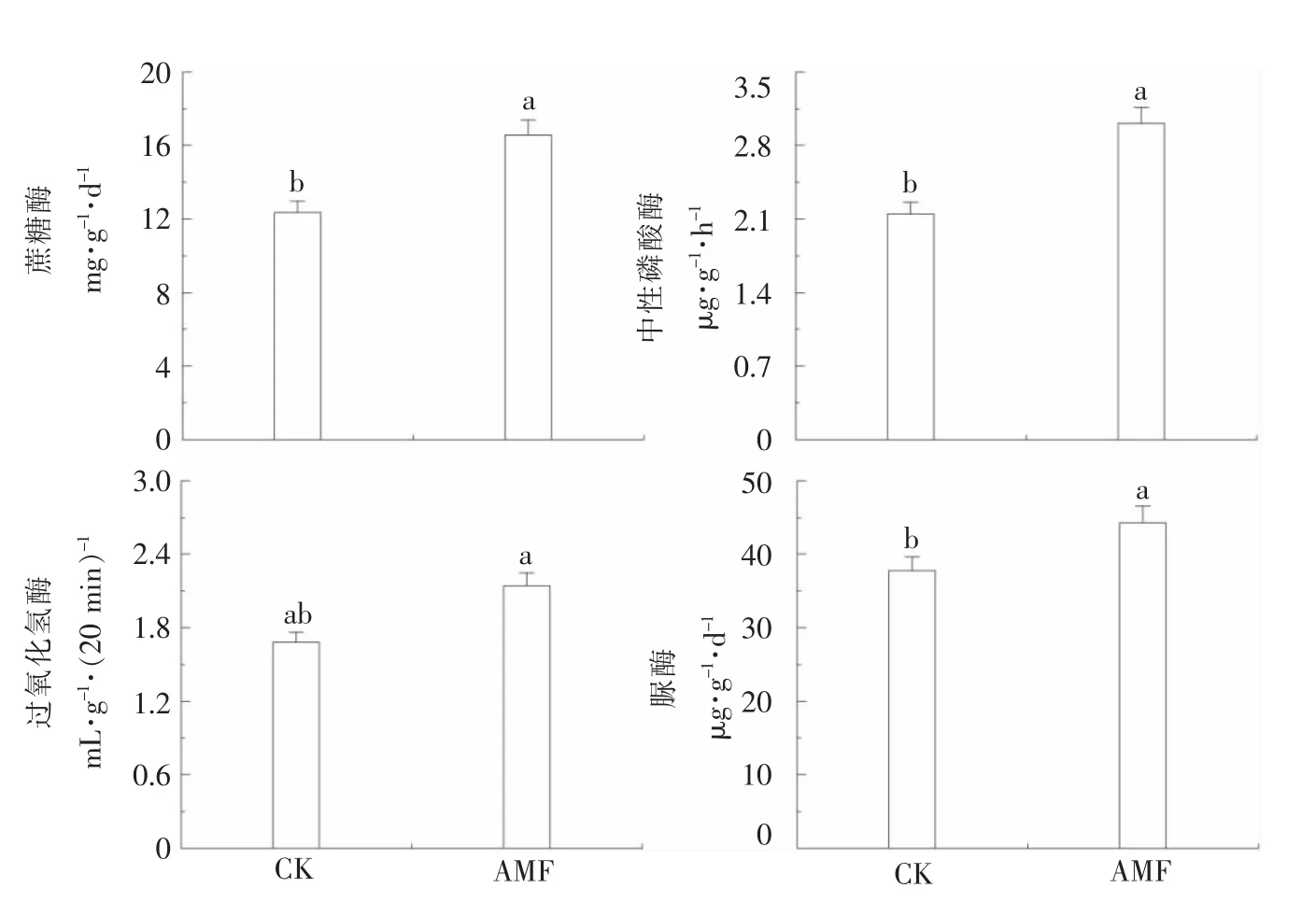
图2 丛枝菌根真菌对番茄幼苗根际酶活性的影响
3 讨论与结论
接种AMF对植物的生长均有同程度的促进作用,在植物的株高、干物质质重、叶面积等方面均有一定的体现[10]。本研究表明,通过在基质中添加AMF,能够显著促进番茄幼苗的生长,提高番茄幼苗的菌根侵染率,说明基质中添加AMF能够显著提高基质的使用效果。
大多数的土壤微生物是有利于作物的生长发育,参与土壤中氧化、氨化、固氮和硝化等生化过程。细菌在根际生态系统中占据着重要地位,因为菌根的高生理活性,所以菌根和非菌根根际的细菌种群和数量将会不同。潘超美等[11]研究结果表明,接种菌根真菌使得玉米的根际土壤的细菌和放线菌数量明显增多,真菌数量则减少。本研究结果显示,在混配基质中添加AMF,促使基质中微生物区系从低肥力的“真菌型”向高肥力的“细菌型”转化,提高基质中微生物的活力水平,有助于促进番茄幼苗对有效养分的转化和吸收。
根际酶是具有催化活性的蛋白质,反映了介质中养分的转化能力以及介质中生物活性的大小,参与介质中各种代谢过程和能量转化,被认为是重要的土壤介质性质和生态稳定的指示剂[12,13]。郑舜怡等[14]向基质中添加AMF,显著提高了辣椒植株根际酶活性。研究结果显示,单独添加AMF,根际基质中蔗糖酶活性、磷酸酶活性和脲酶活性显著升高,说明AMF能够促进基质中有机质转化,提高含氮有机物以及磷化合物水解速率,这与前人在土壤接种AMF的研究结果一致[15]。
综上所述,基质中添加AMF能显著提高番茄幼苗根际微生物数量,促使番茄幼苗根际微生物区系从“真菌型”向“细菌型”转化,提高根际微生物多样性;还能提高根际酶活性,有利于有机质的转化,维持植株根际生态系统的稳定性;而且添加AMF还可以提高幼苗的菌根侵染率,从而促进番茄幼苗的生长。
[1]Serrano P R,Gaxiola R.Microbial models and salt stress tolerance in plants[J].Critical Reviews in Plant Sciences,1994,13:121-138.
[2]Smith S E,Read D J.Mycorrhizal Symbiosis(Second Edition)[M].Manhattan:Academic Press,1997.
[3]廖继佩,林先贵,曹志洪,等.丛枝菌根真菌与重金属的相互作用对玉米根际微生物数量和磷酸酶活性的影响[J].应用与环境生物学报,2002(8):407-413.
[4]蔡晓布,冯固,钱成,等.丛枝菌根真菌对西藏高原草地植物和土壤环境的影响[J].土壤学报,2007,44:63-72.
[5]杨亚宁,巴雷,白晓楠,等.一种改进的丛枝菌根染色方法[J].生态学报,2010(30):774-779.
[6]Biermann B,Linderman R G.Quantifying verculararbuscular mycorrhizas: Aproposed method towards standardization[J].New Phytol,1981,87:63-67.
[7]胡开辉.微生物学实验[M].北京:中国林业出版社,2004.
[8]Wei L I,Cheng Z H,Meng H W,et al.Effect of rotating different vegetables on micro-biomass and enzyme in tomato continuous cropped substrate and afterculture tomato under plastic tunnel cultivation [J].Acta Horticulturae Sinica,2012(1):72-80.
[9]吴金水.土壤微生物生物量测定方法及其应用[M].北京:气象出版社,2006.
[10]王倡宪,郝志鹏.丛枝菌根真菌对黄瓜枯萎病的影响[J].菌物学报,2008,27:395-404.
[11]潘超美,郭庆荣,邱桥姐,等.VA菌根真菌对玉米生长及根际土壤微生态环境的影响[J].生态环境学报,2000(9):304-306.
[12]Stege P W,Messina G A,Bianchi G,et al.Determination of arylsulphatase and phosphatase enzyme activities in soil using screen-printed electrodes modified with multiwalled carbon nanotubes[J].Soil Biology and Biochemistry,2010,41:24 44-2 452.
[13]Tian L,Dell E,Shi W.Chemical composition of dissolved organic matter in agroecosystems:correlations with soil enzyme activity and carbon and nitrogen mineralization[J].Applied Soil Ecology,2010,46:426-435.
[14]郑舜怡,郭世荣,张钰,等.丛枝菌根真菌对辣椒光合特性及根际微生物多样性和酶活性的影响[J].西北植物学报,2014,34:800-809.
[15]黄啸.堆肥对黄瓜枯萎病抑制效果及其机理研究[M].杭州:浙江大学,2010.

