黄酮类化合物对镉毒性营养干预分子机制的研究进展
白卫滨,李 夏,朱翠娟,胡云峰,焦 睿,蒋鑫炜,孙建霞*
(1.暨南大学食品科学与工程系,广东 广州 510632;2.广东工业大学轻工化工学院,广东 广州 510090)
黄酮类化合物对镉毒性营养干预分子机制的研究进展
白卫滨1,李 夏1,朱翠娟1,胡云峰1,焦 睿1,蒋鑫炜1,孙建霞2,*
(1.暨南大学食品科学与工程系,广东 广州 510632;2.广东工业大学轻工化工学院,广东 广州 510090)
镉对生物器官和系统如肝脏、肾脏、骨、免疫系统和生殖系统等有着广泛的损伤作用;黄酮类化合物是多酚类化合物,广泛存在于多种植物中,而研究表明黄酮类化合物能有效预防或改善镉引起的机体损伤。本文主要对黄酮类化合物干预镉毒性的研究进展以及发挥保护作用的分子机制方面进行综述,为预防镉毒性和营养干预机制的进一步研究提供参考。
镉;黄酮;损伤;营养干预
镉(cadmium,Cd)是人体非必需微量元素,在环境中普遍存在。1968年,由慢性镉中毒引起的“痛痛病”被日本政府认定为公害病,使镉污染和镉中毒受到世界关注。镉作为重要的环境污染物和生产性毒物,对人类健康构成严重威胁。镉能通过职业接触、饮食、吸烟等方式进入人体,在体内生物半衰期长达10~30 年,对机体许多组织和器官都有毒性作用[1-2]。目前认为,镉中毒的主要机制为氧化损伤、干扰机体必需微量元素代谢、介导细胞凋亡以及影响表观遗传等[3]。虽然镉对细胞或组织的损伤效果是由于几个机制的协同作用,但是在特定类型的细胞中某一个机制占有主导地位[4]。因此,应用抗氧化剂、必需微量元素、络合剂和中草药等在镉中毒防治应用上备受关注[3,5]。
黄酮类化合物(flavonoids)是植物次级代谢产物,以结合态(黄酮苷)或自由态(黄酮苷元)形式存在于草药、水果蔬菜、豆类和茶叶等食源性植物,具有抗氧化性[6],可清除自由基,调节人体新陈代谢,预防慢性疾病。黄酮类化合物能通过抗氧化、清除自由基、螯合金属离子等多种机制对镉致机体多种组织器官损伤进行营养干预[6-7]。本文通过概述黄酮类化合物对镉毒性的营养干预作用的研究现状,为科学制定镉毒性作用的干预措施提供理论依据。
1 黄酮类化合物结构及特点
黄酮类化合物结构上均为两个具有酚羟基的苯环(A-环与B-环)通过中央3 个碳原子相互连结而成,基本母核称为2-苯基色原酮。黄酮类化合物的结构分类主要根据中央三碳链(即C3部分)的氧化程度、是否构成环状以及B环连接位置(2-或3-位)等不同进行分类。主要的天然黄酮类化合物包括黄酮类(flavones)和黄酮醇类(flavonols)、二氢黄酮类(flavonones)和二氢黄酮醇类(flavanonols)、异黄酮类(isoflavones)和二氢异黄酮类(isoflavanones)、查尔酮类(chalcones)和二氢查尔酮类(dihydrochalcones)、黄烷类(flavanes)、花色素类(anthocyanidines)和双黄酮类(bif l avones)[8]。
2 黄酮类化合物对镉毒性的干预机制
2.1 肝脏损伤的营养干预
很多实验表明,镉通过诱导氧化应激对机体造成损伤,主要通过调节核转录因子κB(nuclear factor κB,NF-κB)或基因调节蛋白P53影响相关DNA的转录,介导死亡受体通路或线粒体通路引发细胞凋亡,干扰必需金属元素造成肝损伤。而黄酮类化合物可以通过抗氧化、清除自由基以及螯合镉等机制保护镉致肝脏损伤。
2.1.1 黄酮类化合物对镉诱导活性氧簇的清除作用及抗脂质过氧化作用
镉通过多种途径诱导机体产生大量活性氧簇(reactive oxygen species,ROS),包括超氧阴离子自由基(superoxide anion free radical,O2-•)、过氧化氢(hydrogen peroxide,H2O2)和羟自由基(hydroxyl free radical,•OH)[9-11]。线粒体是细胞内ROS的主要来源[4],镉对细胞呼吸作用产生干扰,并协同Fe2+、Cu2+产生氧化自由基,加重了肝细胞的损伤[9,11-12]。镉与DNA结合蛋白“锌指”结构中的Zn2+发生置换反应时产生自由基,活化黄嘌呤氧化酶、血红素氧化酶使细胞内产生过量的超氧自由基[9]。镉使还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶(nicotinamide adenine dinucleotide phosphate oxidase,NOXs)活性增强,产生更多的O2-•[12]。ROS可以攻击生物膜系统,造成脂质过氧化(lipid peroxidation,LPO)[13-14],从而增加肝丙二醛(malondialdehyde,MDA)或硫代巴比妥酸产物(thiobarbituric acid reactive substances,TBARS)的含量[15-17],并抑制钙离子ATP酶使膜流动性降低[18]。在生理状态下,肝组织中主要表达内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS),不表达或较少表达诱生型一氧化氮合酶(inducible nitric oxide synthase,iNOS)。镉刺激机体iNOS产生过多的一氧化氮(NO),当其与O2-•形成过氧亚硝基阴离子等活性氮时,可以诱导脂质过氧化或进一步造成细胞损伤[19]。NO还可以抑制三羧酸循环中酶的活性,对生物能量代谢产生影响[11],所以过表达NO也是镉损伤的机制之一。研究还表明,脂质过氧化作用有助于急性镉中毒对肝脏的损伤但并不是镉损伤的必需机制,表明其他机制也可能参与肝的损伤如通过诱导线粒体通透性发挥镉毒性[17]。
黄酮类化合物具有低氧化还原电位和释放电子或氢原子的能力,能通过酚羟基与自由基反应生成较稳定的半醌式自由基,从而终止自由基链式反应,降低生物膜脂质过氧化的发生[20-26]。有研究发现柚皮素可以螯合亚铁离子从而减少•OH的产生[27]。Li Ruijin等[19]用异槲皮苷干预镉处理的小鼠,发现异槲皮苷可以螯合镉,减少氧自由基的产生,其酚羟基可以和O2-•及•OH反应,降低ROS水平,降低小鼠肝脏中MDA的含量,并且抑制NO和过氧硝酸盐的升高[14,19]。王静[11]用花青素、Gong Pin等[28]用越橘蓝莓提取物(花色苷),作用于镉诱导的小鼠,结果显示花青素和提取物均能降低LPO和MDA的含量,表现出了极强的抗氧化能力[29-31]。
2.1.2 黄酮类化合物对镉致肝毒性指标的影响
氧化应激不仅损伤磷脂双分子层造成脂质过氧化,还能氧化膜上巯基使得蛋白质羰基化合物(protein carbonyl compounds,PCO)[12,16]水平升高或者与膜上的酶和(或)受体结合,最终导致细胞膜的流动性和通透性改变,一些在线粒体或细胞质中的酶如谷丙转氨酶(alanine-aminotransferase,ALT)、碱性磷酸酶(alkaline phosphatase,ALP)、酸性磷酸酶(acid phosphatase,ACP)、谷草转氨酶(aspartateamino transferase,AST)、乳酸脱氢酶(lactate deshidrogenase,LDH)、谷氨酰转肽酶(glutamyl transpeptidase,GGT)就会在细胞膜受损后流出细胞,进入血液循环,所以这些肝酶常常被认为是肝损伤的标志物[17,20]。一些研究表明,镉负荷可以使血清中肝脏损伤相关酶活性升高[12,14,16]。
黄酮类化合物可以显著改善对肝脏损伤相关酶的影响,降低这些酶的活性。体内实验表明,长蒴黄麻叶水提取物(aqueous extract of Corchorus olitorius leaves,AECO)(50、100 mg/kg(以体质量计,下同))下调CdCl2(4 mg/kg)引起的血液ALT和AST的上升[16]。阿江榄仁树的果实提取物(the fruit extract of Terminalia arjuna,AE)可以抑制镉致小鼠血清ALT和ALP水平的升高[14]。然而,Vicente-Sánchez等[17]的研究表明槲皮素并没有改善镉对血浆标记酶ALT、AST、ALP、ACP、LDH和GGT的影响,这可能是因为肝损伤模型、镉处理方式、槲皮素的剂量以及干预时间的不同而造成槲皮素对镉毒性干预效果不同。此外,槲皮素的保护机制并不包括金属螯合[17,20]。
2.1.3 黄酮类化合物对镉损害抗氧化系统的保护机制
抗氧化防御系统可以保护细胞免受活性氧中毒和脂质过氧化,主要包括非酶抗氧化剂如还原型谷胱甘肽(reduced glutathione,GSH),以及谷胱甘肽-S-转移酶(glutathione S-transferase,GST)、谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)、超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、谷胱甘肽还原酶(glutathione reductase,GR)和葡萄糖-6-磷酸脱氢酶(glutathione-6-phosphate dehydrogenase,G6PD)等抗氧化酶。镉与巯基结合或者置换酶活性位点的辅基导致抗氧化酶活性下降或失活,造成ROS大量积累,进一步对肝脏造成多种损伤[14,16,27]。有研究证明,镉与GPx中的硒形成复合物,抑制活性[9]。镉与SOD的巯基结合或置换Cu-Zn SOD中的Zn,镉取代肝线粒体Mn SOD中的Mn2+从而使其抗氧化活性降低或丧失[9,32],但是Vicente-Sánchez等[17]发现镉处理Wistar大鼠后,SOD的活性上升,这可能是机体针对有毒物质的自我保护机制。镉与维持G6PD三级结构的—SH形成复合物,使其活性降低,又减小NADPH的产生,降低GR活性。镉能够抑制荷镉猴子的肝和肾中GST的合成,出现同工酶丢失现象,但能增加GST活性[9,33]。也有相关研究表明镉可以增加睾丸GST活性但不影响GSH水平,说明镉诱导此酶通过GSH循环解毒[34]。GSH可以中和ROS,还可以和镉结合发挥解毒作用[9,28]。镉使CAT大量耗尽促使自由基积累,反过来抑制活性。镉使得GSH耗竭[12,16],可以增加细胞脆弱性,进而破坏机体氧化-抗氧化平衡,引起自由基的过量积蓄,当过量自由基得不到及时清除,而又超过机体抗氧化系统的负荷时,能再次抑制抗氧化酶活性[11]。有资料表明,慢性镉暴露时GSH含量与组织内镉浓度的变化有相关性,高浓度镉可使GSH水平升高[9]。
实验研究证明黄酮类化合物可以恢复抗氧化剂的耗竭,拮抗镉对抗氧化酶活性的影响[11,17,20-21,23,28],从而提高机体抗氧化能力。Li Ruijin等[19]研究表明异槲皮苷可以通过抗氧化性能增加小鼠肝脏中SOD和CAT的活性从而减弱镉诱导的肝细胞毒性[21,35]。Ghosh等[14]用AE(含黄酮类物质)作用于镉处理的小鼠,发现AE可以改善镉导致的GST、GPx和GR等抗氧化酶活性的降低以及GSH的减少,保护机体达到正常的氧化还原水平以此应对氧化应激。Dua等[12]研究表明蕹菜水提取物(aqueous extracts of Ipomoea aquatica,AEIA)和沼菊水提取物(aqueous extracts of Enhydra fl uctuans,AEEF)(100 mg/kg)(含黄酮类物质)可以通过螯合或者清除自由基,改善电子传递链从而改善CdCl2(4 mg/kg)引起的G6PD、GST、GR、CAT和SOD等酶的活性降低以及GSH的含量下降。
2.1.4 黄酮类化合物对镉损伤大分子以及细胞凋亡的保护机制
氧化应激可以造成DNA损伤[9,20]。自由基可以直接损伤DNA分子,造成DNA的断裂[16]和DNA修复的抑制。DNA单链断裂后可能形成8-羟基脱氧鸟苷(8-hydroxy-2-deoxyguanosine,8-OHdG),该物质能够引起突变。因此8-OHdG也被普遍认为是致癌作用中氧化应激的标记物,并且DNA断裂程度以及8-OHdG的含量都与金属镉浓度呈正向依赖关系[15]。8-OHdG还能释放出与非金属硫蛋白(metallothionein,MT)结合的镉从而诱导DNA损伤。另外,镉可以影响细胞凋亡、坏死和增殖的有关基因和蛋白质的表达从而诱导细胞凋亡、细胞突变、细胞坏死、致畸、癌症等[15]。死亡受体通路通过Fas受体,激活半胱氨酸蛋白酶(caspase)-8,再激活凋亡效应因子caspase-3,最终诱导细胞凋亡。线粒体通路通过释放细胞色素c(cytochrome c,Cytc),激活caspase-9,再激活caspase-3,最终诱导细胞凋亡。B细胞淋巴瘤/白血病2(Bcl-2)家族(抗凋亡蛋白Bcl-2、促凋亡蛋白Bax、Bad、Bid)可以调节线粒体外膜对Cytc的释放,而自由基可以影响Bcl-2家族,诱导细胞凋亡[12]。此外,线粒体非caspases凋亡通路通过释放凋亡诱导因子(apoptosisinducing factor,AIF)造成细胞核DNA片段化从而诱导细胞凋亡。ROS也可以影响内质网应激[16],内质网应激可激活caspase-12通路诱导细胞凋亡[32]。NOXs可以激活丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)家族,而NF-κB可以调节某些基因的转录[9,11],诱导细胞凋亡。
曹锋[36]研究大豆异黄酮对镉造成的DNA损伤的保护作用,结果表明大豆异黄酮可通过清除自由基[21]的作用而拮抗镉造成的DNA损伤[11,21-22,28]。黄酮类化合物还能阻止线粒体中渗透性转变孔的形成阻止细胞凋亡[37]。Dua等[12]研究表明AEIA和AEEF(含黄酮类物质)可以抑制镉间接诱导产生的ROS引发的Bcl-2、Bad、Cytc、caspases、Fas、Bid的改变从而抑制肝细胞凋亡,并且通过螯合细胞内外的游离镉从而减轻机体镉负担。Dewanjee等[16]用AECO(200或400 μg/mL)(含黄酮类物质)作用于CdCl2(30 μmol/L)处理的小鼠肝细胞,发现AECO可以通过上调Bcl-2的表达,下调Bad、caspase-9、caspase-3以及NF-κB的表达从而阻断细胞凋亡通路[14],改善NOXs和内质网应激,拮抗镉毒性。AE(含黄酮类物质)可以下调磷酸化的c-Jun氨基末端激酶(phospho-c-Jun N-terminal kinase, phospho-JNK)P38蛋白激酶、细胞外信号调节激酶(extracellular regulated proteinhnase l/2,ERK 1/2)的表达,抑制MAPKs家族诱导的细胞凋亡[14]。
2.1.5 黄酮类化合物对镉诱导的炎症以及纤维化的保护机制
镉刺激巨噬细胞合成肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和转化生长因子-β(transforming growth factor-β,TGF-β),增强iNOS过表达一氧化氮(NO)[38],诱导环氧合酶(cyclooxygenase,COX)-2的表达介导炎症因子,从而引发炎症反应和/或导致肝细胞纤维化。NO可以促使各种炎症因子释放引发炎症反应造成肝脏损伤。T细胞分泌的白细胞介素(interleukin,IL)-4可以抑制炎症。由于镉诱导而增多的TNF-α和TGF-β可以激活肝星状细胞(hepatic stellate cells,HSCs),活化的HSCs增殖并表达a1胶原蛋白基因,分泌胶原蛋白,促使细胞外基质的合成最终引起肝纤维化。
研究表明,黄酮类化合物可以通过对iNOS、过氧化物酶和COX-2等作用[21],或者直接和NO反应来减少NO含量抑制炎症[11,21,28]。研究发现花色苷可以降低细胞因子TNF-α、IL-6和IL-1的释放,表明花色苷抑制了U937源巨噬细胞的活化,抑制NO的释放,从而抑制炎症[37,39]。黄酮类化合物由于其抗氧化作用可以控制ROS的产生,通过降低TNF-α和NO含量,升高IL-4含量抑制炎症[21,23]。黄酮类化合物可以降低TGF-β1和胶原蛋白的标志物羟脯氨酸(Hyp)的含量,减少胶原蛋白的产生。Hwang等[22]用荔枝花的丙酮提取物(含黄酮类化合物)作用于镉诱导的大鼠,研究结果表明提取物以其抗氧化作用可以抑制TGF-β1介导的HSCs的激活。卢春风等[40]实验证明槲皮素是酪氨酸蛋白激酶特异性抑制剂,竞争性抑制酪氨酸蛋白激酶活性,可阻滞HSCs由G0/G期进入S期,抑制了HSCs的增殖,相应减少细胞外间质(extracellular matrix,ECM)的合成,从而阻断了肝纤维化的形成。槲皮素和镉同处理还能诱导eNOS的超表达,增加NO产量,明显改善氧化应激[17]。
2.1.6 黄酮类化合物对镉干扰金属元素的保护机制
镉干扰生物必需金属如钙和锌。镉可通过钙通道进入细胞内也是导致镉的肝毒性的一种重要的生物过程。Cd2+浓度升高,Ca2+浓度升高。镉通过抑制Ca2+-ATP酶,增加Ca2+向细胞内的流动,使得细胞内Ca稳态失衡。镉又能加速非酶促反应,生成大量自由基,如此反复,最终引起细胞坏死[11]。钙离子释放到细胞质中可以促进镉致线粒体损伤,介导Cytc的释放和caspase-9的激活[28]。
镉竞争性结合Ca2+结合位点,干扰酶系统。还能取代钙与肌动蛋白、微丝、微管结合,损害细胞功能。Cd2+能够替代Ca2+与钙调蛋白(CaM)结合,激活钙调蛋白依赖型激酶以及与Ca2+相关的酶类,从而干扰信息传递,产生毒性[11,28]。镉可以置换Zn、干扰代谢、干扰酶系统。镉进入细胞后模拟其他二价离子如Zn2+和Ca2+去激活或抑制多种酶,从而干扰细胞代谢[28]。Cd2+浓度升高,Zn2+浓度减少。Zn消耗通过影响转录因子p53和p21的表达,使得镉诱导caspase-3的活化和细胞凋亡[28]。Gong Pin等[28]研究结果表明蓝莓提取物作用于镉诱导的小鼠后,提取物可以通过改变Zn2+和(或)Ca2+的含量而发挥其保肝作用。
2.1.7 黄酮类化合物对镉的积累的作用机制
镉的积累可能是造成镉毒性的原因之一。急性镉中毒时引起的氧化损伤与细胞内的GSH耗竭有关;而在慢性镉中毒的情况下,则与肾脏内MT结合镉浓度和微量元素的平衡紊乱有关[9]。MT可以螯合大量重金属,保护机体免遭镉等重金属的损伤,镉的诱导可以增加MT的表达。黄酮类化合物可以通过直接螯合重金属或者刺激MT的表达从而抑制镉在肝脏中的蓄积[3,23,28,41]。花青素对Cd2+有一定螯合作用,并且螯合作用与花青素的浓度有关。花青素能抑制Cd2+在肝脏中的蓄积,缓解损伤,加速Cd2+从肝细胞排出,减小游离Cd2+对机体损伤,还原肝细胞功能,促进镉损伤小鼠健康生长[11]。Vicente-Sánchez等[17]评估槲皮素对镉诱导的Wistar大鼠肝毒性保护作用,结果显示槲皮素和镉同时处理比镉单独诱导明显增加MT-1、MT-2 mRNA和蛋白质水平,增加MT的表达。
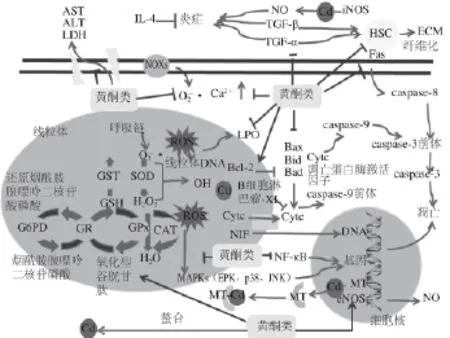
图1 黄酮类化合物对镉致肝毒性的营养干预Fig.1 Nutritional intervention of flavonoids on cadmium-induced hepatotoxicity
黄酮类化合物可以抑制或清除自由基,直接螯合重金属或者刺激MT的表达发挥解毒作用;抑制脂质过氧化,保护蛋白质和DNA不受自由基损伤,提高GSH的含量和抗氧化酶GST、GPx、SOD和CAT等酶的活性;调整Bcl-2家族,阻止线粒体中渗透性转变孔的形成从而抑制线粒体凋亡信号通路;黄酮类化合物既可以通过降低TNF-α和NO含量、升高IL-4含量从而抑制炎症反应,也可以通过抑制TNF-α和TGF-β1介导的HSCs的激活增殖,防止TGF-β1信号通路以及胶原蛋白的合成以此抗纤维化。恢复锌和钙离子到正常水平,发挥其保肝作用(图1)。
2.2 肾脏损伤的营养干预
进入人体的镉,主要在肝脏诱导MT合成并与之结合成Cd-MT。该复合物可通过血液运输达到肾脏。Cd-MT经肾小球滤过,流经肾小管时,肾小管上皮细胞膜上有与Cd-MT特异结合的位点,Cd-MT在刷状缘的表面或内部分裂为Cd2+和MT。这时MT分解消失,体内新的MT尚未合成,游离Cd2+诱导产生自由基,对刷状缘膜造成氧化性损伤[42]。在肾脏中,镉可以通过影响抗氧化系统中的GSH和抗氧化酶,使胞内ROS大量堆积,引发DNA断裂、蛋白质变性、脂质过氧化、线粒体膜损伤及细胞凋亡。镉可以增加巨噬细胞COX-2(合成前列腺素E2(prostaglandin E2,PGE2))和iNOS的表达从而诱发炎症,也可以通过影响嘌呤核苷酸和蛋白质分解代谢从而使得尿酸和尿素的含量上升。镉也能影响肌肉代谢,导致肌酐含量增高,肌酐清除率下降。另外,镉可以导致肾小管坏死,炎性细胞浸润,肾小管退化。
Dkhil等[43]用灯笼草的果实提取物(含黄酮类化合物)或柚皮素干预氯化镉致大鼠肝肾毒性,研究发现其抗氧化活性可以逆转大鼠肝和肾组织的病理变化,发挥抗氧化和抗凋亡作用。在大鼠腹腔注射6.5 mg/kg剂量的氯化镉前,预先给大鼠口服提取物200 mg/kg,结果表明提取物可以清除ROS、清除体内的毒素、防止镉引起的脂质过氧化和进一步的氧化损伤[27,44-45];提取物和柚皮素都可以恢复抗氧化酶(SOD、CAT、GR、GPx)活性[27,44-47],增加稳定谷胱甘肽的状态和(或)合成率,加强抗氧化系统,显著抑制镉引起的肾脏重量和肾脏指数降低以及血清中尿酸、尿素和肌酐含量的增加[27,44-45],这表明提取物改善了镉致肾毒性和肾小体、肾小管退行性改变。另外,提取物恢复了镉对iNOS的上调和NO的增加从而抑制了炎症反应[48],并且解除了镉对Bcl-2的抑制引起的细胞凋亡,增加肾中Bcl-2蛋白的表达。然而,Bcl-2的增加不完全抑制镉诱导的肾脏细胞凋亡,这表明其他机制也参与镉对肾细胞的损伤。Wang Lin等[49]发现P38-MAPK途径在槲皮素对抗镉致急性肾损伤的保护机制中起重要作用,在大鼠肾脏近曲小管上皮细胞(proximal tubular epithelial cells,rPT)中,槲皮素通过抑制氯化镉激活的P38-MAPK途径从而抑制原癌基因c-myc与c-fos的表达,提高细胞的存活率,减轻血清、尿和肾组织中的生化改变。槲皮素对镉致肾毒性的保护作用可能包括增加肾脏eNOS的表达,增加NO产量[27,48,50]。
Kandasamy等[51-52]研究发现杨梅素可以改善糖代谢从而提高葡萄糖利用率和肾功能,减轻链脲佐菌素镉诱导的糖尿病肾病大鼠的肾组织损伤。杨梅素通过清除自由基,保护β细胞以及再生β细胞,升高血浆胰岛素的含量,增加糖原的合成,增强碳水化合物代谢酶如糖原合成酶和己糖激酶活性,增强胰岛素信号分子的表达如葡萄糖转运蛋白(glucose transporter,GLUT)-2、GLUT-4、胰岛素受体底物(insulin receptor substrate,IRS)-1、IRS-2和蛋白激酶B(protein kinase B,PKB)从而显著恢复糖代谢产物如血糖、糖化血红蛋白、糖原磷酸化酶和糖异生酶和肾功能指标正常化。杨梅素还具有金属螯合作用,也可以促使镉排出体外(图2)。

图2 黄酮类化合物对镉致肾毒性的营养干预Fig.2 Nutritional intervention of fl avonoids on cadmium-induced nephrotoxicity
2.3 生殖系统损伤的营养干预
镉可以诱导睾丸ROS大量生成及脂质过氧化程度增加,同时耗竭GSH,降低抗氧化酶(SOD、GPx)的活性,激活促凋亡蛋白Bax和caspase-3的表达并抑制抗凋亡蛋白Bcl-2的表达,经线粒体信号途径引起生殖细胞的凋亡[53]。下丘脑释放促性腺激素释放激素(gonadotropinreleasing hormone,GnRH),刺激垂体产生促黄体生成激素(luteinizing hormone,LH),控制睾丸间质细胞的功能。垂体分泌的促卵泡激素(follicle stimulating hormone,FSH)可以启动生精,而睾丸间质细胞利用胆固醇合成的睾酮(testosterone,T)可以维持生精。抑制素具有强烈的抑制FSH分泌的作用,但对LH的分泌仅具轻微的抑制作用。另外,睾丸中的唾液酸可以维持细胞膜的完整性,同时对精子的运动有润滑效果,镉也可以通过影响Ca2+进而影响精子的运动[54]。国内外均有镉对实验动物激素水平影响的研究,但是结论却不完全一致。阎平等[23,55-56]研究表明镉对LH、FSH和T没有明显影响,表明垂体的代偿功能维持LH和FSH在正常水平范围。Farombi等[34]的研究结果显示镉可以降低FSH的含量,降低垂体对LH的分泌,从而降低T的产生,镉也能减少睾丸支持细胞和间质细胞数量影响雄激素状态[34,57]。镉对大鼠的影响呈现年龄相关性,对发育期大鼠的LH和FSH无显著影响,使T水平增加,但是会降低青春期后的大鼠FSH和T的水平[58]。也有研究表明镉可以增加LH和FSH并且降低T的含量[59]。这可能是与染毒途径、剂量、时间以及所采用的实验动物种类不同有关。
Manigandan等[60]研究证明花旗松素有着较强浓度依赖性的抗氧化性能,能减少斑马鱼胚胎中脂质过氧化作用,极大地增强抗氧化酶(SOD、CAT、GPx和GR)的含量[4,23,34,53],通过调节发育畸形和氧化应激而减轻致死效应[61]。研究发现,胡芦巴籽粉对睾丸的保护机制和对肝脏类似,通过降低TNF-α和NO的含量,升高IL-4的含量发挥抗炎效果[23]。黄酮类化合物可以通过降低Hyp和TGF-β1的含量,减少胶原蛋白的产生,从而抑制纤维化。Jia Yudong等[4]用槲皮素干预镉致鸡卵泡颗粒细胞损伤,结果表明质量浓度为1 μg/mL的槲皮素可通过抑制镉引起鸡卵泡颗粒细胞较高的Bax和caspase-3表达,并调节镉对抗凋亡蛋白Bcl-2及X连锁凋亡抑制蛋白(X linked inhibitor of apoptosis p rotein,XIAP)的抑制从而减轻镉诱导的细胞凋亡[53]。这说明槲皮素可以通过其抗氧化特性调节线粒体和caspase-3途径抑制凋亡,有效缓解镉造成的生殖毒性[4,53,62-63]。Farombi等[34]比较了双黄酮kolaviron和槲皮素在镉致成年雄性大鼠的生殖毒性的保护作用,发现这两者能屏蔽自由基介导的睾丸膜损伤,抑制转氨酶和碱性磷酸酶活性的增加,并通过增加LH、T、FSH含量从而有效抵制镉对内分泌和睾丸结构的不利影响[54]。另外,kolaviron和槲皮素能降低TNF-α的含量,升高血清睾酮的水平[23,55]。Adaramoye等[54]的研究表明面包果的甲醇提取物(methanol extract of Artocarpus altilis,AA)和槲皮素都能提高大鼠睾丸中胆固醇和唾液酸的含量。Minutoli等[59]研究发现类黄酮f l avocoxid通过降低信号调节激酶(p-ERK 1/2)、TNF-α、COX-2、5-脂氧酶(5-lipoxygenase,5-LOX)、MDA、Bax、FSH、LH和TGF-β3,增加Bcl-2、T、抑制素B、紧密连接蛋白(occludin)和神经钙黏素(N-cadherin)改善睾丸组织结构和血-睾丸屏障。f l avocoxid以其抗炎、抗氧化和抗凋亡作用减轻镉致小鼠睾丸损伤作用(图3)。
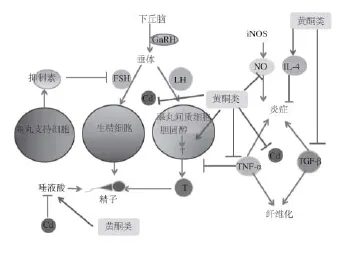
图3 黄酮类化合物对镉影响内分泌的营养干预Fig.3 Nutritional intervention of fl avonoids on endocrine in the presence of cadmium
2.4 骨骼损伤的营养干预
镉可以直接作用于骨细胞,影响其分化和活性。镉可以取代羟基磷灰石晶体中的钙,直接影响骨代谢。镉也可以通过损伤肾小管间接影响骨代谢,降低血浆1,25(OH)2D3的浓度,通过抑制钙结合蛋白的合成以此降低钙的吸收,增加尿钙排泄量、骨矿物质流失[64]。镉抑制骨形成,增强骨吸收,骨转换率升高,所以骨密度降低,最终导致骨软化和骨质疏松症[65-67]。镉导致血清骨钙素含量明显升高(抑制软骨钙化)。
黄酮类化合物可以通过抑制骨吸收,降低血清骨钙素,恢复骨细胞对金属离子的吸收和平衡,促进镉的排泄等方式保护骨骼。染料木黄酮能有效抑制镉处理的切除卵巢雌性Wistar大鼠中骨钙的释放,从而抑制血清钙浓度的增加,并且抑制骨转换尤其是骨吸收增加引起的骨密度降低、骨量减少,预防骨质疏松症,还能增加股骨质量。染料木黄酮和大豆苷元由于含有羟基基团,与镉形成不溶性的化合物,提高尿镉、粪便镉的排泄量预防镉致骨质流失[68-69]。Brzóska等[64]的研究表明黑果腺肋花楸多酚(Aronia melanocarpa polyphenols,AMP)(主要是花色苷)可以螯合胃肠道和骨骼中已吸收或未吸收的镉,降低镉的积累,提高ALP和可以抑制破骨细胞活性的骨保护素(osteoprotegerin,OPG)含量,增强骨形成,并且下调可溶性核因子激活受体的配体(soluble receptor activator of nuclear factor-κB ligand,sRANKL)/ OPG,减弱骨吸收。
2.5 其他损伤的营养干预
2.5.1 神经系统损伤的营养干预
核苷三磷酸水解酶(nucleoside triphosphate diphosphohydrolase,NTPDase)水解ATP或ADP形成AMP,AMP被核苷酸酶水解形成腺嘌呤核苷,腺嘌呤核苷被腺苷脱氨酶(adenosine deaminase,ADA)水解形成次黄嘌呤核苷[70]。镉穿越血脑屏障(blood brain barrier,BBB),增强NTPDase、ADA和核苷酸酶的活性,抑制GSH、GST和GR活性,诱导产生的ROS氧化神经元膜类脂和膜蛋白,通过膜完整性的破坏和膜电位损失或者结合酶的巯基形成Cd-ATP酶,导致对ATP酶(包括Na+/K+-ATP酶和Mg2+-ATP酶)的抑制。膜损伤导致细胞膜上的乙酰胆碱酯酶(acetylcholinesterase,AChE)的构象发生改变,镉可以取代金属离子或直接钝化此酶从而抑制AChE对乙酰胆碱(acetylcholine,Ach)的降解,过度激活胆碱受体,引起亢进、惊厥、癫痫持续状态或产生焦虑以及影响学习记忆等认知活动[71-72]。也有研究表明镉在大脑皮层中和下丘脑中促进AChE的活性[70,72]。预处理橙皮素通过金属螯合自由基清除和抗氧化性能防止脂质过氧化,降低LPO水平,影响其他非酶抗氧化剂的性能;减轻氧化应激,解除对ATP酶和AChE的抑制,缓解神经毒性[71]。Abdalla等[72]发现槲皮素能够改善镉诱导的氧化应激,减轻DNA损伤,调整大脑皮层、海马体和下丘脑中Na+/K+-ATP酶和AChE的活性,调节记忆认知和焦虑样行为。另外,Abdalla等[70]也证明了槲皮素能阻止镉导致大鼠大脑皮层中NTPDase、ADA和核苷酸酶活性的升高,维持ATP和腺嘌呤核苷含量在一定的水平,保证神经系统正常。
2.5.2 心血管系统损伤的营养干预
镉可以对心血管内皮细胞造成氧化损伤,损伤DNA,促进细胞凋亡[73]。镉提高大鼠心肌GST活性(机体主动清除过氧化物或者有毒带电体),使得GR显著降低,但是镉增加GPx的活性,这3 种酶最终导致GSH水平的降低。镉与铜锌的拮抗影响呼吸链,如抑制NADH-细胞色素c还原酶、细胞色素c氧化酶,诱导超氧阴离子形成,导致SOD构象变化、活性减少,然而镉会增加CAT的活性(机体自身保护),超氧阴离子自由基积累。另外,镉能抑制丙酮酸脱氢酶,与三羧酸循环有关的酶(如琥珀酸脱氢酶)以及和呼吸链有关的酶的活性[74]。
Mitra等[74]研究表明,咖喱叶水提取物(黄酮醇)可以通过其直接以及间接的抗氧化活性保护镉诱导大鼠心脏的组织的氧化应激。提取物能够减少产生的自由基的累积量,改善脂质过氧化,降低蛋白质羰基含量。预处理提取物能够防止谷胱甘肽代谢酶GST、GR和GPx活性变化,调节GSH的合成,从而提供抗氧化防御对抗镉损伤,降低血清AST和LDH1的活力,保护与线粒体三羧酸循环和呼吸链有关的酶。提取物的保护机制可能是在组织或血液中螯合镉,也可能是抑制或清除ROS,或者是上调抗氧化酶的表达减少氧化剂的水平,具体的干预机制有待进一步研究。
2.5.3 免疫系统损伤的营养干预
镉诱导淋巴细胞DNA断裂,通过上调p53、caspase-3和Fas的基因诱导人淋巴细胞凋亡。Alshatwi等[75]用儿茶素水合物干预镉在淋巴细胞的细胞毒性作用,研究发现10 μmol/L和20 μmol/L的镉分别引发31.8%和44.4%的淋巴细胞凋亡,镉和儿茶素水合物(10 μmol/L镉和10 μmol/L儿茶素水合物、20 μmol/L镉和20 μmol/L儿茶素水合物)共同处理细胞可减少淋巴细胞的凋亡(相应减少至7.3%和10.5%)。儿茶素水合物通过减少DNA断裂和抑制镉诱导的凋亡相关基因的表达从而发挥抗基因毒性和免疫毒性的保护作用。
3 结 语
黄酮类化合物作为功能食品的活性成分广泛存在于我们的日常生活中,诸多针对镉致机体损伤进行营养干预的研究进一步证明了黄酮类化合物生物活性的多样性。因为镉在不同生物模型中损伤机制具有多样性,所以黄酮类化合物的预防或干预效果也不能一概而论。有报道指出黄烷醇类儿茶素能够吸收重金属解除中毒等疾病,但是吸收机制不明[76]。诸多研究表明黄酮类化合物对镉致机体毒性的干预作用呈剂量依赖性,但也有研究指出,一些黄酮类化合物在高剂量的时候会表现出毒性,对人体造成伤害。黄酮类化合物对正常肝细胞的凋亡起到抑制作用,但是对肿瘤细胞却表现出促进作用[21]。所以黄酮类化合物诸多干预机制的具体过程以及在不同的镉毒性模型中是否具有协同作用有待进一步研究。鉴于黄酮类化合物具有多种生理活性,黄酮类化合物的提取分离及应用研究获得前所未有的发展,这些活性成分的功效研究也将获得极大重视。目前,在黄酮类化合物对镉致生殖系统、神经系统、心血管系统以及内分泌系统等领域的干预及其机制的研究需要深入探索。在某种程度上,黄酮的化学结构将影响其各种活性,黄酮类化合物与重金属的构效关系可能是未来的研究方向。富含黄酮类化合物的提取物的干预作用具体和其中哪些活性成分有关、其作用途径及作用机制的研究目前了解得尚不够深入,需进一步的研究。另外,关于黄酮类化合物干预镉损伤的流行病学调查和临床实验较少,可能成为未来研究的热点。
[1] 杨望, 赵先英, 张定林, 等. 镉的毒性及损伤机制研究进展[J]. 职业与健康, 2013, 29(8): 1001-1003.
[2] FOWLER B A. Monitoring of human populations for early markers of cadmium toxicity: a review[J]. Toxicology and Applied Pharmacology, 2009, 238(3): 294-300. DOI:10.1016/j.taap.2009.05.004.
[3] 李光先, 余日安. 镉毒性作用干预方法及其机制研究进展[J]. 中国职业医学, 2014(2): 222-226.
[4] JIA Y D, LIN J X, MI Y L, et al. Quercetin attenuates cadmiuminduced oxidative damage and apoptosis in granulosa cells from chicken ovarian follicles[J]. Reproductive Toxicology, 2011, 31(4):477-485. DOI:10.1016/j.reprotox.2010.12.057.
[5] ZHANG H, SUN J X, LI M W, et al. Research progress on heavy metals detoxification in human body[J]. Agricultural Science and Technology, 2015, 16(8): 1785-1790; 1809.
[6] D’ANDREA G. Quercetin: a flavonol with multifaceted therapeutic applications?[J]. Fitoterapia, 2015, 106: 256-271. DOI:10.1016/ j.f i tote.2015.09.018.
[7] IRANSHAHI M, REZAEE R, PARHIZ H, et al. Protective effects of flavonoids against microbes and toxins: the cases of hesperidin and hesperetin[J]. Life Sciences, 2015, 137: 125-132. DOI:10.1016/ j.lfs.2015.07.014.
[8] 孔令义. 天然药物化学[M]. 北京: 中国医药科技出版社, 2015: 266-268.
[9] 朱善良, 陈龙. 镉毒性损伤及其机制的研究进展[J]. 生物学教学, 2006, 31(8): 2-5.
[10] MANDEL S, AMIT T, REZNICHENKO L, et al. Green tea catechins as brain-permeable, natural iron chelators-antioxidants for the treatment of neurodegenerative disorders[J]. Molecular Nutrition and Food Research, 2006, 50(2): 229-234. DOI:10.1002/mnfr.200500156.
[11] 王静. 花青素对镉诱导肝脏损伤的保护作用及机制研究[D]. 西安:陕西科技大学, 2013: 24-51.
[12] DUA T K, DEWANJEE S, KHANRA R, et al. The effects of two common edible herbs, Ipomoea aquatica and Enhydra fluctuans, on cadmium-induced pathophysiology: a focus on oxidative defence and anti-apoptotic mechanism[J]. Journal of Translational Medicine, 2015, 13(1): 1-19. DOI:10.1186/s12967-015-0598-6.
[13] SMALINSKIENE A, LESAUSKAITE V, ZITKEVICIUS V, et al. Estimation of the combined effect of eleutherococcus senticosus extract and cadmium on liver cells[J]. Annals of the New York Academy of Sciences, 2009, 1171(1): 314-320. DOI:10.1111/j.1749-6632.2009.04678.x.
[14] GHOSH J, DAS J, MANNA P, et al. Protective effect of the fruits of Terminalia arjuna against cadmium-induced oxidant stress and hepatic cell injury via MAPK activation and mitochondria dependent pathway[J]. Food Chemistry, 2010, 123(4): 1062-1075. DOI:10.1016/ j.foodchem.2010.05.062.
[15] FERRAMOLA M L, DIAZ M F F P, HONOR S M, et al. Cadmiuminduced oxidative stress and histological damage in the myocardium. effects of a soy-based diet[J]. Toxicology and Applied Pharmacology, 2012, 265(3): 380-389. DOI:10.1016/j.taap.2012.09.009.
[16] DEWANJEE S, GANGOPADHYAY M, SAHU R, et al. Cadmium induced pathophysiology: prophylactic role of edible jute (Corchorus olitorius) leaves with special emphasis on oxidative stress and mitochondrial involvement[J]. Food and Chemical Toxicology, 2013, 60(10): 188-198. DOI:10.1016/j.fct.2013.07.043.
[17] VICENTE-SANCHEZ C, EDIGO J, SANCHEZ-GONZALEZ P D, et al. Effect of the flavonoid quercetin on cadmium-induced hepatotoxicity[J]. Food and Chemical Toxicology, 2008, 46(6):2279-2287. DOI:10.1016/j.fct.2008.03.009.
[18] 梁弟. 镉对机体毒性作用机制国内研究进展[J]. 职业与健康, 2002, 18(1): 9-10.
[19] LI R J, YUAN C, DONG C, et al. In vivo antioxidative effect of isoquercitrin on cadmium-induced oxidative damage to mouse liver and kidney[J]. Naunyn-Schmiedeberg’s Archives of Pharmacology, 2011, 383(5): 437-445. DOI:10.1007/s00210-011-0613-2.
[20] PRABU S M, SHAGIRTHA K, RENUGADEVI J. Quercetin in combination with vitamins (C and E) improve oxidative stress and hepatic injury in cadmium intoxicated rats[J]. Biomedicine & Preventive Nutrition, 2011, 1(1): 1-7. DOI:10.1016/ j.bionut.2010.12.003.
[21] 梁爽. 黄酮类化合物保肝作用机理的研究进展[J]. 中山大学研究生学刊(自然科学与医学版), 2009(4): 21-27.
[22] HWANG J Y, LIN J T, LIU S C, et al. Protective role of litchi (Litchi chinensis Sonn.) flower extract against cadmium- and lead-induced cytotoxicity and transforming growth factor beta 1-stimulated expression of smooth muscle alpha-actin estimated with rat liver cell lines[J]. Journal of Functional Foods, 2013, 5(2): 698-705. DOI:10.1016/j.jff.2013.01.013.
[23] ARAFA M H, MOHAMMAD N S, ATTEIA H H. Fenugreek seed powder mitigates cadmium-induced testicular damage and hepatotoxicity in male rats[J]. Experimental and Toxicologic Pathology, 2014, 66(7): 293-300. DOI:10.1016/j.etp.2014.04.001.
[24] El-NEWESHY M S, El-MADDAWY Z K, El-SAYED Y S. Therapeutic effects of date palm (Phoenix dactylifera L.) pollen extract on cadmium-induced testicular toxicity[J]. Andrologia, 2013, 45(6):369-378. DOI:10.1111/and.12025.
[25] SINGH J P, SELVENDIRAN K, BANU S M, et al. Protective role of apigenin on the status of lipid peroxidation and antioxidant defense against hepatocarcinogenesis in Wistar albino rats[J]. Phytomedicine, 2004, 11(4): 309-314. DOI:10.1078/0944711041495254.
[26] HU Y, MA Y, WU S, et al. Protective effect of cyanidin-3-O-glucoside against ultraviolet B radiation-induced cell damage in human HaCaT keratinocytes[J]. Frontiers in Pharmacology, 2016, 7: 301. DOI:10.3389/fphar.2016.00301.
[27] RENUGADEVI J, PRABU S M. Naringenin protects against cadmium-induced oxidative renal dysfunction in rats[J]. Toxicology, 2009, 256(1): 128-134. DOI:10.1016/j.tox.2008.11.012.
[28] GONG P, CHEN F X, WANG L, et al. Protective effects of blueberries (Vaccinium corymbosum L.) extract against cadmiuminduced hepatotoxicity in mice[J]. Environmental Toxicology and Pharmacology, 2014, 37(3): 1015-1027. DOI:10.1016/ j.etap.2014.03.017.
[29] de PASCUAL-TERESA S. Molecular mechanisms involved in the cardiovascular and neuroprotective effects of anthocyanins[J]. Archives of Biochemistry and Biophysics, 2014, 559: 68-74. DOI:10.1016/ j.abb.2014.04.012.
[30] SHI L, LIU Y E, TAN D H, et al. Blueberry anthocyanins ameliorate cyclophosphamide-induced liver damage in rats by reducing inf l ammation and apoptosis[J]. Journal of Functional Foods, 2014, 11:71-81. DOI:10.1016/j.jff.2014.07.008.
[31] OPREA E, RUTA L L, NICOLAU I, et al. Vaccinium corymbosum L. (blueberry) extracts exhibit protective action against cadmium toxicity in Saccharomyces cerevisiae cells[J]. Food Chemistry, 2014, 152: 516-521. DOI:10.1016/j.foodchem.2013.12.020.
[32] BIAGIOLI M, PIFFERI S, RAGGHIANTI M, et al. Endoplasmic reticulum stress and alteration in calcium homeostasis are involved in cadmium-induced apoptosis[J]. Cell Calcium, 2008, 43(2): 184-195. DOI:10.1016/j.ceca.2007.05.003.
[33] DJURIC A, BEGIC A, GOBELJIC B, et al. Oxidative stress, bioelements and androgen status in testes of rats subacutely exposed to cadmium[J]. Food and Chemical Toxicology, 2015, 86: 25-33. DOI:10.1016/j.fct.2015.09.004.
[34] FAROMBI E O, ADEDARA I A, AKINRINDE S A, et al. Protective effects of kolaviron and quercetin on cadmium-induced testicular damage and endocrine pathology in rats[J]. Andrologia, 2012, 44(4):273-284. DOI:10.1111/j.1439-0272.2012.01279.x.
[35] 汪纪仓, 朱华丽, 肖桥, 等. 黄芩素对镉致大鼠肝脏损伤的保护作用研究[J]. 黑龙江畜牧兽医, 2014(23): 159-160.
[36] 曹锋. 镉对DNA代谢的影响和大豆异黄酮的保护作用[D]. 上海: 复旦大学, 2006: 69-74.
[37] OKOKO T, ERE D. Hibiscus sabdariffa extractivities on cadmiummediated alterations of human U937 cell viability and activation[J]. Asian Pacific Journal of Tropical Medicine, 2012, 5(1): 33-36. DOI:10.1016/S1995-7645(11)60241-1.
[38] CHEN L, ZHOU J, GAO W, et al. Action of NO and TNF-alpha release of rats with cadmium loading in malfunctiion of multiple system organ[J]. Acta Physiologica Sinica, 2003, 55(5): 535-540.
[39] CHESHCHEVIK V T, LAPSHINA E A, DREMZA I K, et al. Rat liver mitochondrial damage under acute or chronic carbon tetrachlorideinduced intoxication: protection by melatonin and cranberry flavonoids[J]. Toxicology and Applied Pharmacology, 2012, 261(3):271-279. DOI:10.1016/j.taap.2012.04.007.
[40] 卢春凤, 陈廷玉, 王淑秋, 等. 槲皮素抑制离体大鼠肝星状细胞增殖[J].中国病理生理杂志, 2005, 21(6): 1154.
[41] STETINA R, VARVAROVSKA J, RUSAVY Z, et al. Oxidative stress, DNA damage and DNA repair capacity in children with type 1 diabetes mellitus[J]. Toxicology Letters, 2006, 164: S134. DOI:10.1016/ j.toxlet.2006.06.281.
[42] 张晓华, 肖雄斌. 镉毒性作用机制及临床防治进展[J]. 实用预防医学, 2012, 19(11): 1761-1762.
[43] DKHIL M A, AL-QURAISHY S, DIAB M M, et al. The potential protective role of Physalis peruviana L. fruit in cadmium-induced hepatotoxicity and nephrotoxicity[J]. Food and Chemical Toxicology, 2014, 74: 98-106. DOI:10.1016/j.fct.2014.09.013.
[44] SHAGIRTHA K, PARI L. Hesperetin, a citrus flavonone, attenuates cadmium-induced nephrotoxicity in rat[J]. Biomedicine and Preventive Nutrition, 2011, 1(2): 139-145. DOI:10.1016/j.bionut.2011.02.005.
[45] RENUGADEVI J, PRABU S M. Quercetin protects against oxidative stress-related renal dysfunction by cadmium in rats[J]. Experimental and Toxicologic Pathology, 2010, 62(5): 471-481. DOI:10.1016/ j.etp.2009.06.006.
[46] 周清萍. 镉致肾脏毒性机制及防治研究进展[J]. 宜春学院学报, 2013, 35(12): 80-83.
[47] MORALES A I, VICENTE-SANCHEZ C, SANDOVAL J M S, et al. Protective effect of quercetin on experimental chronic cadmium nephrotoxicity in rats is based on its antioxidant properties[J]. Food and Chemical Toxicology, 2006, 44(12): 2092-2100. DOI:10.1016/ j.fct.2006.07.012.
[48] MORALES A I, VICENTE-SANCHEZ C, JERKIC M, et al. Effect of quercetin on metallothionein, nitric oxide synthases and cyclooxygenase-2 expression on experimental chronic cadmium nephrotoxicity in rats[J]. Toxicology and Applied Pharmacology, 2006, 210(1/2): 128-135. DOI:10.1016/j.taap.2005.09.006.
[49] WANG L, LIN S Q, HE Y L, et al. Protective effects of quercetin on cadmium-induced cytotoxicity in primary cultures of rat proximal tubular cells[J]. Biomedical and Environmental Sciences, 2013, 26(4):258-267. DOI:10.3967/0895-3988.2013.04.004.
[50] 张兆洲, 戴恩来. 槲皮素在慢性肾脏病防治中的研究进展[J]. 中国民族民间医药, 2015(11): 17-18.
[51] KANDASAMY N, ASHOKKUMAR N. Myricetin, a natural fl avonoid, normalizes hyperglycemia in streptozotocin-cadmium-induced experimental diabetic nephrotoxic rats[J]. Biomedicine and Preventive Nutrition, 2012, 2(4): 246-251. DOI:10.1016/j.bionut.2012.04.003.
[52] KANDASAMY N, ASHOKKUMAR N. Protective effect of bioflavonoid myricetin enhances carbohydrate metabolic enzymes and insulin signaling molecules in streptozotocin-cadmium induced diabetic nephrotoxic rats[J]. Toxicology and Applied Pharmacology, 2014, 279(2): 173-185. DOI:10.1016/j.taap.2014.05.014.
[53] 布同良. 槲皮素缓解镉和硝基酚诱导的生精细胞毒性作用的研究[D].杭州: 浙江大学, 2011: 1-58.
[54] ADARAMOYE O, AKANNI O. Protective effects of Artocarpus altilis (Moraceae) on cadmium-induced changes in sperm characteristics and testicular oxidative damage in rats[J]. Andrologia, 2015, 48(2): 152-163. DOI:10.1111/and.12426.
[55] 刘舒瑜. 芹菜素对雄性小鼠生殖系统影响的研究[D]. 兰州: 兰州大学, 2010: 6-44.
[56] 阎平, 李煌元, 张文昌, 等. 镉对雌性大鼠血清FSH、LH水平的影响[J].职业与健康, 2002, 18(6): 35-36.
[57] SADIK N A H. Effects of diallyl sulfide and zinc on testicular steroidogenesis in cadmium-treated male rats[J]. Journal of Biochemical and Molecular Toxicology, 2008, 22(5): 345-353. DOI:10.1002/jbt.20247.
[58] LAFUENTE A, MARQUEZ N, PEREZ-LORENZO M, et al. Pubertal and postpubertal cadmium exposure differentially affects the hypothalamic-pituitary-testicular axis function in the rat[J]. Food and Chemical Toxicology, 2000, 38(10): 913-923. DOI:10.1016/S0278-6915(00)00077-6.
[59] MINUTOLI L, MICALI A, PISANI A, et al. Research article flavocoxid protects against cadmium-induced disruption of the blood-testis barrier and improves testicular damage and germ cell impairment in mice[J]. Toxicological Sciences, 2015, 148(1): 311-329. DOI:10.1093/toxsci/kfv185.
[60] MANIGANDAN K, JAYARAJ R L, JAGATHEESH K, et al. Taxifolin mitigates oxidative DNA damage in vitro and protects zebrafish (Danio rerio) embryos against cadmium toxicity[J]. Environmental Toxicology and Pharmacology, 2015, 39(3): 1252-1261. DOI:10.1016/ j.etap.2015.04.021.
[61] BAI W B, SUN J X, XU W, et al. Cyanidin-3-O-glucoside protects against 1,3-dichloro-2-propanol-induced reduction of progesterone by up-regulation of steroidogenic enzymes and cAMP level in Leydig cells[J]. Frontiers in Pharmacology, 2016, 7: 399. DOI:10.33 89/ fphar.2016.00399.
[62] BHARTI S, MISRO M M, RAI U. Quercetin supplementation restores testicular function and augments germ cell survival in the estrogenized rats[J]. Molecular and Cellular Endocrinology, 2014, 383(1/2): 10-20. DOI:10.1016/j.mce.2013.11.021.
[63] BU T L, MI Y L, ZENG W D, et al. Protective effect of quercetin on cadmium-induced oxidative toxicity on germ cells in male mice[J]. The Anatomical Record, 2011, 294(3): 520-526. DOI:10.1002/ ar.21317.
[64] BRZÓSKA M M, ROGALSKA J, GALAZYN-SIDORCZUK M, et al. Protective effect of Aronia melanocarpa polyphenols against cadmium-induced disorders in bone metabolism: a study in a rat model of lifetime human exposure to this heavy metal[J]. Chemico-Biological Interactions, 2015, 229: 132-146. DOI:10.1016/j.cbi.2015.01.031.
[65] 陈晓. 镉致骨毒效应及预后[D]. 上海: 复旦大学, 2010: 10-97.
[66] 王怡. 镉对大鼠成骨细胞的毒性机理及NAC的保护效应[D]. 扬州:扬州大学, 2014: 17-138.
[67] 马蓓蕾, 蔡美琴. 微量元素与骨质疏松防治的研究进展[J]. 中华临床营养杂志, 2005, 13(5): 318-324.
[68] PAIK M K, LEE H O, CHUNG H S, et al. Genistein may prevent cadmium-induced bone loss in ovariectomized rats[J]. Journal of Medicinal Food, 2003, 6(4): 337-343. DOI:10.1089/109662003772519895.
[69] OM A S, SHIM J Y. Effect of daidzein in rats on cadmium excretion[J]. Bulletin of Environmental Contamination and Toxicology, 2007, 78(6):485-488. DOI:10.1007/s00128-007-9098-6.
[70] ABDALLA F H, CARDOSO A M, PEREIRA L B, et al. Neuroprotective effect of quercetin in ectoenzymes and acetylcholinesterase activities in cerebral cortex synaptosomes of cadmium-exposed rats[J]. Molecular and Cellular Biochemistry, 2013, 381(1/2): 1-8. DOI:10.1007/s11010-013-1659-x.
[71] KHAN M H, PARVEZ S. Hesperidin ameliorates heavy metal induced toxicity mediated by oxidative stress in brain of Wistar rats[J]. Journal of Trace Elements in Medicine and Biology, 2015, 31: 53-60. DOI:10.1016/j.jtemb.2015.03.002.
[72] ABDALLA F H, SCHMATZ R, CARDOSO A M, et al. Quercetin protects the impairment of memory and anxiogenic-like behavior in rats exposed to cadmium: possible involvement of the acetylcholinesterase and Na+, K+-ATPase activities[J]. Physiology and Behavior, 2014, 135: 152-167. DOI:10.1016/j.physbeh.2014.06.008.
[73] RONCO A M, MONTENEGRO M, CASTILLO P, et al. Maternal exposure to cadmium during gestation perturbs the vascular system of the adult rat offspring[J]. Toxicology and Applied Pharmacology, 2011, 251(2): 137-145. DOI:10.1016/j.taap.2011.01.001.
[74] MITRA E, GHOSH A K, GHOSH D, et al. Protective effect of aqueous Curry leaf (Murraya koenigii) extract against cadmium-induced oxidative stress in rat heart[J]. Food and Chemical Toxicology, 2012, 50(5): 1340-1353. DOI:10.1016/j.fct.2012.01.048.
[75] ALSHATWI A A, HASAN T N, ALQAHTANI A M, et al. Delineating the anti-cytotoxic and anti-genotoxic potentials of catechin hydrate against cadmium toxicity in human peripheral blood lymphocytes[J]. Environmental Toxicology and Pharmacology, 2014, 38(2): 653-662. DOI:10.1016/j.etap.2014.07.013.
[76] 孙世利, 杨军国, 张岚翠, 等. 儿茶素与金属离子相互作用及其生物学意义[J]. 中国细胞生物学学报, 2007, 29(2): 225-228.
Progress in Understanding the Molecular Mechanism of Nutrition Intervention of Flavonoids on Cadmium Toxicity
BAI Weibin1, LI Xia1, ZHU Cuijuan1, HU Yunfeng1, JIAO Rui1, JIANG Xinwei1, SUN Jianxia2,*
(1. Department of Food Science and Engineering, Jinan University, Guangzhou 510632, China; 2. Faculty of Chemical Engineering and Light Industry, Guangdong University of Technology, Guangzhou 510090, China)
Cadmium causes damage to a wide range of organs and biological systems such as liver, kidney, bone, immune system and reproductive system. Flavonoids are polyphenolic compounds widely present in many plants, which have been shown to prevent or mitigate cadmium-induced damage in the body. This review focuses on recent advances in understanding the protective effects and molecular mechanisms of fl avonoids against cadmium toxicity. We hope that this review will provide useful references for the prevention of cadmium toxicity and the mechanistic exploration of nutrition intervention strategies.
cadmium; fl avonoids; damage; nutrition intervention
10.7506/spkx1002-6630-201703040
TS201.4
A
1002-6630(2017)03-0245-09
白卫滨, 李夏, 朱翠娟, 等. 黄酮类化合物对镉毒性营养干预分子机制的研究进展[J]. 食品科学, 2017, 38(3): 245-253.
DOI:10.7506/spkx1002-6630-201703040. http://www.spkx.net.cn
BAI Weibin, LI Xia, ZHU Cuijuan, et al. Progress in understanding the molecular mechanism of nutrition intervention of
fl avonoids on cadmium toxicity[J]. Food Science, 2017, 38(3): 245-253. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201703040. http://www.spkx.net.cn
2016-03-14
国家自然科学基金面上项目(31471588);国家自然科学基金青年科学基金项目(31201340);教育部新世纪优秀人才支持计划项目;广东省高等学校优秀青年教师培养计划项目(Yq2013024)
白卫滨(1978—),男,研究员,博士,研究方向为食品营养。E-mail:baiweibin@163.com
*通信作者:孙建霞(1978—),女,副教授,博士,研究方向为果蔬营养。E-mail:jxsun1220@163.com

