ω—3多不饱和脂肪酸对结肠癌根治术后化疗患者营养及生活质量的影响
程涛 朱锡元 滕向龙 郭景泉 邹武军 卢吉英


[摘要] 目的 探讨ω-3多不饱和脂肪酸对结肠癌根治术后化疗患者营养及生活质量的影响。 方法 收集2014年6月~2016年1月在我院行结肠癌根治术需要化疗患者。所有患者采用国产奥沙利铂(L-OHL)联合亚叶酸钙(CF)及氟脲嘧啶(5-Fu)组成的mFOLFOX6方案化疗,每14天重复1次,连用12个周期。实验组:化疗期间予中/长链脂肪乳1.0 g/(kg·d) 的基础上加用10%鱼油脂肪乳剂100 mL营养支持×2 d。对照组:化疗期间单纯给予中/长链脂肪乳剂 1.2 g/(kg·d)营养支持×2 d。比较两组的临床疗效,以及两组患者治疗前后TP、ALB、TF水平、生活质量评分的变化情况。 结果 观察组的总有效率为53.3%,显著高于对照组的33.3%,差异有统计学意义(P<0.05), 治疗后观察组患者的TP、ALB、TF水平均较对照组改变更显著。观察组患者治疗后生活质量的躯体功能、角色功能、情绪功能、认知功能、社会功能评分分别显著高于对照组(P<0.05)。观察组患者治疗后生活质量的疲倦、恶心呕吐、疼痛评分分别显著低于对照组(P<0.05)。 结论 ω-3多不饱和脂肪酸用于结肠癌根治术后化疗疗效确切,能明显改善患者的营养水平及生活质量,有较高的临床推广价值和意义。
[关键词] 结肠癌根治术;化疗;ω-3多不饱和脂肪酸;营养;生活质量
[中图分类号] R735.35 [文献标识码] A [文章编号] 1673-9701(2016)31-0025-04
结肠癌行根治切除术后仍需辅助化疗,以改善患者的预后及生活质量[1]。但是肿瘤可引起机体代谢紊乱、免疫力下降,进而影响化疗耐受和效率[2,3],因此,寻找一种新型的治疗方案对改善患者的免疫营养状态、降低术后并发症的发生率和病死率,提高患者的生活质量具有重要意义[4]。ω-3多不饱和脂肪酸(ω-3PUFAs)是近年来临床广泛应用的一种免疫增强素,流行病学调查发现,ω-3PUFA对前列腺癌、乳腺癌、结肠癌等均具有抑制作用[5,6]。目前临床仍缺乏ω-3鱼油脂肪乳对结肠癌根治术患者术后化疗营养免疫状态的前瞻性随机对照研究,尤其化疗过程中ω-3鱼油脂肪乳对总蛋白、白蛋白等营养指标及生活质量的影响,并了解ω-3鱼油脂肪乳的治疗效果和安全性。本研究拟通过营养指标及生活质量评分,了解应用ω-3 鱼油脂肪乳治疗可改善结肠癌根治术化疗后营养状态,以减少并发症及改善患者的生活质量,现报道如下。
1資料与方法
1.1一般资料
收集2014年6月~2016年1月在我院行结肠癌根治术需要化疗患者60例。所有患者均经病理检查证实,且无代谢性和免疫性疾病;肝肾功能正常;未行脾切除。剔除标准:①对蛋白质过敏的患者;②出凝血时间异常者;③存在肿瘤远处器官转移的患者。全部患者分为两组,每组各30例,其中对照组患者中男19例,女11例,年龄42~78岁,平均(53.24±8.12)岁,观察组患者中男18例,女12例,年龄41~76岁,平均(52.63±6.23)岁,两组患者在年龄、性别等临床资料方面经统计学处理及分析比较,差异无统计学意义(P>0.05),具有可比性。
1.2 治疗方法
所有患者均采用国产奥沙利铂(L-OHL)联合亚叶酸钙(CF)及氟脲嘧啶(5-Fu)组成的mFOLFOX6方案化疗,每14天重复1次,14 d为1个周期,连用12个周期。观察组:化疗期间予中/长链脂肪乳1.0 g/(kg·d)的基础上加用10%鱼油脂肪乳剂100 mL×2 d。对照组:化疗期间单纯给予中/长链脂肪乳剂 1.2 g/(kg·d)×2 d。
1.3 评价指标
①疗效评价标准[7]:依据肿瘤消失或缩小的程度来评定:完全缓解(CR):全部肿瘤消失,至少维持4周;部分缓解(PR):肿瘤病灶的最大径及其最大垂直径的乘积减少50%以上并维持4周以上;好转:肿瘤病灶的两径乘积缩小50%以上,但<50%无新病灶出现;稳定(SD):肿瘤病灶的两径乘积缩小25%,或增大<25%,无新病灶出现;病变进展(PD):肿瘤病灶的两径乘积增大>25%,或出现新病灶。总有效率=CR+PR。②检测两组患者每次化疗前后营养指标总蛋白(TP)、白蛋白(ALB)、转铁蛋白(TF)的变化情况。采用我院生化科全自动生化分析仪检测。③比较两组患者化疗前后生活质量情况,参照生活质量核心量表(EORTCQ LQ-C30)V 3.0[5]标准,分为功能领域和症状领域两方面。功能领域包括躯体、角色、情绪、认知和社会功能,症状领域包括:疲劳、疼痛、恶心与呕吐。功能领域得分越高,说明功能状况和生活质量越好;症状领域得分越高,表明生活质量越差[8]。
1.4 统计学方法
采用SPSS16.0软件进行统计分析,计数资料采用χ2检验;计量资料以均数±标准差(x±s)表示,组间比较采用t检验;P<0.05表示差异有统计学意义。
2 结果
2.1 两组临床疗效比较
观察组的总有效率为53.3%,显著高于对照组的33.3%,差异有统计学意义(χ2=6.236,P<0.05)。见表1。
2.2 两组患者治疗前后各项营养指标比较
治疗后观察组患者的TP、ALB、TF水平均较对照组改变更显著,差异有统计学意义(P<0.05)。见表2。
2.3 两组患者治疗前后生活质量评分比较
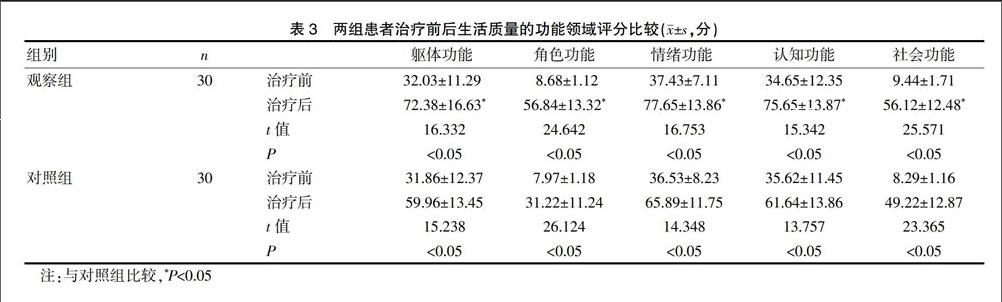
2.3.1 两组患者治疗前后生活质量的功能领域评分比较 观察组与对照组患者治疗后的生活质量功能领域评分包括躯体功能、角色功能、情绪功能、认知功能、社会功能方面的评分分别较治疗前显著升高,且观察组患者的躯体功能、角色功能、情绪功能、认知功能、社会功能评分分别显著高于对照组,差异有统计学意义(P<0.05),见表3。
2.3.2 两组患者治疗前后生活质量的症状领域评分比较 观察组与对照组患者治疗后的生活质量症状领域评分包括疲倦、恶心呕吐、疼痛评分分别较治疗前显著降低,且观察组患者的疲倦、恶心呕吐、疼痛评分分别显著低于对照组(P<0.05)。见表4。
3讨论
结肠癌是常见的消化道恶性肿瘤之一,由于其造成机体恶病质,患者营养状况下降,常伴有营养不足或营养风险,加之大范围的根治性切除治疗以及术后化疗,进一步加重患者的病情进展,甚至使化疗风险增高,导致患者多数存在不同程度的营养不良,甚至发生感染等并发症[9,10]。而营养状态的好坏则影响患者的预后和生存质量。营养不良常导致住院患者死亡率和并发症发生率提高,并导致住院时间延长、生存质量下降进而降低生存期,因此,给予患者营养支持,才能减少并发症的发生、改善患者的预后及提高患者的生活质量[11,12]。
近年来,免疫增强营养素在临床广泛应用,并取得了較好的临床效果。免疫增强营养素包括精氨酸、ω-3多不饱和脂肪酸、谷氨酰胺等混合制剂。许多实验研究发现,服用鱼油(ω-3 多不饱和脂肪酸)可减少结肠癌的风险,长期摄入高水平ω-3 多不饱和脂肪酸,其发生乳腺癌、结肠癌等恶性肿瘤的危险性明显低于普通人群[13,14]。此外,ω-3 多不饱和脂肪酸还可以改善肿瘤恶病质患者的体质,提高肿瘤患者的存活率[15-18]。刘流等[5]将收治的40 例胃肠道恶性肿瘤患者随机分为对照组和实验组各20 例。术后两组患者均连续行7 d肠外营养支持治疗,实验组每天加用ω-3 多不饱和脂肪酸,结果证实ω-3多不饱和脂肪酸能够有效改善胃肠道恶性肿瘤患者的营养状态,有利于促进机体康复。本研究在结直肠恶性肿瘤患者化疗过程中加用ω-3 鱼油脂肪乳,旨在探讨结肠癌患者术后营养状况及生活质量情况,结果显示,观察组的总有效率为53.3%,显著高于对照组的33.3%,差异有统计学意义(P<0.05),治疗后观察组患者的TP、ALB、TF水平均较对照组改变更显著,与高炜等[19]报道的观点是一致的,说明ω-3多不饱和脂肪酸能改善结肠癌患者的营养状态。同时本研究对两组患者的生活质量评分在功能领域与症状领域评分进行比较分析,结果显示,观察组患者的躯体功能、角色功能、情绪功能、认知功能、社会功能评分分别显著高于对照组。观察组患者治疗后的疲倦、恶心呕吐、疼痛评分分别显著低于对照组(P<0.05),证实ω-3多不饱和脂肪酸用于结肠癌根治术后化疗还可以显著提高患者的生活质量。
综上所述,ω-3多不饱和脂肪酸用于结肠癌根治术后化疗疗效确切,能明显改善患者的营养水平及生活质量,有较高的临床推广价值和意义。
[参考文献]
[1] Bathen TF,Holmgren K,Lundemo AG. Omega-3 fatty acids suppress growth of SW620 human colon cancer xenografts in nude mice[J]. Anticancer Res,2008,28(6A):3717-3723.
[2] Yu JH,Kang SG,Jung UY,et al. Effects of omega-3 fatty acids on apoptosis of human gastric epithelial cells exposed to silica-immobilized glucose oxidase[J]. Ann N Y Acad Sci,2009,1171:359-364.
[3] 陈丰. 黄芪注射液配合化疗对晚期结肠癌术后患者生活质量的影响[J]. 河北中医,2009,31(11):1698-1699.
[4] 程艳华,刘丽兰,朱国栋,等. ε-3 多不饱和脂肪酸减低胃肠道肿瘤患者化疗后胃肠道及全身炎症因子反应[J]. 广州医药,2016,7(2):66-67.
[5] 刘流,庄文,陈忠. ω-3 不饱和脂肪酸促进胃肠道恶性肿瘤患者术后康复的疗效研究[J]. 中国普外基础与临床杂志,2009 ,16(11):895-899.
[6] Shiu YC,Lin JK,Huang CJ,et al. Is C-reactive protein a prognostic factor of colorectal cancer?[J]. Diseases Colon Rectum,2008,51(4):443-449.
[7] Lin MT,Yeh SL,Yeh CL,et al. Parenteral ω-3 fatty acids modulate inflammatory and immune response in rats undergoing total gastrectomy[J]. Shock,2006,25(1):56-60.
[8] Cockbain AJ,Toogood GJ,Hull MA. Omega-3 polyunsaturated fatty acids for the treatment and prevention of colorectal cancer[J]. Gut,2012,61:135-149.
[9] CSCO肿瘤营养治疗专家委员会. 恶性肿瘤患者的营养治疗专家共识[J]. 临床肿瘤学杂志,2012,19(1):59-60.
[10] 杨志文,乌新林,施琳. ω-3 多不饱和脂肪酸在肿瘤治疗中的研究进展[J]. 内蒙古医学院学报,2012,34(6):991-992.
[11] Lim K,Han C,Dai Y,et al. Omega-3polyunsaturated fatty acids inhibit hepatocellular carcinoma cell growth through blocking β-catenin and cox-02[J]. Mol Cancer Ther,2009,8(11):3046-3055.
[12] Karsten H,Weylandt Lena F. Krause Beate Gomolka Suppressed liver tumorigenesis in fat-1mice with elevated omega-3fatty acids is associated with increased omega-3derived lipid mediators and reduced TNF-α[J]. J Carcinogenesis,2011,32(6):897-903.
[13] 孫兰恩,顾萍萍,余亚琼. 补中益气汤辅助治疗对结肠癌术后化疗患者生活质量的影响[J].新中医,2015,47(12):258-259.
[14] 李群珍,庄树彤,蔡燕娟,等. 多不饱和脂肪酸不同比值对结肠癌患者术后营养状况、炎症反应和预后的影响[J]. 肠外与肠内营养,2013,20(4):196-197.
[15] Felekis D. Effect of perioperative immuno-enhanced enteral nutrition on inflammatory response,nutritional status,and outcomes in head and neck cancer patients undergoing major surgery[J]. Nutr Cancer,2010,62(8):1105-1112.
[16] 王思平,谢杰,李红,等. 结肠癌患者血中多不饱和脂肪酸水平与其疾病的相关性分析[J]. 中国临床药理学杂志,2013,29(11):258-259.
[17] 韩东景,赵楠,薛永飞,等. 多不饱和脂肪酸和谷氨酰胺对具有营养风险的晚期肺癌化疗患者的影响[J]. 郑州大学学报(医学版),2013,48(4):536-537.
[18] 李伟学,邬善敏,曾涛. 胃癌根治术围手术期应用ω-3多不饱和脂肪酸的临床疗效研究[J]. 海南医学院学报,2016,22(8):803-805.
[19] 高炜,杨建伟,陈帆,等. ω-3 多不饱和脂肪酸对结肠癌患者的营养治疗作用[J]. 广东医学,2011,32(16):2097-2098.
(收稿日期:2016-07-17)

