大豆水酶法水解液中蛋白质超滤回收及特性研究
江连洲 张巧智 李 杨 王中江 齐宝坤 隋晓楠
(东北农业大学食品学院, 哈尔滨 150030)
大豆水酶法水解液中蛋白质超滤回收及特性研究
江连洲 张巧智 李 杨 王中江 齐宝坤 隋晓楠
(东北农业大学食品学院, 哈尔滨 150030)
采用超滤法回收水解液中的蛋白质,在单因素试验的基础上,通过Box-Behnken响应面法试验设计建立了操作压力、溶液质量分数、溶液pH值对膜通量影响的模型。研究结果表明,各因素对膜通量的影响由大到小依次为溶液质量分数、操作压力、溶液pH值。经优化得到的最佳工艺参数为:操作压力0.20 MPa、溶液质量分数5.60%、溶液pH值8.50。在此条件下超滤膜通量为7.02 L/(m2·h),回收物中蛋白质质量分数增至88.63%,红外光谱显示构成大豆蛋白的各官能团特征峰明显,高效液相色谱结果显示超滤对水解液中低聚糖类物质的脱除效果较好,所回收蛋白在功能特性上溶解性得到提升,且在酸性pH值范围内有明显改善,而乳化活性指数和乳化稳定性指数有所降低。超滤法回收水解液蛋白可实现同步浓缩与杂质分离,为水解液的增值利用提供了可行方法。
大豆蛋白; 超滤; 功能特性; 水酶法; 工艺优化
引言
水酶法是一种新兴的绿色提油技术,通过机械破碎和酶解手段,破坏细胞壁及油脂体膜,使油脂得以释放。该方法萃取条件温和,避免了传统提油工艺中有机试剂及高温处理的介入,所制油品质高、杂质含量低[1],具有十分广阔的应用前景。通过对原料预处理及乳状液破乳工艺的研究,大豆水酶法游离油得率已提升至92.6%[2-3]。但与此同时,水相提取体系伴随产生的副产物——水解液,由于含有大部分原料中的可溶性物质,作为废液会造成大量资源浪费,极大地限制水酶法提油技术的经济可行性。已有研究表明,大豆水酶法水解液的主要成分为限制性酶解蛋白[4-5],可作为大豆蛋白的丰富来源,但水解液中可溶性糖类、细小油滴、盐类等其他成分的存在会对产品的感官品质及功能特性产生不利影响。因此,提取回收水解液中的蛋白质、脱除非蛋白组分对大豆水酶法工艺的产业化推广具有重要意义。
传统的大豆分离蛋白提取方法主要利用其在等电点(pH值 4.5)附近溶解度较低的特性进行提取,但由于酶解处理后大豆蛋白在酸性pH值范围内溶解度提升,碱溶酸沉法仅能回收约30%水解液蛋白[6]。超滤技术作为一种膜分离方法,通过压力差的推动可选择性地将溶液中较大溶质分子截留于微孔滤膜之上,具有操作简捷、分离系数大、高效节能、无相变、无二次污染等特点[7],已广泛应用于蛋白质提取、分离纯化等领域。李旭等[8]利用不同截留分子量的超滤膜分离油茶籽蛋白并对各组分的功能特性进行了研究;YANG等[9]利用植酸酶酶解辅助超滤分离法大幅度降低了大豆分离蛋白中植酸及异黄酮的含量。CAMPBELL等[6]利用超滤回收水酶法蛋白但仅得到70%纯度的产品,且仍含有油脂、低聚糖等杂质成分。将超滤技术应用于水解液蛋白质的回收,可为开发利用水解液资源提供一种行之有效的方法,该领域国内尚无相关报道。在超滤操作过程中,工艺条件的选择是决定超滤效果及工艺成本的关键因素。因此,本文在探讨水解液蛋白超滤过程中影响膜通量及蛋白质截留率主要因素的基础上,通过响应面法试验设计确定最佳的超滤工艺条件,并进一步对所得水解液蛋白的功能特性进行研究,为大豆水酶法水解液蛋白超滤回收的工业化生产提供参考。
1 材料与方法
1.1 材料与仪器
全脂大豆片(东农42号,含水率10.54%,粗脂肪质量分数19.73%,粗蛋白质量分数38.48%,灰分质量分数4.21%),大豆分离蛋白(粗蛋白质量分数92.37%),聊城蓝山集团;Alcalase 2.4L碱性内切蛋白酶,杰能科(中国)生物工程有限公司;蔗糖、水苏糖、棉籽糖标准品,Sigma-Aldrich公司;乙腈、三氟乙胺均为色谱纯,石油醚、乙醚、SDS等均为分析纯。
T20型双螺杆挤压机,法国Clextral公司;PHS-25型数显台式酸度计,上海雷磁仪器厂;FD5型冷冻干燥机,美国西盟国际集团;RE-52CS-1型旋转蒸发仪,上海亚荣生化仪器厂;3-18K型高速冷冻离心机,Sigma-Aldrich公司;1、3、5 kDa平板聚醚砜超滤膜、MSC300型杯式超滤器,上海摩速科学器材有限公司;K-436型快速消解仪、K-370型自动凯氏定氮仪,瑞士步琦有限公司;高速剪切乳化机,上海昂尼仪器仪表有限公司;分光光度计,上海精密科学仪器有限公司;e2695型高效液相色谱仪(配有四元溶剂管理器、自动进样器、柱温箱、示差折光检测器),美国Waters公司;BEH Amide色谱柱(4.6 mm×150 mm,3.5 μm),美国Waters公司;IRTracer-100型傅里叶变换红外光谱仪,日本岛津公司。
1.2 试验方法
1.2.1 基本化学成分测定
含水率,依据GB/T 5497—1985 《粮食、油料检验 水分测定法》进行测定;粗脂肪质量分数,依据GB/T 14772—2008 《食品中粗脂肪的测定》进行测定;粗蛋白质量分数,依据GB 5009.5—2010《食品中蛋白质的测定》进行测定;灰分质量分数,依据GB/T 5009.4—2010《食品中灰分的测定》进行测定。
1.2.2 大豆水酶法水解液的制备
水解液作为大豆水酶法提油工艺的副产物,所采用的提取条件为LI等[2-3]优化的最佳提油工艺,其主要流程如下:全脂大豆片→粉碎→调节含水率为14.5%→挤压膨化(60℃、300 r/min)→粉碎过60目筛→调节固液比至6 mL/mg→调节温度为50℃、pH值为8.5→酶解3 h(加酶量1.85 mL/(100 g))→灭酶(100℃、10 min)→离心分离(8 000g、20 min)→收集水解液→冷冻干燥→水解液冻干粉。
1.2.3 水解液蛋白质的超滤回收及膜的选择
为避免水解液中的少量油滴污染超滤膜,提升所得蛋白的产品质量,预先将水解液冻干粉经正己烷浸提12 h以除去残余油脂,再用超纯水复溶。通过实验室级超滤装置对水解液中的蛋白质进行回收,如图1所示,考虑到水解液中杂质成分的种类,分别采用截留分子量为1、3、5 kDa的超滤膜进行蛋白回收,待系统稳定后准确记录一段时间内透过液的体积,当体积缩减至初始值1/4时分别收集透过液和截留液,冷冻干燥备用。膜通量及蛋白质截留率计算公式[7,9-10]分别为
(1)
式中R——膜通量,L/(m2·h)V——透过液体积,LT——超滤时间,hA——膜有效面积,m2
(2)
式中P——蛋白质截留率,%C——初始溶液的蛋白质量浓度,mg/mLC′——透过液的蛋白质量浓度,mg/mL

图1 超滤装置示意图Fig.1 Schematic diagram of ultrafiltration device1.氮气瓶 2.磁力搅拌器 3.超滤杯 4.搅拌杆 5.进料口 6.出料口
1.2.4 试验设计
(1)单因素试验
在超滤回收水解液蛋白的过程中,影响超滤效果的因素主要有操作压力、溶液质量分数及溶液pH值。首先进行单因素试验,以选取试验因素及水平。选取操作压力为0.10、0.14、0.16、0.18、0.20、0.22 MPa,溶液质量分数为2.5%、4.0%、5.5%、7.0%、8.5%、10.0%,溶液pH值为3.5、4.5、5.5、6.5、7.5、8.5、9.5。以膜通量和蛋白质截留率为评价指标确定最佳超滤工艺。
(2)响应面试验
在上述单因素试验基础上,采用Box-Behnken设计原理,以操作压力、溶液质量分数及溶液pH值为自变量,以膜通量为响应值,试验因素水平与编码见表1。
1.2.5 可溶性糖类测定
大豆水酶法水解液中除蛋白外还含有部分糖类物质,为分析水解液中可溶性糖类的组成及分布以及超滤操作对于糖类的脱除效果,采用HPLC-RID

表1 响应面试验因素水平Tab.1 Levels and variables of response surface method
方法进行测定[4,11]。分析前,为除去蛋白质,先将0.3 mL样品与0.7 mL乙腈混合,在10 000g下离心10 min。取10 μL上清液注入高效液相色谱仪,柱温为35℃。采用75%乙腈溶液(添加0.2%TEA)在0.6 mL/min的流速下进行等度洗脱。将样品峰的保留时间与标准品进行对照,并根据各糖标准品的外标曲线进行定量。
1.2.6 红外光谱测定
将水解液蛋白冻干粉与KBr以质量比1∶100混合后在玛瑙研钵中研磨均匀,并用压片机压成薄片,在500~4 000 cm-1范围内以4 cm-1的分辨率扫描32次,采集样品图谱数据,并在样品测试相同条件下采集背景[12-13]。
1.2.7 蛋白质功能特性测定
(1)蛋白质氮溶解指数
参照LIU等[14]的方法测定超滤回收蛋白在不同pH值下的氮溶解指数(Nitrogen soluble index,NSI),即利用微量凯氏定氮法测定离心后上清液中的氮含量占总氮含量的百分比,氮溶解指数计算公式为
(3)
式中N——氮溶解指数,%m——上清液中的氮质量,gm′——初始溶液中的氮质量,g
(2)蛋白质乳化性
参照GHRIBI等[15-16]的方法测定超滤回收蛋白的乳化活性指数(Emulsifying activity index,EAI)及乳化稳定性指数(Emulsifying stability index,ESI)并做若干修改:将质量浓度0.02 g/mL蛋白质样品溶液与大豆油以体积比例3∶1混合,置于高速均质机在20 000 r/min下均质1 min。立即用0.001 g/mL SDS溶液稀释1 000倍,记录此时及15 min后在500 nm处的吸光度,乳化活性指数和乳化稳定性指数计算公式为
(4)
(5)
式中EAI——乳化活性指数,m2/gESI——乳化稳定性指数,minA——乳液在0 min时在500 nm处吸光度A′——乳液在15 min时在500 nm处吸光度φ——油脂所占体积分数,%c——样品溶液中蛋白质质量浓度,g/mLD——稀释倍数,取1 000t——间隔时间,取15 min
2 结果与讨论
2.1 大豆水酶法水解液的主要化学组成
表2所示为大豆水酶法水解液的主要化学组成。由表2可知,水解液中主要含有70.46%蛋白质、11.48%脂肪、12.99%碳水化合物及5.07%灰分。若1 kg大豆经水酶法提取后产生4.6 kg水解液,以10%干物质计,则水解液中将包含大豆原料中约46%的固形物,其中包括84.23%蛋白质、26.77%油脂及22.10%糖类,若加以分离利用将能产生可观的经济效益。脱去油脂后,水解液中蛋白质质量分数提升至78.62%,超过市售大豆浓缩蛋白纯度(70%),可作为大豆蛋白的丰富来源,具有较高的潜在经济价值。水酶法水解液中除蛋白质外的主要非蛋白组分是可溶性碳水化合物,主要为蔗糖、水苏糖和棉籽糖。其中后两者属大豆低聚糖类,由于人体或动物缺乏α-半乳糖苷酶而易引起胀气、消化不良等症状[17-18],被认为是大豆蛋白产品中的主要抗营养因子之一。此外,由于水解液中干物质含量较低,常规浓缩方法将增加蛋白回收耗能[19],利用超滤操作回收蛋白可实现同步浓缩与杂质分离,为水解液的增值利用提供了可行办法。

表2 大豆水酶法水解液的化学成分组成(质量分数,以干基计)Tab.2 Chemical composition of skim from EAEP of soybeans %
2.2 膜截留分子量对超滤效果的影响
膜截留分子量(Molecular weight cut-offs,MWCO)对超滤效果及工艺成本具有重要影响,根据水解液中杂质成分的分子量特征,分别选择截留分子量为1、3、5 kDa的平板聚醚砜超滤膜对水解液中的蛋白进行回收,考察膜截留分子量对膜通量及蛋白质截留率的影响,结果如图2所示。

图2 膜截留分子量对超滤效果的影响Fig.2 Influence of membrane molecular weight cuts-off on ultrafiltration performance
由图2可知,随超滤膜截留分子量的降低,膜通量随之下降,且当MWCO为1 kDa时下降较为剧烈,其原因可能是1 kDa时,绝大部分蛋白质被截留、聚集并压实于超滤膜表面,出现了浓差极化现象进而形成凝胶层,部分堵塞超滤膜孔,使膜通量大幅下降[20-21]。另一方面,MWCO的降低使蛋白质截留率由91.38%升至97.32%,说明低MWCO超滤膜对水解液蛋白有较好的回收效果,且当MWCO为3 kDa时,膜通量及蛋白质截留率均较理想,考虑到超滤效率及操作成本,后续试验将选择3 kDa作为水解液蛋白回收所用膜的截留分子量。
2.3 超滤回收水解液蛋白的单因素试验分析
2.3.1 操作压力
在溶液质量分数为5.5%,pH值为8.5条件下,操作压力对膜通量及蛋白质截留率的影响如图3所示。
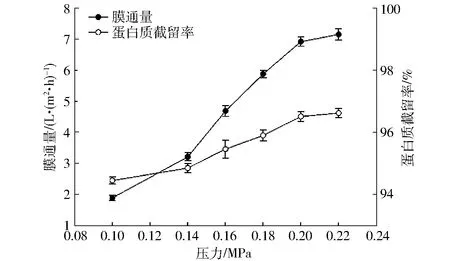
图3 操作压力对超滤效果的影响Fig.3 Influence of operational pressure on ultrafiltration performance
压力是影响超滤效果的重要因素,由图3可知,随操作压力的增大,膜通量呈上升趋势,这是由于跨膜压力的增加,使料液流速加快并呈现湍流状,此时浓差极化现象不显著,膜通量显著上升。但当压力超过一定范围时,浓差极化现象加剧并导致部分溶质聚集于膜表面形成凝胶层,使得膜通量增幅趋慢[22];操作压力对蛋白质截留率影响较小,跨膜压力由0.10 MPa增加至0.22 MPa可使蛋白质截留率提高2.17%,但压力过大易导致超滤膜孔堵塞及污染,增加后续不必要的能耗损失,因此在优化操作压力时选择0.20 MPa为中心点。
2.3.2 溶液质量分数
在操作压力为0.20 MPa、溶液pH值为8.5时,溶液质量分数对膜通量及蛋白质截留率的影响如图4所示。
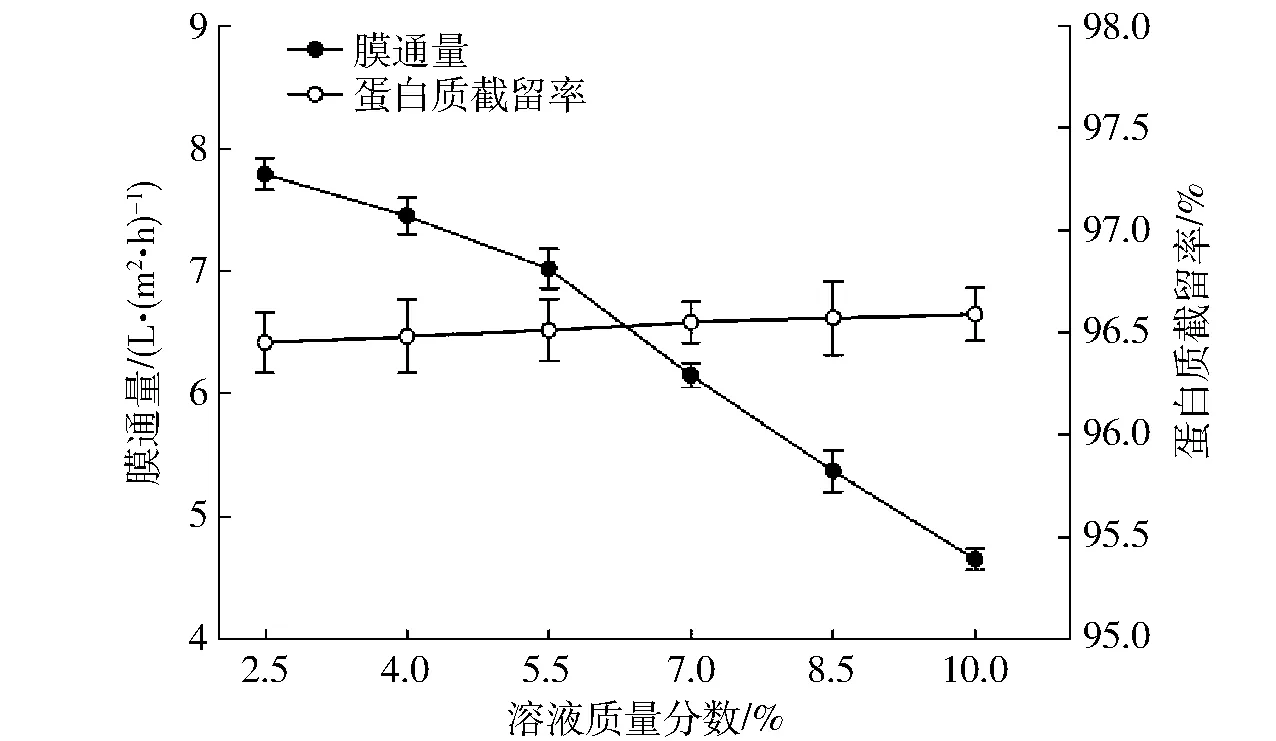
图4 溶液质量分数对超滤效果的影响Fig.4 Influence of solution concentration on ultrafiltration performance
由图4可知,膜通量随料液质量分数的增加而逐渐降低,且在大于5.5%时下降较为剧烈。产生这一现象的原因可能是料液体积分数增大使得溶液粘度增加,溶质分子间相互作用增强,扩散系数降低,更易在超滤膜表面形成浓差极化及凝胶层,增大透过阻力,使得膜通量逐渐下降[23],但料液质量分数过低时会导致超滤时间延长,增大工艺耗能,为后续膜清洗带来困难;随溶液质量分数的增加,蛋白质截留率稍有上升,其原因可能是蛋白质分子间较强的相互作用阻碍了小分子蛋白透过超滤膜,使透过液中蛋白质浓度降低,综合考虑膜通量与蛋白回收效果,在优化溶液质量分数时选择5.5%为中心点。
2.3.3 溶液pH值
在操作压力为0.20 MPa、溶液质量分数为5.5%时,溶液pH值对膜通量及蛋白质截留率的影响如图5所示。

图5 溶液pH值对超滤效果的影响Fig.5 Influence of solution pH value on ultrafiltration performance
由图5可知,当溶液pH值为4.5和5.5时,膜通量达到最低值,蛋白质截留率最高,此时接近水解液蛋白等电点,溶解度最小,蛋白质分子间静电斥力几乎为零,易析出并聚集于膜表面形成吸附层,增加透过阻力[24],该结论与黄群等[10]研究结果相一致。当pH值小于4.5或大于5.5时,膜通量随pH值偏离等电点程度的增加而上升,且在6.5~8.5范围内增幅显著,此时溶液中蛋白质与水分子亲和作用增强,分子间静电斥力可削弱膜表面的浓差极化现象,蛋白质截留率有小幅降低,当pH值大于8.5时,继续增加pH值对膜通量及蛋白质截留率影响不大,且pH值8.5接近水酶法酶解体系终点pH值,可避免额外加入碱类物质。因此,在优化溶液pH值时选择8.5为中心点。
2.4 超滤回收水解液蛋白的响应面试验分析
在上述单因素试验中,可以看出各因素对膜通量有显著影响,而对蛋白质截留率影响较小(回归模型不显著),蛋白质截留率始终在94%以上,说明超滤操作对水解液蛋白截留效果良好。为进一步确定超滤操作的最佳工艺,以膜通量为响应值,选择操作压力、溶液质量分数和溶液pH值3个因素,采用Box-Behnken试验设计进行响应面分析。试验设计及结果见表3,表中X1~X3为x1~x3的编码值。

表3 Box-Behnken试验设计及结果Tab.3 Experimental design and results of Box-Behnken
通过Design-Expert 8.0.6软件,对表3中数据进行多元回归拟合,得到超滤膜通量(R)对操作压力(X1)、溶液质量分数(X2)、溶液pH值(X3)的回归方程模型为

在回归方程基础上,对模型进行降维分析,以考察各因素及因素间交互作用对膜通量的影响,所得响应曲面如图6所示。由图6可知在所考察因素范围内,膜通量均随操作压力、溶液质量分数、溶液pH值的增大呈现先上升后下降的趋势,与上述单因素试验结果相一致,且各曲面均为下开口凹面,中心位于所考察区域内,说明所考查范围内存在膜通量的最大值。

表4 响应面结果方差分析Tab.4 ANOVA of response surface results
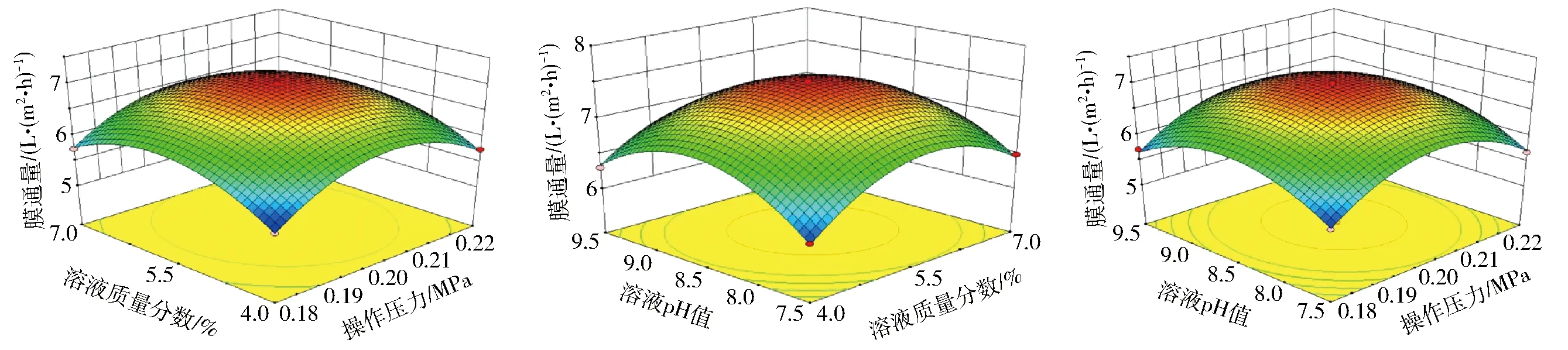
图6 超滤回收工艺参数对膜通量影响的响应曲面Fig.6 Response surfaces exhibiting effects of ultrafitration parameters on membrane flux
通过Design-Expert软件分析,得到超滤回收水解液蛋白的最佳工艺参数为:操作压力0.20 MPa、溶液质量分数5.61%、溶液pH值8.49,在此条件下超滤膜通量预测值为7.035 3 L/(m2·h)。考虑到实际可操作性,将上述条件修正为:操作压力0.20 MPa,溶液质量分数5.60%、溶液pH值8.50,在此最优条件下进行验证试验,得到的超滤膜通量为7.02 L/(m2·h),与预测值较为接近,说明响应面优化得到的超滤工艺条件准确可靠,具有一定的实际参考价值。
在上述最佳超滤回收工艺基础上,进一步考察超滤法对水解液蛋白中杂质的脱除效果,对回收物中可溶性糖类物质及灰分含量进行了测定,结果见表5。
由表5可知,超滤法对水解液中可溶性糖类物质的脱除效果较好,其中对蔗糖和水苏糖的脱除率分别为54.94%和49.12%,棉籽糖脱除率高达100%,但对盐类物质脱除效果欠佳,增加超滤、反渗透等膜分离工序可能会改善脱除效果。超滤操作后,回收物中蛋白纯度可提升至88.63%,超过市售大豆浓缩蛋白纯度,并接近大豆分离蛋白纯度,且抗营养性低聚糖含量较低,可作为蛋白质的优质来源,具有巨大的附加经济价值。

表5 超滤回收水解液蛋白中的杂质组成(质量分数,以干基计)Tab.5 Impurity contents in skim protein recovered from EAEP of soybeans %
2.5 水解液蛋白的红外光谱分析
超滤回收处理前后水解液蛋白的红外光谱如图7所示。

图7 水解液蛋白的红外光谱图Fig.7 Infrared spectra of skim protein
2.6 水解液蛋白的功能特性分析
水酶法提取过程中伴随着大豆蛋白的限制性酶解,蛋白多肽链长短及三维空间结构发生变化,并导致部分被包埋的氨基酸残基曝露出来[12],这一过程必然对蛋白质的功能特性产生影响,本研究分别考察了超滤回收后水解液蛋白质的氮溶解指数、乳化活性指数及乳化稳定性指数,并与大豆分离蛋白进行对比,结果如图8所示。

图8 水解液蛋白质的功能特性Fig.8 Functional properties of skim protein
如图8所示,水解液蛋白及分离蛋白的溶解性-pH值曲线呈现典型的U型曲线,即在pH 值4.5(大豆蛋白等电点)附近溶解性最低,在pH 值2.0~7.0范围内,水解液蛋白的溶解性均较分离蛋白有所提升,且在酸性条件下提升较显著,如在pH 值3.0和4.5处,水解液蛋白的氮溶解指数较大豆分离蛋白分别提高了0.51和15.6倍。蛋白酶解后小分子片段的增加、亲水性基团的释放以及表面积的增大促进了水合作用,使蛋白溶解性得到增强。大豆蛋白由于其酸溶性的限制在饮料加工领域应用十分有限,而水解液蛋白这一特性的改善可在一定程度上扩大其在酸性食品体系中的应用,如果汁、酸乳饮料、碳酸饮料等。图8所示为水解液蛋白及分离蛋白的乳化活性指数及乳化稳定性指数随pH值变化的曲线。与分离蛋白相比较,水解液蛋白的乳化性略有下降,其乳化活性指数及乳化稳定性指数分别较分离蛋白下降了45.42%和18.61%。这一结论与ALMEIDA等[25]对Protex 6L酶解后蛋白的乳化特性测定结果趋势相似。水酶法提取过程中蛋白酶的介入在不同程度上破坏了蛋白质结构中氢键、疏水相互作用、离子键等作用力,并产生较小分子量的肽段或氨基酸,它们无法同大分子蛋白一样稳定存在于油水界面并维持界面张力[16],致使乳化活性指数及乳化稳定性指数有所降低。
3 结束语
采用超滤法回收水解液中的蛋白质,在单因素试验的基础上,通过响应面法试验设计建立了操作压力、溶液质量分数、溶液pH值对膜通量影响的模型。研究结果表明,各因素对膜通量的影响由大到小依次为溶液质量分数、操作压力、溶液pH值。经优化得到的最佳工艺参数为:操作压力0.20 MPa、溶液质量分数5.60%、溶液pH值8.50。在上述条件下超滤膜通量为7.02 L/(m2·h),回收物中蛋白质质量分数增至88.63%,接近市售大豆分离蛋白纯度。红外光谱结果显示构成大豆蛋白的各官能团特征峰明显,蛋白制品纯度较理想,色谱结果显示超滤对水解液中的可溶性糖类物质尤其是棉籽糖脱除效果较好,所回收蛋白在功能特性上溶解性得到明显改善,而乳化活性指数及乳化稳定性指数有所降低。
1 YUSOFF M M, GORDON M H, NIRANJAN K. Aqueous enzyme assisted oil extraction from oilseeds andemulsion de-emulsifying methods: a review[J]. Trends in Food Science & Technology, 2015, 41(1):60-82.
2 LI Y, SUI X N, QI B K, et al. Optimization of ethanol-ultrasound-assisted destabilization of a cream recovered from enzymatic extraction of soybean oil[J]. Journal of the American Oil Chemists Society, 2014, 91(1):159-168.
3 LI Y, JIANG L Z, QIAO G H. Effect of extruding parameters on soybean oil yield of enzyme-assisted aqueous extraction processing[J]. Advanced Materials Research, 2010, 148-149:7-18.
4 DE MOURA BELL J M L N, MAURER D, YAO L, et al. Characteristics of oil and skim in enzyme-assisted aqueous extraction of soybeans[J]. Journal of the American Oil Chemists Society, 2013, 90(7):1079-1088.
6 CAMPBELL K A, GLATZC E. Protein recovery from enzyme-assisted aqueous extraction of soybean[J]. Biotechnology Progress, 2009, 26(2):488-495.
7 王周利, 伍小红, 岳田利,等. 苹果酒超滤澄清工艺的响应面法优化[J/OL]. 农业机械学报, 2014, 45(1):209-213. http:∥www.j-csam.org/jcsam/ch/reader/view_abstract.aspx?file_no=20140133&flag=1. DOI: 10.6041/j.issn. 1000-1298. 2014. 01. 033. WANG Zhouli, WU Xiaohong, YUE Tianli, et al. Application of ultra-filtration technology in cider clarification[J/OL]. Transactions of the Chinese Society for Agricultural Machinery, 2014, 45(1):209-213.(in Chinese)
8 李旭, 邓俊琳, 申世安,等. 油茶籽粕分离蛋白及其超滤组分的功能特性研究[J]. 中国粮油学报, 2015, 30(10):37-42. LI Xu, DENG Junlin, SHEN Shian, et al. Functional properties ofCamelliaoleiferaseed cake separated protein and its ultrafiltration fractions[J]. Journal of the Chinese Cereals and Oils Association, 2015, 30(10):37-42.(in Chinese)
9 YANG J, GUO J, YANG X Q, et al. A novel soy protein isolate prepared from soy protein concentrate using jet-cooking combined with enzyme-assisted ultra-filtration[J]. Journal of Food Engineering, 2014, 143(143):25-32.
10 黄群, 马美湖, 黄茜,等. 鸡蛋清卵白蛋白与溶菌酶的两步超滤法分离[J/OL]. 农业机械学报, 2012, 43(3):146-151. http:∥www.j-csam.org/jcsam/ch/reader/view_abstract.aspx?file_no=20120327&flag=1. DOI:10.6041/j.issn.1000-1298.2012.03.027. HUANG Qun, MA Meihu, HUANG Xi, et al. Separation of ovalbumin and lysozyme from chicken eggwhite using two-stage ultrafiltration technique[J/OL]. Transactions of the Chinese Society for Agricultural Machinery, 2012, 43(3):146-151.(in Chinese)
11 MOURA J M L N D, CAMPBELL K, MAHFUZ A, et al. Enzyme-assisted aqueous extraction of oil and protein from soybeans and cream de-emulsification[J]. Journal of the American Oil Chemists Society, 2008, 85(10):985-995.
12 李琳琳, 金华丽, 崔彬彬,等. 基于近红外透射光谱的大豆蛋白质和粗脂肪含量快速检测[J]. 粮食与油脂, 2014(12):57-60. LI Linlin, JIN Huali, CUI Binbin, et al. Rapid determination of soybean protein and crude fat content by near-infrared transmittance spectroscopy[J].Journal of Cereals and Oils, 2014(12):57-60.(in Chinese)
13 NIU F, DONG Y, SHEN Fei, et al. Phase separation behavior and structural analysis of ovalbumin-gum arabic complex coacervation[J]. Food Hydrocolloids, 2015,43:1-7.
14 LIU A, YIN S, LI L. Structure, trypsin inhibitor activity and functional properties of germinated soybean protein isolate[J]. International Journal of Food Science & Technology, 2014, 49(3):911-919.
15 GHRIBI A M, GAFSI I M, SILA A, et al. Effects of enzymatic hydrolysis on conformational and functional properties of chickpea protein isolate[J]. Food Chemistry, 2015, 187:322-330.
16 DOMBROWSKI J, DECHAU J, KULOZIK U. Multiscale approach to characterize bulk, surface and foaming behavior of casein micelles as a function of alkalinisation[J]. Food Hydrocolloids, 2016, 57:92-102.
17 LIENERI E. Implications of antinutritional components in soybean foods[J]. Critical Reviews in Food Science & Nutrition, 1994, 34(1):31-67.
18 杨道强, 邢建荣, 陆胜民. 大豆不同前处理方式对豆浆品质的影响[J]. 食品科学, 2016(1):69-73. YANG Daoqiang, XING Jianrong, LU Shengmin. Effect of different soybean pretreatment methods on the quality of soy milk[J]. Food Science, 2016(1):69-73.(in Chinese)
19 OSMAN A, GRINGER N, SVENDSEN T, et al. Quantification of biomolecules in herring (Clupeaharengus) industry processing waters and their recovery using electroflocculation and ultrafiltration[J]. Food & Bioproducts Processing, 2015, 96:198-210.
20 陈全胜, 赵杰文, 岳鹏翔. 中空纤维超滤膜分离菜籽饼粕中蛋白质的试验[J]. 农业机械学报, 2006, 37(8):1-4. CHEN Quansheng, ZHAO Jiewen, YUE Pengxiang. Study on application of hollow fiber ultrafilter in separating protein from rapeseed meal[J]. Transactions of the Chinese Society for Agricultural Machinery, 2006, 37(8):1-4.(in Chinese)
21 陈婷, 余群力, 赵莉,等. 超滤膜分离技术回收乳清蛋白工艺研究[J]. 食品工业科技, 2010(4):226-228. CHEN Ting, YU Qunli, ZHAO Li, et al.Study on the technology of ultrafiltration membrane separation in recycling of whey protein[J]. Science and Technology of Food Industry, 2010(4):226-228.(in Chinese)
22 CAMPBELL K A, GLATZ C E, JOHNSON L A, et al. Advances in aqueous extraction processing of soybeans[J]. Journal of the American Oil Chemists Society, 2011, 88(4):449-465.
23 MOURA J M L N D, CAMPBELL K, ALMEIDA N M D, et al. Protein extraction and membrane recovery in enzyme-assisted aqueous extraction processing of soybeans[J]. Journal of the American Oil Chemists Society, 2011, 88(6):877-889.
24 MOLEK J, RUANJAIKAEN K, ZYDNEY A L. Effect of electrostatic interactions on transmission of PEGylated proteins through charged ultrafiltration membranes[J]. Journal of Membrane Science, 2010, 353(1):60-69.
25 DE ALMEIDA N M, DE MOURA BELL J M L N, JOHNSON L A.Properties of soy protein produced by countercurrent,two-stage, enzyme-assisted aqueous extraction[J].Journal of the American Oil Chemists Society,2014, 91(6):1077-1085.
Ultrafiltration Recovery of Skim Protein from Enzyme-assisted Aqueous Extraction Process of Soybean and Its Functional Properties
JIANG Lianzhou ZHANG Qiaozhi LI Yang WANG Zhongjiang QI Baokun SUI Xiaonan
(CollegeofFoodScience,NortheastAgriculturalUniversity,Harbin150030,China)
Enzyme-assisted aqueous extraction processing (EAEP) has long been considered as a promising alternative to traditional solvent oil extraction, which has gained increasing attention recently. After EAEP of soybeans, three distinct layers are formed: cream, skim and residual fraction. The skim fraction contains substantial amount of protein as well as oil, sugar and other impurities. In order to recover value from this liquid fraction, ultrafiltration was employed for protein concentration and isolation. To investigate the interrelationship between operating parameters and membrane flux, Box-Behnken response surface methodology was introduced. The results indicated that the three factors’ effects on membrane flux followed the decreasing order as: solution mass fraction, transmembrane pressure and solution pH value. The improved regression model was fitted with determination coefficient of 0.997 5 and optimal factors were as follows: operative pressure of 0.20 MPa, solution mass fraction of 5.60%, and solution pH value of 8.50. The permeate flux under above conditions was 7.02 L/(m2·h) and protein purity was increased to 88.63%. The infrared spectrum and HPLC analysis showed evidently characteristic peaks of functional groups in soybean protein and remarkable low levels of undigestible oligosaccharides. Besides, the protein extracted from EAEP showed improved solubilities especially at acidic pH value, but it slightly decreased emulsifying activity index and emulsifying stability index. Further improvement can be achieved if industrial fractionation unit was employed and process optimization was conducted. A complete cost-effectiveness analysis would also need to be done to estimate the economic viability of this application.
soybean protein; ultrafiltration; functional properties;enzyme-assisted aqueous extraction process; process optimization
10.6041/j.issn.1000-1298.2017.02.044
2016-07-02
2016-08-04
国家重点研发计划项目(2016YFD0401402、2016YFD0400700)、国家自然科学基金重点项目(31430067)和国家自然科学基金面上项目(31571876)
江连洲(1960—),男,教授,博士生导师,主要从事粮食、油脂及植物蛋白工程研究,E-mail: jlzname@163.com
隋晓楠(1987—),男,副教授,主要从事粮食、油脂及植物蛋白工程研究,E-mail: xiaonan.sui@neau.edu.cn
TS221
A
1000-1298(2017)02-0327-08

