供氮和不供氮条件下玉米穗部性状的 QTL 定位
何坤辉,常立国,李亚楠,渠建洲,崔婷婷,徐淑兔,薛吉全,刘建超
(西北农林科技大学农学院/农业部西北旱区玉米生物学与遗传育种重点实验室,陕西杨凌 712100)
供氮和不供氮条件下玉米穗部性状的 QTL 定位
何坤辉,常立国,李亚楠,渠建洲,崔婷婷,徐淑兔,薛吉全*,刘建超*
(西北农林科技大学农学院/农业部西北旱区玉米生物学与遗传育种重点实验室,陕西杨凌 712100)
【目的】分析供氮 (+N) 和不供氮 (–N) 2 种条件下玉米穗部性状 QTL 定位结果的差异,挖掘在 –N 条件下特异表达的主效 QTL,为玉米的氮高效分子育种提供理论依据。【方法】以优良玉米自交系许 178 (氮高效) × K12 (氮低效) 衍生的 150 个 F7代重组自交系 (recombinant inbred lines,RILs) 为试验材料,在 +N 和 –N 2 种处理条件下进行 2 年的田间试验,对玉米的穗长、穗粗、穗行数、行粒数和单株产量共 5 个穗部性状进行表性鉴定。使用基于混合线性模型 (mixed liner model,MLM) 的最佳线性无偏预测法 (best linear unbiased prediction,BLUP),结合 2 年的表型数据,估计各家系各性状在不同氮水平下的育种值。然后利用 QTL IciMapping V4.0 软件的完备区间作图法 (inclusive composite interval mapping,ICIM) 对这 5 个性状的育种值进行 +N 和 –N 条件下的 QTL 分析。【结果】玉米的穗长、穗粗和穗行数在不同氮水平下差异不大,而行粒数和单株产量在 –N 条件下呈现出显著降低的结果。两种氮水平下共定位到 20 个穗部性状 QTL,其中 +N 条件下定位到 11 个 QTL,包括穗长 2 个、穗粗 1 个、穗行数 2 个、行粒数 1 个和单株产量 5 个。–N 条件下定位到 9 个 QTL,包括穗长 1个、穗粗 1 个、穗行数 2 个、行粒数 1 个和单株产量 4 个。这些 QTL 分布在除第 2 染色体以外的其余染色体上。两种氮水平下定位到 5 个“一致性 QTL”,分别为 qEL7a,qED7a,qRNE9b,qGYP1a 和 qGYP6a,这 5 个“一致性 QTL”具有较高的表型贡献率,在不同氮水平下的贡献率均超过了 10.00%。在 – N 条件下共发现 4 个特异表达的 QTL,分别为 qRNE9a,qKNR6a,qGYP3a 和 qGYP8a,其中 qRNE9a 和 qGYP3a 是贡献率超过10.00% 的主效 QTL。无论是在 +N 还是 –N 条件下,都发现了控制不同性状的基因之间紧密连锁或是同一个基因的一因多效现象,这与穗部各性状间的高度相关性表现一致。【结论】控制玉米穗部性状的基因在不同氮水平下的特异性表达直接导致了玉米穗部性状表型上的差异。5 个“一致性”主效 QTL 和 2 个在不供氮条件下特异表达的主效 QTL,均有利于提高玉米抵抗低氮胁迫的能力。研究中发现的几个控制玉米穗部性状的 QTL 富集区可能存在一些关键基因,值得进一步研究。
玉米;穗部性状;低氮胁迫;QTL
我国农业生产中普遍存在氮肥利用率低的问题[1]。氮肥的过度施用,不仅没有换来实质上的产量提升,反而造成极大的资源浪费,增加了生产成本,污染了生态环境[2–3],不利于农业的可持续发展。研究玉米在低氮环境下的遗传机制,发掘玉米氮高效基因,进而培育氮高效玉米品种,有利于减少氮肥施用量,保护农业生态,促进农业的可持续发展。玉米的穗部性状在产量形成中具有重要作用,因而在氮效率研究中得到关注。陈范骏等[4]在不同氮水平下对玉米的穗部性状进行了研究,结果表明在低氮条件下穗重和穗行数对产量的贡献最大,指出在低氮条件下选择氮高效品种时应选择大穗型、穗行数多,且有较大成熟期生物量的品种。Chen 等[5]研究了热带玉米部分穗部性状在低氮条件下的遗传变异,结果表明在低氮条件下子粒产量、穗行数、百粒重和穗长等性状皆有显著的加性遗传方差,这为氮高效品种的选育提供了科学依据。自 20 世纪 80年代以来,分子标记技术的发展和数量性状统计模型的日臻完善,为从分子水平研究玉米氮效率的遗传基础提供了有力的支持。1999 年,Agrama 等[6]绘制出了首张玉米氮效率的 QTL 定位图谱,标志着氮效率的分子遗传学研究在玉米上取得重要进展。此后许多科研人员对玉米的穗部性状做了大量的氮效率 QTL 定位研究[7–20],发现了许多 QTL 位点,这些位点在玉米的 10 条染色体上均有分布。Luo 等[21]通过元分析 (Meta-analysis) 方法对前人的定位结果进行整合,最终获得 14 个与氮效率有关的穗部性状“一致性 QTL”,分布在玉米的第 1、2、3、4、6、8 和9 染色体上。尽管前人在玉米穗部性状氮效率遗传方面的研究上取得了一些成果,但由于氮效率是一个多基因控制的复杂性状,必须使用大量不同的群体进行挖掘,才有可能发现更多的氮效率位点。因此,本研究以优良玉米自交系许 178 (氮高效) × K12 (氮低效) 衍生的 150 个 F7代 RILs 家系为试验材料,在施氮和不施氮条件下,通过 2 年的田间试验,对穗长、穗粗、穗行数、行粒数和单株产量进行 QTL定位的对比研究,以期挖掘到更多影响玉米氮效率的主效位点,为深入研究玉米的氮高效遗传机制及开展氮高效分子育种提供理论支持。
1 材料与方法
1.1 试验材料
本试验所用的 RILs 群体是以两个在氮效率上存在显著差异的玉米自交系许 178 × K12 为基础材料[22],杂交后代经过连续多代自交建成的 F7代群体,该群体总共包含 150 个家系。
1.2 田间试验及数据处理
2014 年和 2015 年的 4 月到 9 月,在陕西省杨凌区西北农林科技大学玉米试验基地进行春播试验,0—30 cm 土壤有机质含量 15.1 g/kg、全氮 0.85 g/kg、速效磷 15.9 mg/kg、速效钾 138.5 mg/kg。试验设供氮 (纯氮 180 kg/hm2,+N) 和不供氮 (–N) 两个处理,每个处理设 3 次重复,单行区,行长 4 m,每行 16株玉米,行距 0.6 m,密度 66667 plant/hm2。供氮区播种前施尿素 191 kg/hm2、过磷酸钙 750 kg/hm2、氯化钾 135 kg/hm2,大喇叭口期追施尿素 200 kg/hm2;不供氮区除不施氮肥外,其他与供氮处理相同。成熟后从每行均匀挑出 5 穗用于室内考种,包括穗长、穗粗、穗行数、行粒数和单株产量共 5 个性状。取 5 个单株的表型平均值代表该重复的表型值,3 个重复的表型平均值代表该年份的表型值。用SAS V9.2 软件进行方差分析,广义遗传力的计算采用下面的公式:

其中,σG2表示基因型方差;σGE2表示基因型与环境互作的方差;σE2为误差项;r 为重复数,本试验中为 3;n 为环境数,本试验中为 2。
使用 Henderson[24]提出的基于混合线性模型(mixed liner model,MLM) 的最佳线性无偏预测法(best linear unbiased prediction,BLUP) 结合 2 年表型值数据估计每个家系各性状的育种值 (estimated breeding value,EBV)。使用 Excel V2010 软件计算各性状育种值之间的相关系数。
1.3 遗传连锁图谱构建及 QTL 定位
亲本和各家系的基因组 DNA 采用 CTAB 法[25]提取。从 MaizeGDB 网站 (http://www.maizegdb.org/) 中均匀挑选覆盖玉米基因组的 495 对 SSR 引物进行亲本间多态性筛选,然后选用在双亲间表现多态性的引物对 RILs 群体进行基因型分析。PCR 扩增产物用6% PAGE 凝胶电泳,银染检测。带型以 1、2、0 进行统计,其中“1”代表母本许 178 的带型,“2”代表父本 K12 的带型,“0”表示杂合和缺失带型。
利用亲本许 178 和 K12 共筛选出 217 对多态性SSR 引物,能够在群体中清晰扩增出来的引物有 193对。MapMaker V3.0 软件[26]被用来构建遗传图谱,采用 Kosambi 函数将重组率转化为遗传距离“cM”,以 Min LOD=3.0,Max Distance=37.2 cM为条件进行连锁分析和连锁群划分,最终有 191 个标记被划分到 10 个连锁群中。用 MapDraw V2.1 软件[27]来绘制遗传图谱。
采用 QTL IciMapping V4.0 软件[28]的完备区间作图法对 5 个穗部性状进行 QTL 分析。QTL 分析时,采用不同氮水平下各性状的育种值进行分析。PIN设为 0.01,每 1 cM 步长 (walking speed) 对目的性状进行全基因组扫描,采用模拟运算 (permutation) 1000 次的方法确定 LOD 阈值,当某个位置检测到的LOD 值大于 LOD 阈值时,就认为该位置存在 1 个QTL[29]。
2 结果与分析
2.1 穗部性状的表型分析
150 个 RIL 群体及其双亲在两种氮水平下的表型结果如表 1 所示。双亲所调查的 5 个性状在不同年份和氮处理中均存在显著差异。在氮处理间亲本各性状的显著性有所不同,许 178 除穗长和穗粗不显著外,其余性状都显著;K12 除穗行数不显著外,其余性状都达到显著水平。双亲的穗长、穗粗和穗行数在 –N 条件下减小幅度不明显,而行粒数和单株产量在 –N 条件下出现明显的下降,说明这 2 个性状受氮素的影响较大。在 F7代 RILs 群体中,所调查的5 个性状均表现出一定程度的双向超亲分离,各性状的偏度和峰度均小于 1,符合 QTL 定位的要求。+N条件下各性状的遗传力均高于 –N 条件下,说明玉米穗部性状在低氮条件下更容易受到环境的影响。穗行数的遗传力最高,分别为 83.3% 和 79.6%;单株产量的遗传力最低,分别为 73.2% 和 64.1% (表 1)。
联合方差分析表明,穗部各性状除穗长、穗粗和穗行数在不同氮水平间差异不显著外,行粒数和单株产量在不同年份和氮水平间均表现出极显著差异 (表 2),说明玉米的行粒数和单株产量更容易受到供氮量的影响。相关分析表明,在不同氮水平下,单株产量与穗长、穗粗、穗行数和行粒数呈极显著正相关,行粒数与穗长、穗粗和穗行数呈极显著正相关,穗行数与穗粗的相关性也达到了极显著水平。穗长与穗粗和穗行数不具有相关性 (表 3),说明产量是多个穗部性状共同作用的结果。
2.2 遗传连锁图谱的构建
构建的遗传图谱全长 2 069.1 cM,平均图距 10.8 cM (图 1) , 符合 QTL 初步定位的要求。以第 1 和第4 连
锁群上的标记最多,均为 25 个,第 10 连锁群上的标记最少,仅有 12 个。10 个连锁群中,图距最长的是第 1 连锁群,为 291.3 cM,最短的是第 6 连锁群,图距为 163.4 cM。平均图距最长的是第 5 连锁群,为 14.3 cM,最短的是第 7 连锁群,为 8.5 cM。图谱中未出现距离大于 30 cM 的“gap”。
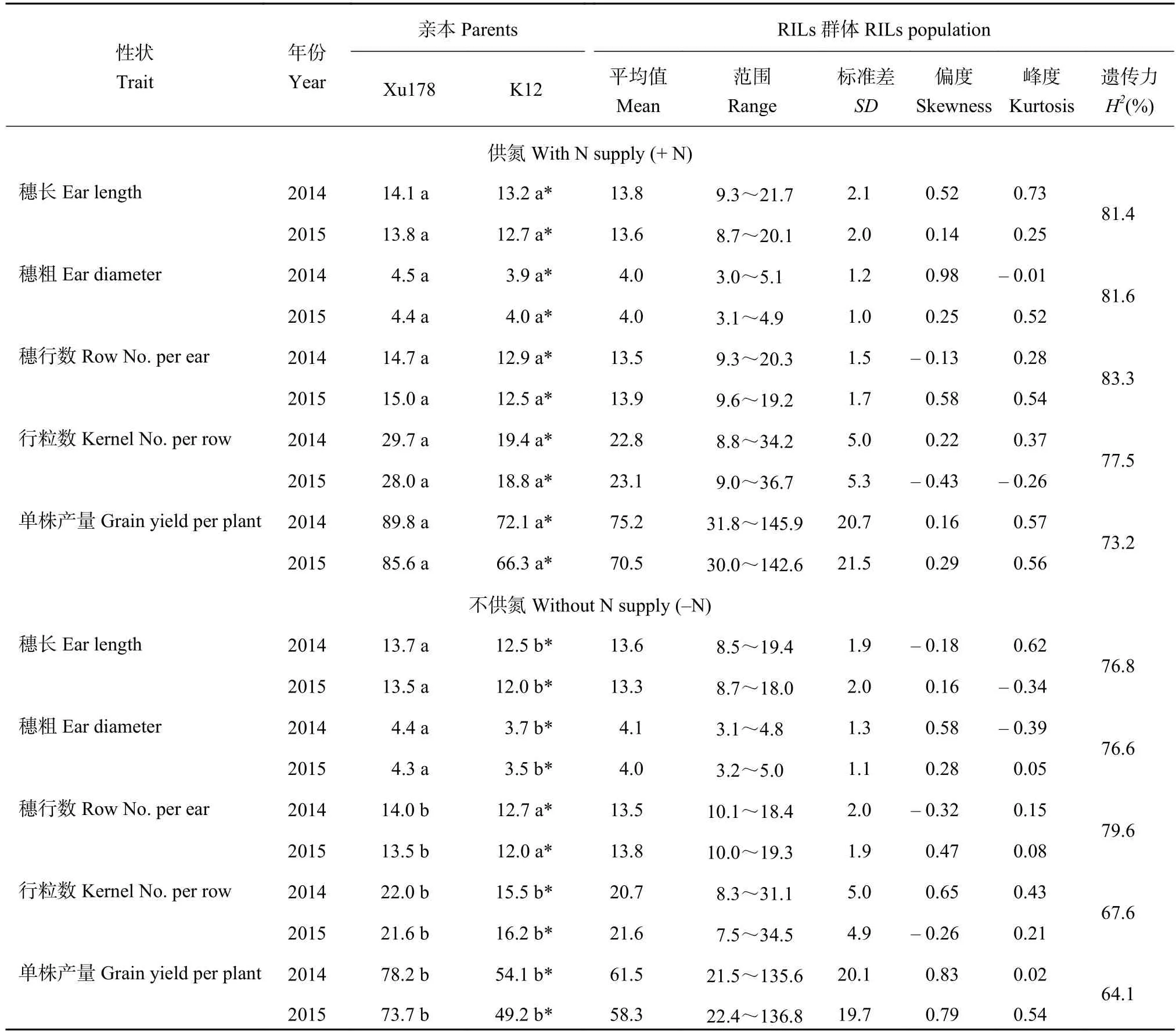
表1 两种氮水平下亲本及重组自交系群体各性状的表现Table 1 Breeding value of the parents and RILs population under two nitrogen applications
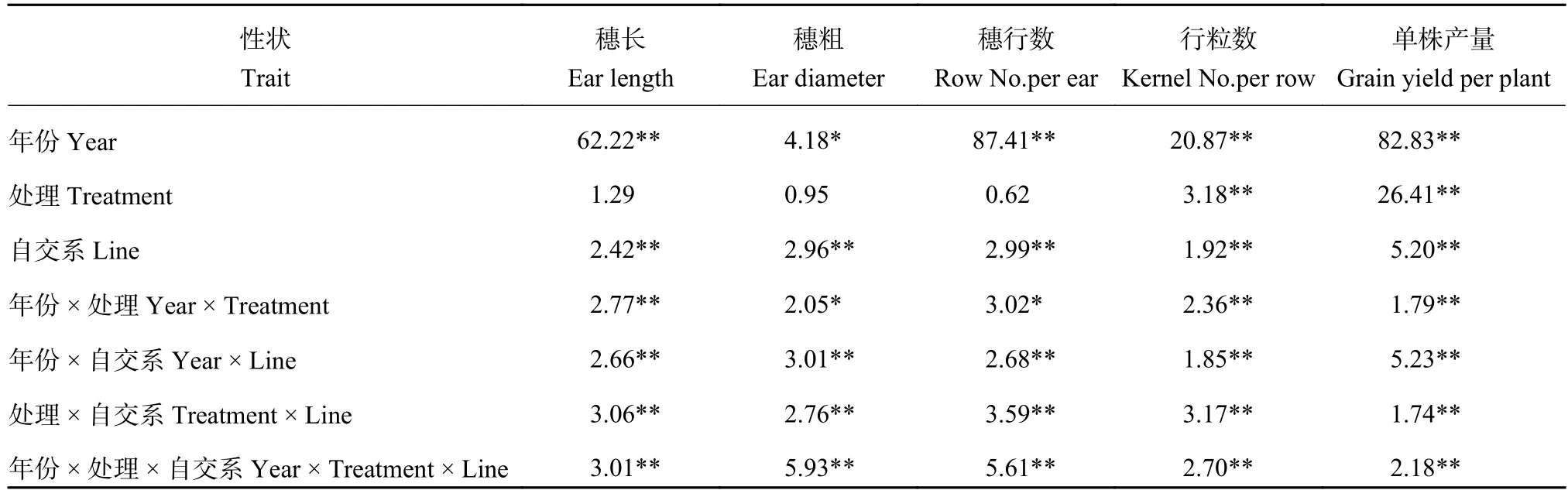
表2 不同年份和氮水平间玉米穗部性状的联合方差分析Table 2 Complex variance analysis of ear traits of maize under different years and nitrogen levels

表3 两种氮水平下玉米穗部性状育种值的相关性分析Table 3 Correlation analysis of ear traits of maize under two nitrogen applications
2.3 穗部性状 QTL 定位
+N 条件下共检测到 11 个 QTL,–N 条件下共检测到 9 个 QTL,这些 QTL 分布在除第 2 染色体外的其余染色体上 (图 1,表 4)。
2.3.1 穗长 共定位到 3 个 QTL。其中 +N 条件下检测到 2 个 QTL,分布在第 7 和第 10 染色体上,贡献率分别为 12.87% 和 9.05%;–N 条件下检测到 1 个QTL,分布于第 7 染色体上,贡献率为 10.92%。位于 Bin7.04 区域的 2 个 QTL 处于相同标记区间,且增效等位基因均来自母本许 178,是同一个 QTL。
2.3.2 穗粗 共定位到 2 个 QTL。其中 +N 条件下定位到 1 个 QTL,位于第 7 染色体,贡献率为 15.85%;–N 条件下定位到 1 个 QTL,位于第 7 染色体上,贡献率为 12.30%。这 2 个 QTL 都位于 Bin7.03 区域的相同标记区间,增效等位基因均来自父本 K12,是同一个 QTL。
2.3.3 穗行数 共定位到 4 个 QTL。其中 +N 条件下定位到 2 个 QTL,分布于第 4 和第 9 染色体,贡献率分别为 11.16% 和 12.91%;–N 条件下定位到 2 个QTL,都分布在第 9 染色体,贡献率分别为 13.43%和 21.27%。位于 Bin9.05/9.06 区域的 2 个 QTL 处于相同的标记区间,增效等位基因均来自父本 K12,是同一个 QTL。
2.3.4 行粒数 共定位到 2 个 QTL。其中 +N 条件下定位到 1 个 QTL,位于 Bin10.07,贡献率为 11.34%;–N 条件下定位到 1 个 QTL,位于 Bin6.02/6.04,贡献率为 8.72%。
2.3.5 单株产量 共定位到 9 个 QTL。其中 +N 条件下定位到 5 个 QTL,分布于第 1、第 5、第 6、第 7和第 10 染色体上,贡献率为分别为 20.47%、7.45%、21.38%、8.28% 和 9.38%;–N 条件下定位到 4 个QTL,分布于第 1、第 3、第 6 和第 8 染色体,贡献率分别为 15.21%、8.32%、11.92% 和 6.03%。位于Bin1.06 区域的 2 个 QTL 处于相同的标记区间,增效等位基因均来自母本许 178,是同一个 QTL,位于Bin6.02/6.04 区域的 2 个 QTL 处于相同标记区间,增效等位基因均来自 K12,是同一个 QTL。
3 讨论
3.1 供氮量对玉米穗部性状的影响
玉米的穗部是对氮素比较敏感的部位,容易受到供氮量的影响。王长成等[30]研究发现,玉米穗部性状在不同氮水平下差异达到了显著或极显著水平,穗部性状的表现会随氮水平变化而发生明显变化。刘宗华等[31]研究表明,玉米籽粒在 –N 条件下的产量普遍低于 +N 条件下的产量,平均下降 15.89%,最高可达 50.00% 以上。米国华等[32]研究指出,氮素供应不足严重影响玉米雌穗的发育,会造成授粉不足,籽粒结实率差,籽粒数目显著减少,从而导致产量下降。本研究发现玉米的穗长、穗粗和穗行数在不同氮水平下差异较小,而玉米籽粒的行粒数在–N 条件下明显减少,并进一步导致穗粒数的减少,从而造成减产。说明在 –N 条件下,籽粒行粒数是一个重要的氮效率次级选择指标。在分子研究层面,Agrama 等[6]、Gallais 等[33]、刘宗华等[17]和刘建超等[18]的研究结果均表明,在 –N 条件下玉米穗部性状的分子遗传机制发生了很大改变,只有很少的 QTL 能同时在两种供氮水平下被检测到。本研究用不同氮水平下各性状的育种值进行 QTL 分析,总共定位到 20个 QTL,发现只有 5 个位点能同时在两种氮水平下被检测到,多数 QTL 都只能在 +N 或者 –N 条件下被检测到,这与前人的研究结果一致。说明在不同的供氮水平下,控制玉米穗部性状的基因作用方式发生了变化,有些在 +N 条件下表达的基因在 –N 条件下被抑制了,而有些在 +N 条件下不表达的基因在–N 环境的诱导下被激活了。基因在不同氮水平下的特异性表达直接导致了玉米穗部性状表型上的差异。
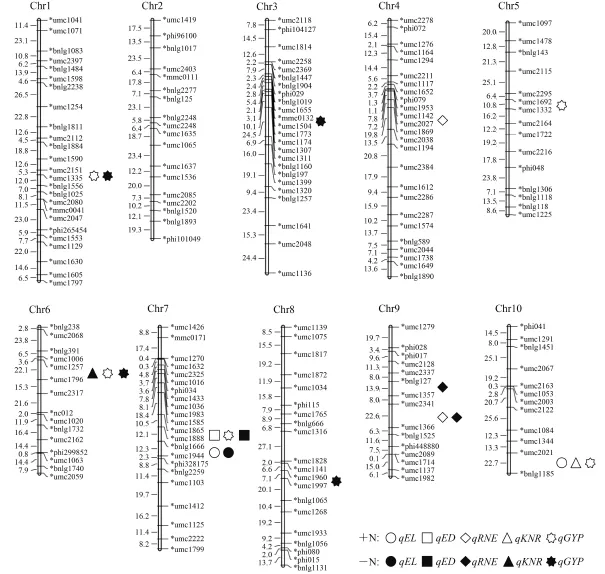
图1 供氮和不供氮玉米穗部性状的 QTL 定位结果Fig.1 QTL mapping results of ear traits of maize with and without N supply
3.2 穗部性状 QTL 定位结果与前人的比较
玉米的穗部性状是一个复杂的数量性状,因而使用不同的研究材料所定位到的 QTL 不尽相同。本研究在两种氮水平下共检测到 20 个穗部性状 QTL,其中 +N 条件下定位到 11 个位点,分布在第 1、4、5、6、7、9 和 10 染色体上;–N 条件下定位到 9 个位点,分布在第 1、3、6、7、8 和 9 染色体上。在 +N条件下定位到的穗行数 QTL-qRNE4a 与 Liu 等[16]、刘宗华等[17]和刘建超等[18]的定位结果一致,穗行数QTL-qRNE9b 与刘宗华等[17]的定位结果一致;–N 条件下定位到的穗粗 QTL-qED7a 与刘宗华等[17]的定位结果一致,行粒数 QTL-qKNR6a 与 Liu 等[16]的定位结果一致,单株产量 QTL-qGYP1a 与刘建超等[18]的定位结果一致。研究定位到的其余 QTL 均是新发现的位点,这种结果一定程度上反映了控制玉米穗部性状基因网络的复杂性。因而必须使用不同的研究材料进行挖掘才能深入认识玉米穗部性状的遗传机制。
本研究在 –N 条件下共定位到 4 个特异表达的QTL,分别是位于染色体 Bin9.03/9.04 的穗行数QTL-qRNE9a、位于 Bin6.02/6.04 的行粒数 QTL-qKNR6a、位于 Bin3.04 与 Bin8.05/8.06 的单株产量QTL-qGYP3a 和 QTL-qGYP8a,这些在 –N 条件下特异表达的 QTL 很可能与氮素的高效利用有关。Luo等[21]对 16 篇有关氮效率研究的论文进行综合分析,通过 Meta-analysis 方法发现了 14 个与产量及产量构成因子有关的氮效率“一致性 QTL”,并根据表达数据对其所在区间的候选基因进行了预测。而本研究定位到的 4 个位点中有 3 个与之处于相同或邻近的染色体区间 (Bin3.04、Bin8.06 和 Bin9.03),这也充分证明了本研究结果的真实性和可靠性。此外,本研究定位到的 Bin6.02/6.04 区间是否存在真实有效的氮效率基因还未见报道,有待于进一步的研究。

表4 两种氮水平下玉米穗部性状育种值的 QTL 定位Table 4 QTL mapping of maize ear traits under two nitrogen application treatments
3.3 不同氮水平下的“一致性 QTL”
Tuberosa 等[34]提出,在不同环境下检测到相同性状的 QTL,如果它们的标记区间相同,且增效等位基因来源相同,即认为是同一个 QTL,而本研究中检测到多个这样的位点。染色体 Bin1.06 区域存在一个控制单株产量的 QTL-qGYP1a,该位点在两种氮水平下均被检测到,贡献率大于 15.00%,增效等位基因来源于母本许 178;染色体 Bin6.02/6.04 区域存在一个控制单株产量的 QTL-qGYP6a,该位点在两种氮水平下均被检测到,贡献率大于 11.00%,增效等位基因来源于父本 K12;染色体 Bin7.04 区域存在一个控制穗长的 QTL-qEL7a,该位点在两种氮水平下均被检测到,贡献率大于 10.00%,增效等位基因来自母本许 178;染色体 Bin7.03 区域的穗粗QTL-qED7a 在两种氮水平下均被检测到,贡献率超过了 12.00%,增效等位基因来自父本 K12;位于第9 染色体 Bin9.05/9.06 区域的穗行数 QTL-qRNE9b 在两种氮水平被检测到,贡献率均超过了 12.00%,增效等位基因来源于父本 K12。这些在不同氮水平下均被检测到的“一致性 QTL”贡献率都超过了10.00%,是主效 QTL,推测它们可能是组成型表达的基因,表达不受时间、空间和环境的影响。这些组成型 QTL 对于玉米的产量形成具有重要的意义,对这些“一致性 QTL”在育种中加以利用,有助于耐低氮新品种的选育。而在 –N 条件下特异表达的QTL,属于诱导型 QTL,有利于在 –N 条件下提高玉米的氮效率,对于玉米适应低氮胁迫具有重要的意义。本研究在 –N 条件下定位到 4 个特异表达的氮高效 QTL,其中有 2 个是贡献率超过 10.00% 的主效QTL (qRNE9a 和 qGYP3a),对这 2 个 QTL 加以应用,有可能获得耐低氮胁迫的玉米新品种。
3.4 性状相关和 QTL 的“一因多效”
前人研究[35–37]表明,控制不同穗部性状的 QTL常被定位在相同或相近的染色体区域,在本研究中也发现了几个这样的染色体区域。如 +N 条件下,在Bin7.03 区域检测到控制穗粗和单株产量的 QTL,在临近的 Bin7.04 区域检测到控制穗长的 QTL,在Bin10.07 的 umc2021—bnlg1185 标记区间内同时检测到控制穗长、行粒数和单株产量的 QTL。–N 条件下,在 Bin6.02/6.04 区域的 umc1257—umc1796 标记区间定位到控制行粒数和单株产量的 QTL;在Bin7.03 和 Bin7.04 区域分别定位到控制穗粗和穗长的 QTL。而以上这些区域大都与前人定位的区域相近或相同,如谭巍巍等[38–39]在 Bin7.02/7.03 区域定位到控制穗行数、行粒数和单株产量的 QTL,在Bin6.02/6.04 区域定位到控制穗粗和单株产量的QTL;兰进好等[40]在 Bin10.07 区域检测到控制穗重和单株产量的 QTL。这种控制不同性状的 QTL 定位于同一染色体区域的现象,可能是基因的“一因多效”或是控制不同性状的基因之间的紧密连锁,而且这种控制不同性状的 QTL 在染色体上重叠的现象与穗部性状之间的高度相关性表现一致 (表 3)。研究中发现的这些 QTL 富集区域虽然与前人定位的区域高度一致,但是定位到的 QTL 所控制的性状却不尽相同,体现了穗部性状遗传基础的复杂性。今后对这些染色体区域进行更深入的探索,将有可能在穗部性状的遗传机制研究上获得突破。
4 结论
本研究利用许 178 × K12 衍生的 F7代 RILs 群体在供 N 和不供 N 条件下对玉米的穗长、穗粗、穗行数、行粒数和单株产量这 5 个穗部性状进行了 QTL分析,共检测到 20 个 QTL,分布在除第 2 染色体以外的其余染色体上。在不同氮水平下定位的 QTL 存在较大差异,只有 5 个位点同时在供氮和不供氮两种条件下被检测到,表明控制玉米穗部性状的基因在不同氮水平下作用方式发生了较大变化。5 个“一致性”QTL 和不供氮条件下发现的 2 个特异表达的、贡献率较大的主效 QTL,对于玉米适应低氮胁迫具有重要的意义。研究中发现的几个穗部性状的QTL 富集区,可能存在控制玉米穗部性状的关键基因,有必要进一步探索。
[1]张福锁, 王激清, 张卫峰, 等. 中国主要粮食作物肥料利用率现状与提高途径[J]. 土壤学报, 2008, 45(5): 915–924. Zhang F S, Wang J Q, Zhang W F, et al. Nutrient use efficiency of major cereal crops in China and measures for improvement[J]. ActaPedologica Sinica, 2008, 45(5): 915–924.
[2]Guo J H, Liu X J, Zhang Y, et al. Significant acidification in major Chinese croplands[J]. Science, 2010, 327(5968): 1008–1010.
[3]Liu X J, Zhang Y, Han W X, et al. Enhanced nitrogen deposition over China[J]. Nature, 2013, 494(7438): 459–462.
[4]陈范骏, 米国华, 崔振岭, 等. 玉米杂交种氮效率遗传相关与通径分析[J]. 玉米科学, 2002, 10(1): 10–14. Chen F J, Mi G H, Cui Z L, et al. Genetic correlation and path analysis of nitrogen use efficiency of maize hybrids[J]. Journal of Maize Sciences, 2002, 10(1): 10–14.
[5]Chen Z H, Carpena A L. Genetic variation of characters associated with low nitrogen tolerance in tropical maize[J]. Southwest China Journal of Agricultural Sciences, 2000, 13(1): 42–49.
[6]Agrama H A S, Zakaria A G, Said F B, et al. Identification of quantitative trait loci for nitrogen use efficiency in maize[J]. Molecular Breeding, 1999, 5(5): 187–195.
[7]Hirel B, Bertin P, Quilleré I, et al. Towards a better understanding of the genetic and physiological basis for nitrogen use efficiency in maize.[J]. Plant Physiology, 2001, 125(3): 1258–1270.
[8]Jansen C, Zhang Y, Liu H, et al. Genetic and agronomic assessment of cob traits in corn under low and normal nitrogen management conditions[J]. Theoretical and Applied Genetics, 2015, 128(7): 1231–1242.
[9]Veldboom L R, Lee M. Genetic mapping of quantitative trait loci in maize in stress and nonstress environments: I. grain yield and yield components[J]. Crop Science, 1996, 36(5): 1310–1319.
[10]Liu X H, Zheng Z P, Tan Z B, et al. Genetic analysis of two new quantitative trait loci for ear weight in maize inbred line Huangzao4[J]. Genetics & Molecular Research, 2010, 9(4): 2140–2147.
[11]Zheng Z P, Liu X H, Wu X, et al. Genetic loci mapping for ear axis weight using recombinant inbred line (RIL) population under different nitrogen regimes in maize[J]. African Journal of Biotechnology, 2011, 10(42): 8255–8259.
[12]Zhang H M, Zheng Z P, Liu X H, et al. QTL mapping for ear length and ear diameter under different nitrogen regimes in maize[J]. African Journal of Agricultural Research, 2010, 5(8): 626–630.
[13]Ribaut J M, Fracheboud Y, Monneveux P, et al. Quantitative trait loci for yield and correlated traits under high and low soil nitrogen conditions in tropical maize[J]. Molecular Breeding, 2007, 20(1): 15–29.
[14]Liu X H, Zheng Z P, Tan Z B, et al. Quantitative trait locus (QTL) mapping for 100-kernel weight of maize (Zea mays L.) under different nitrogen regimes[J]. African Journal of Biotechnology, 2010, 9(49): 8283–8289.
[15]Liu X H, He S L, Zheng Z P, et al. Identification of the QTLs for grain yield using RIL population under different nitrogen regimes in maize[J]. African Journal of Agricultural Research, 2010, 5(15): 2002–2007.
[16]Liu X H, He S L, Zheng Z P, et al. QTL identification for row number per ear and grain number per row in maize[J]. Maydica, 2010, 55(2): 127–133.
[17]刘宗华, 汤继华, 卫晓轶, 等. 氮胁迫和正常条件下玉米穗部性状的QTL分析[J]. 中国农业科学, 2007, 40(11): 2409–2417. Liu Z H, Tang J H, Wei X Y, et al. QTL mapping of ear traits under low and high nitrogen conditions in maize[J]. Scientia Agricultura Sinica, 2007, 40(11): 2409–2417.
[18]刘建超, 米国华, 陈范骏. 两种供氮水平下玉米穗部性状的QTL定位[J]. 玉米科学, 2011, 19(2): 17–20. Liu J C, Mi G H, Chen F J. QTL mapping of ear traits in maize grown under two nitrogen applications[J]. Journal of Maize Sciences, 2011, 19(2): 17–20.
[19]Liu X H, He S L, Zheng Z P, et al. Genetic loci mapping associated with maize kernel number per ear based on a recombinant inbred line population grown under different nitrogen regimes[J]. Genetics and Molecular Research 2011, 10(4): 3267–3274.
[20]Cai H, Chu Q, Gu R, et al. Identification of QTLs for plant height, ear height and grain yield in maize (Zea mays L.) in response to nitrogen and phosphorus supply[J]. Plant Breeding, 2012, 131(4): 502–510.
[21]Luo B, Tang H, Liu H, et al. Mining for low-nitrogen tolerance genes by integrating meta-analysis and large-scale gene expression data from maize[J]. Euphytica, 2015, 206(1): 117–131.
[22]任仰涛, 秦德斌, 刘建超, 等. 氮素对吐丝后不同保绿型玉米自交系生理生化特性的影响[J]. 西北农业学报, 2014, 23(5): 70–75. Ren Y T, Qin D B, Liu J C, et al. Effects of the nitrogen on physiological and biochemical characteristics in different stay-green maize inbred lines after silking[J]. Acta Agriculturae Borealioccidentalis Sinica, 2014, 23(5): 70–75.
[23]Nyquist W E, Baker R J. Estimation of heritability and prediction of selection response in plant populations[J]. Critical Reviews in Plant Sciences, 1991, 10(3): 235–322.
[24]Henderson C R. General flexibility of linear model techniques for sire evaluation[J]. Journal of Dairy Science, 1974, 57(8): 963–972.
[25]Maroof M A S, Biyashev R M, Yang G P, et al. Extraordinarily polymorphic microsatellite DNA in barley: species diversity, chromosomal locations, and population dynamics[J]. Proceedings of the National Academy of Sciences of the USA, 1994, 91(12): 5466–5470.
[26]Lander E S, Green P, Abrahanson J, et al. MAPMAKER: an interactive computer package for constructing primary genetic linkage maps of experimental and natural populations[J]. Genomics, 1987, 1(2): 174–181.
[27]Liu R H, Meng J L. MapDraw: a microsoft excel macro for drawing genetic linkage maps based on given genetic linkage data[J]. Hereditas, 2003, 25(3): 317–321.
[28]Li H H, Ye G Y, Wang J K. A modified algorithm for the improvement of composite interval mapping[J]. Genetics, 2007, 175(1): 361–374.
[29]王建康. 数量性状基因的完备区间作图方法[J]. 作物学报, 2009, 35(2): 239–245. Wang J K. Inclusive composite interval mapping of quantitative trait genes[J]. Acta Agronomica Sinica, 2009, 35(2): 239–245.
[30]王长成, 张占辉, 付忠军, 等. 氮肥对玉米高代重组近交系穗部性状的影响[J]. 河南农业大学学报, 2010, 44(1): 7–11. Wang C C, Zhang Z H, Fu Z J, et al. Effect of nitrogen fertilizer on ear traits of high-generation recombinant inbred lines in maize[J]. Journal of Henan Agricultural University, 2010, 44(1): 7–11.
[31]刘宗华, 王春丽, 汤继华, 等. 氮胁迫对不同玉米自交系若干农艺性状和产量的影响[J]. 河南农业大学学报, 2006, 40(6): 573–577. Liu Z H, Wang C L, Tang J H, et al. Effect of low nitrogen stress on several agronomy characters and grain yield of different maizeinbreds[J]. Journal of Henan Agricultural University, 2006, 40(6): 573–577.
[32]米国华, 陈范骏, 春亮, 等. 玉米氮高效品种的生物学特征[J]. 植物营养与肥料学报, 2007, 13(1): 155–159. Mi G H, Chen F J, Chun L, et al. Biological characteristics of nitrogen efficient maize genotypes[J]. Plant Nutrition and Fertilizer Science, 2007, 13(1): 155–159.
[33]Gallais A, Hirel B. An approach to the genetics of nitrogen use efficiency in maize[J]. Journal of Experimental Botany, 2004, 55(396): 295–306.
[34]Tuberosa R, Salvi S, Sanguineti M C, et al. Mapping QTLs regulating morpho-physiological traits and yield: case studies, shortcomings and perspectives in drought-stressed maize[J]. Annals of Botany, 2002, 89(7): 941–963.
[35]Li Y X, Wang Y, Shi Y S, et al. Correlation analysis and QTL mapping for traits of kernel structure and yield components in maize[J]. Scientia Agricultura Sinica, 2009, 42(2): 408–418.
[36]Yang C, Liu J, Rong T Z. Detection of quantitative trait loci for ear row number in F2populations of maize[J]. Genetics and Molecular Research, 2014, 14(4): 14229–14238.
[37]Peng B, Li Y, Wang Y, et al. QTL analysis for yield components and kernel-related traits in maize across multi-environments[J]. Theoretical and Applied Genetics, 2011, 122(7): 1305–1320.
[38]谭巍巍, 李永祥, 王阳, 等. 在干旱和正常水分条件下玉米穗部性状QTL分析[J]. 作物学报, 2011, 37(2): 235–248. Tan W W, Li Y X, Wang Y, et al. QTL mapping of ear traits of maize under different water regimes[J]. Acta Agronomica Sinica, 2011, 37(2): 235–248.
[39]谭巍巍, 王阳, 李永祥, 等. 不同环境下多个玉米穗部性状的QTL分析[J]. 中国农业科学, 2011, 44(2): 233–244. Tan W W, Wang Y, Li Y X, et al. QTL analysis of ear traits in maize across multiple environments[J]. Scientia Agricultura Sinica, 2011, 44(2): 233–244.
[40]兰进好, 宋希云, 谢传晓, 等. 玉米强优势组合7个主要穗部性状在3种环境下的QTL分析[J]. 农业生物技术学报, 2012, 20(7): 756–765. Lan J H, Song X Y, Xie C X, et al. QTL analysis of 7 main ear traits in 3 environments in an elite cross of maize(Zea mays L.)[J]. Journal of Agricultural Biotechnology, 2012, 20(7): 756–765.
QTL mapping of ear traits of maize with and without N input
HE Kun-hui, CHANG Li-guo, LI Ya-nan, QU Jian-zhou, CUI Ting-ting, XU Shu-tu, XUE Ji-quan*, LIU Jian-chao*
( Key Laboratory of Biology and Genetic Improvement of Maize in Arid Area of Northwest Region, Ministry of Agriculture/ College of Agronomy, Northwest A&F University, Yangling, Shaanxi 712100, China )
【Objectives】The difference of QTL mapping in ear traits of maize treated with and without nitrogen input is helpful to identify the major QTL specific expression, which will provide theoretical basis for maize nitrogen efficient molecular breeding.【Methods】The experimental materials used in a two-year’s field experiment were one hundred and fifty recombinant inbred lines (RILs, the F7generation), which were derived from the dominant maize inbred lines Xu178 (high nitrogen use efficiency) and K12 (low nitrogen use efficiency). In the field experiment, all the RILs were supplied with and without N, and the phenotypes were authenticated in five ear traits including ear length, ear diameter, row number per ear, kernel number per row and grain yield per plant in total. The breeding values of each trait under different nitrogen levels were estimated using the best linearunbiased prediction (BLUP) which based on mixed liner model (MLM) combining with the phenotype data in two years. Then the QTL analysis of the five traits with and without N supply was conducted utilizing the inclusive composite interval mapping method from the software of QTL IciMapping V4.0.【Results】The ear length, ear diameter and row number per ear were similar in both nitrogen levels, but the kernel number per row and grain yield per plant were dramatically declined without N input. Twenty QTLs for ear traits were detected in the experiment, eleven from treatment with N supply (2 for ear length, 1 for ear diameter, 2 for row number per ear, 1 for kernel number per row and 5 for grain yield per plant) and nine from treatment without N supply (1 for ear length, 1 for ear diameter, 2 for row number per ear, 1 for kernel number per row and 4 for grain yield per plant). These QTLs distributed on all the chromosomes except chromosome 2. Five “consistency QTLs” were detected in the experiment, they are qEL7a, qED7a, qRNE9b, qGYP1a, and qGYP6a respectively. These 5 QTLs had high phenotypic contribution rate, which contribute more than 10.00% under both the nitrogen supply conditions. Four specific expression QTLs were detected in treatment without N, they are qRNE9a, qKNR6a, qGYP3a and qGYP8a respectively, in which the phenotypic contribution of qRNE9a and qGYP3a was more than 10.00%, they were major QTLs. In both N supply treatments, the genes controlling different traits were closely linked or the same gene had phenomenon of pleiotropism, which was consistent with the high correlation of ear traits.【Conclusions】The specific expression of genes controlling ear traits will change greatly under different nitrogen supply levels, which will bring about difference in ear traits in maize. The expression of the five consistency major QTLs and two low-N major QTLs is beneficial to strengthen the resistance of maize to low nitrogen stress. These QTL enriched region may exist some key genes controlling ear traits in maize, which is worth of further research.
maize; ear traits; low nitrogen stress; QTL
2016–04–19接受日期:2016–05–27
国家自然科学基金(31301830);西北农林科技大学基本科研业务费专项资金(QN2012001);陕西省自然科学基础研究计划项目(2014JQ3108)资助。
何坤辉(1993—),男,陕西周至人,硕士研究生,主要从事玉米遗传改良研究。E-mail:HKH7811@163.com
* 通信作者 E-mail:xjq2934@163.com;ljcnwsuaf@nwsuaf.edu.cn

