蚕丝蛋白残留物提取与鉴定方法的改进研究
刘 峰, 龚德才
(中国科学技术大学 科技史与科技考古系文物保护科学基础研究中心,合肥 230026)
研究与技术
蚕丝蛋白残留物提取与鉴定方法的改进研究
刘 峰, 龚德才
(中国科学技术大学 科技史与科技考古系文物保护科学基础研究中心,合肥 230026)
考古遗址土壤中的古代丝绸残留物提取与蛋白质组学鉴定分析,可以为丝绸起源等考古学研究提供重要的信息。针对样品透析可能存在小分子蛋白残留物流失的问题,以六安战国荒帷丝绸样品为研究对象,通过改变透析膜的截留分子量(MWCO)来优化提取方法。应用尺寸排阻色谱(SEC)分析两种透析方法,得到蚕丝蛋白提取液的相对分子质量分布,并比较两种透析方法对蚕丝蛋白质谱鉴定结果的影响。SEC结果显示,LA2000样品中保留更多的相对分子质量较小的蛋白残留物。经过生物质谱分析和数据库比对后,LA14000样品中只检测到来自丝素蛋白重链亚基的4种不同的多肽片段,而LA2000样品中则检测到7种。说明改进后的方法可以显著提高古代蚕丝蛋白的提取效率,从而增强生物质谱鉴定方法的准确性和灵敏度。
蚕丝蛋白;残留物;透析;生物质谱;六安荒帷
丝绸的发明在中国辉煌灿烂的历史文化中有着举足轻重的地位,对促进世界文明的发展有着突出的贡献。研究分析古代丝绸残留物能够提供丰富的信息,对考古学研究尤其是蚕桑农业起源等问题具有十分重要的意义[1]。但是,丝绸的原料为蚕丝蛋白,在数千年的地下埋藏过程中很容易发生降解而难以保存下来。如何在丝绸蛋白降解严重的情况下鉴定丝绸存在的证据,成为研究早期丝绸的关键问题。在这种情况下,生物质谱技术为解决这一问题提供了可能。
目前,生物质谱技术鉴定蛋白已经成为蛋白质组学研究的一个重要组成部分。在古蛋白残留物的研究方面,虽然生物质谱技术尚属于新兴技术,但已经得到了一些有价值的科研成果,例如,Solazzo等[2]利用肽质量指纹图谱(peptide mass fingerprinting)对铜器表面矿化纺织品残留物的鉴定分析,证明了这一方法在蛋白质类纺织品材质鉴定中的可靠性;Nirmala等[3]利用生物质谱技术鉴定了茧丝中的数条相对分子质量较小的蛋白质,表明这一方法也适用于蚕丝蛋白的相关研究。但对古代蚕丝蛋白残留物的生物质谱鉴定分析研究,目前比较匮乏,仍然处于方法的探索和优化阶段。
李力[1]在博士论文《贾湖遗址墓葬土壤中蚕丝蛋白残留物的鉴定与分析》中建立了一套基于生物质谱检测和生物信息学分析的蚕丝蛋白残留物提取与鉴定基本实验流程,并通过这一方法成功从贾湖先民遗骸下腹部土壤中鉴定出了多条蚕丝丝素蛋白重链残基。但该方法中使用的是截留分子量(MWCO)为14000的透析膜,实验过程中可能会丢失大量的重要信息,而这也导致了其实验结果遭受质疑。本研究以此为基础,以六安战国荒帷丝绸残片样品为研究对象,在不改变该方法的其他条件的前提下,将提取过程中使用的透析膜换为截留分子量较小的透析膜。即将原方法中的MWCO14000换为MWCO2000,通过改变透析膜的MWCO对提取方法的透析脱盐环节进行改进优化。采用尺寸排阻色谱(SEC)分析两种透析方法,得到古代蚕丝蛋白的相对分子质量分布,直观地评价优化效果。并分别将改进前后的提取方法得到的蚕丝蛋白提取液进行生物质谱分析,从数据库的比对结果来评价改进效果。
1 实 验
1.1 材料与仪器
六安荒帷丝绸残片样品(样品编号LA),取自安徽省六安市白鹭洲战国M585墓葬出土荒帷,该墓葬属于战国时期墓葬(公元前475—前221)[4]。六安战国荒帷样品及扫描电镜图如图1所示。

图1 六安战国荒帷样品及扫描电镜图Fig.1 Sample of the silk pall from the Warring States Period in Lu’an city and its SEM picture
试剂:碳酸钠、氯化钙、无水乙醇、磷酸二氢钠、磷酸二氢钾、叠氮化钠等均为分析纯(上海国药集团);尺寸排阻色谱标准品采用一系列单分散聚苯乙烯磺酸钠盐,相对分子质量分别为4300、6800、17000、32000、77000,纯度为色谱纯(Sigma-Aldric公司);质谱分析中使用洗脱溶液为色谱纯级甲醇及甲酸溶液(Sigma-Aldric公司)。
钙醇溶液:氯化钙、乙醇、水按摩尔比1︰2︰8配制而成[5],用于溶解蚕丝蛋白。
主要仪器:真空浓缩仪(Concentrator Plus,德国Eppendorf公司),透析袋(截留分子量2000和14000),Amicon-Ultra-15超滤管、LTQ-Qrbitrap XL质谱仪(美国热电)。
尺寸排阻色谱仪系统包含以下几个部分:高效液相色谱泵(LC-20AT,岛津),柱温箱(CTO-20A,岛津),紫外检测器(SPD-20A,岛津),三根色谱柱(PROTEIN KW-803,shodex)串联使用。
1.2 方 法
1.2.1 尺寸排阻色谱
1.2.1.1 流动相
磷酸二氢钠(80.8 g)、磷酸二氢钾(35.2 g)和叠氮化钠(4.0 g)溶于500 mL超纯水中,作为储备液。取50 mL储备液稀释至2 000 mL作为尺寸排阻色谱流动相。
1.2.1.2 色谱条件
进样量20 μL,柱温35 ℃,流动相流速1 mL/min,检测波长210 nm。
1.2.1.3 标准溶液的检测
分别称取一系列单分散聚苯乙烯磺酸钠盐标准品0.003~0.004 g,溶于5 mL流动相溶液中[6]。将标样进样检测制作校正曲线。
1.2.2 不同截留分子量透析袋透析效果比较
分别称取两份六安荒帷丝绸残片样品各1 mg(分别编号LA2000和LA14000),用去离子水清洗,去除表面污染物,低温烘干。将清洗后的样品加入预先配置好的0.5%Na2CO3水溶液中(水浴比1︰100),95 ℃水浴脱胶30 min,重复一次后,用去离子水清洗,低温烘干。
烘干后取相同质量的丝绸残片分别放入2 mL预先配好的钙醇溶液中,95 ℃加热至完全溶解。将LA2000溶液使用截留分子量2000的透析袋透析24 h(每4 h更换一次去离子水)。将LA14000溶液使用截留分子量14000的透析袋透析24 h(每4 h更换一次去离子水)。
将透析后的LA2000和LA14000溶液用45 μm纤维素微孔滤膜过滤,浓缩至100 μL,取50 μL进行尺寸排阻色谱检测。
1.2.3 生物质谱检测结果比较
分别取蛋白提取液50 μL,加入1 μg胰凝乳蛋白酶,25 ℃恒温过夜(16~20 h)。在10 000 r/min下离心10 min,取上清液。
分别取10 μL上清液注入毛细管柱中,以600 nL/min的速度进行梯度洗脱分离(洗脱溶液A为添加有0.1%甲酸的纯水溶液,溶液B为色谱纯级甲醇)。分离使用二氧化硅C18反向层析毛细管柱。梯度洗脱分离后样品进入质谱仪,使用正离子模式,离子阱分辨率为60 000。每次扫描取强度最高的5个母离子进行二级质谱检测,每隔90 s会将之前扫描过的高强度离子进行动态淘汰。为了消除样品间可能存在的残留污染,每次实验前均添加空白对照。
使用Proteome Discoverer 1.2 (ThermoFisher Scientific)软件分析获得的数据。软件选取SEQUEST算法对各数据进行数据库比对。所使用的数据库来自National Center for Biotechnology Information(NCBI),为B.mori.fasta 和fibroin.fasta (B.mori.fasta:发布日期01/10/2012;fibroin.fasta:发布日期01/10/2012)。对于每一个多肽的母离子其绝对质量误差应<3×10-6,对应的二级碎片离子的质量误差应<0.8 Da。除特殊情况,所有被认同的SEQUEST输出结果其Δscore均应≥0.1。
将检测结果上传至NCBI进行BLAST(basic local alignment search tool)检索以确认其来源。
2 结果与分析
2.1 不同截留分子量透析袋透析效果比较
对LA2000和LA14000样品采用相同的实验条件进行SEC检测,得到如图2所示的检测结果。

图2 六安荒帷丝绸样品蚕丝蛋白SEC检测结果Fig.2 SEC detection result of fibroin fromLu’an silk pall samples
根据SEC校正曲线对两个古代样品的检测结果进行平均相对分子质量计算,得到结果如表1所示。
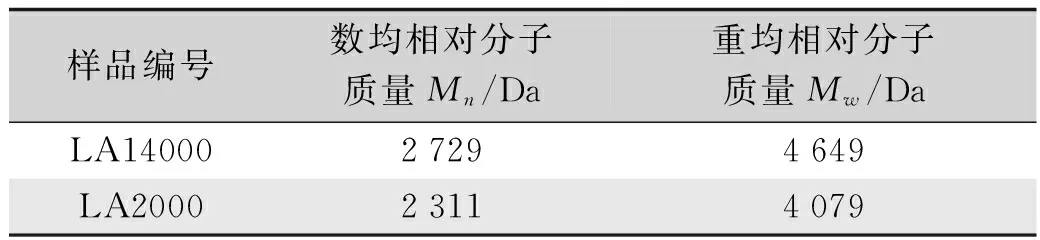
表1 LA样品的蚕丝蛋白相对分子质量Tab.1 Relative molecular weight of fibroin fromLA silk pall samples
尺寸排阻色谱的原理是根据不同相对分子质量的保留时间不同而进行相对分子质量的测定,相对分子质量大的大分子较快通过凝胶色谱柱进入检测器当中,保留时间较短,同理相对分子质量越小的分子则保留时间越长。如图2所示,分别采用截留分子量2000和截留分子量14000的透析膜透析的相同样品,经过24 h透析后,LA2000与LA14000相比,在保留时间30 min之前的相对分子质量较大的区域内的含量基本相同,而在30 min之后的小分子区域的含量,LA2000样品则明显多于LA14000样品。这说明溶解得到的六安荒帷丝绸蚕丝蛋白提取液中一部分蛋白分子已经降解至相对分子质量14000之下,所以采用截留分子量较小的透析袋透析可以获得更多的小分子蛋白残留物。从表1的结果同样可以说明这一结论,由于LA2000样品中包含更多的相对分子质量较小的蛋白分子,所以拉低了LA2000样品的平均相对分子质量,使得LA2000样品的数均相对分子质量和重均相对分子质量皆小于LA14000样品。
透析袋的截留分子量的选择对于最后提取到的残留物蛋白含量的影响是非常明显的。古代文物样品经历了上千年的地下埋藏,受到各种环境因素影响而降解严重,蚕丝蛋白经过降解相对分子质量严重下降。所以在透析脱盐过程中如果采用截留分子量较大的透析袋,则会使得溶液中的小分子蛋白透析出去而大量流失,这部分蛋白信息的流失则会严重影响最后的生物质谱检测结果。所以,经过对比研究发现,对于降解严重的古代丝绸样品(如六安荒帷丝绸残片样品),大部分的蚕丝蛋白已经降解至相对分子质量14000以下。对于此类样品的提取,采用截留分子量2000的透析袋可以大幅度提高提取效率。
2.2 六安荒帷丝绸残片样品生物质谱检测结果比较
六安荒帷样品为丝绸残片,虽然保留了一定的蚕丝纤维形态,但保存状况较差,丝绸纤维的强度很低,稍微触碰便会掉粉掉渣。在脱胶过程中残片也极为脆弱,很容易破碎变为粉末状,所以过程中应注意对样品的回收。由此可以看出,六安战国荒帷丝绸样品中的古代蚕丝蛋白已经严重老化降解[7-8]。表2和表3分别为LA14000和LA2000的生物质谱检测结果。

表2 样品LA14000生物质谱检测结果Tab.2 Biomass spectrometry result of LA14000 sample

表3 样品LA2000生物质谱检测结果Tab.3 Biomass spectrometry result of LA2000 sample
根据表2的结果可以看出,在LA14000样品中共检测到4种不同的多肽片段,均属于丝素蛋白重链亚基。而根据表3的结果判断,在LA2000样品中共检测到7种不同的多肽片段,也全部来自丝素蛋白重链亚基。通过比较可以发现,采用优化后的方法可以检测到更多的多肽片段,得到更丰富的蚕丝蛋白残留物信息。
在本次实验中,LA2000样品共检测出7种多肽片段,较LA14000样品多出3种,即GAGAGVGY、GAGAGSGAASGAGAGAGAGTGSSGFGPY和EYAWSSDF。将这三条肽段数据上传至NCBI,使用BLAST检索对其可能来源进行验证,结果如表4所示。

表4 肽段BLAST检索结果Tab.4 Blast search result of the peptides
检测结果表明,额外检出的三种多肽片段中,除GAGAGVGY外,另外两种均单一来源于蚕丝丝素蛋白重链亚基。作为对比,在最初检测出的四条多肽片段中,仅有GAGAGSGAASGAGAGAGAGAGTGSSGFGPY这一种多肽片段单一来源于丝素蛋白重链亚基,其余三种均存在多种来源,需进行进一步排除分析才能确定检测结果。对于古代丝绸文物样品,尤其是保存状况差、降解严重的古代丝绸残留物样品的生物质谱鉴定,往往由于提取方法的问题而严重影响最后的检测结果。目前在蛋白质组学分析中,一般认为,通过质谱检测的结果中出现两条或两条以上的多肽来自同一个蛋白时,即可认为样品中含有此蛋白[9]。本实验中使用改进方法额外检测出的三种多肽片段,尤其是两种单一来源的多肽片段,大大提高了检测结果的可信度。同时这也表明,实验中改进原始方法对于丝绸蛋白残留物的鉴定研究具有很大的帮助,可以使结论更准确更具有说服力。
在丝绸的地下埋藏过程当中,包裹丝素的可溶性丝胶蛋白首先溶失或降解,使丝素蛋白暴露在环境当中。丝素蛋白中存在着结晶区和非结晶区,结晶区肽链排列紧密,非结晶区肽链较为松散。在各种环境因素下,非结晶区首先发生降解,结晶区之间连接减少,使得丝素蛋白肽链断裂,相对分子质量下降[10]。游离的结晶区继续降解,使得丝素蛋白残留物的相对分子质量继续下降,甚至降解至14000以下。所以,如果选用截留分子量较大的透析膜进行透析,则会使得大量小分子多肽流失,从而影响生物质谱鉴定结果。
3 结 论
本研究改进透析袋的截留分子量来优化古代蚕丝蛋白残留物的提取方法,以六安荒帷丝绸残片样品为实验对象,以求达到提高提取效率的目的。采用SEC法研究不同截留分子量透析袋透析后溶液的相对分子质量分布,检测结果显示采用MWCO2000比MWCO14000透析后得到的蛋白平均相对分子质量更小。从SEC谱图中也可以明显地看出,在小分子区域LA2000样品的峰高明显高于LA14000样品,说明保留了更多小分子蛋白产物。对提取得到的蚕丝蛋白提取液进行特异性酶切和生物质谱检测,结果显示,采用优化前后的提取方法提取到的样品中分别检测到4条和7条特征多肽片段。同时,对特征多肽的BLAST检索结果表明,改进后的实验结果与原结果相比可信度有了很大的提高。这一结果表明优化后的提取方法可以提取到更多的蚕丝蛋白残留物信息,对古代蚕丝蛋白残留物的鉴定具有十分重要的价值和意义。
总之,通过对蚕丝蛋白生物质谱鉴定技术中蛋白质提取环节的优化,可以显著增强鉴定技术的灵敏度和准确性,使得这项技术更加适用于降解非常严重的古代残留物样品,为考古发掘样品丝绸残留物的鉴定研究奠定基础。
[1]李力.贾湖遗址墓葬土壤中蚕丝蛋白残留物的鉴定与分析[D].合肥:中国科学技术大学,2015:1-2. LI Li. The Identification and Analysis of the Silk Residues in the Tomb Soils from Jiahu Site[D]. Hefei: University of Science and Technology of China,2015:1-2.
[2]SOLAZZO C, ROGERS P W, WEBER L, et al. Species identification by peptide mass fingerprinting (PMF) in fibre products preserved by association with copper-alloy artefacts[J]. Journal of Archaeological Science,2014,49:524-535.
[3]NIRMALA X, MITA K, VANISREEV, et al. Identification of four small molecular mass proteins in the silk of Bombyx mori[J]. Insect Molecular Biology,2001,10(5):437-445.
[4]秦让平.安徽六安市白鹭洲战国墓M585的发掘[J].考古,2012(11):4. QING Rangping. The excavation of Grave M585, Bailuzhou cemetery, Lu’an city, Anhui province[J]. Archaeology,2012(11):4.
[5]AJISAWA A. Dissolution of silk fibroin with calciumchloride/ethanol aqueous solution[J]. Journal of Sericultural Science of Japan,1998,67(2):91-94.
[6]姜莹,周雅婷.明胶分子量与黏度的关系[J].明胶科学与技术,2010,30(3):132-135. JIANG Ying, ZHOU Yating. Relationship between molecular weight and viscosity of gelatin[J]. The Science and Technology of Gelatin,2010,30(3):132-135.
[7]GONG D, YANG H. The discovery of free radicals in ancient silk textiles[J]. Polymer Degradation and Stability,2013,98(9):1780-1783.
[8]ZHANG X, YUAN S. Measuring quantitatively the deterioration degree of ancient silk textiles by viscometry[J]. Chinese Journal of Chemistry,2010,28(4):656-662.
[9]DE SOUZA G A, DE GODOY L M F, MANN M. Identification of 491 proteins in the tear fluid proteome reveals a large number of proteases and protease inhibitors[J]. Genome Biology,2006,7(8):R72.
[10]LI L, GONG Y, YIN H, et al. Different types of peptide detected by mass spectrometry among fresh silk and archaeological silk remains for distinguishing modern contamination[J]. Plos One,2015,10(7):e0132827.
Improvement research of methods to extract and determine for fibroin residues
LIU Feng, GONG Decai
(Basic Research Center of Heritage Conservation Science, Department of Scientific and Technical History and Archaeology,
University of Science and Technology of China, Hefei 230026, China)
The extraction and proteomics identification of the ancient fibroin residues in the soil of archaeological site can provide important information for the archaeological study on the origin of silk. Since sample dialysis may has the problem of small molecular protein residue loss, a silk pall sample from the Warring States Period in Lu’an City was applied as research subjects to improve the extraction methods by changing the molecular weight cut off (MWCO) of membranes. Size exclusion chromatography (SEC) was used to analyze the molecular weight distribution of silk protein extracts obtained from two dialysis methods, and the effect of the two dialysis methods on the identification results of silk protein was compared by biomass spectrometry analysis. SEC results show that LA2000 samples retain more protein residues with small molecular weight. After the analysis of biomass spectrometry and database search, only 4 kinds of polypeptide fragments from silk fibroin heavy chain are detected in LA14000 samples, and 7 kinds of polypeptide fragments are detected in LA2000 samples. This indicates that the improved method can significantly improve the extraction efficiency of the ancient silk protein, thus enhancing the accuracy and sensitivity of the biomass spectrometry identification method.
silk fibroin; residues; dialysis; bio-mass spectrometry; silk pall in Lu’an
10.3969/j.issn.1001-7003.2017.02.001
2016-03-17;
2016-12-09
国家文物局文化遗产保护领域科学和技术研究项目(2013-YB-HT-029)
刘峰(1990-),男,硕士研究生,研究方向为古代残留物分析研究。通信作者:龚德才,教授,gdclucky@ustc.edu.cn。
TS195.644
A
1001-7003(2017)02-0001-05 引用页码: 021101

