乙酸异戊酯+异戊醇和乙酸异戊酯+正己醇体系汽液平衡
周峰,陈长旭,许春建
(化学工程联合国家重点实验室,天津大学化工学院,天津 300072)
乙酸异戊酯+异戊醇和乙酸异戊酯+正己醇体系汽液平衡
周峰,陈长旭,许春建
(化学工程联合国家重点实验室,天津大学化工学院,天津 300072)
在50.00和101.33 kPa下,采用改进的Rose汽液平衡釜测量乙酸异戊酯+异戊醇和乙酸异戊酯+正己醇体系的汽液平衡数据。乙酸异戊酯+异戊醇在50.00 kPa下形成最低共沸物。使用Herington法对汽液平衡数据进行热力学一次性检验,结果表明测得的汽液平衡数据符合热力学一致性。对实验数据使用NRTL、Wilson和UNIQUAC活度系数模型进行关联,回归获得相应的二元交互参数,模型计算的温度和组成与实验值相比均方差小于0.20 K和0.0050,表明3种模型的拟合结果与实验数据吻合较好。通过Wilson模型预测乙酸异戊酯+异戊醇体系在98.4 kPa时共沸点消失。为化工数据库增添了内容,为乙酸异戊酯体系的工程设计和进一步深入研究奠定了基础。
汽液平衡;乙酸异戊酯;异戊醇;正己醇;热力学模型
引 言
乙酸异戊酯,俗称香蕉水,具有特殊水果香味,作为香精、添加剂等广泛应用于食品、制药、纺织等领域。乙酸异戊酯可以作为药物、铁、镍等生产中的萃取剂,也可作为涂料、颜料生产中的溶剂。目前乙酸异戊酯主要通过乙酸和异戊醇在强酸或对甲基苯磺酸的催化下酯化反应获得[1]。产品脱水后的主要杂质是异戊醇,以及少量的正己醇。工业生产中为了获得高纯度的乙酸异戊酯,需采用精馏的方法将异戊醇和正己醇从产物中分离。为了实现精馏过程的设计、模拟和优化,需要乙酸异戊酯+异戊醇和乙酸异戊酯+正己醇体系的等压汽液平衡数据。Krokhin[2]报道乙酸异戊酯+异戊醇在常压下存在共沸组成(T=403.15 K,x=0.93),Emilio[3]报道乙酸异戊酯+异戊醇在常压下不存在共沸组成,二者数据相差较大。此外,关于乙酸异戊酯+异戊醇在低压下的汽液平衡数据以及乙酸异戊酯+正己醇体系的汽液平衡数据尚未见报道。本文通过实验分别测定了乙酸异戊酯+异戊醇和乙酸异戊酯+正己醇体系在50.00、101.33 kPa下的汽液平衡数据,并使用Herington法[4]对数据进行热力学一致性检验。此外,分别用NRTL[5]、Wilson[6]、UNIQUAC[7]活度系数模型对数据进行关联,回归获得二元交互参数。以期为精馏分离的设计优化提供必要的汽液平衡数据,为化工数据库增添内容。
1 实验部分
1.1 实验试剂
乙酸异戊酯、异戊醇、正己醇皆购自上海阿拉丁生化科技股份有限公司,试剂纯度为分析纯。通过安捷伦GC7890气相色谱(TCD热导池检测器)对实验试剂纯度进行分析,为了验证实验试剂纯度,使用阿贝折光仪测量试剂在298.15 K下的折射率,同时使用汽液平衡釜测定试剂在常压下的沸点,并与文献值进行比较,测量结果见表1,从表1结果可知所用试剂的折射率及沸点与文献值十分接近,试剂纯度达到要求。

表1 实验试剂Table 1 Materials description
1.2 实验装置和实验步骤
本实验使用如图1所示的改进的Rose汽液平衡釜测量汽液平衡数据;使用100~150、150~200℃精密温度计,最小刻度0.1℃;U形水银压差计。汽液平衡釜含有一个沸腾室和冷凝室,底部含有一加热棒提供热量。开启加热后,汽液两相连续循环以达到汽液平衡。当系统温度和压力维持1 h以上不变时,可认为系统达到汽液平衡。使用微量进样器从汽相和液相样品池中取样,为了将取样对平衡状态的影响降到最低,每一个样品的体积控制在2 μl左右。
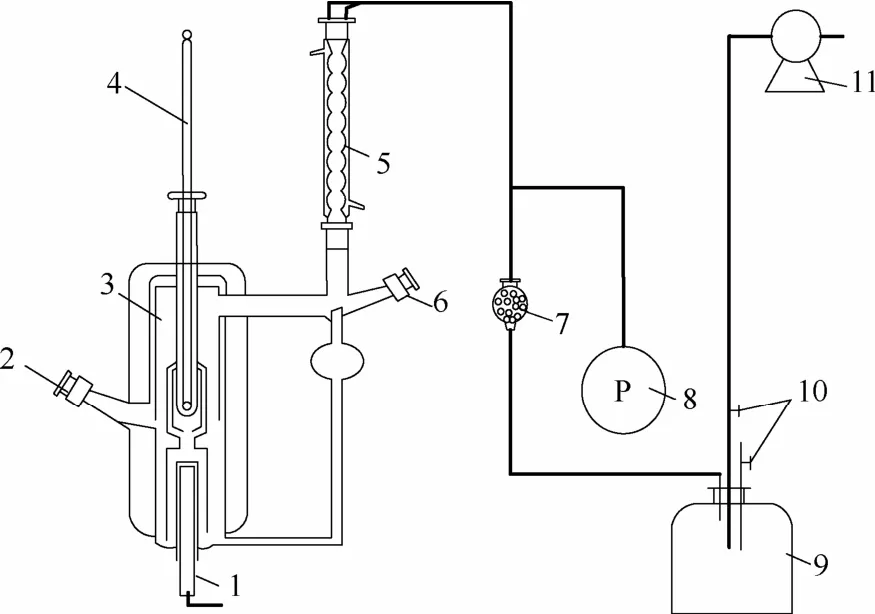
图1 汽液平衡实验装置Fig.1 Schematic diagram of VLE apparatus
1.3 实验分析
使用安捷伦GC-7890气相色谱对样品进行分析,色谱采用安捷伦公司生产的DB-WAX毛细管柱(30 m×250 μm×0.25 μm)。载气为氢气,气速30 ml·min-1。色谱分析条件为:柱箱373.15 K,汽化室523.15 K,检测器523.15 K。程序升温为初始温度373.15 K,之后以10 K·min-1升温至473.15 K。
2 实验结果与讨论
2.1 实验装置可靠性检验
为了检验装置的可靠性,测量了40 kPa下苯+氯苯体系的汽液平衡数据。将实验值与文献值[12]进行对比,如图2所示,实验值与文献值吻合良好,证明实验装置和实验方法是可靠的。

图2 40 kPa压力下苯+氯苯y1-x1图Fig.2y1-x1diagram of benzene (1) + chlorobenzene (2) system at 101.33 kPa
2.2 汽液平衡数据
实验测得的50.00、101.33 kPa压力下乙酸异戊酯+异戊醇和乙酸异戊酯+正己醇体系的汽液平衡数据及计算所得的各组分的活度系数见表2、表3。乙酸异戊酯+异戊醇二元体系在50.00 kPa下形成最低共沸物,在101.33 kPa下无共沸现象。共沸组成可以通过计算方程(x1-y1)=f(x1)中x1的值获得[13]。50.00 kPa压力下乙酸异戊酯+异戊醇体系共沸组成为0.1967(乙酸异戊酯摩尔分数),温度为384.33 K。

表2 乙酸异戊酯+异戊醇汽液平衡数据Table 2 Experimental vapor-liquid equilibrium data for binary system isoamyl acetate(1) + isoamyl alcohol(2) at 50.00 kPa and 101.33 kPa
在平衡体系当中,汽液两相的组成关系可表示为[14]

式中,p为系统压力;为组分i在汽相混合物中的逸度系数;yi为组分i在汽相中的摩尔分数;为平衡温度T下纯物质i的饱和蒸气压;为纯组分i在相平衡温度T下,饱和蒸气压下的逸度系数;γi为组分i的活度系数;xi为组分i在液相中的摩尔分数;为组分i的液相摩尔体积;R是摩尔通用气体常数。

、由SRK方程计算获得,由Antoine方程计算得到,各组分的Antoine参数见表4。
2.3 热力学一致性检验
采用Gibbs-Duhem方程的活度形式来检验汽液平衡数据可靠性的方法称为热力学一致性检验。对于二元等压体系,Gibbs-Duhem方程的积分形式为[16]

由于式(3)右边的积分结果不易获得,常使用Herington的半经验方法对二元体系汽液平衡数据进行热力学一致性检验。Herington法可表示为[17]

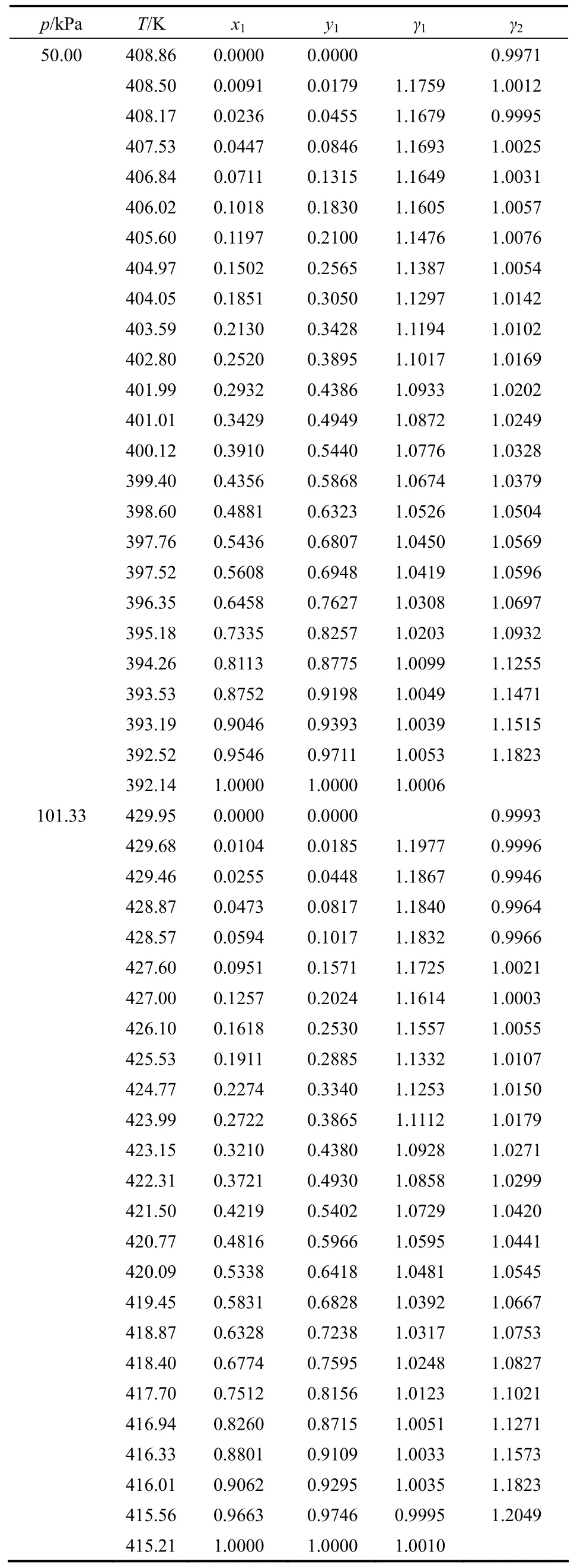
表3 乙酸异戊酯(1)+正己醇(2)汽液平衡数据Table 3 Experimental vapor-liquid equilibrium data for binary system isoamyl acetate(1) +n-hexanol (2) at 50.00 kPa and 101.33 kPa
Tmax和Tmin分别为体系的最高温度和最低温度。根据汽液平衡数据的活度系数作ln(γ1/γ2)-x1曲线,如图3、图4所示。S+为 ln(γ1/γ2)-x1曲线x轴上方的面积,S-为曲线x轴下方的面积。当D-J的值小于10时,则认为该组汽液平衡数据通过热力学一致性检验。汽液平衡数据的D、J及D-J值见表5,从表5可以看出各组数据D-J值都小于10,说明实验测得的各组汽液平衡数据都符合热力学一致性。
2.4 实验数据关联
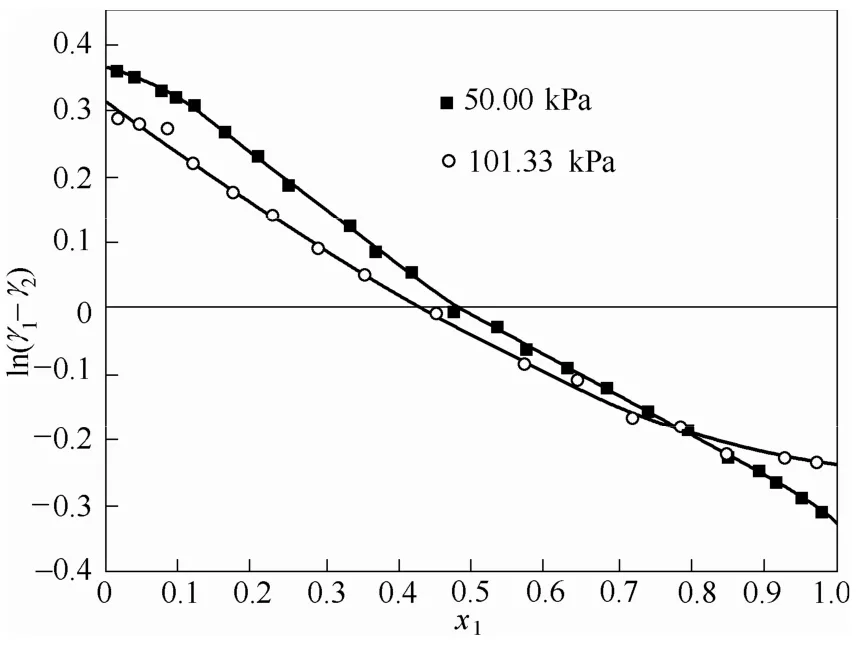
图3 乙酸异戊酯(1)+异戊醇(2)体系ln(γ1/γ2)-x1图Fig.3 Plot of ln(γ1/γ2)-x1for isoamyl acetate (1) + isoamyl alcohol (2)
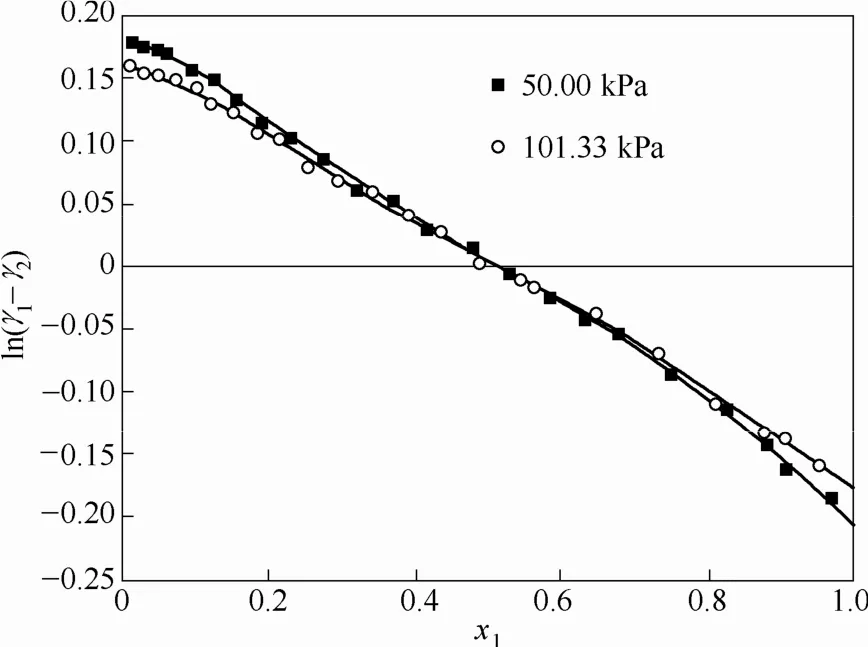
图4 乙酸异戊酯(1)+正己醇(2)体系ln(γ1/γ2)-x1图Fig.4 Plot of ln(γ1/γ2)-x1for isoamyl acetate (1) +n-hexanol (2)
使用NRTL[5]、Wilson[6]和UNIQUAC[7]3种热力学模型,应用matlab2014数学软件对实验数据进行关联回归。对实验数据进行回归时,同一体系不同压力的数据一并回归。通过3种模型回归二元汽液平衡数据,使下列目标函数OF值最小
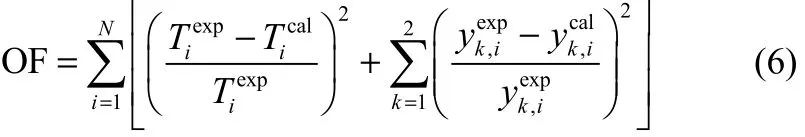
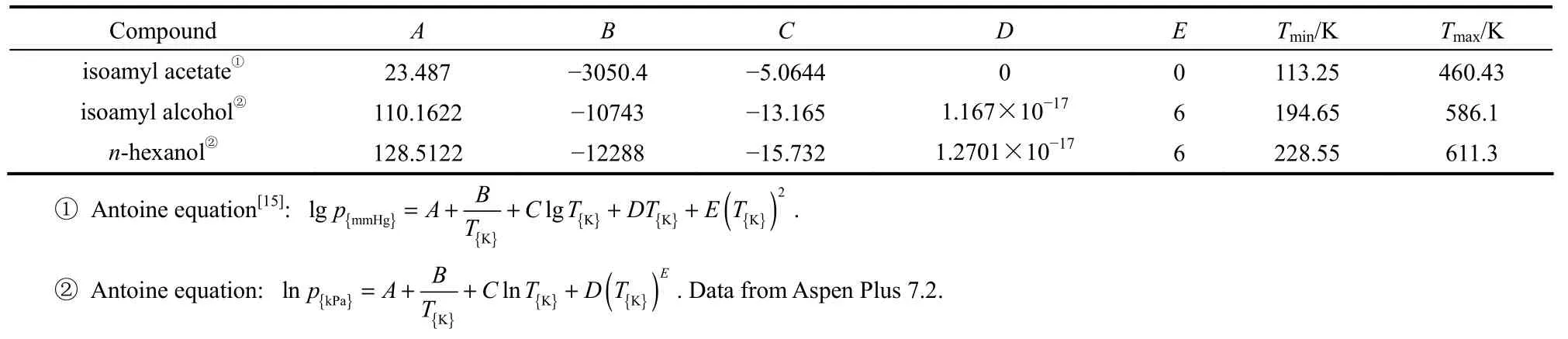
表4 Antoine方程参数Table 4 Antoine constants of components

表5 Herington法热力学一致性检验计算结果Table 5 Thermodynamic consistency check results of Herington method
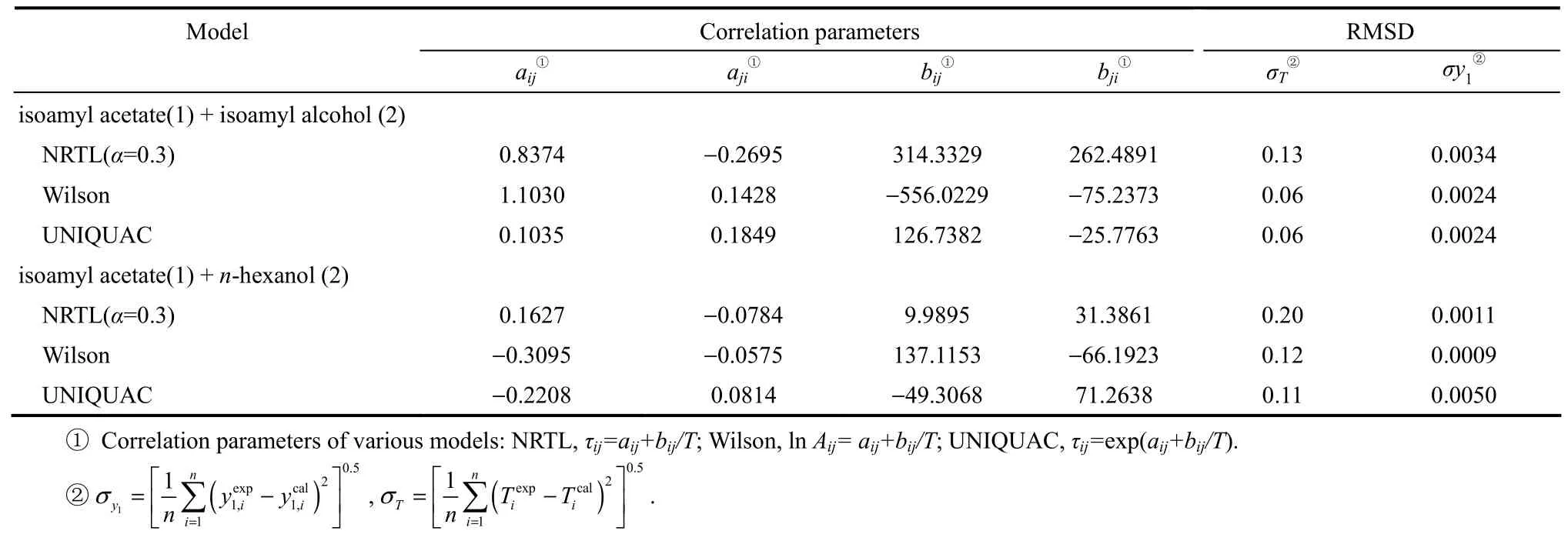
表6 体系二元交互参数与均方差Table 6 Correlation parameters and root-mean-square deviations (RMSD) for systems
式中,N为实验数据点;分别为实验平衡温度和计算温度;分别为实验气相摩尔分数和计算气相摩尔分数。关联汽液平衡数据获得的NRTL、Wilson和UNIQUAC模型的二元交互参数及均方差见表6。使用二元交互参数推算各体系的汽液平衡数据,并将计算值与实验数据进行比较,结果如图5~图8所示。
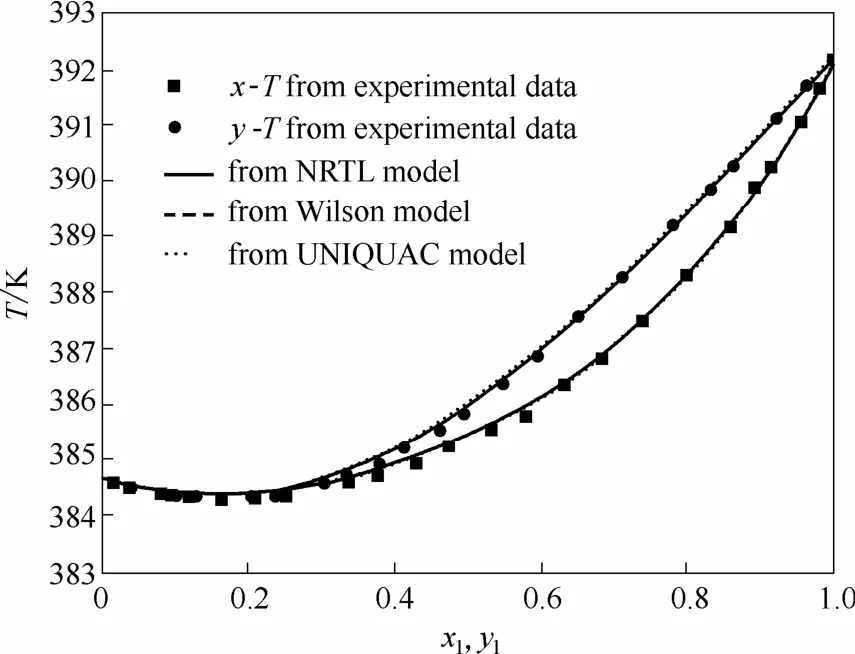
图5 50.00 kPa压力下乙酸异戊酯(1)+异戊醇(2)体系T-xy图Fig. 5 Temperature-composition diagram for isoamyl acetate(1) + isoamyl alcohol(2) at 50.00 kPa
从图5~图8可以看出,根据NRTL、Wilson和UNIQUAC模型计算的数据与实验测得的数据相比相差很小。平衡温度T、汽相组成y的最大均方差分别为0.20 K和0.0050。由Wilson模型和UNIQUAC模型推算的T-xy图几乎重叠。从工业应用角度,NRTL、Wilson和UNIQUAC 3个活度系数模型都可用于计算这两个体系的汽液平衡。乙酸异戊酯+异戊醇体系在50.00 kPa压力下存在共沸现象,而在常压下无共沸现象,使用Wilson模型计算该体系在不同压力下的汽液平衡,可获得压力为98.4 kPa时共沸点消失。
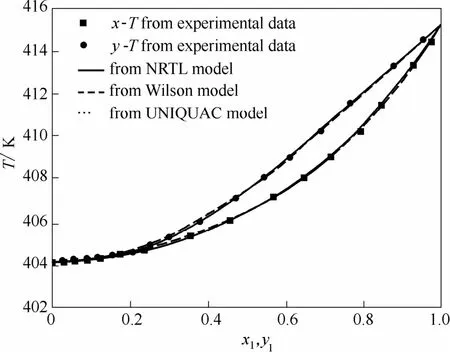
图6 101.33 kPa压力下乙酸异戊酯(1)+异戊醇(2)体系T-xy图Fig. 6 Temperature-composition diagram for isoamyl acetate(1) + isoamyl alcohol(2) at 101.33 kPa

图7 50.00 kPa压力下乙酸异戊酯(1)+正己醇(2)体系T-xy图Fig. 7 Temperature-composition diagram for isoamyl acetate(1) +n-hexanol (2) at 50.00 kPa
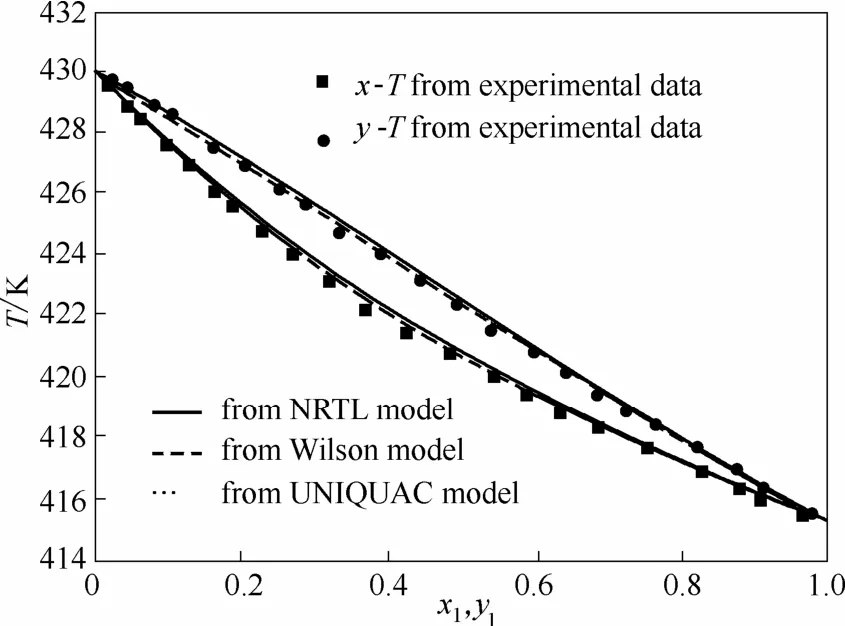
图8 101.33 kPa压力下乙酸异戊酯(1)+正己醇(2)体系T-xy图Fig. 8 Temperature-composition diagram for isoamyl acetate(1) +n-hexanol (2) at 101.33 kPa
3 结 论
实验分别测定了乙酸异戊酯+异戊醇和乙酸异戊酯+正己醇体系在50.00 kPa和101.33 kPa下的汽液平衡数据。乙酸异戊酯+异戊醇在50.00 kPa压力下形成最低共沸物,在101.33 kPa压力下并未出现共沸现象,通过Wilson模型计算乙酸异戊酯+异戊醇体系在98.4 kPa压力时共沸消失。使用Herington法对实验数据进行热力学一致性检验,结果4组数据都符合热力学一致性。使用NRTL、Wilson和UNIQUAC活度系数模型对实验数据进行关联回归,获得相应二元交互参数。结果表明实验数据与计算值相吻合,回归获得相互作用参数能够用于乙酸异戊酯+异戊醇和乙酸异戊酯+正己醇体系的分离设计与优化。通过对测得的汽液平衡数据进行分析,乙酸异戊酯+异戊醇体系在普通精馏的条件下难以实现分离,需要使用特殊精馏的方法。本文测得的汽液平衡数据对精馏分离的设计优化和实际生产提供了依据。
符 号 说 明
A,B,C,D,E,F——Antoine常数
aij,bij——二元交互参数
HE——混合热
N——实验数据点数
p——系统压力,kPa
——平衡温度T下纯物质i的饱和蒸气压
R——摩尔通用气体常数
Tmax——体系最高温度
Tmin——体系最低温度
——组分i的液相摩尔体积
xi——组分i在液相中的摩尔分数
yi——组分i在汽相中的摩尔分数
α——NRTL模型非随机参数
γi——组分i的活度系数
σT——温度的平均方差
σy——汽相组成的平均方差
——纯组分i在相平衡温度T、饱和蒸气压下的逸度系数
上角标
cal——计算值
exp ——实验值
下角标
1,2,i,j——组分
[1] LIU X G, YIN Y B, SHI M C. Esterification of acetic acid with isoamyl alcohol over expandable graphite catalyst [J]. Chem. World, 1994, 35: 350-351.
[2] KROKHIN N G. Equiibrium liquid-vapor ratios in the system acetic acid-isoamyl alcohol-isoamyl acetate (Ⅱ): Binary systems acetic acidisoamyl acetate and isoamyl alcohol-isoamyl acetate [J]. Zh. Fiz. Khim., 1967, 41: 1509-1511.
[3] EMILIO A. Isobaric vapor-liquid equilibrium for binary mixtures of 3-methyl-1-butanol + 3-methyl-1-butyl ethanoate and 1-pentanol + pentyl ethanoate at 101.3 kPa [J]. J. Chem. Eng. Data, 2010, 55(6): 2349-2354.
[4] HERRINGTON E F G. Tests of consistency of experimental isobaric vapor-liquid equilibrium data [J]. J. Inst. Pet., 1951, 37: 467-470.
[5] RENON H, PRAUSNITZ J M. Local compositions in thermodynamic excess functions for liquid mixtures [J]. AIChE J., 1968, 14(1): 135-144.
[6] WILSON G M. A new expression for the excess free energy of mixing [J]. J. Am. Chem. Soc., 1964, 86(2): 127-130.
[7] ABRAMS D S, PRAUSNITZ J M. Statistical thermodynamics of liquid mixtures: a new expression for Gibbs energy of partly or completely miscible system [J]. AIChE J., 1975, 21(1): 116-128.
[8] ZHANG J, LIU Y, MENG N. Isobaric vapor-liquid equilibria of binary systems (propyl acetate +n-pentanol), (propyl acetate + 1-methyl-1-butanol), and (propyl acetate + 3-methyl-1-butanol) at 101.3 kPa [J].J. Chem. Eng. Data, 2013, 58(11): 3254-3258.
[9] RAO D S, RAO K V, PRASAD A R,et al. Extraction of acetonitrile from aqueous mixtures (Ⅱ): Ternary liquid equilibria [J]. J. Chem. Eng. Data, 1979, 24(3): 241-243.
[10] SHEU Y, TU C. Densities and viscosities of binary mixtures of isoamyl acetate, ethyl caproate, ethyl benzoate, isoamyl butyrate, ethyl phenylacetate, and ethyl caprylate with ethanol atT=(288.15, 298.15, 308.15, and 318.15K) [J]. J. Chem. Eng. Data, 2006, 51(2): 496-503.
[11] REDDY K S, SWAMY A V N, PRASAD T E. Vapor-liquid equilibria of binary mixtures formed by hexan-1-ol with chloroethanes and chloroethenes at 95.6 kPa [J]. J. Chem. Eng. Data, 2010, 55(6): 2073-2076.
[12] MARLUS P R, MARIA A K. Vapor-liquid equilibria of binary and ternary mixtures of benzene, cyclohexane, and chlorobenzene at 40.0 kPa and 101.3 kPa [J]. J. Chem. Eng. Data, 2001, 46(2): 256-260.
[13] CHEN R Q, ZHONG L, XU C J. Isobaric vapor-liquid equilibrium for binary systems of toluene + ethanol and toluene + isopropanol at (101.3, 121.3, 161.3, and 201.3) kPa [J]. J. Chem. Eng. Data, 2011, 57(1): 155-165.
[14] SMITH J M, VAN N H C, ABBOTT M M. Introduction to Chemical Engineering Thermodynamics [M]. 7th ed. New York: McGraw-Hill, 2005.
[15] YAWS C L. Chemical Properties Handbook: Physical, Thermodynamic, Environmental, Transport, Safety, and Health Related Properties for Organic and Inorganic Chemicals [M]. New York: McGRAW-Hill, 1999.
[16] 马沛生, 李永红. 化工热力学[M]. 2版. 北京: 化学工业出版社, 2009: 148-151. MA P S, LI Y H. Chemical Engineering Thermodynamics [M]. 2nd ed. Beijing: Chemical Industry Press, 2009: 148-151.
[17] WISNIAK J. A new test for the thermodynamic consistency of vapor liquid equilibrium[J]. Ind. Eng. Chem. Res., 1993, 32(7): 1531-1533.
Isobaric vapor-liquid equilibrium for binary systems of isoamyl acetate + isoamyl alcohol and isoamyl acetate +n-hexanol at 50.00 and 101.33 kPa
ZHOU Feng, CHEN Changxu, XU Chunjian (State Key Laboratory of Chemical Engineering,School of Chemical Engineering and Technology,Tianjin University,Tianjin300072,China)
Isobaric vapor-liquid equilibrium data of the binary systems isoamyl acetate + isoamyl alcohol and isoamyl acetate +n-hexanol at 50.00 and 101.33 kPa were measured using a vapor-liquid equilibrium still. The isoamyl acetate + isoamyl alcohol system formed a minimum temperature azeotrope at 50.00 kPa. The thermodynamic consistency of the VLE experimental data were checked by Herington method, and the results were satisfied with Gibbs-Duhem's thermodynamic consistency. The experimental measurements for the binary systems were correlated by nonrandom two-liquid (NRTL), Wilson and universal quasichemical (UNIQUAC) activity coefficient models. Then, the corresponding parameters for the three models were obtained. Compared with the experimental data, the root-mean-square deviations of the boiling temperature and the vapor mole fraction calculated with the correlated parameters were less than 0.20 K and 0.0050, respectively. The calculated results showed that the experimental data agreed well with NRTL, Wilson and UNIQUAC models. Wilson activity coefficient model was used to predict the azeotropic phenomenon of isoamyl acetate + isoamyl alcohol, which indicated that the azeotrope would disappear at 98.4 kPa. This work provided important engineering data for chemical database and further study in the engineering design containing isoamyl acetate.
vapor-liquid equilibrium; isoamyl acetate; isoamyl alcohol;n-hexanol; thermodynamic model
Prof. XU Chunjian, cjxu@tju.edu.cn
O 642.42
:A
:0438—1157(2017)02—0560—07
10.11949/j.issn.0438-1157.20160924
2016-07-04收到初稿,2016-08-23收到修改稿。
联系人:许春建。
:周峰(1990—),男,硕士研究生。
化学工程联合国家重点实验室基金项目。
Received date: 2016-07-04.
Foundation item: supported by the State Key Laboratory of Chemical Engineering Foundation.

