Roscovitine通过影响核因子κB活化抑制大鼠颈动脉内膜损伤导致的炎性增生*
赵京山, 孙佳欢, 于 琨, 2, 刘 玉, 2, 王 超, 李爱英
(1河北中医学院基础医学院生物化学与生物学教研室, 2河北省心脑血管病中医药防治重点实验室,河北 石家庄 050200; 3河北省人民医院, 河北 石家庄 050051)
Roscovitine通过影响核因子κB活化抑制大鼠颈动脉内膜损伤导致的炎性增生*
赵京山1, 2△, 孙佳欢1, 于 琨1, 2, 刘 玉1, 2, 王 超3, 李爱英1, 2△
(1河北中医学院基础医学院生物化学与生物学教研室,2河北省心脑血管病中医药防治重点实验室,河北 石家庄 050200;3河北省人民医院, 河北 石家庄 050051)
目的: 探讨roscovitine通过影响核因子κB(nuclear factor-κB,NF-κB)活化抑制大鼠颈动脉内膜损伤导致炎性增生的作用及其分子机制。 方法:随机将SD大鼠分成对照组、模型组和治疗组3组,每组20只。模型组采用胰蛋白酶消化法制作颈动脉内膜损伤模型;对照组采用假手术,用生理盐水代替胰蛋白酶消化步骤,其他同模型组操作;治疗组在分离的颈动脉血管外壁均匀涂抹终浓度为2 g/L roscovitine 缓释凝胶0.5 mL,其他同模型组。各组大鼠术后常规饲养4周后取材备检。采用HE染色观察各组形态学变化,采用Western blot法检测IκB的表达变化和磷酸化降解,检测NF-κB的表达变化、磷酸化激活以及其下游环氧合酶2(cyclooxygenase-2,COX-2)、血管细胞黏附分子1(vascular cell adhesion molecule-1,VCAM-1)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和白细胞介素6(interleukin-6,IL-6) 的表达变化。 结果:Roscovitine通过抑制胰蛋白酶损伤诱导的IκB-α磷酸化降解,阻断NF-κB-p65的磷酸化活化,进而下调COX-2表达,抑制VCAM-1、TNF-α和IL-6的表达,从而发挥抑制损伤血管内膜增生的作用。 结论:Roscovitine通过影响NF-κB活化抑制大鼠颈动脉内膜损伤导致的炎性增生。
Roscovitine; 核因子κB; 颈动脉内膜; 炎性增生
随着社会的老龄化,动脉粥样硬化性疾病的发病率逐年升高,已经成为严重危害人类健康的主要疾病。虽然动脉粥样硬化性疾病的发病机理尚未完全阐明,但经多年的发展,血管搭桥术、动脉球囊扩张术及支架置入术等多种形式的血管重建术已经成为治疗这类疾病常用而有效的方法[1];然而,术后较高的再狭窄率使其远期疗效不容乐观。虽然人们尝试采用药物支架、转基因技术、血管内照射以及多种治疗药物(包括抗凝药、血管紧张素转换酶抑制剂、他汀类药、细胞毒类药)等方法来预防再狭窄,但是,到目前为止,人们尚未找到一种安全有效、用药简便、能作用于多种病理环节防治再狭窄的药物以及能够完全有效地的解决这一难题的方法[2-3]。研究表明,再狭窄的最主要的病理变化是新生内膜增生,因此可从抑制构成血管壁细胞增殖的视角来研究防治再狭窄形成。
国内外研究表明,血管壁的内皮细胞、平滑肌细胞及成纤维细胞的的异常增生是高血压、动脉粥样硬化、血管成形术后再狭窄等血管增殖性疾病发生的核心事件,研究血管壁细胞增殖的机制,寻找抗细胞增殖的药物已成为防治血管增殖性疾病领域的主要研究课题。血管壁细胞尤其是平滑肌细胞异常增生是血管增殖性疾病特征性病理变化,机械损伤和生长因子的刺激使得平滑肌细胞表现出与肿瘤细胞类似的生物学行为,在疾病发生的分子机制上,调控血管平滑肌增殖的信号传导通路与许多调控肿瘤发生发展的信号通路相一致[3]。因此,应用抗肿瘤药物治疗血管增殖性疾病可能是一种新的治疗策略。但使用抗增殖药防治血管增生性疾病还处于实验阶段,探索抗增殖药防治血管增生性疾病的机制将有助于抗增殖药防治血管增生性疾病在临床上的应用与推广。
大量研究表明,roscovitine 具有广泛的生物学效应,roscovitine可抑制多种类型细胞的增殖,包括多种肿瘤细胞、角化细胞和成纤维细胞等[4]。NF-κB作为一种多向性转录因子其结合序列存在于多种促炎和促增殖基因的启动子和增强子中,通过激活靶基因表达,广泛参与机体的免疫炎症反应、细胞周期调控、细胞增殖分化与凋亡[5-8]。Roscovitine是一种小分子抑制肿瘤细胞增殖药物,具有低毒高效的特点[7]。Roscovitine是否能通过影响核因子-κB(nuclear factor-κB,NF-κB)信号途径而抑制血管壁细胞增生是一个值得研究的问题。本课题采用胰酶消化法建立SD大鼠颈动脉血管损伤模型,观察roscovitine 对血管新生内膜增生的影响,并探讨其作用机制,从而为临床应用roscovitine治疗血管增殖性疾病提供实验和理论依据。
材 料 和 方 法
1 实验动物和主要试剂
实验动物为体重300~330 g的成年雄性SD大鼠,由河北省医学动物中心提供;实验所用单克隆抗体购自Santa Cruz;多克隆抗体购自北京中杉公司;roscovitine购自Gibco;胰蛋白酶购自Sigma;其余试剂为进口或国产分析纯。
2 主要实验仪器
酶标仪和高速冷冻离心机(Thermo);电泳仪(Bio-Rad);显微镜(HITACHI); ID数码成像分析系统(Kodak)。
3 主要方法
3.1 模型制作 大鼠称重,用10%水合氯醛(3 mL/kg)进行麻醉。麻醉成功后备皮,取5%碘伏给大鼠颈动脉区皮肤消毒1次,再用75%乙醇消毒2次,铺无菌巾。然后操作者在无菌条件下进行颈动脉剥离,暴露出2 cm。用动脉夹夹住剥离血管两端,再将一段手术结扎线置于剥离血管下以备用。取0.33 mm注射器平行于血管纵轴方向穿刺进入血管, 0.9%生理盐水冲洗置换出管腔内的血液后抽出生理盐水,保留针头,再抽取0.25%胰酶溶液进行注射,直至血管充盈,将已准备好的手术结扎线在针眼上方进行结扎,防止胰酶漏出,拔出注射器,再用医用生物胶粘合针孔。计时10 min后将结扎线解开取出,并松开动脉夹,进行切口缝合,缝合后注射0.2%青霉素2 mL。
3.2 Roscovitine缓释凝胶的制备 利用Pluronic F127制备roscovitine血管外涂药物缓释凝胶,称固体PF127粉30 g,溶于PBS中,40 ℃搅拌至澄清,定容至100 mL。将roscovitine 50 mg先溶解于1 mL DMSO, 然后再溶解于24 mL Pluronie F-127凝胶中,40 ℃搅拌过夜,制成终浓度为2 g/L 的roscovitine缓释凝胶备用。
3.3 实验分组和取材 随机将SD大鼠分成对照组、模型组和治疗组3组,每组20只。对照组采用假手术,用生理盐水代替胰蛋白酶消化步骤,其他同模型组操作;模型组按照3.1方法制作;治疗组在进行切口缝合前,在分离的颈动脉血管外壁均匀涂抹终浓度为2 g/L的roscovitine 缓释凝胶0.5 mL,其他同模型组。各组大鼠术后常规饲养4周后取材(术后前3 d注射0.2%青霉素2 mL/d),取出各组的颈动脉段,放在装有生理盐水的培养皿中进行冲洗,冲洗干净后,取约1 cm 用于病理形态学观察,其余部分制备蛋白提取液。
3.4 病理形态学的观察 取颈动脉1 cm左右置冷PBS中洗净残留血液,放入4%多聚甲醛/PBS中固定至少24 h,乙醇梯度脱水,低温石蜡垂直定向包埋、切片,常规HE染色。于光镜下观察、照相、进行图像学分析,计算内膜厚度、中膜厚度和内膜/中膜厚度之比(I/M)。
3.5 蛋白提取液的制备 取损伤部位血管,用生理盐水洗净后,按100 mg组织加入1 mL提取液(150 mmol/L NaC1,50 mmol/L Tris-HCl,pH 7.8,0.1% NP-40,0.5%脱氧胆酸钠,0.1% SDS)匀浆。冰浴反应30 min;4 ℃、8 000 r/min离心10 min,取上清用改良酚试剂法测定提取液的蛋白含量。
3.6 Western blot实验 按照3.5的方法提取血管壁细胞总蛋白,用改良的Lowry法测定蛋白浓度。各组取等量蛋白提取液与5×SDS上样缓冲液混匀后,100 ℃沸水浴中加热5 min, 自然冷却后在120 V恒压条件下,进行SDS-PAGE,电转移至PVDF膜上,随后与相应的Ⅰ抗及Ⅱ抗反应,用化学发光法检测抗原抗体结合区带。用数码成像分析系统软件对电泳条带进行密度扫描,以GAPDH为内参照进行定量分析。
4 统计学处理
数据以均数±标准差(mean±SD)表示,组间资料应用单因素方差分析(one-way ANOVA),组间两两比较采用LSD法,各项统计均用SPSS 13.0统计软件进行处理。以P<0.05为差异有统计学意义。
结 果
1 病理形态学的改变
对照组大鼠主动脉壁各层结构完整,内膜光滑,中膜血管平滑肌细胞排列整齐。模型组内膜呈弥漫性增厚,管腔变小,增厚的内膜中以细胞成分为主,有炎症细胞浸润,中膜细胞排列完整。给予roscovitine 治疗后,血管内膜增生明显被抑制,炎症细胞减少。形态测量分析表明,模型组与对照组相比,模型组的血管内膜增生明显,血管内膜厚度显著升高,内膜/中膜面积(I/M)比值升高了0.81倍,roscovitine 治疗组的上述指标均有不同程度的降低,与模型组比较I/M比值降低了0.35倍,差异具有统计学显著性(P<0.05),见图1。

Figure 1.Inhibitory effect of roscovitine on intimal hyperplasia in rat carotid artery after trypsin digestion iniury. A: HE staining of the rat carotid artery; B: the ratio of intimal to medial (I/M) area. Mean±SD.n=20.*P<0.05vscontrol;#P<0.05vsmodel.
图1 Roscovitine 抑制胰蛋白酶消化损伤造成的大鼠颈动脉内膜增生
2 NF-κB下游环氧合酶2(cyclooxygenase-2,COX-2)、血管细胞黏附分子1(vascular cell adhesion molecule-1,VCAM-1)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和白细胞介素6(interleukin-6,IL-6)的表达变化
为了观察roscovitine抑制胰蛋白酶损伤后的早期血管炎症反应,本实验检测了炎性标志物COX-2、VCAM-1、TNF-α和IL-6在血管壁中的表达。Western blot实验结果显示,对照组中可检测到少量的COX-2、VCAM-1、TNF-α和IL-6 蛋白;模型组的COX-2、VCAM-1、TNF-α和IL-6蛋白水平明显升高,约是对照组的2.25、2.13、2.04和2.19倍,说明炎性增生模型复制成功;roscovitine可明显抑制 COX-2、VCAM-1、TNF-α和IL-6的表达,COX-2、VCAM-1、TNF-α和IL-6的蛋白水平显著降低,较模型组分别减少了34.8 %、28.9%、41.1%和38.7%,差异有统计学显著性(P<0.05),见图2。
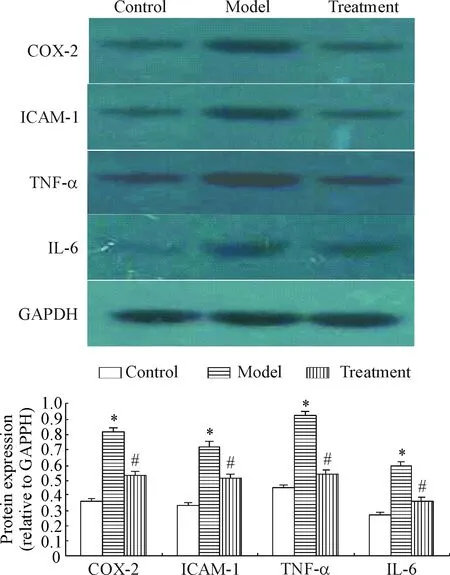
Figure 2.The effect of roscovitine on the expression of COX-2, VCAM-1, TNF-α and IL-6 in rat carotid artery after trypsin digestion injury. Mean±SD.n=20.*P<0.05vscontrol;#P<0.05vsmodel.
图2 Roscovitine 对胰蛋白酶消化损伤后大鼠颈动脉COX-2、VCAM-1、TNF-α和IL-6表达的影响
3 NF-κB表达水平及磷酸化活化的变化
Western blot实验结果显示,对照组、模型组及治疗组的NF-κB总量无差别,而磷酸化的NF-κB (p-NF-κB-p65)有明显差别,对照组中可检测到少量的p-NF-κB 蛋白;模型组的p-NF-κB水平明显升高,较对照组升高了57.1%。Roscovitine可明显抑制 p-NF-κB的蛋白水平,p-NF-κB的蛋白水平显著降低,较模型组减少了29.6%,差异有统计学显著性(P<0.05),见图3。
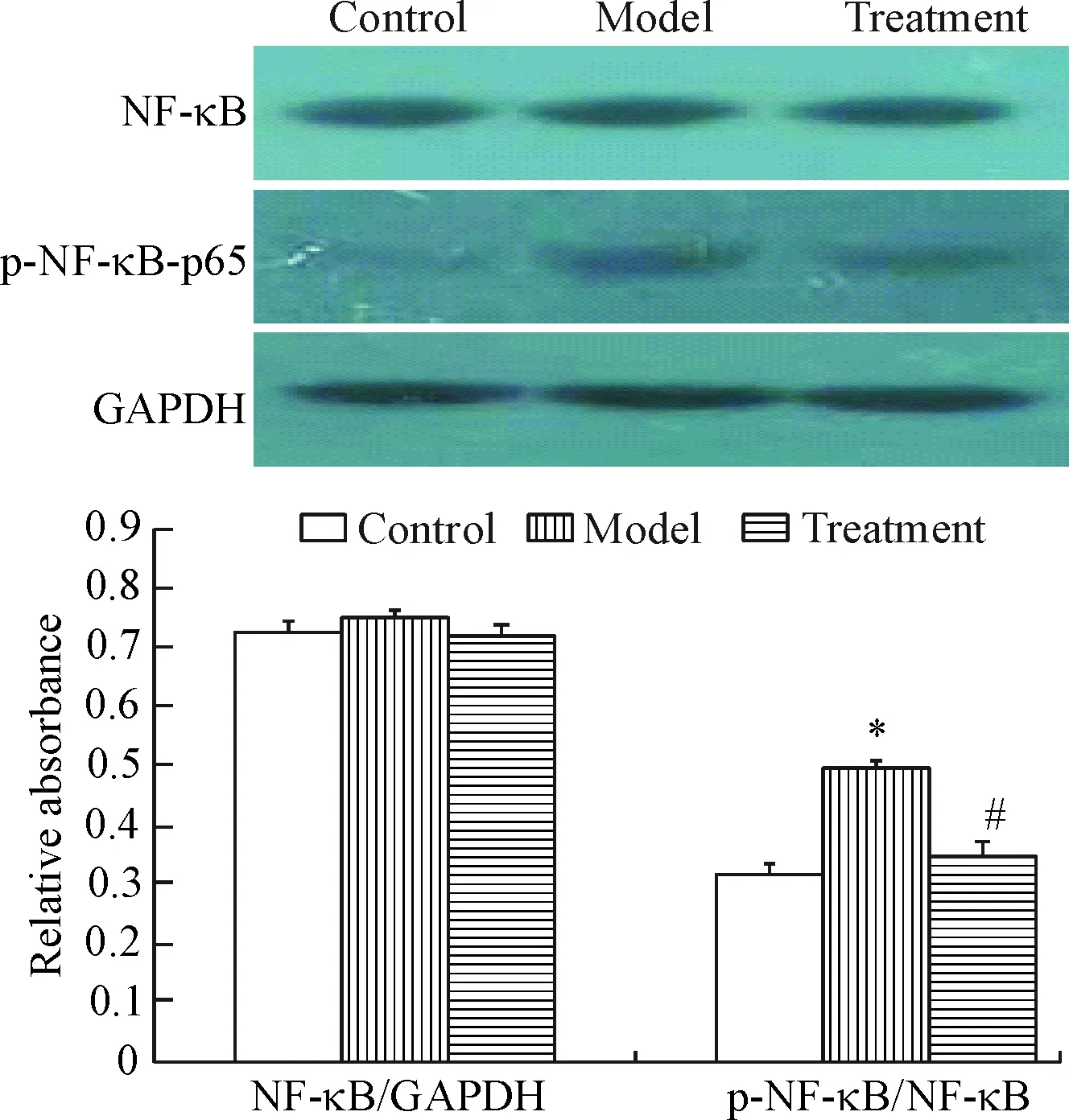
Figure 3.The effect of roscovitine on the expression of NF-κB in rat carotid artery after trypsin digestion injury. Mean±SD.n=20.*P<0.05vscontrol;#P<0.05vsmodel.
图3 Roscovitine 对胰蛋白酶消化损伤后大鼠颈动脉NF-κB表达的影响
4 IκB表达水平的变化及磷酸化降解
Western blot实验结果显示,对照组、模型组及治疗组IκB的总量无差别,而磷酸化IκB的水平有明显差别,对照组中可检测到少量的p-IκB 蛋白;模型组的p-IκB水平明显升高,较对照组升高了43.9%;治疗组roscovitine可明显抑制 p-IκB,p-IκB的蛋白水平几乎恢复到了对照组的水平,较模型组下降约23.1%,差异有统计学显著性(P<0.05)。
讨 论
动脉粥样硬化和血管再狭窄是一种慢性血管炎症性疾病,经皮冠状动脉腔内成形术(percutaneous transluminal coronary angioplasty,PTCA)作为治疗冠心病的有效手段现已得到广泛的应用,但介入性治疗后3~6个月约35%~50%的患者出现血管再狭窄,严重限制了PTCA 的远期疗效。目前认为造成PTCA术后再狭窄的主要病理基础是,血管内膜受到刺激后,炎细胞浸润、内皮细胞增生导致血管平滑肌细胞表型改变,从收缩型转变为增殖型,血管平滑肌细胞迁移活性发生改变,从血管中膜迁移至内膜,进而分裂增殖,血管壁内皮细胞、血管平滑肌细胞增生及其产生的基质等形成新生内膜,导致管壁增厚,管腔变窄[5,10]。因此,如何抑制细胞的异常增殖,防止再狭窄的发生,就成为心血管疾病研究的一个重要问题。
核因子NF-κB作为一种多向性转录调控因子,其结合序列存在于多种促炎基因和促增殖基因的启动子和增强子中,通过激活靶基因表达广泛参与机体的免疫炎症反应、细胞增殖分化与凋亡等生物行为[5,9-12]。NF-κB蛋白是一个转录因子家族,所有成员都含有Rel同源区域,介导二聚体形成,其蛋白质以同源/异源二聚体形式形成复合体,P65/P50是最常见的二聚体形式。静息状态NF-κB二聚体与抑制蛋白IκB相结合以非活性形式存在于胞浆中。NF-κB途径可以被一系列的细胞外刺激所激活,通过各自的细胞膜受体将炎症信号传导至细胞内,激活IκB激酶(IKK)复合体,活化的IKK进而催化IκB磷酸化,后者随即被泛素化,而后降解,使NF-κB-p65得以游离释放,并发生磷酸化,而后转位入核,与靶基因启动子区域基序GGGRNNYYCC结合,激活靶基因转录。NF-κB 是血管炎症发生和发展的关键转录因子,通过基因调控序列同源性比对,分析后发现,致炎因子诱导的异常基因表达大多受NF-κB的反式激活[13-17],因此,通过抑制NF-κB 活化进行的抗炎治疗已成为防治增殖性心血管疾病的新策略。
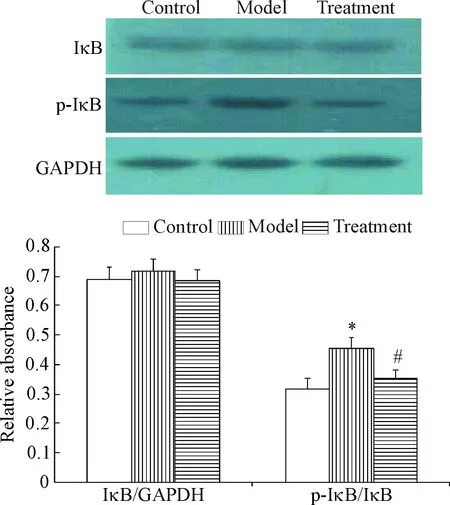
Figure 4.The effect of roscovitine on the expression of IκB after trypsin digestion injury in the rat carotid artery. Mean±SD.n=6.*P<0.05vscontrol;#P<0.05vsmodel.
图4 Roscovitine 对大鼠颈动脉胰蛋白酶消化损伤后IκB表达的影响
Roscovitine是一种小分子抑制细胞增殖药物,roscovitine作为新型的抗肿瘤药物具有低毒高效的特点[7],有广泛的生物学效应,尤其是抗炎性增殖作用明显,该作用通过抑制NF-κB的活化抑制肿瘤细胞增殖和降低Mcl-1表达诱导炎症细胞凋亡。研究表明,roscovitine是一种低毒高效的抑制细胞增殖的抗肿瘤药物,它可显著抑制多种肿瘤细胞的增殖,而对正常细胞几乎无影响,这是目前开发此类药物的意义所在[8]。我们的预实验表明,roscovitine对正常血管壁细胞(内壁细胞、平滑肌细胞等)无影响,而对损伤的血管壁细胞具有抑制作用。正常血管,平滑肌细胞、内皮细胞等处于相对静止状态,roscovitine对其无影响,而当血管受损时,构成血管壁的细胞增殖活跃,这时它既可抑制平滑肌细胞,也可抑制其他细胞的增殖。而以动脉粥样硬化、高血压为代表的心血管疾病,血管壁细胞的炎性增殖是其病理基础,roscovitine能否通过影响NF-κB信号途径而抑制血管内膜炎性增生是本研究的兴趣点。
本课题采用胰蛋白酶消化法造成颈动脉损伤模型,应用新型药物缓释技术进行干预治疗,观察roscovitine抑制血管壁损伤导致的内膜增生,探讨其抑制血管壁增生的分子机制。胰蛋白酶消化法大鼠颈动脉炎性增生模型造模成功的标准是:内膜粗糙,呈弥漫性增厚,管腔变小,增厚的内膜中主要有细胞外基质细胞成分构成,有炎细胞浸润,中膜平滑肌细胞排列紊乱,I/M比值较正常对照组升高0.5倍以上,同时损伤局部血管炎性因子表达增加。本研究图1实验结果显示形态学变化符合上述标准,且模型组I/M比值较正常对照组升高了0.81倍;图2结果显示,模型组的炎性因子COX-2、VCAM-1、TNF-α和IL-6较正常对照组表达水平明显升高,约是对照组的2.25、2.13、2.04和2.19倍,上述数据表明大鼠血管壁炎性增生模型造模成功,可用于实验研究。
本实验采用新型药物缓释技术——“缓释凝胶”给药,该方法已在临床中应用,例如治疗血管狭窄性疾病时所应用的药物涂层支架,其药物涂层常采用“缓释凝胶”给药的方法。临床上在动脉中置入支架治疗血管狭窄性疾病,约有30%~50%的病人会因局部血管增生出现再狭窄,目前预防再狭窄的有效措施之一便是采用药物涂层支架,采用该给药方式是为下一步开发roscovitine药物涂层支架做准备。
HE染色形态学结果显示,模型组与对照组相比,模型组的血管内膜增生明显,血管内膜厚度显著升高,I/M比值升高0.81倍,roscovitine 治疗组的上述指标均有不同程度的降低,I/M比值较模型组降低了0.35倍,差异具有统计学显著性(P<0.05)。以上统计结果表明roscovitine能够明显抑制胰蛋白酶消化造成的大鼠血管内皮剥脱诱导的新生内膜增生。
为了观察roscovitine抑制胰蛋白酶损伤后的血管炎症增殖反应,本实验检测了炎性标志物COX-2、VCAM-1、TNF-α和IL-6在血管壁中的表达。Western blot实验的结果显示,对照组中可检测到少量的COX-2、VCAM-1、TNF-α和IL-6蛋白;模型组的COX-2、VCAM-1、TNF-α和IL-6水平明显升高,约是对照组的2.25、2.13、2.04和2.19倍。治疗组Roscovitine可明显抑制 COX-2、VCAM-1、TNF-α和IL-6的表达,使COX-2、VCAM-1、 TNF-α和IL-6的蛋白水平显著降低,较模型组分别减少了34.8 %、28.9%、41.1%和38.7%。该结果表明,roscovitine可抑制受损血管致炎基因的表达,通过抑制炎症反应抑制血管增生。
以往研究表明,NF-κB 是血管炎症发生和发展的关键转录调控因子,因此,课题组观察了胰蛋白酶损伤后roscovitine对NF-κB活化的影响,进一步探讨其抑制血管内膜增生的分子机制。实验结果表明roscovitine不影响NF-κB的表达,可明显抑制 NF-κB-p65的磷酸化,治疗组较模型组减少了29.6%。Roscovitine可明显抑制 IκB 的磷酸化水平,治疗组p-IκB 几乎恢复到了对照组的水平,较模型组下降约23.1%,而roscovitine不影响IκB 蛋白的表达水平。上述结果说明roscovitine对NF-κB活化的抑制作用与其减少 IκB 磷酸化降解有关,而关于 IκB 磷酸化的机制有待于下一步深入研究。
综上所述,采用药物缓释技术,在血管外给药,一次性涂抹roscovitine缓释凝胶具有明显的抑制血管内膜增生作用。Roscovitine通过抑制胰蛋白酶损伤诱导的IκB磷酸化降解,阻断NF-κB-p65的磷酸化,下调炎性因子COX-2、VCAM-1、TNF-α和IL-6的表达,从而发挥抑制损伤血管的炎性增生作用,本研究为治疗血管增生性疾病提供了新的思路和实验依据。
[1] Zhao JS, Niu HL, Li AY, et al. Acetylbritannilactone modulates vascular endothelial growth factor signaling and regulates angiogenesis in endothelial cells[J]. PLoS One, 2016, 11(4):e0148968.
[2] Mitchell S, Vargas J, Hoffmann A. Signaling via the NFκB system[J]. Wiley Interdiscip Rev Syst Biol Med, 2016, 8(3):227-241.
[3] Welt FG, Rogers C. Inflammation and restenosis in the stent era[J]. Arterioscler Thromb Vasc Biol, 2002, 22(11):1769-1776.
[4] Christian F, Smith EL, Carmody RJ.The regulation of NF-κB subunits by phosphorylation[J].Cells, 2016, 5(1):E12.
[5] MaruYama T. The nuclear IκB family of proteins controls gene regulation and immune homeostasis[J]. Int Immunopharmacol, 2015, 28(2):836-840.
[6] 赵京山, 方明星, 郭浅妤, 等. 羟基红花黄色素A通过影响PCNA表达和MEK-ERK1/2信号通路抑制大鼠血管平滑肌细胞增殖[J]. 中国药理学通报, 2015, 31(7):984-988.
[7] Meijer L, Borgne A, Mulner O, et al. Biochemical and cellular effects of roscovitine, a potent and selective inhi-bitor of the cyclin-dependent kinases cdc2, cdk2 and cdk5[J]. Eur J Biochem, 1997, 243(1-2):527-536.
[8] Cicenas J, Kalyan K,Sorokinas A, et al. Roscovitine in cancer and other diseases[J]. Ann Transl Med, 2015, 3(10):135-147.
[9] Gilmore TD. Introduction to NF-κB: players, pathways, perspectives[J]. Oncogene, 2006, 25(3):6680-6684.
[10]Escoubet-Lozach L, Benner C, Kaikkonen MU, et al. Mechanisms establishing TLR4-responsive activation states of inflammatory response genes[J]. PLoS Genet, 2011, 7(12):e1002401.
[11]张 凤, 张玲玲, 魏 伟. B细胞活化因子及其受体介导的信号通路参与类风湿关节炎病理机制研究进展[J]. 中国免疫学杂志, 2016, 3(2):258-260.
[12]张 刚. NF-κB 及其相关分子研究进展[J]. 国外医学:临床生物化学与检验学分册, 2002, 23(5):258-261.
[13]吴亚楠, 赵鹏翔, 马雪梅. NF-κB 研究进展及其与炎症的关系[J]. 安徽农业科学, 2012, 40(34):16533-16538.
[14]张劲松, 王兴宇, 单佑安, 等. 转录因子NF-κB 的研究进展[J]. 科学通报, 2002, 47(5):322-328.
[15]赵京山, 方明星, 郭浅妤, 等. 羟基红花黄色素A抑制PDGF促大鼠血管平滑肌细胞增殖的作用[J]. 中国细胞生物学学报, 2015, 7(6):827-831.
[16]赵京山, 郭浅妤, 赖少鸿, 等. 羟基红花黄色素A可抑制血管平滑肌细胞增殖[J]. 中华心血管病杂志, 2015, 43(8):728-731.
[17]梁伟杰, 陈美姬, 何洁仪, 等. ATP敏感性钾通道的开放通过抑制TLR4/NF-κB通路对抗高糖引起的H9c2心肌细胞损伤和炎症[J]. 中国病理生理杂志, 2016, 32(7):1153-1160.
(责任编辑: 林白霜, 罗 森)
Roscovitine inhibits inflammatory hyperplasia of carotid artery intima in rats via suppressing nuclear factor-κB activation
ZHAO Jing-shan1, 2, SUN Jia-huan1, YU Kun1, 2, LIU Yu1, 2, WANG Chao3, LI Ai-ying1, 2
(1TheDepartmentofBiochemistryandBiology,BasicMedicalCollege,HebeiUniversityofChineseMedicine,2HebeiKeyLaboratoryofChineseMedicineResearchonCardiocerebrovascularDisease,Shijiazhuang050200,China;3HebeiGeneralHospital,Shijiazhuang050051,China.E-mail:lay1963@126.com;zjs10@sina.com)
AIM: To study the effect of roscovitine on the inflammatory hyperplasia of carotid artery intima in rats and the related mechanisms. METHODS: SD rats (n=60) were randomly divided into 3 groups including control group, model group and treatment group. The rat model was established by trypsin digestion injury. The rats in control group were given sham operation. The rats in treatment group were administered with 0.5 mL roscovitine (2 g/L) slow-releasing gelatin. The rats in each group were fed normally for 4 weeks, then killed to take out carotid arteries for further observations. The effects of roscovitine on the inflammatory hyperplasia of carotid artery intima and the related mechanism via nuclear factor-κB (NF-κB) in the rats were detected by Western blot. RESUITS: Roscovitine inhibited the activation of NF-κB and the expression of inflammatory factors cyclooxygenase-2 (COX-2), vascular cell adhesion molecule-1 (VCAM-1),TNF-α and IL-6 via blocking the phosphorylation activation of NF-κB and inhibiting the degradation of IκB-α. CONCLUSION: Roscovitine inhibits inflammatory hyperplasia of carotid artery intima in the rats via suppressing NF-κB activation.
Roscovitine; Nuclear factor-κB; Carotid artery intima; Inflammatory hyperplasia
1000- 4718(2017)02- 0233- 06
2016- 07- 04
2016- 11- 01
国家自然科学基金资助项目(No. 31271466; No. 81573698);河北省科技支撑计划(No.13277739D);河北省教育厅科技类重点项目(No. ZD2014005);河北省自然科学基金资助项目(No. 2009001053)
R543.5; R363
A
10.3969/j.issn.1000- 4718.2017.02.007
杂志网址: http://www.cjpp.net
△通讯作者 李爱英 Tel: 0311-89926235; E-mail: lay1963@126.com; 赵京山 Tel: 0311-89926236; E-mail: zjs10@sina.com

