拟交感效应对快速起搏离体心脏心房缝隙连接蛋白43重构的影响*
舒成霖, 何 燕△, 曾志羽, 何 涛, 李金轶, 黄伟强, 许 键, 黄艳群
(广西医科大学第一附属医院 1老年心血管内科, 2心电诊断科, 3心血管病研究所,广西 南宁 530021)
拟交感效应对快速起搏离体心脏心房缝隙连接蛋白43重构的影响*
舒成霖1, 何 燕1△, 曾志羽1, 何 涛2, 李金轶3, 黄伟强3, 许 键1, 黄艳群1
(广西医科大学第一附属医院1老年心血管内科,2心电诊断科,3心血管病研究所,广西 南宁 530021)
目的: 通过建立离体拟交感心房颤动模型,探讨缝隙连接蛋白43(Cx43)水平的变化。方法: 15只杂种犬随机分为3组(每组5只):对照组(control组)、快速心房起搏组(RAP组)和异丙肾上腺素灌流+快速心房起搏组(ISO+RAP组)。经胸骨正中切开术,快速取出心脏,建立心脏Langendorff离体灌流模型。各组分别检测心房有效不应期(AERP)及房颤诱发率,免疫组化检测酪氨酸羟化酶(TH)在细胞内的表达,Western blot 检测Cx43和磷酸化Cx43的蛋白含量,免疫荧光检测Cx43在心肌组织的变化,TUNEL法检测心肌细胞凋亡,荧光比色法检测线粒体活性氧簇(ROS)的生成量。结果: 与control组比较,RAP组的AERP无明显变化,且仅出现电紊乱, ISO+RAP组的AERP明显缩短(P<0.05),并可成功诱发房颤。与control组比较,RAP组和ISO+RAP组的TH表达量、细胞凋亡指数和线粒体ROS生成量均逐渐增多(P<0.05),Cx43蛋白表达量和磷酸化水平逐渐减少(P<0.05)。免疫荧光显示,与control组相比,RAP组的Cx43荧光强度降低,且呈明显侧链化,ISO+RAP组则呈点状散在分布。结论: 交感神经可能通过氧化应激效应,引起Cx43的重构与下调,从而介导心房颤动的发生。
交感神经; 缝隙连接蛋白 43; 心房颤动; 氧化应激; 自噬
缝隙连接蛋白是维持细胞与细胞间连接与通信的结构,它可以允许小分子如ATP、cAMP、IP3、葡萄糖等通过。在心脏中,缝隙连接蛋白介导心肌细胞之间的电偶联,形成细胞通路,使引起同步收缩的电激动有序传播[1]。其中,缝隙连接蛋白43(connexin 43,Cx43)在心肌中表达最丰富。心房颤动(atrial fibrillation,AF)是临床上最常见的房性心律失常。自主神经张力的改变和神经重构是房颤发生和维持的重要因素。研究表明交感神经与房颤的发生密切相关[2],但其内在机制目前尚不十分明确。已有的临床资料表明,房颤患者缝隙连接蛋白43表达量与正常对照组相比表达有升有降[3]。本研究旨在运用离体灌流技术,在脱离机体神经体液影响的情况下,构建拟交感房颤模型,并在此基础上探讨Cx43的变化情况。
材 料 和 方 法
1 实验动物及主要试剂
实验杂种幼犬15只,雌雄不分,体重在2~3 kg。异丙肾上腺素(isoprenaline, ISO)注射液、戊巴比妥钠粉剂、肝素钠注射液、改良台氏液(北京索来宝);分子探针H2DCF/DA(Sigma);兔抗Cx43抗体(CST);鼠抗Cx43单克隆抗体(Santa Cruz);鼠抗磷酸化Cx43抗体(Chemicon);兔抗酪氨酸羟化酶(tyrosine hydroxylase, TH)抗体(北京博奥森)。DF-5A电生理刺激仪、凋亡试剂盒(Roche)。
2 主要方法
2.1 实验动物分组及模型构建 动物雌雄不分,随机分成3组,每组5只。对照(control)组将实验犬以3%戊巴比妥钠腹腔注射后麻醉,固定于手术台上,行胸骨正中切开术,向左心室注射肝素8 000 U,快速将心脏连同肺一并取出,置于预冷台氏液中修剪,分离心脏,挤出剩余血液,随后将主动脉根部连接至心脏离体灌流仪,37 ℃下以改良台氏液灌注心脏(250 r/min),待心率恢复至100次/min左右后,分别于左、右心耳,心尖部放置针状电极,连接电生理仪,刺激仪,记录心电图,持续灌流约1 h后留取心房组织;快速起搏(rapid atrium pacing,RAP)组:灌注方法同control组,仅在灌流时以频率800次/min起搏30 s,共30次;ISO+RAP组:以含0.1 μmol/L异丙肾上腺素的改良台氏液灌流心脏,余同RAP组。
2.2 电生理参数测量 心脏搏动稳定后即行电生理参数检测,以S1S2心脏程序期前刺激法检测心房有效不应期(atrial effective refractory period,AERP),S1S2偶联间期从基础刺激周长300 ms开始,刺激比例为8∶1,10 ms步长递减,脉宽2 ms,刺激强度为2倍的舒张阈值强度。直至不能夺获心房的最长S1S2间期为AERP,重复3次,取平均值。记录除对照组外房颤的诱发次数,诱发出的房颤定义为持续时间大于2 s的快速不规则心房电活动。
2.3 心房肌TH免疫组化染色和分析 取下部分左心房组织,快速置于4%甲醛固定24 h后包埋,常规石蜡切片,于60 ℃烤箱中烘烤2 h,经二甲苯及乙醇脱蜡后于柠檬酸盐缓冲盐中高温高压修复3 min,以3% H2O2孵育10 min,PBS漂洗5 min×3次,滴加TH抗体(1∶300),置于4 ℃孵育过夜。采用二步法行TH免疫组织化学染色(按试剂盒说明书操作),光镜下阳性为棕褐色。
2.4 Western blot检测Cx43总蛋白和磷酸化蛋白的含量 将冻存左心房组织用液氮研磨,匀浆,加RIPA裂解液,再加入100 mg/L PMSF,提取总蛋白,用BCA法行蛋白浓度测定。按每泳道加总蛋白40 μg,在12%分离胶和5%浓缩胶上电泳后以100 mA×2 h湿转将蛋白条带转至PVDF膜上。5%脱脂奶粉缓冲液室温摇动封闭1 h,分别加入小鼠单克隆抗Cx43抗体(1∶1 000)、小鼠抗磷酸化Cx43抗体(1∶1 000)和小鼠抗GAPDH单克隆抗体(1∶10 000),4 ℃孵育过夜,室温下加相应Ⅱ抗(1∶10 000)孵育2 h,室温下TBST溶液清洗蛋白膜15 min×3次,用增强化学发光法显色,X光片曝光显影。凝胶成像系统摄像分析。
2.5 免疫荧光测定Cx43 取左心房肌组织行常规石蜡纵向切片,脱蜡后于柠檬酸盐缓冲盐中高温高压修复3 min,10%血清封闭1 h,倒去血清,滴加Ⅰ抗Cx43(1∶50)于4 ℃孵育过夜;第2天将玻片用PBS漂洗后,以FITC标记的荧光Ⅱ抗(1∶100)室温避光孵育1 h,PBS漂洗后,DAPI染色,缓冲甘油封片。Olympus荧光显微镜下观察切片,将数字化图像储存于计算机,待实验结束后进行图像分析。
2.6 TUNEL法检测心肌细胞凋亡 参照凋亡试剂盒说明书进行实验。光镜下正常心肌细胞核呈蓝绿色,凋亡细胞核呈棕褐色。每张切片与凋亡细胞分布区域各取3个高倍视野,计算出每100个细胞的凋亡细胞数,并以百分数表示凋亡指数(apoptotic index,AI)。
2.7 荧光比色法测ROS的生成 各组心房肌组织在取下后1 h内于冰上快速剪碎,采用碧云天公司线粒体提取试剂盒分离线粒体。随后参照Korde等[4]的方法测定线粒体ROS。
3 统计学处理
采用SPSS 17.0统计学软件对实验数据进行分析。计量资料用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析,各组均数间的两两比较采用Bonferroni校正的t检验,以P<0.05为差异有统计学意义。
结 果
1 各组AERP的比较
Control组与RAP组的AERP差异无统计学显著性;与RAP组比较,ISO+RAP组的 AERP明显缩短(P<0.05),见图1。

Figure 1.The comparison of AERP in each group. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsRAP group.
图1 各组AERP的比较
2 各组房颤诱发率的比较
Control组与RAP组均无法诱发出房颤,RAP组仅出现短暂心房电紊乱现象。与RAP组比较, ISO+RAP组则可诱发出房颤(P<0.05),各组间房颤的阳性诱发率比较见图2。
3 各组TH免疫组化染色和分析
TH阳性为细胞核特异性着色,呈棕褐色。同control组相比,各组TH阳性逐渐增多,且ISO+RAP组明显多于RAP组,见图3。
4 Cx43的免疫荧光染色和Western blot 检测结果
免疫荧光染色可见,control组的Cx43蛋白表达清楚,位于心肌闰盘处,主要呈端-端分布,条状,少数呈点状散在分布,心肌细胞侧边分布较少。RAP组Cx43荧光相对减弱,主要依心肌细胞长轴方向呈侧-侧分布,条状,少数呈点状散在分布。ISO+RAP组的Cx43表达明显减少,呈点状散在分布,见图4。
Western blot检测结果显示,与control组相比,RAP组和ISO+RAP组的Cx43总蛋白及磷酸化Cx43蛋白的含量均降低,且呈逐渐下降趋势,相邻各组间差异均有统计学意义(P<0.05),见图4。
5 各组心肌细胞凋亡的比较
TUNEL染色观察可见,凋亡阳性心肌细胞核呈棕褐色,未凋亡细胞核呈深蓝色。与control组相比,各干预组的AI值均明显升高(P<0.01),且由RAP组至ISO+RAP组呈逐渐增高的趋势(P<0.01),见图5。

Figure 2.The positive induction rates of atrial fibrillation in each group. A: the ECG showed that atrial fibrillation was induced successfully (a) or just atrial electrical disorder appeared (b); B: the quantitative analysis of the atrial fibrillation rates. Mean±SD.n=5.*P<0.05vscontrol group;#P<0.05vsRAP group.
图2 各组房颤诱发率的比较
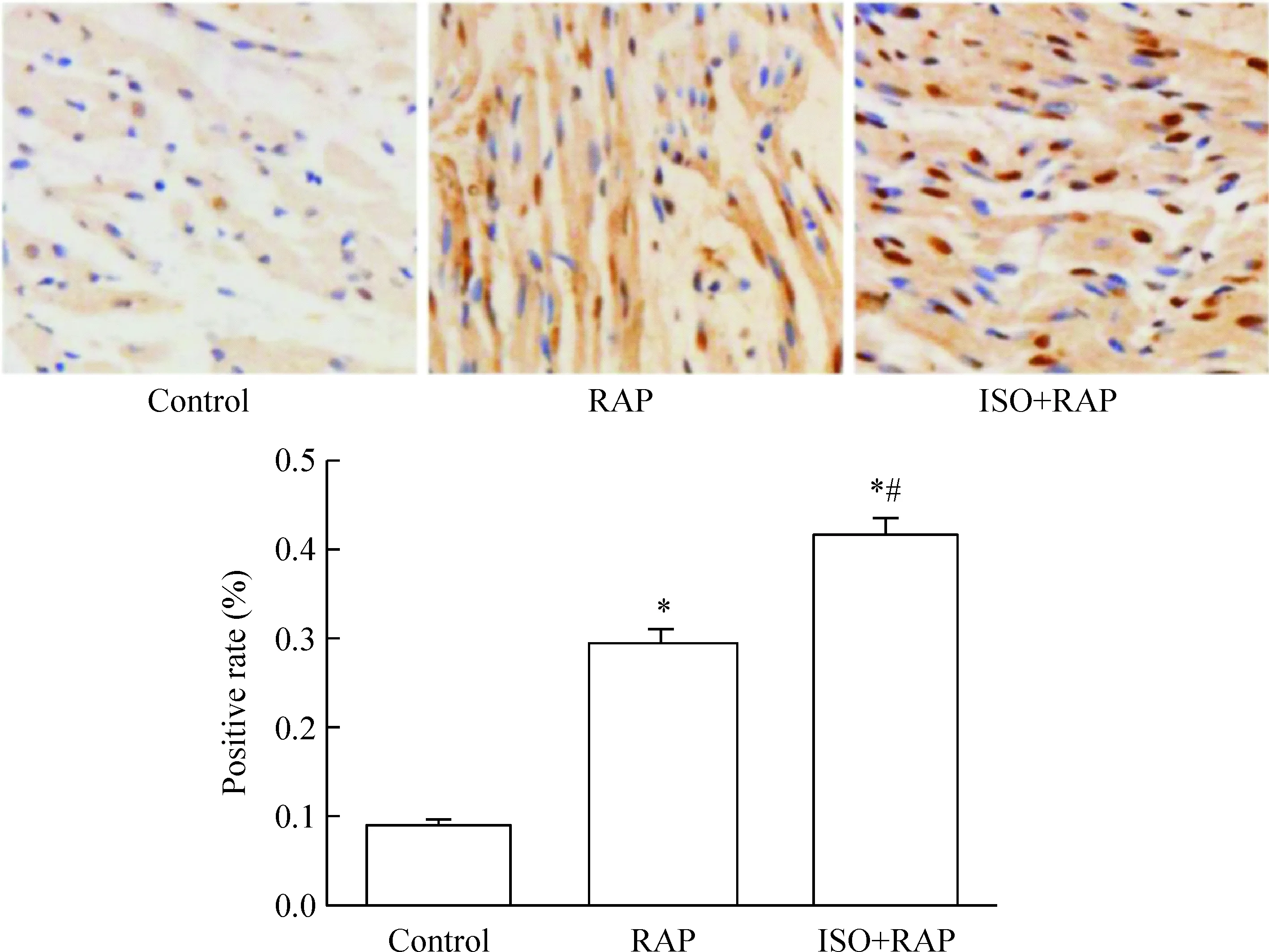
Figure 3.Detection of tyrosine hydroxylase (TH) by immunohistochemical staining in each group (×400). The positive staining showed as brown. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsRAP group.
图3 各组TH免疫组化染色结果
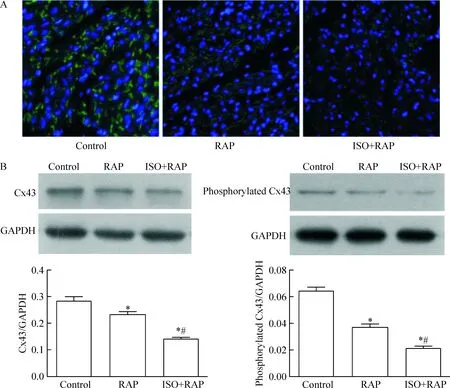
Figure 4.The total protein expression of Cx43 and phosphorated protein level of Cx43 in each group. A: observation of the protein expression of Cx43 in the myocardial tissues under microscope with immunofluorescence staining (×200); B: determination of the total and phosphorylated proteins of Cx43 in the myocardial tissues by Western blot. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsRAP group.
图4 各组心肌细胞Cx43总蛋白及磷酸化Cx43蛋白水平的比较
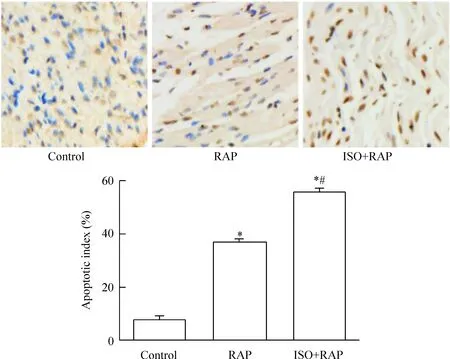
Figure 5.Observation of apoptosis of the myocardial cells in each group by TUNEL staining (×400). Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsRAP group.
图5 各组心肌细胞凋亡的TUNEL染色
6 各组ROS生成量的比较
与control组比较,各组ROS的生成量均明显增加(P<0.05),且ISO+RAP组生成量高于RAP组,差异有统计学意义(P<0.05),见图6。
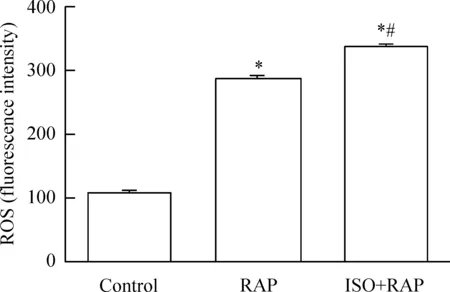
Figure 6.The generation of ROS in each group. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsRAP group.
图6 各组ROS生成量的比较
讨 论
缝隙连接蛋白是构成缝隙连接的基本结构和功能的蛋白,每6个跨膜的蛋白亚基围绕中央孔在相邻细胞膜上排列形成一个连接子,进而构成缝隙连接。Cx43是构成哺乳动物心脏缝隙连接通道的主要蛋白。Cx43形成的缝隙连接通道的数目、大小、特征及互相连接的心肌细胞的几何形状保证了化学物质和电冲动在相邻心肌间的有效传递[5]。大量研究表明,Cx43的重构和心律失常的发生密切相关[6]。心房颤动是临床最常见的心律失常,自主神经重构与其发生机制密切相关。目前大多数房颤研究主要为在体实验,离体实验很少。在本研究中,我们成功构建了拟交感房颤模型,并进一步探讨了其可能的内在机制。
我们发现,control组和RAP组AERP未发生明显改变,而ISO+RAP组AERP则明显缩短,同时,ISO+RAP组可以成功诱发出房颤。β-肾上腺素能受体的持续刺激是交感神经活跃的标志,ISO是人工合成非选择性β-肾上腺素能受体激动剂,因此ISO可用于模拟交感神经兴奋状态。TH是交感神经特异性标志物,TH阳性区域提示交感神经分布[7]。研究中,control组、RAP组和ISO+RAP组的TH阳性呈逐渐递增趋势。这说明高频起搏可一定程度兴奋交感神经,但在实验所持续的时长里,其对心电活动影响不大。而交感神经高度兴奋后,可以明显缩短AERP,并显著促进交感神经的增生,从而增加房颤的易感性。这也证实了交感神经和房颤间的密切关系。
人体内存在维持蛋白质内在稳定性的机制,主要包括泛素化系统和自噬作用。对于低再生能力的细胞,则更需要这种机制来确保其蛋白质的质量。当出现心功能不全或心脏处于某些应激状态(如氧化应激,缺氧等)时,会激活闰盘处分布的自噬小体,进而引起Cx43的内部化、侧链化,甚至降解[8]。在我们的研究中,我们也发现,经高频起搏刺激后,胞膜Cx43的分布出现了明显的侧链化趋势,且总蛋白含量略有下降。在荧光比色检测活性氧族的实验中,我们发现ISO所激发的交感神经兴奋状态可加剧氧化应激效应。因此,在ISO+RAP组Cx43无论分布还是含量都出现了明显的减少。另外,众所周知,Cx43在经过磷酸化后才能更好代表其功能状态[9],实验中,我们也发现ISO+RAP组的磷酸化Cx43也出现明显下调,这也更进一步说明了细胞之间的信号传导受到了显著影响。在细胞凋亡实验中,我们也发现,control组,RAP组,ISO+RAP组的凋亡指数呈逐渐增高的趋势。有研究者认为在应激状态的早期Cx43的降解是一种保护性的反应,这是为了防止细胞内生成的有害物质迅速传播,从而使损伤局限化。但是随着损伤的加剧和时间的延长,这种保护机制开始发挥相反的作用,会进一步加剧细胞的自噬作用,引起更多细胞凋亡,进而使心功能受损[10-11]。
在既往研究中,Cx43和房颤的关系一直存在一定争议。Wetzel等[12]发现,Cx43的总含量在房颤病人中表达增高。严卉等[13]发现,房颤患者中的Cx43的表达量增加,但排列紊乱无规则。而最近的一些研究中,Shin等[14]通过构建心肌肥厚模型,借助食道调搏仪诱发心房颤动,发现Cx43表达下降和侧链化会增加房颤的易感性,Igarashi等[15]通过快速心房起搏建立房颤模型,发现房颤组Cx43表达降低,而以腺病毒转染增加Cx43的表达后,可以减少房颤的发生。Cx43的重构包括了Cx43的内部化,侧链化,乃至降解。而真正能够发挥信号传导作用的是位于闰盘处的缝隙连接蛋白,侧链化的Cx43传递信号的功能大为减弱[3]。因此,部分研究中Cx43总含量增高,可能是由于发挥信号传导功能的缝隙连接蛋白虽然减少,但侧链化及内部化增多,从而引起总含量增高。
综上所述,我们认为Cx43的重构和降解与房颤的易感性密切相关,而交感神经可能通过氧化应激效应,引起Cx43的重构与下调,从而介导心房颤动的发生。
[1] Del Ry S, Moscato S, Bianchi F, et al. Altered expression of connexin 43 and related molecular partners in a pig model of left ventricular dysfunction with and without dipyrydamole therapy[J]. Pharmacol Res, 2015, 95-96:92-101.
[2] 易 忠, 张海澄, 张 萍, 等. 犬心房与肺静脉交感神经分布与阵发性心房颤动的关系[J]. 中华医学杂志, 2007, 87(48):3433-3435.
[3] Duffy HS, Wit AL. Is there a role for remodeled connexins in AF? No simple answers[J]. J Mol Cell Cardiol, 2008, 44(1):4-13.
[4] Korde AS, Yadav VR, Zheng YM, et al. Primary role of mitochondrial Rieske iron-sulfur protein in hypoxic ROS production in pulmonary artery myocytes[J]. Free Radic Biol Med, 2011, 50(8):945-952.
[5] Harris BS, Baicu CF, Haghshenas N, et al. Remodeling of the peripheral cardiac conduction system in response to pressure overload[J]. Am J Physiol Heart Circ Physiol, 2012, 302(8):H1712-H1725.
[6] 李华波, 陈世健, 胡建华, 等. 通心络对心肌梗死大鼠心室缝隙连接蛋白43重构及室性心律失常的影响[J]. 中国病理生理杂志, 2015, 31(2):274-278.
[7] 甄 洁, 李晓霞. 有氧运动抑制心梗后心力衰竭大鼠左室重塑及交感神经重塑[J]. 中国病理生理杂志, 2015, 31(6):973-979.
[8] Martins-Marques T, Catarino S, Marques C, et al. To beat or not to beat: degradation of Cx43 imposes the heart rhythm[J]. Biochem Soc Trans, 2015, 43(3):476-481.
[9] Adam O, Lavall D, Theobald K, et al. Rac1-induced connective tissue growth factor regulates connexin 43 and N-cadherin expression in atrial fibrillation[J]. J Am Coll Cardiol, 2010, 55(5):469-480.
[10]Martins-Marques T, Catarino S, Zuzarte M, et al. Ischaemia-induced autophagy leads to degradation of gap junction protein connexin43 in cardiomyocytes[J]. Biochem J, 2015, 467(2):231-245.
[11]Matsui Y, Takagi H, Qu X, et al. Distinct roles of autophagy in the heart during ischemia and reperfusion: roles of AMP-activated protein kinase and Beclin 1 in mediating autophagy[J]. Circ Res, 2007, 100(6):914-922.
[12]Wetzel U, Boldt A, Lauschke J, et al. Expression of connexins 40 and 43 in human left atrium in atrial fibrillation of different aetiologies[J]. Heart, 2005, 91(2):166-170.
[13]严 卉, 陈君柱, 倪一鸣. 心房肌缝隙连接蛋白40、43表达改变与心房颤动的关系[J]. 国外医学: 心血管疾病分册, 2003, 30(6):375-377, 381.
[14]Shin SY, Jo WM, Min TJ, et al. Gap junction remodelling by chronic pressure overload is related to the increased susceptibility to atrial fibrillation in rat heart[J]. Europace, 2015, 17(4):655-663.
[15]Igarashi T, Finet JE, Takeuchi A, et al. Connexin gene transfer preserves conduction velocity and prevents atrial fibrillation[J]. Circulation, 2012, 125(2):216-225.
(责任编辑: 陈妙玲, 罗 森)
Effects of sympathomimetic agent on remodeling of connexin 43 in atrium of isolated heart with rapid atrial pacing
SHU Cheng-lin1, HE Yan1, ZENG Zhi-yu1, HE Tao2, LI Jin-yi3, HUANG Wei-qiang3, XU Jian1, HUANG Yan-qun1
(1DepartmentofGeriatricCardiology,2DepartmentofElectrocardiogram,3DepartmentofCardiology,FirstAffiliatedHospitalofGuangxiMedicalUniversity,Nanning530021,China.E-mail:hyxjwxy@126.com)
AIM: To investigate the changes of connexin 43 (Cx43) via establishing a model of sympathomimetic atrial fibrillation (AF). METHODS: The mongrels (n=15) were randomly divided into control group, rapid atrial pacing (RAP) group and isoprenaline (ISO) perfusion+RAP group (ISO+RAP group). All mongrels’ hearts were taken out rapidly by median sternotomy to establish the cardiac model with Langendorff perfusioninvitro. The atrial effective refractory period (AERP) and AF inducability were tested. The expression and distribution of tyrosine hydroxylase (TH) were analyzed by immunohistochemistry. Total protein level of Cx43 and phosphorylation of Cx43 were determined by Western blot. The distribution of Cx43 were also observed by immunofluorescence staining. The cell apoptosis was analyzed by TUNEL staining. The generation of reactive oxygen species (ROS) in the mitochondria was measured by fluorescence spectrophotometry. RESULTS: No significant change of AERP was found between control group and RAP group, while that in ISO+RAP group was significantly decreased (P<0.05) and induced AF. Compared with control group, the expression of TH, apoptotic index and the generation of ROS increased gradually (P<0.05), while the content of Cx43 decreased gradually both in the total protein and the phosphorylation levels in RAP group and ISO+RAP group (P<0.05). The fluorescence intensity of Cx43 was also attenuated and Cx43 were lateralized apparently in RAP group, while Cx43 were characterized as punctate distribution in ISO+RAP group. CONCLUSION: Sympathetic nerves may activate autophagosome at intercalated discs and trigger cell apoptosis, resulting in remodeling and downregulation of Cx43 via oxidative stress, thus having effects on mediating and maintaining AF.
Sympathetic nerves; Connexin 43; Atrial fibrillation; Oxidative stress; Autophagy
1000- 4718(2017)02- 0215- 06
2016- 07- 28
2016- 11- 07
国家自然科学基金资助项目(No. 81260039);广西自然科学基金资助项目(No. 2013GXNSFAA278005);第一批广西医学高层次骨干人才培养“139”计划经费
R541.7; R363
A
10.3969/j.issn.1000- 4718.2017.02.004
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 0771-5356307; E-mail: hyxjwxy@126.com

