依达拉奉治疗急性脑梗死的疗效及对炎症因子与NIHSS评分的影响
夏 慧, 胡婷婷, 陆悌明
(东南大学附属中大医院江北院区(原南京市大厂医院) 神经内科, 江苏 南京, 210044)
依达拉奉治疗急性脑梗死的疗效及对炎症因子与NIHSS评分的影响
夏 慧, 胡婷婷, 陆悌明
(东南大学附属中大医院江北院区(原南京市大厂医院) 神经内科, 江苏 南京, 210044)
依达拉奉; 急性脑梗死; 炎症因子; NIHSS
急性脑梗死俗称中风,是临床上神经内科常见的急症之一[1]。急性脑梗死发病机制复杂,病死率极高,治疗后也极易伴发瘫痪或残疾等严重并发症[2]。血清炎症因子如超敏C反应蛋白(hs-CRP)、白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)等能在一定程度上反映急性脑梗死的病情发展程度[3]。依达拉奉是一种神经保护剂,能够清除对神经细胞有害的自由基,缓解神经元受损[4-5]。本文观察依达拉奉对急性脑梗死患者的临床疗效及其对患者血清炎症因子和美国国立卫生研究院制定的卒中量表(NIHSS)的影响,现报告如下。
1 资料与方法
1.1 一般资料
选取本院神经内科2013年6月—2014年12月收治的急性脑梗死患者92例,所有患者均符合中国第4届脑血管病会议对急性脑梗死制定的诊断标准[6]。将92例患者随机分为观察组和对照组。观察组46例,男30例,女16例,年龄47~81岁,平均(64.3±7.6)岁,平均病程(41.2±9.5) h; 对照组46例,男31例,女15例,年龄46~82岁,平均(65.6±8.1)岁,平均(42.8±10.1) h。2组患者性别、年龄、病程等一般资料比较,差异无统计学意义(P>0.05), 具有可比性。排除标准: ① 患有感染性疾病、出血性疾病、恶性肿瘤、自身免疫性疾病、血液系统疾病等的患者; ② 严重肝功能和肾功能不全的患者; ③ 治疗前应用过能够影响血清炎症因子的药物,例如抗炎药、抗生素等; ④ 病情特别危急需采用其他治疗方案的患者; ⑤ 妊娠期或哺乳期妇女; ⑥ 存在神志不清或精神疾病的患者; ⑦ 签署知情同意书的患者。退出标准: ① 治疗过程中出现严重药物不良反应的患者; ② 治疗过程中病情加重而急需采用其他治疗的患者; ③ 患者自身或患者家属要求退出的; ④ 由于其他不可控因素而退出的患者。
1.2 治疗方法
2组在治疗过程中均无患者退出。对照组给予阿司匹林100 mg, 口服1次/d, 血塞通400 mg, 溶于5%的葡萄糖溶液250 mL, 静脉滴注, 1次/d, 持续14 d。观察组在对照组的基础上,采用30 mg依达拉奉(生产厂家:南京先声东元制药有限公司;批准文号:国药准字H20031342)溶于0.9%的氯化钠溶液100 mL, 静脉滴注,2次/d, 持续治疗14 d。治疗后对2组患者进行疗效判定,观察2组患者治疗前后血清hs-CRP、IL-6、TNF-α水平和NIHSS评分变化,以及治疗过程中不良反应发生情况。
1.3 疗效判定
依据全国第4届脑血管病学术会议上通过的对脑梗死患者临床神经功能缺损程度评分标准减少程度[7]为临床疗效判定标准: ① 基本痊愈:神经功能缺损评分减少程度在91~100%, 且为0级病残程度; ② 显著进步:神经功能缺损评分减少程度在46~90%, 且为1~3级病残程度; ③ 进步:神经功能缺损评分减少程度在18~45%; ④ 无效:神经功能缺损评分减少程度小于18%, 或者神经功能缺损评分增加,或者患者死亡。
1.4 观察指标
在治疗前后分别采集2组患者的空腹上肢静脉血6 mL, 以3 000 r/min的速度常温离心15 min, 分离血清为2份置于-70℃保存待检。分别应用胶乳增强免疫透射比浊法(LEITD)测定血清hs-CRP水平,酶联免疫吸附法(ELISA)测定血清IL-6, 放射免疫分析法(RIA)测定TNF-α水平,实验所需试剂盒均购自南京建成生物科技有限公司,并且严格按照试剂盒说明书进行操作。
1.5 统计学方法
研究所得数据均使用统计学软件SPSS 17.0来分析,其中用均数(标准差表示计量资料,组间比较采用t检验;计数资料用例数或百分比或率表示,采用χ2检验,检验水准(α=0.05,P<0.05为差异有统计学意义。
2 结 果
观察组基本痊愈14例,显著进步18例,进步12例,无效2例,总有效率为95.65%; 对照组基本痊愈5例,显著进步9例,进步22例,无效10例,总有效率为78.26%。观察组总有效率显著高于对照组(χ2=6.133,P<0.05)。观察组、对照组患者治疗前NIHSS评分为(16.34±4.13)、(16.48±4.20)分,差异无统计学意义(P>0.05)。治疗后观察组、对照组NIHSS评分为(7.56±2.97)、(10.02±3.18)分,均较治疗前显著下降,且观察组显著低于对照组(P<0.05)。
治疗后, 2组患者的血清hs-CRP、IL-6、TNF-α水平均显著下降(P<0.05); 治疗后,观察组的血清hs-CRP、IL-6、TNF-α水平显著低于对照组(P<0.05), 见表1。观察组在治疗过程中有3例发生不良反应,分别为皮疹1例,恶心呕吐1例,血小板减少1例,不良反应发生率为6.52%; 对照组中有2例发生不良反应,分别为皮疹1例,腹部疼痛1例,不良反应发生率为4.35%。
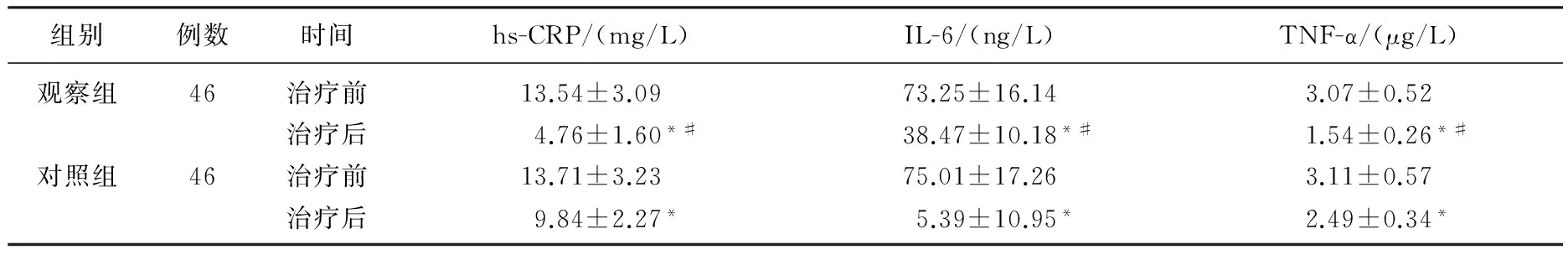
表1 2组患者治疗前后血清hs-CRP、IL-6、TNF-α水平比较
与治疗前相比, *P<0.05; 与对照组相比, #P<0.05。
3 讨 论
大量研究[8-9]均证实炎症反应与急性脑梗死的发病和发展过程密切相关,大脑局部缺血后,周围白细胞进入缺血部位和产生大量的活性氧自由基,激活免疫系统和炎细胞,诱导一系列的炎症反应因子的分泌和释放,介导炎症反应。大量的炎症反应因子使脑组织缺血性损伤转变成炎症性损伤,加剧神经元细胞的凋亡。此外,炎症反应是动脉粥样硬化形成和扩大的主要因素,而冠状动脉粥样硬化是急性脑梗死的病理基础,是引发急性脑梗死的最主要的危险因素之一。hs-CRP是一种能够标志炎症反应程度的非特异性急性时相反应蛋白,在炎症反应中发挥着至关重要的作用,是反映急性脑梗死病情发展程度和预后的独立指标[10]。大量研究[11-12]表明,急性脑梗死患者的血清hs-CRP水平会迅速提升,在得到有效的治疗后,血清hs-CRP水平会缓慢降低。有报道称心血管疾病患者的血清hs-CRP水平与急性脑梗死风险呈正相关性, hs-CRP水平越高,急性脑梗死的发病率也随之增高。
IL-6和TNF-α也是两种在炎症反应中起着重要作用的炎症反应因子。局部脑组织缺血损伤后, hs-CRP水平升高,刺激内皮细胞释放大量的活性氧自由基,激活炎症反应,进一步促使巨噬细胞和黏附分子对炎症反应因子IL-6、TNF-α的分泌,介导炎症反应。TNF-α水平的升高能诱导IL-6的上调,而IL-6不仅可以反过来对TNF-α产生负反馈调节作用,升高TNF-α水平,而且还能诱导和刺激hs-CRP的合成和释放。hs-CRP的升高能促使动脉粥样硬化斑块的形成和扩大, IL-6对血小板的聚集和黏附具有促进作用,而过高的TNF-α具有间接的神经毒性,不断损伤神经元细胞,导致急性脑梗病情不断恶化。本研究结果显示, 2组急性脑梗死患者在采取治疗后,血清hs-CRP、IL-6和TNF-α三者水平均显著下降(P<0.05), 而且NIHSS评分也显著降低(P<0.05), 说明血清炎症因子是急性脑梗死预后的重要独立指标,其水平的下降能改善患者神经功能缺损。
自由基是另一种造成炎症反应和脑组织缺血再灌注损伤相关的重要物质,体内的自由基过多,将对脑组织造成过氧化损伤,引起或加重炎症反应,最终导致神经元的损伤,扩大梗死面积。依达拉奉是一种强效的新型自由基清除剂,其化学结构为3-甲基-1-苯基-2-吡唑啉-5-酮,分子量较小,脂溶性较强,易于透过血脑屏障,从而在脑组织中起到有效迅速清除自由基作用。此外,依达拉奉在体内进一步促进会和刺激前列环素的合成和释放,前列环素可以减少炎症反应因子的释放,下调hs-CRP、IL-6和TNF-α的水平,抑制或缓解炎症反应,最终同样可以起到神经元保护作用。本文中,观察组采用依达拉奉治疗急性脑梗死患者,其总有效率为95.65%, 显著高于对照组的78.26%(P<0.05); 治疗后,观察组患者的血清hs-CRP、IL-6和TNF-α水平均显著低于对照组(P<0.05), 并且其NIHSS评分也显著小于对照组(P<0.05), 这些结果均证明依达拉奉的神经保护作用明显并具有一定的抗炎作用,能提高临床疗效。观察组和对照组的不良反应发生率分别为6.52%和4.35%, 差异无统计学意义(P>0.05)。
[1] Wong K S, Shan G M, Yu L C F, et al. Mechanisms of acute cerebral infarctions in patients with middle cerebral artery stenosis: A diffusion-weighted imaging and microemboli monitoring study[J]. Annals of Neurology, 2006, 52(1): 74-81.
[2] 黄渊智, 胡翠竹, 黄载文. 脑梗死出血性并发症的相关危险因素及预后分析[J]. 实用临床医药杂志, 2013, 17(07): 33-35.
[3] 桂千, 程庆璋. 炎症因子与急性脑梗死的相关性研究[J]. 中国实用神经疾病杂志, 2015(20): 42-43.
[4] 余永程. 依达拉奉联合高压氧治疗急性脑梗死的临床观察[J]. 贵州医药, 2013, 37(01): 49-51.
[5] Brott T, Adams H P, Olinger C P, et al. Measurements of acute cerebral infarction: a clinical examination scale[J]. Stroke, 1989, 20(20): 864-870.
[6] 全国第4届脑血管病学术会议. 各类脑血管疾病诊断要点[J]. 中华神经科杂志, 1996, 29(6): 379-380.
[7] 盛莉. 脑卒中患者临床神经功能缺损程度评分标准[J]. 中国乡村医药, 1995(1): 45-45.
[8] 薛龙, 尧荣凤, 葛岭, 等. 轻型颅脑损伤后患者血清生物标志物GFAP-BPDs的相关性研究[J]. 外科研究与新技术, 2014, 3(1): 24-27.
[9] Wong C H, Crack P J. Modulation of neuro-inflammation and vascular response by oxidative stress following cerebral ischemia-reperfusion injury[J]. Current Medicinal Chemistry, 2008, 15(1): 1-14.
[10] 刘伟民, 杨晓武, 周红兵. 急性脑梗死与血清超敏C反应蛋白水平的相关性研究[J]. 贵州医药, 2009, 33(10): 891-892.
[11] 王建明, 王崇, 杨威, 等. 急性脑梗死患者血清高敏C-反应蛋白检测的临床意义[J]. 实用临床医药杂志, 2015, 19(21): 187-188.
[12] 吴海荣, 蔡毅, 苏庆杰, 等. 进展性脑梗死与血清炎性细胞因子白细胞介素-6和肿瘤坏死因子-α的相关性研究[J]. 临床神经病学杂志, 2014, 27(06): 455-457.
2016-11-03
R 743
A
1672-2353(2017)01-150-02
10.7619/jcmp.201701052

