奥沙利铂对结肠癌细胞DNA损伤修复类抗药基因表达的影响
房 晓, 尹 华, 胡腾惠, 金世光, 王大新
(1. 扬州大学医学院, 江苏 扬州, 225001; 2. 扬州大学临床医学院, 江苏 扬州, 225001)
论 著
奥沙利铂对结肠癌细胞DNA损伤修复类抗药基因表达的影响
房 晓1, 尹 华1, 胡腾惠2, 金世光2, 王大新2
(1. 扬州大学医学院, 江苏 扬州, 225001; 2. 扬州大学临床医学院, 江苏 扬州, 225001)
目的 观察奥利沙铂对结肠癌细胞DNA损伤修复类基因表达的影响。方法 采用奥利沙铂处理结肠癌细胞株HCT116 48 h。以Western blot免疫印迹法检测奥利沙铂诱导的DNA损伤。采用CCK-8方法探讨奥利沙铂对HCT116细胞生长的影响。采用实时荧光定量PCR(qRT-PCR)方法检测奥利沙铂处理后相关DNA损伤修复基因的表达。结果 奥利沙铂处理后, HCT116细胞中DNA损伤标志基因γ-H2AX表达明显上升。DNA损伤切除修复相关基因XPC表达在奥利沙铂处理后出现显著上升,其他DNA损伤修复基因mRNA表达无明显上调。结论 XPC基因可能在临床应用奥沙利铂治疗结肠癌时肿瘤细胞产生抗药性的过程中起到了关键作用。
奥沙利铂; 结肠癌细胞; DNA损伤修复; 抗药性
奥沙利铂是临床上常用的DNA损伤类化疗药物, 对结肠癌有着较好疗效[1-2]。DNA损伤类化疗药物通过诱导DNA损伤以促进肿瘤细胞凋亡,抑制肿瘤细胞生长,是肿瘤化疗药物的一大重要组成,然而其局限性在于用药过程中肿瘤细胞抗药性的产生[3]。肿瘤细胞中DNA修复相关蛋白的表达上调加快了细胞内DNA损伤的修复,从而导致了细胞对DNA损伤类化疗药物如奥沙利铂等的抗药性[4]。本研究观察奥沙利铂作用结肠癌细胞后对DNA损伤修复类相关基因表达的影响,现报告如下。
1 材料与方法
1.1 试剂、细胞系与仪器设备
奥沙利铂(纯度>98%)购自美国Sigma-Aldrich公司; 人结肠癌细胞系HCT116由北京蛋白质组研究中心惠赠; DMEM细胞培养基(Gibco, 美国); 小牛血清(四季青,中国); 青霉素/链霉素双抗溶液(Gibco, 美国); CCK-8细胞增殖活性检测试剂盒(Vazyme, 中国); γ-H2AX(Ser139)抗体(Millipore, 美国); GAPDH抗体(Vazyme, 中国); 辣根过氧化酶标记羊抗小鼠二抗(Biorad, 美国); ECL试剂盒(Thermo, 美国); Trizol RNA提取试剂(Invitrogen, 美国); 反转录试剂盒(Thermo, 美国); SYBR Green荧光定量PCR试剂盒(Vazyme, 中国); 细胞培养箱(Thermo, 美国); 引物合成(Invitrogen, 美国); Tecan M2000酶标仪(Tecan, 美国); Bio-Rad Chemi Doc XRS化学发光凝胶成像仪(Bio-Rad, 美国); ABI StepOne Plus实时荧光定量PCR仪 (ABI, 美国)。
1.2 实验方法
1.2.1 结肠癌细胞培养条件与药物处理: 结肠癌细胞HCT116培养在含15%小牛血清及1%青霉素/链霉素双抗溶液的DMEM完全培养基中,培养条件为37 ℃、5% CO2。待细胞长至60%~70%汇合度,在培养基中加入5 mmol/L奥沙利铂,处理48 h。1.2.2 CCK-8法检测细胞活性: HCT116细胞以2×104个/孔密度接种于96孔板中,分为2组,分别加入0、5 mmol/L奥沙利铂处理。药物处理48 h后,每孔加入10 μL CCK-8溶液,继续培养1.5 h后,于酶标仪450 nm波长读数,检测吸光度。1.2.3 Western Blot检测细胞内DNA损伤: 收取细胞,用RIPA溶液(含蛋白酶抑制剂及磷酸酶抑制剂)裂解提取蛋白,以Bradford法进行蛋白定量,按每孔60 μg蛋白上样进行SDS-PAGE凝胶电泳,浓缩胶浓度为5%, 分离胶浓度为12%。采用湿转方法将蛋白转至0.2 μmol/L硝酸纤维膜,使用含5%脱脂牛奶的TBST溶液室温封闭1 h, 后在γ-H2AX抗体中(稀释浓度1∶200) 4 ℃孵育过夜。二抗(1∶2 000稀释)孵育时间为1 h, 使用伯乐XRS化学发光成像分析仪显影成像。
1.2.4 RNA提取、反转录及荧光实时定量PCR检测DNA损伤修复基因mRNA表达: 采用Trizol试剂,按说明书要求进行细胞总RNA提取,按试剂盒说明书步骤通过两步法完成cDNA反转录,随后使用SYBR Green试剂进行荧光定量PCR检测DNA损伤相关基因的mRNA表达水平。相关引物序列来自Primer Bank数据库[5]。荧光定量PCR扩增体系为20 μL, 扩增反应及结果分析通过Step One Plus实时荧光定量PCR系统(ABI公司,美国)进行。
1.3 统计学分析
本实验采用SPSS 11.5软件进行统计学分析,以Students′ t test进行实验数据组间差异比较,检验水准α=0.05,P<0.05为差异有统计学意义。
2 结 果
2.1 奥沙利铂诱导结肠癌细胞DNA损伤并抑制
其生长
为了证实奥沙利铂对结肠癌细胞通过诱导DNA损伤而产生的生长抑制作用,在HCT116细胞的培养体系中加入了5 mmol/L奥沙利铂孵育48 h, 通过Western Blot方法检测细胞DNA损伤标志基因γ-H2AX的表达。结果显示,奥沙利铂处理后γ-H2AX水平出现显著上调,提示奥沙利铂对DNA损伤的诱导作用。为验证奥沙利铂对结肠癌细胞生长的抑制作用,以CCK-8方法检测奥沙利铂处理48 h后结肠癌细胞的活性。结果显示,奥沙利铂处理后结肠癌细胞生长活性显著下降(39.8%,P<0.01), 提示奥沙利铂抑制结肠癌细胞生长。见图1。
2.2 奥沙利铂促进DNA损伤修复基因XPC的
mRNA表达上调
为了检测奥沙利铂对DNA损伤修复基因表达的影响,以荧光定量PCR方法检测奥沙利铂处理48 h后结肠癌细胞中相关修复基因的表达。根据功能划分, DNA损伤修复基因分为切除修复、错配修复以及直接修复调控基因3大类[4]。 结果发现,奥沙利铂处理后,结肠癌细胞中切除修复类基因XPC的mRNA表达出现显著上升,与对照组相比,其mRNA表达相对丰度为2.707±0.095 (P<0.0005)。其他7个切除修复类基因中, RAD23B表达为(1.546±0.231), 呈略微上升; APEX1、UNG、XRCC1表达均未出现显著变化, FEN1、LIG1及LIG3表达甚至呈现下降趋势。
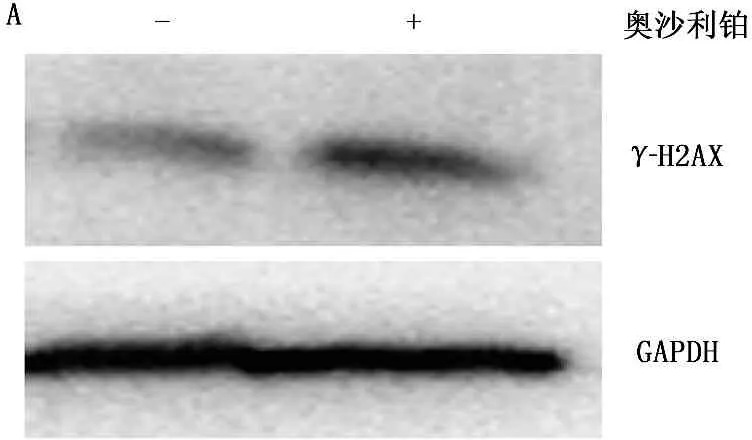
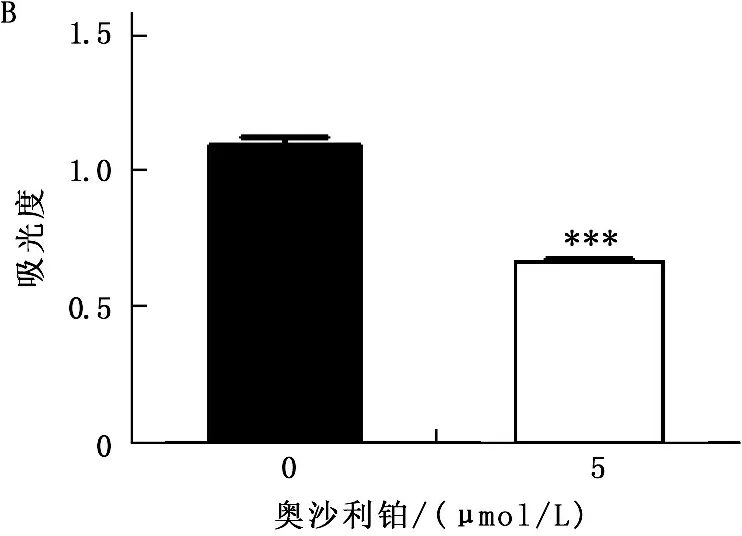
A. 奥沙利铂(5 μmol/L)处理HCT116细胞48 h后, Western blot实验提示DNA损伤标志蛋白γ-H2AX表达显著上升 B. CCK-8实验显示HCT116细胞经5 μmol/L奥沙利铂处理48 h后, 其生长活性显著下降(***P<0.0001)
图1 奥沙利铂诱导结肠癌细胞HCT116产生DNA损伤并抑制其生长活性
奥沙利铂处理结肠癌细胞后,错配修复类基因中MLH1、MSH2及MSH6表达出现下降, PMS2表达没有明显变化; 直接修复类基因MGMT表达亦未发生明显改变。以上结果提示XPC可能是结肠癌细胞经奥沙利铂处理后产生抗药性的关键基因。见图2。
3 讨 论
DNA是临床抗肿瘤药物的一个主要靶点,以诱导DNA损伤来促进肿瘤细胞凋亡为机制的铂类化疗药物是目前最有效的临床化疗药物之一。奥沙利铂通过诱导DNA双链交联,阻断DNA复制及转录过程,是继顺铂后开发出来的第3代铂类抗癌药物[6]。因肿瘤细胞对其产生的抗药性与顺铂等铂类药物相较更低,奥沙利铂在结肠癌的临床治疗中得到了广泛应用[6-8]。
DNA损伤类化疗药物的一大局限在于抗药性的产生,而造成肿瘤细胞对这类药物抗药性的主要原因是DNA损伤反应通路异常,具体包括DNA损伤修复能力上调及DNA损伤耐受性增加2个方面[4, 9]。化疗药物对肿瘤细胞DNA造成的损伤主要通过切除修复、错配修复以及直接修复3种方式进行。DNA损伤修复蛋白的表达上调,提高了肿瘤细胞对DNA损伤的修复能力,从而导致了其对DNA损伤类化疗药物抗药性的产生[4, 10-11]。此外,跨损伤DNA合成机制可以利用损伤DNA链为模板进行DNA合成,提高了细胞对DNA损伤的耐受性,亦可使肿瘤细胞对DNA损伤类化疗药物敏感性降低[12-16]。
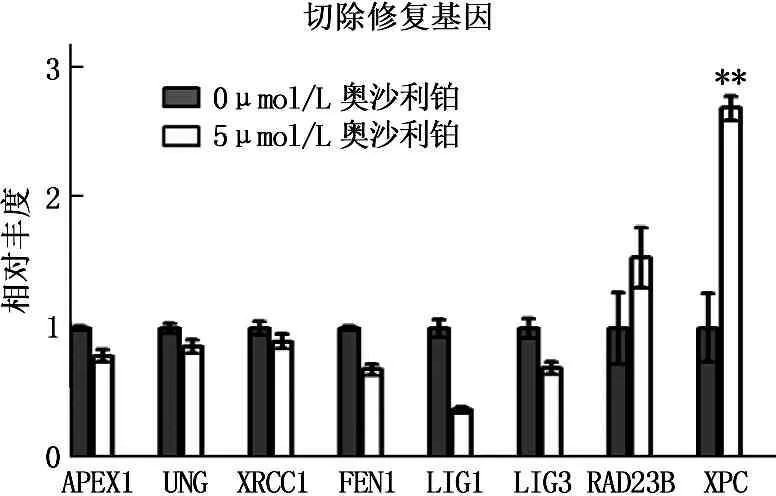
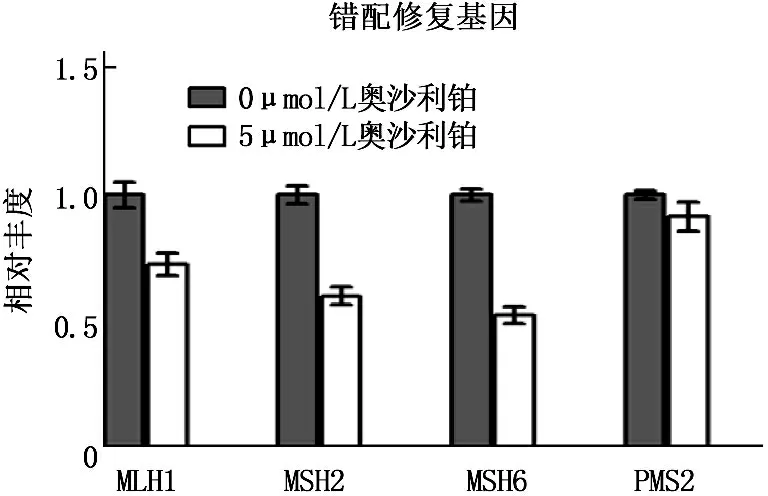
荧光实时定量PCR分析5 μmol/L奥沙利铂处理HCT116细胞48 h后DNA损伤修复基因mRNA表达情况, **P<0.0005
图2 奥沙利铂诱导DNA损伤切除修复基因XPC表达上调
本研究首先通过对奥沙利铂处理结肠癌细胞HCT116后DNA损伤标志性蛋白表达以及细胞生长活性改变的观察,验证了奥沙利铂作为DNA损伤类化疗药物对抑制结肠癌细胞生长的有效性。尽管文献[17-26]报道结肠癌细胞在奥沙利铂处理过程中会逐渐产生抗药性,然而抗药性产生的具体机制目前尚未明确。本研究通过荧光定量PCR方法探讨可能导致抗药性的DNA损伤修复类基因的表达。作者发现奥沙利铂处理后,结肠癌细胞中切除修复基因XPC表达出现显著上升。结合以往研究,推测结肠癌细胞在奥沙利铂处理后可能通过提高XPC的表达,增强DNA损伤修复能力,进而减少奥沙利铂通过诱导DNA损伤而导致的细胞凋亡,此机制可能为结肠癌细胞对奥沙利铂产生抗药性的一个重要方面[21-23]。
综上所述,初步研究结果表明, DNA损伤切除修复基因XPC可能是结肠癌细胞对奥沙利铂产生抗药性的关键基因。
[1] RAYMOND E, FAIVRE S, CHANEY S, et al. Cellular and molecular pharmacology of oxaliplatin[J]. Mol Cancer Ther, 2002, 1(3): 227-235.
[2] SONG N, POGUE-GEILE K L, GAVIN P G, et al. Clinical outcome from oxaliplatin treatment in stage Ⅱ/Ⅲ colon cancer according to intrinsic subtypes: Secondary analysis of nsabp c-07/nrg oncology randomized clinical trial[J]. JAMA Oncol, 2016, 2(9): 1162-1169.
[3] CHEUNG-ONG K, GIAEVER G, NISLOW C. DNA-damaging agents in cancer chemotherapy: Serendipity and chemical biology[J]. Chem Biol, 2013, 20(5): 648-659.
[4] SALEHAN M R, MORSE H R. DNA damage repair and tolerance: A role in chemotherapeutic drug resistance[J]. Br J Biomed Sci, 2013, 70(1): 31-40.
[5] SPANDIDOS A, WANG X, WANG H, et al. Primerbank: A resource of human and mouse pcr primer pairs for gene expression detection and quantification[J]. Nucleic Acids Res, 2010, 38(Database issue): D792-799.
[6] CULY C R, CLEMETT D, WISEMAN L R. Oxaliplatin.A review of its pharmacological properties and clinical efficacy in metastatic colorectal cancer and its potential in other malignancies[J]. Drugs, 2000, 60(4): 895-924.
[7] BLEIBERG H. Oxaliplatin (l-ohp): A new reality in colorectal cancer[J]. Br J Cancer, 1998, 77 (Suppl 4): 1-3.
[8] HIND D, TAPPENDEN P, TUMUR I, et al. The use of irinotecan, oxaliplatin and raltitrexed for the treatment of advanced colorectal cancer: Systematic review and economic evaluation[J]. Health Technol Assess, 2008, 12(15): 162-169.
[9] KACHALAKI S, EBRAHIMI M, MOHAMED KHOSROSHAHI L, et al. Cancer chemoresistance; biochemical and molecular aspects: A brief overview[J]. Eur J Pharm Sci, 2016, 89: 20-30.
[10] GENTILE F, TUSZYNSKI J A, BARAKAT K H. Modelling DNA repair pathways: Recent advances and future directions[J]. Curr Pharm Des, 2016, 22(23): 3527-3546.
[11] HERATH N I, DEVUN F, LIENAFA M C, et al. The DNA repair inhibitor dt01 as a novel therapeutic strategy for chemosensitization of colorectal liver metastasis[J]. Mol Cancer Ther, 2016, 15(1): 15-22.
[12] LEHMANN A R, NIIMI A, OGI T, et al. Translesion synthesis: Y-family polymerases and the polymerase switch[J]. DNA Repair (Amst), 2007, 6(7): 891-899.
[13] ALBERTELLA M R, LAU A, O′CONNOR M J. The overexpression of specialized DNA polymerases in cancer[J]. DNA Repair (Amst), 2005, 4(5): 583-593.
[14] XIANG Z, KANG Q J, XIANG X. Gene and protein expression in the oxaliplatin-resistant ht29/l-ohp human colon cancer cell line[J]. Genet Mol Res, 2015, 14(3): 11013-11022.
[15] LIU Z, QIU M, TANG Q L, et al. Establishment and biological characteristics of oxaliplatin-resistant human colon cancer cell lines[J]. Chin J Cancer, 2010, 29(7): 661-667.
[16] TO K K, POON D C, WEI Y, et al. Data showing the circumvention of oxaliplatin resistance by vatalanib in colon cancer[J]. Data Brief, 2016, 7: 437-444.
[17] 刘杲全. 反式维甲酸联合奥沙利铂对结肠癌LoVo细胞株增殖、血管新生能力的影响[J]. 海南医学院学报, 2014, 20(12): 1610-1613.
[18] 江恒, 陈健, 陈克力, 等. 沉默孕烷X受体增强结肠癌LS174T细胞对奥沙利铂敏感性的影响[J]. 第三军医大学学报, 2012, 34(1): 5-8.
[19] 蔡晓东. 奥沙利铂联合替吉奥治疗复发转移性大肠癌临床观察[J]. 实用临床医药杂志, 2013, 17(23): 113-114.
[20] 徐明昊, 张悦, 孙明华, 等. 通过奥沙利铂抑制PI3K/Akt通路以增强TRAIL诱导结肠癌RKO细胞凋亡敏感性的实验研究[J]. 中国全科医学, 2013, 16(18): 2113-2116.
[21] 吕会增, 陈图锋, 郑宗珩, 等. 全反式维甲酸提高人结肠癌LoVo细胞对奥沙利铂敏感性[J]. 中国药理学通报, 2009, 25(6): 773-777.
[22] 王新颖, 王继德, 姜泊. ROS在奥沙利铂诱导PUMA表达致肠癌细胞凋亡过程中的作用[J]. 中国药理学通报, 2006, 22(12): 1522-1525.
[23] 向征, 张才全, 汤为学. 人结肠癌耐药细胞系HT29/L-OHP的建立及其生物学特性[J]. 第三军医大学学报, 2008, 30(9): 840-843.
Effect of oxaliplatin on expression of drug resistant gene in DNA damage repair in human colon cancer cells
FANG Xiao1, YIN Hua1, HU Tenghui2, JIN Shiguang2, WANG Daxin2
(1.MedicalCollegeofYangzhouUniversity,Yangzhou,Jiangsu, 225001; 2.ClinicalMedicalCollegeofYangzhouUniversity,Yangzhou,Jiangsu, 225001)
Objective To observe the effect of oxaliplatin on expression of drug resistant gene in DNA damage repair in human colon cancer cells.Methods The human colon cancer cell line HCT116 was processed with oxaliplatin for 48 hours.Western blot was used to examine DNA damage induced by oxaliplatin treatment. CCK-8 assay was used to explore the effect of oxaliplatin on growth of HCT116. The real-time PCR was used to detect the expression of DNA repair genes after oxaliplatin treatment. Results After the treatment of oxaliplatin, the expression of the DNA-damage-marker gene γ-H2AX increased significantly, and DNA damage excision repair related gene XPC increased significantly as well.The mRNA expression of other DNA damage repair genes had no significant increase. Conclusion The gene XPC might play a key role in generating drug resistance when treating colon cancer with oxaliplatin in clinic.
oxaliplatin; colon cancer cells; DNA damage repair; drug resistance
2016-10-26
江苏省自然科学基金资助项目(BK20140497); 江苏省高校自然科学研究面上项目(14KJB310024);江苏省扬州市自然科学基金面上项目(YZ2014059)
王大新, E-mail: daxinw2002@sina.com
R 735.3
A
1672-2353(2017)01-001-04
10.7619/jcmp.201701001

