一种家蚕后部丝腺高纯度线粒体提取方法
陈金娥,李风波,何丽华,沈卫锋
(浙江省农业科学院 蚕桑研究所,浙江 杭州 310021)
一种家蚕后部丝腺高纯度线粒体提取方法
陈金娥,李风波,何丽华,沈卫锋
(浙江省农业科学院 蚕桑研究所,浙江 杭州 310021)
为了从家蚕后部丝腺中提取高纯度的线粒体,采用差速离心和非连续Percoll密度梯度离心方法,分离和纯化家蚕后部丝腺线粒体,并通过电镜观察和蛋白免疫印迹验证提取效果。结果表明,采用该方法分离的线粒体杂质少、纯度高,并且线粒体内外膜结构完整。该研究建立了一种提取家蚕后部丝腺线粒体的方法,为进一步研究线粒体在家蚕后部丝腺中的功能奠定了基础。
家蚕; 后部丝腺; 线粒体; 纯化
线粒体是一种重要的细胞器,是细胞的产能、代谢和凋亡中心,在生命过程中发挥着重要的生理功能。线粒体除了生产ATP为细胞供能外,还具有组织特异性以适应不同组织的生理需要,在真核生物的生长发育过程及先天免疫中起重要作用[1-5]。对线粒体结构与功能的研究通常是在离体的线粒体上进行的,因此从某一组织获得高纯度的线粒体是研究线粒体组织功能的关键。家蚕幼虫丝腺是合成分泌丝蛋白的重要组织器官,其中,后部丝腺是专门分泌丝素蛋白的部分,丝素在蚕丝蛋白中大约占70%~80%,研究后部丝腺的功能对提高蚕丝的品质和产量具有重要意义。以往对昆虫线粒体方面的研究大多只采用差速离心获得的线粒体[3,6-7],但是差速离心只能用于分离不同大小、体积和质量的细胞器,对于一些相近的细胞器和物质则难以去除,如果要深入研究线粒体的功能,则需要获得高纯度线粒体,为此需要进一步的纯化。本文介绍了一种联合差速离心和密度梯度离心,从家蚕后部丝腺获得高纯度线粒体的方法。
1 材料与方法
1.1 材料
家蚕p50品种,在标准条件(25 ℃,湿度85%)下催青,用桑叶喂养至5龄第3天。在立体显微镜下解剖家蚕幼虫,取后部丝腺组织,3个重复,每个重复1.2 g组织(10~12条蚕),用0.9% NaCl清洗3遍。
蔗糖(Sucrose)、三羟甲基氨基甲烷(Tris)、乙二胺四乙酸(EDTA)、十二烷基硫酸钠(SDS)、丙烯酰胺(Acrylamide)、甲叉丙烯酰胺(N, N′-Methylene bisacrylamide)均购自Amresco公司;Percoll和Protein marker购自GE公司;细胞色素(Cytochrome)c抗体定制于杭州华安生物技术有限公司;Western及IP细胞裂解液、PMSF蛋白酶抑制剂均购自碧云天生物公司;蛋白定量试剂盒及其他试剂均购于上海生工生物公司。
1.2 线粒体的分离和纯化
线粒体分离和纯化参考Alonso等[8]和Sims等[9]的方法有所修改。
在后部丝腺中以1∶10加入STE匀浆缓冲液(100 mmol·L-1Tris,10 mmol·L-1EDTA, 2.5 mol·L-1sucrose,pH值7.4),冰上放置10 min,用杜恩斯匀浆器的松匀浆棒上下匀浆8次,再用紧匀浆棒上下匀浆10~12次。
把匀浆液移入10 mL离心管中,于4 ℃、1 000g离心10 min,取上清,于4 ℃、10 000g离心10 min,弃上清,沉淀即为粗提的线粒体样品。
沉淀中加入2 mL 15% Percoll溶液,轻轻吹打,充分混匀。然后沿壁缓慢加到由3 mL 23% Percoll溶液和3 mL 40%的Percoll溶液组成的非连续Percoll密度梯度中,4 ℃、31 000g离心5 min。
沉淀在Percoll密度梯度中分为3层,线粒体位于23%/40%之间的那一层,小心取出线粒体层并加入10 mL STE溶液进行稀释。于4 ℃、16 500g离心30 min。弃上清,取沉淀,再加入10 mL STE溶液稀释,于4 ℃、15 000g离心10 min,沉淀即为纯化的线粒体样品。
1.3 电镜观察
在粗提和纯化线粒体沉淀中逐滴加入戊二醛固定液浸泡整个沉淀,4 ℃固定过夜;用0.1 mol·L-1磷酸缓冲液(pH值7.4)漂洗3次,每次15 min;用1%锇酸溶液固定2 h,然后用0.1 mol·L-1磷酸缓冲液漂洗3次,每次15 min;用梯度溶液(50%、70%、80%和90%丙酮)脱水,每种浓度各处理15 min,再用100%丙酮处理2次,每次15 min;用体积比为2∶1的丙酮与包埋剂浸渍液浸渍4 h,之后用体积比1∶2的丙酮∶包埋剂浸渍液浸渍12 h,再用纯包埋液浸渍2次,每次12 h;将样品放入盛有纯包埋剂的包埋板中,将包埋板置于65 ℃各聚合48 h以上;对样品进行超薄切片,切片厚度70 nm,经乙酸双氧铀染色10 min后清洗,最后置于透射电子显微镜FEItecnai G2 spirit下观察并拍照。
1.4 免疫蛋白印迹
配制15% SDS-PAGE胶,粗提线粒体样品和纯化线粒体样品用Western及IP细胞裂解液裂解,蛋白上样量均为20 μg,于150 V电泳80 min;100 V转膜35 min;5%脱脂牛奶常温下封闭1 h后,在常温下孵育一抗(Cytochrome c 抗体1∶2 000稀释)1 h;TBST洗3次,每次10 min;用5%脱脂奶粉1∶5 000稀释羊抗鼠HRP,反应体积1 mL,室温摇床上反应1 h;TBST洗3次,每次10 min;ECL显影,底物反应3 min曝光(Bio-Rad凝胶成像分析仪)。
2 结果与分析
2.1 非线性蔗糖密度梯度离心结果及线粒体得率
组织匀浆液经差速离心后获得后部丝腺粗提线粒体样品,粗提线粒体样品经Percoll密度梯度离心后,离心管内液体明显分为3层(图1)。大部分线粒体集中于Percoll非线性密度梯度23%/40%的位置;通过蛋白浓度测定计算,3次重复的线粒体得率分别为78(0.006 5%)、388(0.032%)、280(0.023%)μg。

图1 非连续性Percoll密度梯度离心纯化线粒体
2.2 透射电子显微镜观察线粒体的纯度和完整性
通过透射电镜观察粗提线粒体样品和纯化线粒体样品,发现经密度梯度离心后线粒体明显被富集,杂质明显减少,并且破损的线粒体也减少;纯化后的线粒体结构完整,包含完整的内外膜结构(图2),说明纯化效果较好。
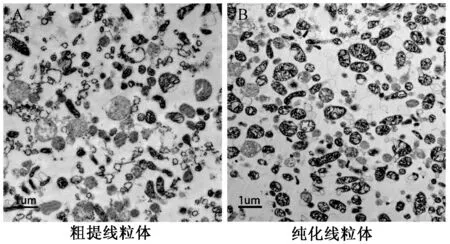
图2 透射电镜观察粗提线粒体(A)和纯化线粒体(B)
2.3 蛋白免疫印迹检测线粒体纯度
为了进一步检验纯化效果,用蛋白免疫印迹方法进行了验证。结果(图3)发现,经过密度梯度离心后,线粒体明显被进一步富集。用于检测的抗体细胞色素c(cytochrome c)位于线粒体内膜和外膜的间隙,进一步证明分离到的线粒体内外膜结构的完整性。

图3 免疫印迹检测线粒体纯度
3 讨论
提取纯净并且结构完好的线粒体是离体线粒体研究工作的必要前提。本文介绍了一种提取家蚕后部丝腺高纯度线粒体的方法,该方法不需要太高的离心速度即可实现纯化。通过电镜观察以及蛋白免疫印迹验证了分离到的线粒体内外膜结构完整,杂质少,并且线粒体得率为0.01%~0.03%,能满足线粒体相关研究所需的量,证实了该方法的实用性,为家蚕后部丝腺线粒体离体功能测定、线粒体基因组、转录组和蛋白质组的研究奠定了基础。
[1] MOOTHA V K, BUNKENBORG J, OLSEN J V, et al. Integrated analysis of protein composition, tissue diversity, and gene regulation in mouse mitochondria [J]. Cell, 2003, 115(5): 629-640.
[2] PAGLIARINI D J, CALVO S E, CHANG B, et al. A mitochondrial protein compendium elucidates complex I disease biology [J]. Cell, 2008, 134(1): 112-123.
[3] BEGNA D, FANG Y, FENG M, et al. Mitochondrial proteins differential expression during honeybee (ApismelliferaL.) queen and worker larvae caste determination [J]. Journal of Proteome Research, 2011, 10(9): 4263-4280.
[4] MARTINEZ F, OLVERASANCHEZ S, ESPARZAPERUSQUIA M, et al. Multiple functions of syncytiotrophoblast mitochondria [J]. Steroids, 2015, 103: 11-22.
[5] CHIKKA M R, ANBALAGAN C, DVORAK K, et al. The mitochondria-regulated immune pathway activated in theC.elegansintestine is neuroprotective [J]. Cell Reports, 2016, 16(9): 2399-2414.
[6] 曹阳, 唐任天, 章潜才, 等. 家蚕后部丝腺离体线粒体的制备及其电镜制样技术的改良[J]. 蚕学通讯, 1986 (4): 34-37, 59.
[7] 乔卿梅, 程茂高, 原国辉. 高质量蝗虫线粒体DNA的快速提取技术研究[J]. 河南农业科学, 2005, 34(10): 52-54.
[8] ALONSO J, RODRIGUEZ J M, BAENALPEZ L A, et al. Characterization of theDrosophilamelanogastermitochondrial proteome [J]. Journal of Proteome Research, 2005, 4(5): 1636-1645.
[9] SIMS N R, ANDERSON M F. Isolation of mitochondria from rat brain using Percoll density gradient centrifugation [J]. Nature Protocol, 2008, 3(7):1228-1239.
(责任编辑:侯春晓)
2016-11-11
浙江省自然科学基金项目(LY14C170001);浙江省植物有害生物防控重点实验室——省部共建国家重点实验室培育基地项目(2010DS700124-KF1514)
陈金娥(1979—),女,浙江上虞人,助理研究员,博士,从事家蚕蛋白质组学的研究工作,E-mail:chenje79@126.com。
10.16178/j.issn.0528-9017.20170249
S881.2
A
0528-9017(2017)02-0347-02
文献著录格式:陈金娥,李风波,何丽华,等. 一种家蚕后部丝腺高纯度线粒体提取方法[J].浙江农业科学,2017,58(2):347-348,352.

