高蛋氨酸饲料饮食诱导血管内皮细胞损伤大鼠模型建立
任晓丽,杨波,陈锡文,楼永良
(温州医科大学,浙江温州 325035,1.实验动物中心;2.环境与公共卫生学院;3.检验医学院与生命科学学院)
·论 著·
高蛋氨酸饲料饮食诱导血管内皮细胞损伤大鼠模型建立
任晓丽1,杨波2,陈锡文1,楼永良3
(温州医科大学,浙江温州 325035,1.实验动物中心;2.环境与公共卫生学院;3.检验医学院与生命科学学院)
目的:探讨不同比例蛋氨酸饮食和不同饲养周期对大鼠血管内皮细胞(EC)损伤模型建立的影响。方法:雄性SD大鼠随机分为正常饮食对照组(C组)、1%高蛋氨酸饮食组(M1组)、3%高蛋氨酸饮食组(M3组)和5%高蛋氨酸饮食组(M5组)。C组喂饲普通饲料,高蛋氨酸饮食组大鼠分别喂饲含1%、3%和5%蛋氨酸饲料,持续8周。实验开始(0周)、第2、第4、第6、第8周末行断尾取血,采用ELISA法检测血清同型半胱氨酸(Hcy)含量,扫描电镜观察第8周末主动脉弓EC形态。结果:各高蛋氨酸饮食组大鼠血清Hcy含量均随饲养时间延长而显著增加(P<0.05),且不同添加比例蛋氨酸饮食与不同饲养周期对大鼠血清Hcy水平具有显著地交互作用(P<0.05)。与C组相比,M1组大鼠血清Hcy含量在饲养第4周显著升高(P<0.05),而M3和M5组大鼠血清Hcy含量在饲养第2周显著升高,差异有统计学意义(P<0.01)。扫描电镜显示M1组大鼠EC排列紊乱、细胞间隙明显增宽、偶见有细胞碎片和血细胞附着;M3组呈典型“虫蚀”样变,病灶边缘呈锯齿状,散在血细胞和细胞碎片;M5组血管内皮大片崩解或脱落,胶原裸露,伴有大量血细胞附壁、血栓形成和脂质沉积。结论:低比例蛋氨酸饲料长期喂养和高比例蛋氨酸饲料短期喂养可诱导EC不同程度损伤,是一种建立EC损伤动物模型有效易行的方法。
蛋氨酸;同型半胱氨酸;动物模型;内皮细胞
血管内皮细胞(endothelialcell,EC)结构和功能障碍与动脉粥样硬化性血管性疾病发生、发展密切相关,其相关机制一直是临床医学领域的研究热点。由于不能直接在人体上进行实验,目前大多数研究是通过建立体外细胞损伤模型[1]和检测体内EC损伤生物标志物来进行。体外细胞损伤模型虽可通过控制各种影响因素,明确细胞损伤的具体机制,但需体内实验研究证实;内皮损伤评价体系虽可以间接评估内皮功能,但缺乏动物模型针对性的研究证据,结论推广受到限制。因此,建立简单无损伤的EC损伤动物模型,对深入研究体内EC损伤机制,评估药物对EC损伤的保护作用具有必不可少的桥梁作用。
近年来,动物模型研究方法(如手术法、基因敲除等)虽可以解决部分研究问题所需,但由于缺乏统一的操作,且价格昂贵、对动物创伤大、成模率低、动物模型不稳定等影响了研究进展。目前,国内外开始采用饮食诱导法建立体内EC损伤模型,大鼠由于饲养方便、模型制作经济、食性与人相近且抵抗力强,是医药研究领域的主要模型动物之一。我们前期对健康雄性Wister大鼠经3%蛋氨酸饲料进行8周干预[2],发现EC排列紊乱,细胞间隙增大,胞膜表面部分脱落呈大小不等的虫蚀状或火山口状缺损,甚至脱落等。有研究[3]发现l%蛋氨酸饲料是诱导大鼠发生高同型半胱氨酸(homocysteine,Hcy)血症较为合适的剂量,且无生长抑制等不良反应,与我们前期研究结果存在差异,这可能是由于大鼠造模的饲养周期不同造成的。因此,为进一步探究蛋氨酸饮食诱导大鼠EC损伤模型建立的最佳建模条件,我们采用不同比例的蛋氨酸饲料喂饲法构建EC损伤大鼠模型,探讨建模的最佳蛋氨酸添加剂量和饲养周期,为高蛋氨酸饲料喂饲法建立体内EC损伤模型技术的推广和应用奠定理论和实验基础。
1 材料和方法
1.1 实验动物选用健康雄性SD大鼠32只,体质量(160~180)g,由上海斯莱克实验动物有限责任公司提供,在温州医科大学实验动物中心SPF级动物房分笼饲养,合格证编号为SCXK(沪)2012-0002,均自由采食、饮水。
1.2 实验设计与分组大鼠适应性饲养1周后,称重、编号并随机分为4组:正常饮食对照组(C组)、1%蛋氨酸饮食组(M1组)、3%蛋氨酸饮食组(M3组)和5%蛋氨酸饮食组(M5组),每组8只。各组大鼠分别在实验开始(0周)、第2、第4、第6和第8周行断尾采血,并常规制备血清。高蛋氨酸饲料是在正常普通饲料配方基础上,将原料分为两部分,一部分直接加工成普通饲料,供C组大鼠食用;另一部分按各实验组添加不同比例蛋氨酸,制成颗粒饲料,即为高蛋氨酸饲料,分别供M1、M3和M5组大鼠食用。所有饲料均购于上海普路腾生物科技有限公司。
1.3 取样饲养8周后,各实验组禁食24h后,称重并依次用10%水合氯醛(0.1mL/100g)腹腔注射麻醉,腹主动脉取血,常规制备血清,-80℃冰箱冻存、待测。迅速打开胸腔,取下主动脉弓,剥离动脉附着组织,0.9%氯化钠溶液灌洗血污,并取主动脉弓下段1cm左右,切成2~3mm小段迅速投入预置2.5%戊二醛溶液青霉素小瓶前固定。
1.4 指标检测

1.4.2 血清Hcy浓度:试剂盒购自南京建成科技有限公司,采用ELISA法,严格按照试剂盒说明书分别检测第0、2、4、6和8周血清Hcy浓度。
1.4.3 EC扫描电镜观察:打开预置2.5%戊二醛溶液的青霉素小瓶,制作扫描电镜样品标本。分别经PBS清洗、锇酸后固定、乙醇梯度脱水、C02临界点干燥和离子溅射法镀金,最后用JSM-6510分析型扫描电子显微镜(日本日立公司)观察并拍照。
1.5 统计学处理方法采用STATA11.0统计软件进行统计学分析。实验数据以±s表示,不同添加比例的高蛋氨酸饮食对大鼠体质量的比较采用重复测量双因素方差分析,不同添加比例的高蛋氨酸饮食对大鼠日平均摄食量的比较采用单因素方差分析,不同添加比例蛋氨酸饮食和不同饲养周期大鼠血清Hcy水平比较采用重复测量双因素方差分析,并采用Bonferroni法进行两两比较。P<0.05为差异有统计学意义。
2 结果
2.1 不同添加比例的高蛋氨酸饮食对大鼠体质量的影响不同比例的蛋氨酸饮食对大鼠体质量的影响见图1。实验后C组和M1组大鼠体质量较实验前均显著增长,且组间体质量增加趋势差异无统计学意义(P>0.05)。M3和M5组大鼠体质量增加趋势显著低于C组,差异有统计学意义(P<0.05),提示添加3%和5%的蛋氨酸饮食对大鼠体质量的增长均具有明显的抑制作用。
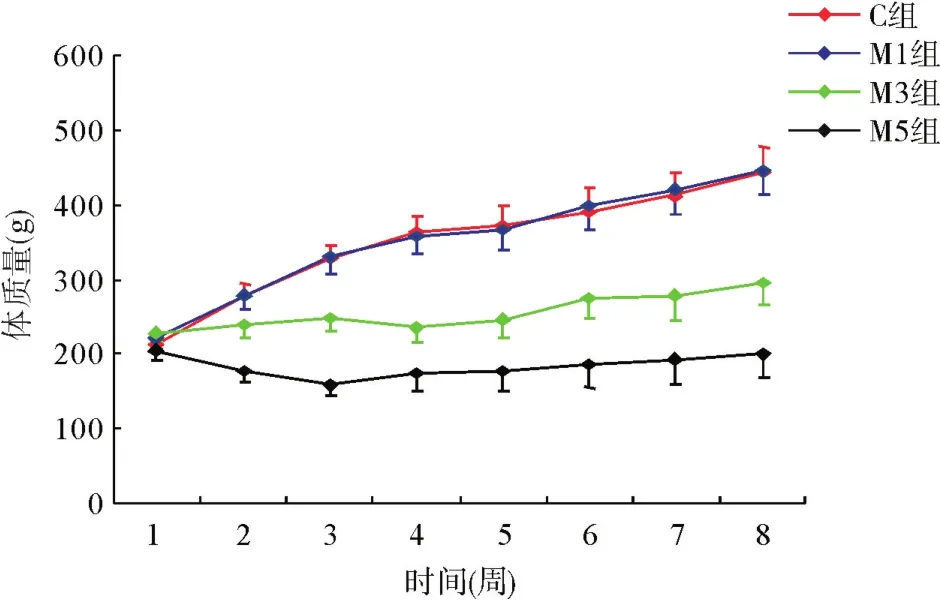
图1 不同添加比例的高蛋氨酸饮食对大鼠体质量的影响
2.2 不同添加比例的高蛋氨酸饮食对大鼠日平均摄食量的影响不同添加比例的高蛋氨酸饮食对大鼠日平均摄食量的影响见图2。与C组相比,M3和M5组大鼠日平均摄食量均显著降低,差异有统计学意义(P<0.01),而M1组大鼠日平均摄食量差异无统计学意义(P>0.05),提示添加3%和5%蛋氨酸饮食对大鼠食欲有明显抑制作用。

图2 不同添加比例的高蛋氨酸饮食对大鼠日平均摄食量的影响
2.3 不同添加比例的高蛋氨酸饮食和不同饲养周期对大鼠血清Hcy水平的影响不同添加比例高蛋氨酸饮食和不同饲养周期对大鼠血清Hcy水平的影响见表1。重复测量双因素方差分析显示,不同添加比例的高蛋氨酸饮食对大鼠血清Hcy含量有显著影响,差异有统计学意义(P<0.05),随饲养时间延长各高蛋氨酸饮食组大鼠血清Hcy含量显著增加,差异有统计学意义(P<0.05),且不同添加比例蛋氨酸饮食与不同饲养周期对大鼠血清Hcy水平具有显著的交互作用,差异有统计学意义(P<0.05)。与0周相比,M1组大鼠血清Hcy含量从饲养第4周开始显著升高,差异有统计学意义(P<0.05),而M3和M5组大鼠血清Hcy含量从饲养第2周开始显著升高,差异有统计学意义(P<0.01)。与C组相比,2周、4周、6周和8周的M3和M5组大鼠血清Hcy水平显著提高,差异有统计学意义(P<0.01);4周、6周和8周M1组与同期C组相比显著升高,差异有统计学意义(P<0.05)。与M1组相比,6周、8周M3组大鼠血清Hcy水平显著提高,差异有有统计学意义(P<0.05),而4周、6周、8周M5组大鼠血清Hcy水平显著高于M1组,差异有统计学意义(P<0.01)。
表1 不同添加比例蛋氨酸饮食和不同饲养周期对大鼠血清Hcy水平的影响(n=8,±s)

表1 不同添加比例蛋氨酸饮食和不同饲养周期对大鼠血清Hcy水平的影响(n=8,±s)
与同组0周比:aP<0.05;与C组同时期比:bP<0.05;与M1组同时期比:cP<0.05
组别Hcy(umol/L)0周2周4周6周8周C组7.54±0.627.66±0.557.72±0.767.93±0.758.01±1.02 M1组7.44±0.557.87±0.958.19±1.02ab8.64±0.92ab9.04±0.64abM3组7.60±0.648.28±0.39ab8.46±1.03ab9.34±0.83abc9.80±0.71abcM5组7.57±0.698.47±0.50ab9.11±0.89abc9.50±1.04abc10.07±0.90abc
2.4 不同添加比例的高蛋氨酸饮食对大鼠主动脉弓EC损伤扫描电镜观察C组大鼠主动脉弓EC呈多边形,大小一致,且沿血管纵轴呈条带状排列,细胞表面光滑,细胞间隙均匀,核所在部位向血管腔面稍隆起,胞膜完整(见图3A-B)。M1组大鼠EC形态大小不一、排列紊乱、细胞间隙明显增宽,胞膜表面部分脱落,偶见有细胞碎片和血细胞附着(见图3C-E)。M3组大鼠EC损伤呈典型的“虫蚀”样损害,病灶处形成表浅性溃疡,边缘呈锯齿状,周边可见散在血细胞和细胞碎片附着(见图3F-H)。M5组大鼠EC大片崩解或脱落,内皮下胶原裸露,伴有大量血细胞附壁、血栓形成和脂质沉积(见图3I-L)。
3 讨论

图3 不同添加比例蛋氨酸饮食对大鼠主动脉弓EC损伤扫描电镜图
蛋氨酸是人体必需含硫氨基酸之一,必须从食物中获取。机体蛋氨酸摄入过高,引起血液Hcy水平升高而诱发高Hcy血症。流行病学和实验研究表明,高Hcy血症可以诱导EC损伤和功能障碍,是导致动脉粥样硬化发生的始动因素[4]。本实验通过研究添加1%、3%和5%蛋氨酸饲料诱导SD大鼠EC损伤,发现不同添加比例蛋氨酸和不同饲养周期对EC损伤具有显著的交互作用。1%高蛋氨酸饮食对大鼠食欲和体质量无明显影响,从饲养第4周开始血清Hcy含量显著高于正常饮食对照组且具有时间趋势效应,提示1%高蛋氨酸饮食经过4周饲养干预可诱发高Hcy血症。3%和5%高蛋氨酸饮食大鼠从饲养第2周开始血清Hcy含量显著高于正常饮食对照组且具有时间趋势效应,提示3%和5%蛋氨酸负荷饮食饲养2周可以诱导高Hcy血症,但大鼠表现为明显食欲和生长抑制等营养不良状态,提示中高比例蛋氨酸饮食大鼠呈长期饥饿状态,这可能是由于高剂量的蛋氨酸添加后造成其他氨基酸等营养素吸收障碍或肝功能障碍引起[5]。饥饿应激能使动物体内自由基含量增多,与细胞膜磷脂多不饱和脂肪酸发生脂质过氧化反应,使磷脂结构发生变化,最终导致细胞结构和功能障碍。柯斌等[6]研究发现,大鼠禁食4d后体质量显著下降,但血脂、血糖和肝肾功能等相关指标均保持正常,提示短期禁食对大鼠具有良好的安全性和耐受性。朱会萍等[7]研究发现,大鼠禁食超过5d后脑组织脂质过氧化反应显著增强,表现为SOD含量显著下降而MDA含量显著增加,提示长期禁食分解代谢加速导致自由基生成增多,诱发组织脂质过氧化损伤。本研究动物持续饲养8周,中高比例蛋氨酸添加组大鼠呈明显长期饥饿应激状态,提示饥饿应激诱发的脂质过氧化反应可能介导了损伤。因此,本研究所观察到的中高剂量组EC损伤比低剂量组大鼠明显,可能是由于饥饿应激与较高蛋氨酸含量对内皮损伤的联合作用。
采用饲料喂饲法诱导EC损伤模型研究报道较多,较为一致的研究认为高蛋氨酸饲料喂养大鼠可诱导血管内皮损伤,但尚不清楚蛋氨酸饮食最佳的成模剂量和饲养周期。EC是Hcy毒作用的靶细胞之一[8-9],不同剂量的蛋氨酸负荷诱导体内Hcy水平升高的差异性可能造成动物EC不同程度损伤。SCHERER等[10]用0.03μmol/g低剂量Hcy灌服Wister大鼠30d,可以导致慢性血管内皮炎性损伤。孟斌等[3]发现l%蛋氨酸饲料诱导大鼠发生高Hcy血症,且无明显生长抑制。然而,先前的研究并未能提供最佳的成模剂量和饲养周期,本研究通过观察不同添加比例蛋氨酸饲料和不同饲养周期对大鼠EC损伤的影响,结果显示蛋氨酸饮食负荷后大鼠血清Hcy在不同的饲养周期显著提高,提示整体动物对蛋氨酸负荷后的代谢反应不同。此外,我们先前研究发现3%蛋氨酸饮食可以诱导大鼠EC结构和功能紊乱,表现为EC形态明显异常,排列紊乱,细胞间隙增大,细胞表面微绒毛减少甚至消失,血管活性物质分泌失衡等[2],提示3%高蛋氨酸饲料喂饲法可诱导EC损伤。本研究通过扫描电镜发现,1%蛋氨酸负荷后EC呈轻度损伤状态,表现为细胞大小不一、排列紊乱、细胞间隙明显增宽,胞膜表面部分脱落,偶见有细胞碎片;3%蛋氨酸负荷后EC呈中度损伤,表现为典型的“虫蚀”样损害,且病灶边缘呈锯齿状,周边可见散在血细胞和细胞碎片;5%蛋氨酸负荷后EC呈重度损伤,表现为血管内皮大面积地崩解或脱落,内皮下胶原纤维裸露,并伴有大量血栓形成和脂质沉积,表明经过8周不同比例的蛋氨酸饮食饲养,大鼠EC呈现出不同程度地结构和功能损害,为体内动物EC损伤模型建立提供客观的形态学依据。
综上所述,蛋氨酸饮食诱导EC损伤模型是一种理想、稳定、易行且与人体动脉粥样硬化发病过程相似的动物模型研究工具。应根据不同的研究需要,添加蛋氨酸剂量并合理选择饲养周期为建模条件。鉴于饮食诱导动物模型的稳定、可复制性以及不同比例蛋氨酸饮食对食欲的影响,尚需要对动物模型的特征性、稳定性和成模机理进行深入研究。
[1] 陈潇, 周浩, 周希, 等. 松弛素对TGF-β诱导的内皮细胞间质化的抑制作用[J]. 温州医科大学学报, 2014, 44(3): 161-165.
[2] 任晓丽, 杨波, 黄陈平, 等. 高蛋氨酸饮食对大鼠血管内皮细胞分泌功能的影响[J]. 氨基酸和生物资源, 2010, 32(4): 50-54.
[3] 孟斌, 高蔚娜, 杨继军, 等. 高蛋氨酸饲料喂养的大鼠高同型半胱氨酸血症模型的实验研究[J]. 氨基酸和生物资源, 2011, 33(2): 53-56.
[4] ZULLI A, HARE D L, BUXTON B F, et al. High dietary methionine plus cholesterol exacerbates atherosclerosis formation in the left main coronary artery of rabbits[J]. Atherosclerosis, 2004, 176(1)∶83-89.
[5] TSEN C M, HSIEH C C, YEN C H, et al. Homocysteine altered ROS generation and NO accumulation in endothelial cells[J]. Chin J Physiol, 2003, 46(3)∶ 129-136.
[6] 柯斌, 秦鉴, 张俊杰. 短期禁食对大鼠生理和生化指标的影响[J]. 时珍国医国药, 2011, 22(11): 2778-2780.
[7] 朱会萍, 张德厚, 王焕景, 等. 维生素B5对全饥饿大鼠脑组织脂质过氧化的动态变化及保护作用[J]. 山西医药杂志, 2013(23): 1335-1337.
[8] KOH J M, LEE Y S, KIM Y S, et al. Homocysteine enhances bone resorption by stimulation of osteoclast formation and activity through increased intracellular ROS generation[J]. J Bone Miner Res, 2006, 21(7)∶ 1003-1011.
[9] CHANG L, ZHANG Z, LI W, et al. Liver-X-receptor activator prevents homocysteine-induced production of IgG antibodies from murine B lymphocytes via the ROS-NF-kappaB pathway[J]. Biochem Biophys Res Commun, 2007, 357(3)∶772-778.
[10] SCHERER E B, SAVIO L E, VUADEN F C, et al. Chronic mild hyperhomocysteinemia alters ectonucleotidase activities and gene expression of ecto-5’-nucleotidase/CD73 in rat lymphocytes[J]. Mol Cell Biochem, 2012, 362(1-2)∶ 187-194.
(本文编辑:赵翠翠)
Stablishment of vascular endothelial cell injury model induced by high methionine feed diet in rats
REN Xiaoli1, Yang Bo2, CHEN Xiwen1, LOU Yongliang3. 1.Laboratory Animal Research Center, Wenzhou Medical University, Whenzou, 325035; 2.School of Environment Science and Public Health, Wenzhou Medical University, Whenzou, 325035; 3.School of Laboratory Medicine and Life Science, Wenzhou Medical University, Whenzou, 325035
Objective:To investigate the effects of the diet rich in different proportions of methionine on endothelial injury in sprague-dawley (SD) rats.Methods:Male SD rats were randomly divided into the normal diet group (CR), 1% methionine loading diet group (M1 R), 3% methionine loading diet group (M3 R) and 5% methionine loading diet group (M5 R), and blood in tail vein were drawn at 0, 2nd, 4th, 6th and 8th week, respectively. After 8 weeks, serum concentrations of homocysteine (Hcy) were measured, and the endothelial ultrastructure changes in aorta wall were observed using scanning electron microscope.Results:A signifcant interaction between high methionine diet and feeding duration on endothelial injury was found (P<0.05), and serum levels of Hcy were signifcantly increased in rats fed with high methionine diet (P<0.05), with feeding duration increasing. Compared with CR, serum level of Hcy in M3 and M5 R was signifcantly higher at 2nd week (P<0.01), whereas serum Hcy in M1 R was signifcantly higher at 4th week (P<0.05). Endothelial cells in M1 R were imperfectly unanimous in size, and the cell surface shrinked. Endothelium in M3 R and M5 R were found to be damaged by worms kinds of harming typical, with enclose wall thrombus and the fat deposition.Conclusion:High dietary intake of methionine is signifcantly associated with endothelial injury, which suggests that a method setting up endothelial injury animal models would be established.
methionine; homocysteine; animal model; endothelial cells
R332
A
10.3969/j.issn.2095-9400.2017.01.010
2016-04-08
浙江省科技计划项目(2013C37007)。
任晓丽(1981-),女,浙江宁波人,实验师。
楼永良,教授,Email:lyl@wmu.edu.cn。

