铁蛋白DrfE对耐辐射异常球菌抗氧化酶活性的影响
吴小丽刘盈盈江世杰,3陈云刘小利汪雨舟平淑珍王劲
(1. 西南科技大学生命科学与工程学院,绵阳 621000;2. 中国农业科学院生物技术研究所,北京 100081;3. 四川大学生命科学学院,成都 610065;4. 中国人民大学附属中学,北京 100080)
铁蛋白DrfE对耐辐射异常球菌抗氧化酶活性的影响
吴小丽1,2刘盈盈2江世杰2,3陈云2刘小利1,2汪雨舟4平淑珍2王劲1,2
(1. 西南科技大学生命科学与工程学院,绵阳 621000;2. 中国农业科学院生物技术研究所,北京 100081;3. 四川大学生命科学学院,成都 610065;4. 中国人民大学附属中学,北京 100080)
为研究耐辐射异常球菌(Deinococcus radiodurans)中drfE编码的铁蛋白DrfE的功能,通过基因回补试验构建drfE基因的回补菌株(pdrfE∷Δ),对野生型WT、突变株ΔdrfE及回补菌株pdrfE∷Δ进行不同浓度H2O2和NaCl胁迫,分别测定野生型WT、突变株ΔdrfE和回补菌株pdrfE∷Δ体内Fe2+含量及抗氧化酶类活性。结果显示,drfE基因缺失导致菌株对氧化和盐胁迫敏感,该基因的回补能够恢复菌株对氧化和盐胁迫的抗性。drfE基因缺失导致耐辐射异常球菌体内Fe2+浓度由232 μmol/L增加至293 μmol/L;80 mmol/L H2O2处理30 min后,突变株ΔdrfE的CAT活性下降32.74%,SOD下降41.3%。以上结果表明DrfE蛋白可能参与耐辐射异常球菌铁代谢途径,并且在细胞抗氧化体系中发挥重要作用。
耐辐射异常球菌;铁蛋白DrfE;非生物胁迫;抗氧化酶;铁离子
干旱、氧化、高盐、辐射和极端温度等非生物胁迫产生的大量活性氧分子(ROS)造成细胞内蛋白质、脂类、碳水化合物和DNA等生物大分子的损伤,严重影响生物体正常的代谢进程[1-3]。据文献报道,耐辐射异常球菌(Deinococcus radiodurans)可通过其体内的抗氧化酶促防御系统清除ROS,从而降低ROS对细胞的毒性,减轻氧化胁迫,其抗氧化酶促防御系统主要包括:过氧化氢酶(Catalase,CAT)、超氧化物歧化酶(Superoxide dismutase,SOD)和过氧化物酶(Peroxidase,POD)等抗氧化酶[4-6]。铁是生物体生长发育所必需的矿物质元素,是生物体中众多反应酶的辅因子和呼吸链的重要组成成分[7-9],并能对生物体抗氧化酶的活性造成不同程度的影响[10]。然而,高浓度的铁在生物体内具有毒性,对生物体的生长具有抑制作用,生物体内的Fe2+很容易与过氧化氢等发生反应产生OH·和
O2
·-等活性氧,对生物体造成氧化损伤[9,11],在氧化胁迫和铁代谢相互交织的情况下,CAT、SOD和POD等抗氧化酶的活性受到明显的抑制,清除ROS的能力下降。
铁蛋白(Ferritin)广泛存在于动物、植物和细菌体内,具有抗氧化胁迫、调节铁代谢平衡和消除部分重金属等有毒分子的毒害作用[12-15],能同时去除过氧化氢胁迫和Fe2+所导致的细胞毒性[16,17]。铁蛋白是一类由24个4股螺旋束结构单体亚基组成的高度对称的球型外壳蛋白,具有铁氧化还原酶中心,能够截获细胞间Fe2+并使其与铁氧化酶结合,将其氧化为Fe3+后以水合氧化铁矿物质的形式储存于蛋白内部空腔中[18],每分子蛋白空腔内最多可以贮存4 500个铁原子,因此能够保护抗氧化酶类使其活性不受铁的抑制,并保护细胞免受氧化损伤。目前关于铁蛋白结构和功能的研究已有报道,例如,关于耐辐射异常球菌中由二聚体组成的Dps家族铁蛋白功能的研究等[8]。
据文献报道,耐辐射异常球菌(Deinococcus radiodurans)中drB0118基因编码的蛋白为铁蛋白,与氧化、高盐和干燥等胁迫抗性相关[19-22],我们将其命名为DrfE(Deinococcus radiodurans Ferritin)。刘盈盈等[22]对非生物胁迫条件下drfE基因的功能进行了初步探索,结果显示该基因的缺失导致耐辐射异常球菌对高盐和氧化胁迫敏感。为了验证并进一步研究DrfE蛋白在非生物胁迫下的抗逆功能及作用机制,本研究构建回补菌株pdrfE∷Δ,验证drfE在细胞耐受高盐和氧化胁迫抗性中的作用,分析氧化胁迫下drfE基因的缺失对耐辐射异常球菌体内CAT、SOD和POD酶活性的影响,探讨DrfE蛋白在抗氧化及耐盐过程中的作用,旨为进一步研究该菌的非生物胁迫抗性机制提供依据。
1 材料与方法
1.1 材料
1.1.1 菌株质粒和培养条件 野生型耐辐射异常球菌(Deinococcus radiodurans,DR)购自于中国科学院微生物菌种保藏中心;突变株ΔdrfE由本实验室保存;高频转化受体菌大肠杆菌Escherichia coli trans 109购自北京全式金生物技术有限公司;pJET1.2/Blunt克隆载体购自Thermo公司;质粒pRADZ3由本实验室保存。大肠杆菌于LB培养基(1% Typtone,0.5% Yeast extract,1% NaCl,pH7.0,固体培养基含1.5%琼脂)中37℃条件下培养,耐辐射异常球菌于TGY培养基(1% Typtone,0.5 % Yeast extract,0.1% Glucose,固体培养基含1.5%琼脂)中30℃条件下培养。
1.1.2 主要试剂 限制性内切酶、T4 DNA连接酶等购于New England Biolabs公司;细菌基因组提取试剂盒购自北京天根科技有限公司,常规质粒提取试剂盒、胶回收纯化试剂盒购自Magen公司;氨苄青霉素和卡那霉素等试剂购于上海生工生物工程公司;H2O2、愈创木酚、氮蓝四唑等抗氧化酶活测定所需试剂购于碧云天生物技术公司;其他生化试剂均为分析纯。引物合成和基因测序均由华大基因完成。
1.2 方法
1.2.1 DrfE蛋白的生物信息学分析 从NCBI中获取耐辐射异常球菌drfE基因序列及其编码蛋白DrfE的氨基酸序列信息,运用SMART(http://smart.embl. de/smart/set_mode.cgi?NORMAL=1)在线工具对蛋白质结构域进行分析;用BLASTP程序获得与DrfE具有一定相似度的大肠杆菌(E. coli)等物种的蛋白序列,通过MEGA软件对其进行序列比对分析。
1.2.2 功能回补菌株pdrfE∷Δ的构建 从NCBI数据库中获取drfE基因及其上游区域300 bp的序列(包含预测的启动子区),利用Primer Premier 5.0设计引物pdrfE-F:5'-GCTCTAGAGCATCATCGTGCAG GGCCT-3'(划线序列为Xba I酶切位点),pdrfE-R:5'-CGGGATCCTTACAGGCTGAGAATACTG-3'(划线序列为BamH I酶切位点),引物由华大基因合成。以D. radiodurans基因组DNA为模板,使用pdrfEF/R引物扩增目的片段pdrfE,扩增产物长度为1 314 bp。PCR反应条件是:95℃预变性10 min;95℃变性30 s,64℃退火30 s,72℃延伸1 min,30个循环;72℃延伸10 min。
通过PCR产物回收完整的drfE基因,连接pJET1.2/Blunt克隆载体,构建pJET-drfE重组质粒,转化E. coli trans 109,挑取阳性转化子测序。提取测序正确的重组pJET-drfE质粒,用BamH I和Xba I酶切,同时用Xba I和BamH I酶切穿梭质粒pRADZ3,纯化回收1 214 bp的drfE基因片段和6 kb的Z3载体,并将回收的基因片段与pRADZ3载体连接,转化E. coli trans 109,在含有50 μg/mL Amp的LB平板上筛选,获得阳性转化子。重组质粒Z3-drfE进行菌落PCR验证和Xba I和BamH I酶切验证并测序。提取测序正确的重组质粒Z3-drfE,线性转化至突变株ΔdrfE中获得回补菌株pdrfE∷Δ。
1.2.3 不同浓度H2O2和NaCl对菌株的冲击实验将活化的野生型WT、突变株ΔdrfE和回补菌株pdrfE∷Δ转接于20 mL TGY液体培养基中,30℃、220 r/min培养至对数初期(OD600=0.6-0.8)。分别取1 mL 野生型WT、突变株ΔdrfE和回补菌株pdrfE∷Δ菌液于1.5 mL EP管中。对于H2O2冲击实验,加入30% H2O2母液使其终浓度分别为0、60、80 mmol/L,混匀后30℃、220 r/min暗处理30 min。对于NaCl冲击实验,5 000 r/min离心5 min收集菌体,菌体分别用1 mL 4 mol/L NaCl和1 mL 5 mol/L NaCl重悬,对照组用无菌水重悬,30℃,220 r/min处理6 h。立即用无菌水进行梯度稀释,每个梯度各取10 μL点在TGY固体培养基上,30℃培养1-2 d后观察菌落形成情况。实验进行3次重复。
1.2.4 细胞内铁离子含量的测定 培养野生型WT、突变株ΔdrfE和回补菌株pdrfE∷Δ菌株至对数生长初期(OD600=0.6-0.8),收集1 L菌量,用PBS清洗2次(1 mmol/L EDTA,pH7.4),菌体烘干后采用ICP-MS的方法测定总Fe2+的含量[23]。测定之前将缓冲液作为对照,收集菌体的过程中所有器皿均用10%以上的硝酸浸泡过夜。
1.2.5 体内抗氧化酶活的测定 培养野生型WT、突变株ΔdrfE和回补菌株pdrfE∷Δ菌株至对数生长初期(OD600=0.6-0.8),加入终浓度分别为0、60和80 mmol/L的H2O2溶液,在30℃、220 r/min分别处理15 min、30 min,然后分别于4℃、8 000 r/min离心收集菌体,200 mmol/L PBS(pH7.0)缓冲液清洗2次,PBS重悬后于冰上超声破碎,4℃、12 000 r/min离心10 min收集蛋白上清液,并以相同生长期未经H2O2处理的菌体蛋白作对照。蛋白浓度测定采用常规的Branford法。SOD活性的检测采用王爱国等[24]的方法,以抑制氮蓝四唑(NBT)光氧化还原50%的酶量为1个活力单位(U,U/mg·protein表示);CAT活性的检测采用曾韶西等[25]的方法,以1 min内A240减少0.1的酶量为一个酶活单位(U);POD活性的检测采用愈创木酚法[26],以1 min每毫克蛋白质催化的470 nm下OD值变化0.01为一个酶活单位(U)。
2 结果
2.1 DrfE生物信息学分析
用SMART在线软件进行功能结构域分析,结果显示DrfE蛋白在61-237氨基酸位置存在Ferritin类似的保守结构域(图1-A)。运用BLASTP在线软件获得来源于不同物种与DrfE序列相似的蛋白,包括Deinococcus deserti、Chitinophaga pinensis、Verticillium alfalfae及Gramella forsetii,对其进行序列比对分析。结果(图1-B)显示,DrfE蛋白与其他物种相似蛋白的序列一致性较低,但其在132、191和224位的谷氨酸Glu(E)非常保守;此外,His135、His227及Lys214位点也非常保守。根据已有研究推测,由这几个保守位点组成的蛋白亚基可能具有铁氧化酶(ferroxidase)的功能,能催化Fe2+转变成Fe3+[27]。
2.2 回补菌株pdrfE∷Δ构建及验证
回补菌株pdrfE∷Δ构建及验证如图2所示,重组质粒Z3-pdrfE通过PCR、酶切及测序验证(图2-A)。将测序正确的重组质粒转化突变株ΔdrfE,经含卡那霉素和氯霉素双抗性的TGY平板筛选,获得回补菌株pdrfE∷Δ,提取基因组进行PCR验证。结果(图2-B)显示,以回补菌株pdrfE∷Δ基因组DNA为模板能扩增出1 314 bp的条带,而以突变株ΔdrfE基因组DNA为模板,没有扩增出条带,表明所获得的回补菌株pdrfE∷Δ完全正确。

图1 DrfE蛋白结构域预测及序列比对
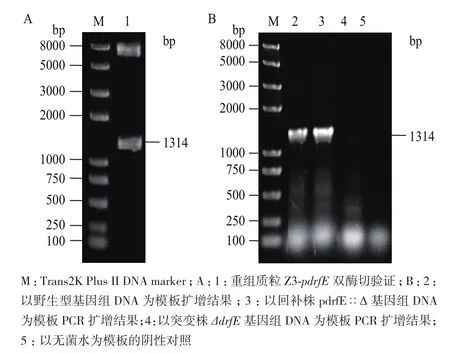
图2 回补菌株pdrfE∷Δ的构建及验证
2.3 drfE的缺失导致菌株对氧化和高盐敏感
氧化和盐胁迫会造成细胞损伤,导致细胞死亡。本实验分别测定了野生型WT、突变株ΔdrfE和回补株pdrfE∷Δ在不同浓度H2O2冲击下的生长情况。结果(图3)显示,正常培养条件下3种菌株的生存能力没有显著差异,60 mmol/L H2O2冲击30 min后,突变株ΔdrfE对H2O2的敏感性显著高于野生型WT和回补株pdrfE∷Δ,而80 mmol/L H2O2冲击30 min后,突变株ΔdrfE几乎不能生长。盐胁迫表型与氧化胁迫类似,4 mol/L NaCl处理4 h后,突变株ΔdrfE对盐的敏感性显著高于野生型WT和回补菌株pdrfE∷Δ,5 mol/L NaCl处理4 h后,突变株ΔdrfE对盐冲击更加敏感(图3)。以上结果说明,drfE基因缺失导致耐辐射异常球菌对H2O2和NaCl敏感,并且drfE基因的回补能够恢复突变株在胁迫条件下的表型缺陷,表明DrfE蛋白在细胞抗氧化和耐盐过程中发挥重要作用。

图3 不同浓度H2O2和NaCl处理对野生型WT、突变株ΔdrfE和回补菌株pdrfE::Δ菌株生长的影响
2.4 DrfE对细胞内铁含量的影响
Fe是动植物和微生物生长发育必不可少的营养元素,低浓度的Fe在生物体正常的生理代谢中起着非常重要的作用,但高浓度的Fe对生物体的生长具有抑制和毒害作用。为了研究耐辐射异常球菌drfE基因的缺失对胞内Fe2+含量的影响,本实验测定了正常培养条件下野生型WT、突变株ΔdrfE和回补菌株pdrfE∷Δ细胞内铁离子的含量。结果(图4)显示,突变株ΔdrfE胞内Fe2+含量高于野生型菌株WT和回补菌株pdrfE∷Δ,说明drfE的缺失会导致耐辐射异常球菌细胞内Fe2+含量的增加,DrfE蛋白可能参与了耐辐射异常球菌体内铁代谢途径。
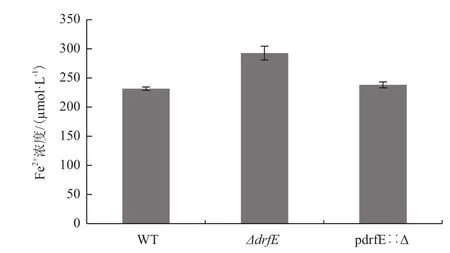
图4 野生型WT、突变株ΔdrfE和回补菌株pdrfE∷Δ菌株胞内Fe2+的含量
2.5 不同浓度H2O2冲击条件下drfE的缺失对耐辐射异常球菌抗氧化酶活性的影响
抗氧化酶是耐辐射异常球菌抗氧化体系的重要成员,主要参与细胞体内的抗氧化反应。为了研究drfE缺失对抗氧化酶活性的影响,本研究分别测定了终浓度为60 mmol/L和80 mmol/L H2O2分别处理15和30 min条件下,野生型WT、突变株ΔdrfE和回补菌株pdrfE∷Δ体内CAT、SOD和POD活性,并设置未经H2O2处理的菌株为对照。结果(图5-A)显示,在未经H2O2处理条件下,突变株ΔdrfE的CAT和SOD活性低于野生型WT和回补菌株pdrfE∷Δ,60 mmol/L H2O2处理15 min后,突变株ΔdrfE的CAT和SOD活性显著低于野生型WT和回补菌株pdrfE∷Δ,经80 mmol/L H2O2处理15 min后,CAT和SOD活性下降更加明显。同样的,用浓度为60、80 mmol/L H2O2处理30 min后,突变株ΔdrfE的CAT和SOD活性显著低于野生型WT和回补菌株pdrfE∷Δ(图5-B)。在正常培养条件和H2O2冲击条件下,野生型菌株WT、突变株ΔdrfE和回补菌株pdrfE∷Δ体内POD活性均无显著变化(图5)。由此得出,drfE基因的缺失会引起耐辐射异常球菌体内CAT、SOD等抗氧化酶活性的下降,从而影响耐辐射异常球菌清除ROS的能力,表明drfE基因能够通过影响耐辐射异常球菌体内抗氧化酶的活性,参与细胞体内的抗氧化反应。
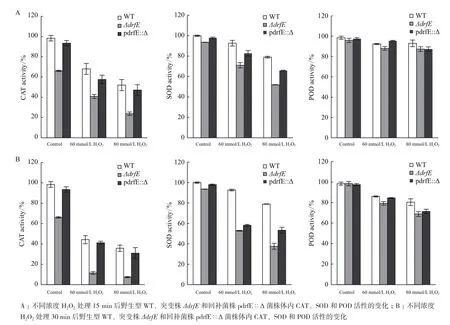
图5 H2O2处理对野生型WT、突变株ΔdrfE和回补菌株pdrfE∷Δ菌株体内抗氧化酶活性的影响
3 讨论
生物体遭受非生物胁迫会产生大量的活性氧自由基,从而导致细胞内蛋白质、脂类、碳水化合物和DNA等严重损伤。细胞内CAT、SOD、POD等多种抗氧化酶在清除氧自由基系统中发挥主要作用,其中SOD是一种非常重要的抗氧化酶,能够催化O2·-转化为H2O2和O2[24,28],CAT和POD能够将H2O2转化为H2O,降低H2O2对细胞膜组分造成的氧化损伤[22]。氧化和高盐胁迫条件下,drfE的突变导致耐辐射异常球菌生存能力显著下降,可能是由于细胞内CAT、SOD、POD活性发生改变,造成细胞抗氧化系统紊乱所造成。据文献报道,不同的生物体对氧化胁迫的敏感性有很大的差异,抗氧化酶活性高的生物体,其抗氧化能力也能够维持在较高的水平[29-32]。
铁是生物体生长发育过程中所必需的矿质元素,但高浓度的Fe对生物体产生毒害作用,影响生物体的生长[7-10]。细胞内过量的Fe2+能与H2O2反应形成羟自由基(OH·),羟自由基是具有超强氧化能力的ROS,会对细胞造成氧化胁迫[1]。此外,生物体内Fe2+的含量过高可能会使细胞内CAT、SOD和POD等抗氧化酶类的活性受到不同程度的抑制。据报道,铁蛋白能催化Fe2+生成Fe3+并以水合氧化铁矿物质的形式储存铁,同时能够降低H2O2胁迫和过量Fe2+所产生的危害[16,17]。生物信息学分析发现DrfE属于铁蛋白2超家族(Ferritin _2 superfamily),是一类铁蛋白。本研究结果表明,drfE的缺失造成耐辐射异常球菌体内铁离子含量的升高,并导致胁迫条件下细胞内CAT和SOD等抗氧化酶类活性的显著下降,致使耐辐射异常球菌抗氧化能力的下降。由此推断DrfE蛋白能够阻止Fenton反应产生具有超强活性的OH·,并且可能保护抗氧化酶使其保持较高的活性,从而保护细胞免受过量H2O2和体内铁代谢所引起的氧化损伤。drfE缺失会导致细胞内CAT、SOD活性显著下降,而对POD活性并无显著的影响。可能是由于SOD与O2·-反应所产生的H2O2主要被CAT利用,因此CAT和SOD这两种酶被大量消耗,故这两种酶活性下降,而POD较少参与到H2O2的清除反应中,故其POD变化不明显[33]。
本研究初步证实,耐辐射异常球菌中铁蛋白DrfE在调节细胞内Fe2+含量,增强CAT和SOD等抗氧化酶活性途径中发挥重要作用,从而保护细胞免受非生物胁迫产生的ROS的损伤,对Fe2+与抗氧化酶类之间的关系仍需深入研究。同时,耐辐射异常球菌所特有的类胡萝卜素是其有效的非酶类抗氧化剂,因此,DrfE蛋白可能参与类胡萝卜素合成途径,其作用机制有待于进一步研究。
4 结论
耐辐射异常球菌drfE基因的缺失导致体内Fe2+浓度增加,同时导致过氧化氢酶(CAT)、超氧化物歧化酶(SOD)等抗氧化酶活性的显著下降,从而使耐辐射异常球菌清除ROS的能力下降,使耐辐射异常球菌对过氧化氢和盐胁迫敏感。因此,DrfE蛋白增强了耐辐射异常球菌对非生物胁迫的抵抗能力。
[1] Xu W, Shen JY, Dunn CA, et al. The Nudix hydrolases of Deinococcus radiodurans[J]. Molecular Microbiology, 2001, 39(2):286-290.
[2] Mittler R. Oxidative stress, antioxidants and stress tolerance[J]. Trends in Plant Science, 2002, 7(9):405-410.
[3] Tuteja N. Chapter twenty-four-mechanisms of high salinity tolerance in plants[J]. Methods in Enzymology, 2007, 428:419-438.
[4] Lemee L, Peuchant E, Clerc M, et al. Deinoxanthin:a new carotenoid isolated from Deinococcus radiodurans[J]. Tetrahedron, 1997, 53(3):919-926.
[5] Morano KA, Grant CM, Moye-Rowley WS. The response to heat shock and oxidative stress in Saccharomyces cerevisiae[J]. Genetics, 2012, 190(4):1157-1195.
[6] Imlay JA. Cellular defenses against superoxide and hydrogen peroxide[J]. Annual Review of Biochemistry, 2008, 77:755.
[7] Andrews SC. Iron storage in bacteria[J]. Advances in Microbial Physiology, 1998, 40:281-351.
[8] Harrison PM, Arosio P. The ferritins:molecular properties, iron storage function and cellular regulation[J]. Biochimica et Biophysica Acta(BBA)-Bioenergetics, 1996, 1275(3):161-203.
[9] Shah AMUH, Zhao Y, Wang Y, et al. A mur regulator protein in the extremophilic bacterium Deinococcus radiodurans[J]. PLoS One, 2014, 9(9):e106341.
[10] Shao G, Chen M, Wang W, et al. Iron nutrition affects cadmium accumulation and toxicity in rice plants[J]. Plant Growth Regulation, 2007, 53(1):33-42.
[11] Chasteen ND, Harrison PM. Mineralization in ferritin:an efficient means of iron storage[J]. Journal of Structural Biology, 1999, 126(3):182-194.
[12] Theil EC. Regulation of ferritin and transferrin receptor mRNAs[J]. Journal of Biological Chemistry, 1990, 265(9):4771-4774.
[13] Thomine S, Lanquar V. Iron transport and signaling in plants// Transporters and Pumps in Plant Signaling[M]. Springer Berlin Heidelberg, 2011:99-131.
[14] Chasteen ND, Harrison PM. Mineralization in ferritin:an efficient means of iron storage[J]. Journal of Structural Biology, 1999, 126(3):182-194.
[15] Huang HQ, Lin QM, Kong B, et al. Role of phosphate and kinetic characteristics of complete iron release from native pig spleen ferritin-Fe[J]. Journal of Protein Chemistry, 1999, 18(4):497-504.
[16] Rouault TA. The role of iron regulatory proteins in mammalian iron homeostasis and disease[J]. Nature Chemical Biology, 2006, 2(8):406-414.
[17] Zhao G, Ceci P, Ilari A, et al. Iron and hydrogen peroxide detoxification properties of DNA-binding protein from starved cells A ferritin-like DNA-binding protein of Escherichia coli[J]. Journal of Biological Chemistry, 2002, 277(31):27689-27696.
[18] Xiaoke Y, Chiancone E, Stefanini S, et al. Iron oxidation and hydrolysis reactions of a novel ferritin from Listeria innocua[J].Biochemical Journal, 2000, 349(3):783-786.
[19] Grove A, Wilkinson SP. Differential DNA binding and protection by dimeric and dodecameric forms of the ferritin homolog Dps from Deinococcus radiodurans[J]. Journal of Molecular Biology, 2005, 347(3):495-508.
[20] Makarova KS, Aravind L, Wolf YI, et al. Genome of the extremely radiation-resistant bacterium Deinococcus radiodurans viewed from the perspective of comparative genomics[J]. Microbiology and Molecular Biology Reviews, 2001, 65(1):44-79.
[21] Battista JR, Park MJ, McLemore AE. Inactivation of two homologues of proteins presumed to be involved in the desiccation tolerance of plants sensitizes Deinococcus radiodurans R1 to desiccation[J]. Cryobiology, 2001, 43(2):133-139.
[22] 刘盈盈, 张陈, 江世杰, 等. 非生物胁迫下耐辐射异常球菌drB0118 基因功能分析[J]. 微生物学通报, 2015, 42(8):1474-1481.
[23] Chen H, Wu R, Xu G, et al. DR2539 is a novel DtxR-like regulator of Mn/Fe ion homeostasis and antioxidant enzyme in Deinococcus radiodurans[J]. Biochemical and Biophysical Research Communications, 2010, 396(2):413-418.
[24] Kim SG, Bhattacharyya G, Grove A, et al. Crystal structure of Dps-1, a functionally distinct Dps protein from Deinococcus radiodurans[J]. Journal of Molecular Biology, 2006, 361(1):105-114.
[25] Wang AG, Luo GH, Shao CB. Research on superoxide dismutase of soybean seed[J]. Acta Phytophysiologia Sinica, 1983, 9(1):78-83.
[26] Zeng SX, Wang YR, Liu HX. Some enzymatic reactions related to chlorophyll degradation in cucumber cotyledons under chilling in the light[J]. Acta Phytophysiologica Sinica, 1991, 17(2):177-182.
[27] Chen YZ, Patterson BD. The effect of chilling temperature on the level of superoxide dismutase, catalase and hydrogen peroxide in some plant leaves[J]. Acta Phytophysiologica Sinica, 1988, 14(4):323-328.
[28] Galay RL, Umemiya-Shirafuji R, Bacolod ET, et al. Two kinds of ferritin protect ixodid ticks from iron overload and consequent oxidative stress[J]. PLoS One, 2014, 9(3):e90661.
[29] Miyake C, Asada K. Ferredoxin-dependent photoreduction of the monodehydroascorbate radical in spinach thylakoids[J]. Plant and Cell Physiology, 1994, 35(4):539-549.
[30] Chen S, Shu Q. Biological mechanism of and genetic engineering for drought stress tolerance in plants[J]. Chinese Bulletin of Botany, 1998, 16(5):555-560.
[31] Chen SY. Membrane-lipid peroxidation and plant stress[J]. Chin Bull Bot, 1989, 6(4):211-217.
[32] Cabuslay GS, Ito O, Alejar AA. Physiological evaluation of responses of rice(Oryza sativa L.)to water deficit[J]. Plant Science, 2002, 163(4):815-827.
[33] Akcay UC, Ercan O, Kavas M, et al. Drought-induced oxidative damage and antioxidant responses in peanut(Arachis hypogaea L.)seedlings[J]. Plant Growth Regulation, 2010, 61(1):21-28.
(责任编辑 马鑫)
Effect of Ferritin DrfE on Antioxidant Enzyme Activity in Deinococcus radiodurans
WU Xiao-li1,2LIU Ying-ying2JIANG Shi-jie2,3CHEN Yun2LIU Xiao-li1,2WANG Yu-zhou4PING Shuzhen2WANG Jin1,2
(1. College of Life Science and Engineering,Southwest University of Science and Technology,Mianyang 621000;2. Biotechnology Research Institute,Chinese Academy of Agricultural Sciences,Beijing 100081;3. College of Life Sciences,Sichuan University,Chengdu 610065;4. The High School Affiliated to Renmin University of China,Beijing 100080)
To investigate the function of the ferritin DrfE encoded by gene drfE in Deinococcus radiodurans,we constructed the complemented strain pdrfE∷Δ,and compared the stress resistances of the wild-type WT,mutant ΔdrfE and complemented strain pdrfE∷Δ under different doses of hydrogen peroxide(H2O2)and NaCl. Also,the Fe2+concentration and antioxidant enzyme activities of three strains were measured under oxidative stress. The results showed that the deletion of gene drfE led the strain to be more sensitive to oxidative and highsalt stresses and the complementation of gene drfE restored the resistance of the strain to oxidative and salt stress. Furthermore,the deletion of drfE resulted in the Fe2+concentration in D. radiodurans cell increased from 232 μmol/L to 293 μmol/L in vivo. After treated with 80 mmol/L H2O2for 30 min,the CAT and SOD activities of the mutant ΔdrfE decreased by 32.74% and 41.3%,respectively,than that of wild-type. The above findings implied that the ferritin DrfE might be involved in iron metabolic pathway of D. radiodurans and played a key role in antioxidant system.
Deinococcus radiodurans;ferritin DrfE;abiotic stress;antioxidant enzyme;iron ion
10.13560/j.cnki.biotech.bull.1985.2017.02.024
2016-11-07
国家重点基础研究发展计划(“973计划”)(2013CB733903)
吴小丽,女,硕士研究生,研究方向:特殊环境微生物功能基因资源利用;E-mail:wuxiaoli513@126.com
王劲,女,博士,研究员,研究方向:微生物分子遗传学;E-mail:wjdsz@vip.sina.com

