非生物胁迫条件下施氏假单胞菌生物膜形成规律的研究
闫宁杨智敏尚立国戴淑玲战嵛华陆伟林敏燕永亮
(1. 西南科技大学生命科学与工程学院,绵阳 621010;2. 中国农业科学院生物技术研究所,北京 100081)
非生物胁迫条件下施氏假单胞菌生物膜形成规律的研究
闫宁1,2杨智敏2尚立国2戴淑玲1,2战嵛华2陆伟2林敏2燕永亮2
(1. 西南科技大学生命科学与工程学院,绵阳 621010;2. 中国农业科学院生物技术研究所,北京 100081)
旨在系统研究非生物胁迫因素对固氮施氏假单胞菌A1501生物膜形成能力的影响,测定了不同NaCl浓度、pH值、温度等培养条件下A1501生长及其生物膜形成能力的变化规律。结果显示,上述3种环境因素均对A1501菌的生长及生物膜形成具有影响,且呈现出一定的规律性。NaCl浓度2 mmol/L、pH值6.8、温度30℃是A1501的最适生长条件,而在0.6 mol/L的NaCl、pH值6.0及温度40℃等胁迫条件下,A1501菌的生物膜形成量均达到最高,分别为最佳生长条件下的7.8、7.0和2.0倍。在测试的诸因素中,NaCl浓度对A1501生物膜形成影响最大。以上结果表明,生物膜的形成与菌体生长负相关,即高盐、弱酸、高温等条件不利于A1501的生长,但刺激了其生物膜的形成。
施氏假单胞菌A1501;非生物胁迫;生物膜形成;生长特性;环境因素
细菌生物膜(bacterial biofilm)是指细菌为适应自然环境,在生长过程中逐渐形成附着于惰性或者活性实体表面的特殊的功能性结构。自然界中绝大多数细菌可以在不同的物体表面形成生物膜[1]。生物膜中除细菌外,还含有其分泌的胞外大分子多聚物、吸附的营养物质、代谢产物及细胞裂解产物,如蛋白质、多糖、DNA、RNA、肽聚糖、脂及磷脂等物质[2]。生物膜最大的特点是内部细胞功能的异质性,不同深度及不同部位的细菌体现出有差异的基因表达模式,也发挥着不同的功能。细菌生物膜由内到外分为里层菌与表层菌,它们的呼吸的强弱及活性、细菌RNA含量、蛋白质的合成途径均不同。表层菌与浮游菌相似,它们易获得氧气与营养,故代谢较活跃、分裂快、菌体体积亦较大,并且对外界环境更为敏感。里层菌则不同,它们不易获得营养物质,代谢率较低,多处于休眠状态,一般不进行频繁分裂,菌体体积也较小。
生物膜对微生物的生存与发展具有重要功能,它有利于细胞聚集、成膜,是细胞的天然保护屏障,保护微生物耐受紫外辐射、干旱、pH变化、抗菌剂等影响,可作为细胞代谢二次能源碳源,供微生物在营养匮乏环境维持生长。在生物膜中,细菌个体聚集在一起可以进行协同代谢,许多遗传物质也可以进行横向传递,从而为细菌群体更快的协同进化提供重要的保障[3]。细菌形成生物膜不但有抗逆性、抗药性的重要作用,在协助细菌吸附、侵染动植物的过程中也发挥着特殊的功能。例如,铜绿假单胞菌形成生物膜有助于增强其致病性[4];有益生防菌枯草芽孢杆菌可以在番茄根系形成浓密的生物膜,提高了其定殖能力,防止病原真菌的侵染,其对番茄青枯病的防治与生物膜形成能力呈正相关[5];生物膜的组成成分胞外多糖可以增强根瘤菌向根毛的吸附,而且对侵染新生表皮的根毛至关重要,进而影响了最终共生固氮体系的建立[6]。
生物膜的形成受到多种环境因素的影响,如营养与代谢信号[7]、无机物[7]、群体感应信号[8]、抗菌剂[7]、渗透压、酒精、pH、温度、氧气的浓度[9]等均可以影响生物膜的形成。已有前人研究表明,胁迫环境可以调节恶臭假单胞菌[10,11]、根瘤菌[12]等细菌生物膜的形成。
施氏假单胞菌A1501(Pseudomonas stutzeri)是一株革兰氏阴性菌,分离自水稻根际,是假单胞菌属中发现的仅有的具有固氮能力的菌株,该菌可定殖在禾本科作物水稻根际进行联合固氮,促进水稻生长[13],在农业生产中具有重要应用价值。将A1501菌开发成为微生物肥料,应用于大田生产,不仅可以降低农业投入,还具有环境友好、保护生物多样性等诸多优点。相关实验室围绕A1501菌的固氮基因表达调控、环境适应机制等工作开展了大量的研究[14,15],但关于A1501生物膜形成机制及其在根际定殖相关的机制研究未见报道,相关环境因素对A1501生物膜形成能力的影响有关研究未曾开展。
我国土地幅员辽阔,不同地域具有温度多样性的环境。并且,由于自然因素及人为因素的原因,分布有广大的盐碱化、酸化土地。这些胁迫环境会抑制微生物生长,降低微生物活性,改变微生物结构,对微生物具有一定的危害作用。施氏假单胞菌A1501作为一株具有重要应用潜力的禾本科固氮菌,其田间应用效果易受到这些环境因素的影响。所以,本实验欲通过测定不同浓度NaCl、pH值、温度等条件对A1501菌的生长状况、生物膜形成的影响,试图揭示不同因素在生物膜形成过程中的作用,对A1501高效优质应用于农业生产具有重要的理论参考与实践指导意义,为研究A1501的生物膜分子调控机制提供基础数据。
1 材料与方法
1.1 材料
1.1.1 实验菌株 施氏假单胞菌(Pseudomonas stutzeri)A1501为本实验室保存。
1.1.2 培养基与主要试剂 LB培养基:氯化钠10 g/L,胰蛋白胨10 g/L,酵母提取物5 g/L,pH值 调节至7。高压灭菌锅内121℃灭菌20 min。K培养基:KH2PO40.4 g/L,K2HPO40.1 g/L,NaCl 0.1 g/L,MgSO4·7H2O 0.2 g/L,MnSO4·H2O 0.01 g/L,Fe(SO4)3·H2O 0.01 g/L,NaMoO4·H2O 0.01 g/L,乳 酸 钠 6 mL/L、(NH4)2SO40.4 g/L,pH调 节 至6.8。高压灭菌锅内121℃灭菌30 min。结晶紫购自Aladdin公司,胰蛋白胨、酵母提取物购自OXOID公司,本实验所用其他培养基试剂均为分析纯。
1.2 方法
1.2.1 生长曲线测定 将A1501菌株在LB培养基中30℃ 220 r/min培养过夜,在4℃条件下 5 000 r/min离心10 min收集菌体,用液体K培养基调节菌悬液的光密度值OD600=1.0,按1∶10的比例转接至新鲜液体K培养基中,体积为20 mL,此时菌液OD600= 0.1,每个条件设置3个重复,置30℃摇床中进行培养。每2 h测定一次OD600的值,连续测定至12 h。记录数据并分析结果,实验进行3次重复。
1.2.2 生物膜的培养 将LB固体平板上新鲜活化的A1501菌落接种到LB液体培养基中,30℃ 220 r/min过夜培养。将菌体5 000 r/min离心10 min,弃上清,利用生理盐水洗涤菌体,再次5 000 r/min离心10 min,弃上清,生理盐水悬浮菌体调整OD600值为2。将OD600为2的菌液按1∶10的比例接入新鲜的K培养基中,使初始OD600为0.2。混匀后以150 μL每孔加入96孔聚苯乙烯板中,每组实验设置7个平行,以等量的无菌培养基作为空白对照组。于30℃静置培养24 h。实验重复3次。
1.2.3 生物膜形成能力的测定 收集悬浮细菌至1.5 mL离心管中,每孔加入140 μL蒸馏水轻柔冲洗残留浮游细菌,再加入150 μL 1%结晶紫染色10 min,倒掉染色液,蒸馏水清洗未结合的结晶紫,晾干后溶解于160 μL 30%乙酸,用酶标仪测定溶液在OD560处的吸光值。同时用紫外分光光度计测定悬浮细菌OD600处吸光值。
1.2.4 培养条件的设定
1.2.4.1 NaCl浓度的设定 分别配置NaCl浓度为2 mmol/L,0.3、0.4、0.5、0.6和0.7 mol/L 的K培养基,测定不同NaCl浓度条件下形成生物膜的OD560值与细菌生长量的OD600值。
1.2.4.2 pH的设定 配置K培养基,分装后调整培养基pH分别为5.0、6.0、6.8、8.0、9.0和10.0、测定不同pH值条件下形成生物膜的OD560值与细菌生长量的OD600值。
1.2.4.3 温度梯度的设定 将A1501菌置于15、20、25、30、37和40℃静置培养24 h,测定不同培养温度下形成生物膜的OD560值与细菌生长量的OD600值。
每批实验只改变单一因子条件,若无特殊说明,NaCl浓度为2 mmol/L,pH6.8,温度为30℃。
1.2.5 统计学分析 实验结果以均值±SD(x-±s)表示。采用SPSS 24.0软件,对细菌在不同环境条件下生物膜形成量进行LSD多重比较。以P<0.05为方差有统计学意义。
2 结果
2.1 NaCl浓度对菌体生长及生物膜形成能力的影响
本实验研究了NaCl浓度对A1501生长速度与生物膜形成的影响。不同NaCl浓度对A1501生长的影响(图1)显示,当NaCl浓度为2 mmol/L时A1501生长速率最快,并且3个生长时期区分非常明显:0-2 h为调整期,2-10 h为对数期,10 h后进入平台期。而提高NaCl浓度后,在0.3-0.6 mol/L的范围内,随着NaCl浓度的不断升高,调整期逐渐延长,生长速度逐渐变缓且菌体浓度依次降低,12 h仍未到达平台期。因此,高浓度的NaCl对细菌的生长具有抑制作用。
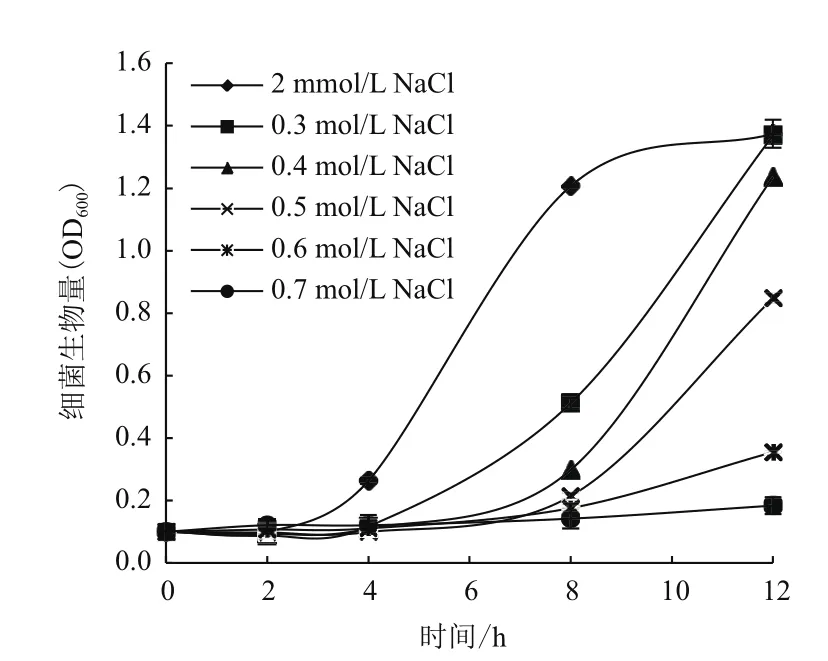
图1 K培养基添加不同浓度NaCl条件下施氏假单胞菌A1501的生长曲线
不同NaCl浓度对A1501生物膜形成的影响(图2)显示,成膜量随着NaCl浓度升高先增加后下降。当NaCl浓度为0.6 mol/L时,生物膜的形成能力最强。在0.002-0.6 mol/L的范围内,随着NaCl浓度的升高其生物膜形成能力显著提高(P<0.05);超过0.6 mol/L时,成膜量开始下降(P<0.05),并且NaCl浓度为0.7 mol/L时所形成生物膜量与0.5 mol/L无显著性差异(P>0.05)。所以低浓度的NaCl(2 mmol/L)有利于细菌的生长,在0.3-0.6 mol/L NaCl范围内,A1501生长速度逐渐降低,而生物膜的形成量依次增加,0.6 mol/L NaCl培养条件下生物膜形成量达到最大,约为最适生长条件(2 mmol/L)的7.8倍。由此可见,低浓度NaCl环境有利于细菌生长,但不利于生物膜的形成;随着NaCl浓度的增加,菌体所受到的盐胁迫程度逐渐增强,抑制了A1501的生长,却促进了其生物膜的形成。
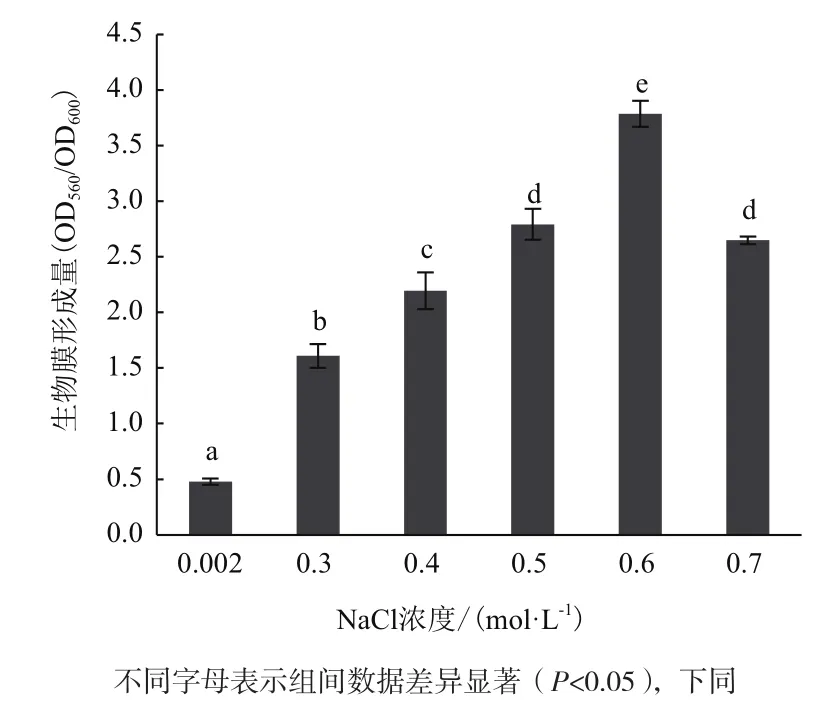
图2 培养基中添加不同浓度NaCl对A1501生物膜形成的影响
2.2 pH值对生物膜形成的影响
本实验探究了在pH值5.0-10.0的范围内,A1501生长的变化(图3)及其对生物膜形成量的影响(图4)。pH值为6.8-9.0时,细菌生长速度最快,且生长曲线基本吻合,10 h到达平台期,12 h OD600终浓度达到1.4(图3)。pH值增加至10.0时,细菌生长速度略变慢,8 h即进入平台期,12 h OD600终浓度仅为1.2。而pH值为5.0-6.0时,A1501的生长被抑制,OD600值始终保持在0.1。结果表明,A1501适宜生活在偏碱性环境中,在pH值6.8-9.0范围内生长速率最快。
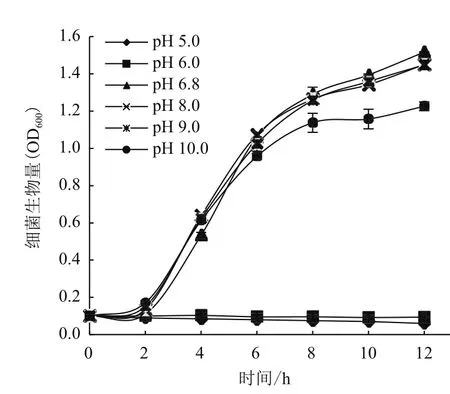
图3 不同pH值培养条件下A1501的生长曲线
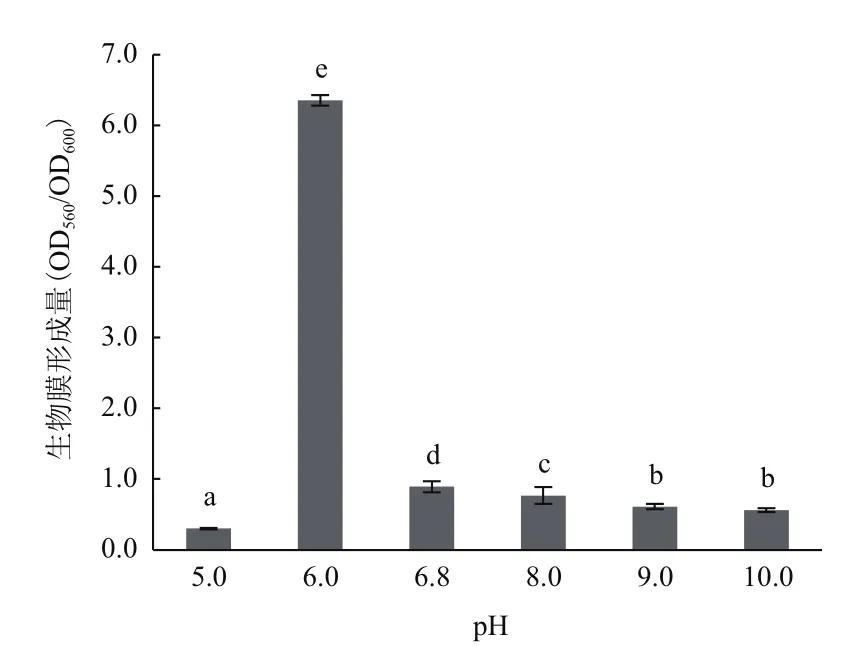
图4 不同pH值培养条件下A1501生物膜形成的影响
相同条件下测定生物膜的形成量,如图4所示:pH值为6.0时,A1501的生物膜形成量最多;在培养液pH值为5.0的酸性条件下,A1501仅形成微量的生物膜;pH值为6.0-9.0时,生物膜形成能力呈现出下降的趋势(P<0.05);当pH值为10.0时,生物膜形成量与pH值9.0无显著差异(P>0.05)。结合生长曲线的测定结果,A1501较适宜在中性及偏碱性的条件下生长,在pH值为6.0的酸性条件下A1501生物膜形成的量约为最适生长条件的7.0倍。由此可得,中性与偏碱性环境适宜A1501生长但不利于生物膜的形成;偏酸性的环境不利于A1501的生长,但促进了菌体生物膜的形成。
2.3 温度对生物膜形成的影响
为探究温度对A1501生长与生物膜形成的影响,本实验测定了15-40℃范围内A1501的生长曲线(图5)与生物膜形成量(图6)。如图5所示,随温度的变化细菌的生长曲线呈规律性变化。在20-40℃范围内,随温度的升高,细菌的生长量逐渐增加,生长速度逐渐增快。当30-40℃培养时,10 h即达到平台期,而20-25℃培养时12 h仍未到达平台期,低温环境使A1501的生长受到明显抑制。但是实验过程中观察到,当37-40℃培养时,培养基中出现了细菌抱团的现象,而在30℃时未观察到类似现象,是否因为37-40℃相对于A1501为高温胁迫环境促使细菌抱团仍需要后续探索。此外,前人研究表明在N2培养下,A1501的最适温度为30℃,温度达40℃时固氮活性明显下降。所以,虽然40℃培养时生成的细菌生物量最多,但产生了抱团的现象,细菌的固氮活性也明显降低,推测40℃为A1501的高温胁迫环境。30℃是施氏假单胞菌A1501固氮与生长的最适温度。
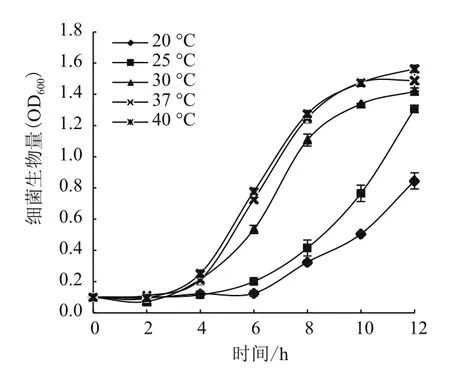
图5 不同温度培养下A1501的生长曲线
温度变化对A1501的生物膜形成的影响(图6)显示,40℃时A1501生物膜形成量最多,显著高于其他温度组(P<0.005)。当15-25℃培养时,随着温度的升高,成膜量显著增多(P<0.005)。相比较25℃,30、37与20℃培养时成膜量显著下降,但三者之间无显著性差异(P>0.005)。经计算,40℃培养时所形成生物膜量为最适生长温度的2倍。由此可得,15-25℃时A1501生长速率加快,生物膜形成也逐渐增强。30℃为A1501的最适生长温度,但不利于生物膜的形成,40℃不利于A1501的生长,但促进了生物膜的形成。
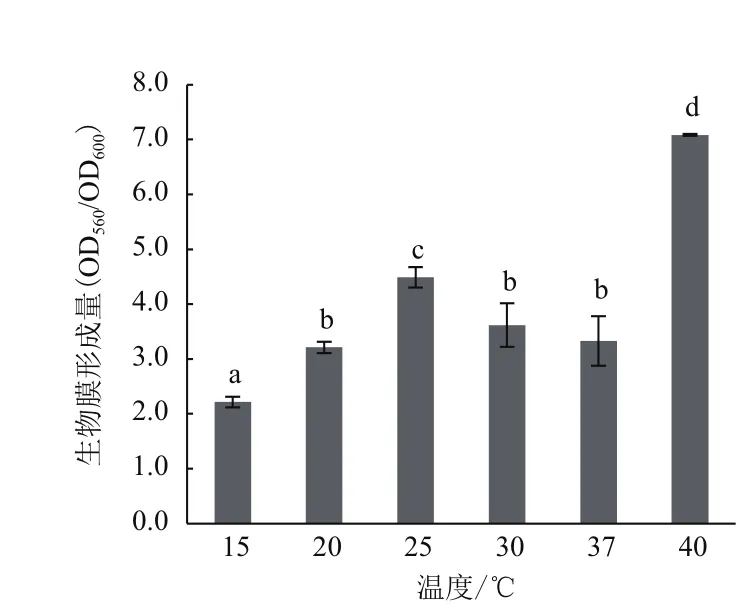
图6 温度对A1501生物膜形成的影响
3 讨论
施氏假单胞菌A1501是一株联合固氮菌,可附着、侵入禾本科植物的根际,具有较强的固氮能力,将固氮产物分泌到土壤中供植物吸收利用,是一株具有极大应用潜力的微生物菌肥。相比较化学肥料,该菌对减少环境污染,改善土壤理化性质,提高土壤肥力水平具有深刻长远的应用价值。生物膜的形成可能对A1501定殖于植物根际并发挥固氮功能具有重要意义。由于外界环境的复杂多变会影响A1501的生长与生物膜形成,因此本实验通过测定NaCl、pH、温度3个因素对A1501生长与生物膜形成的影响,发现二者呈现出一定的规律:环境条件适于A1501生长时,细菌倾向于快速生长,只形成少量的生物膜;A1501面临逆境胁迫时,细菌倾向于形成大量的生物膜,生长速率显著降低。生物膜的形成与生长负相关,说明A1501形成生物膜是一种应对外界胁迫环境的生存策略,该结果可为未来的实际应用提供理论依据。
高浓度的NaCl抑制了施氏假单胞菌A1501的生长,说明A1501适宜在低浓度NaCl的环境中生长。0.6 mol/L NaCl刺激了A1501生物膜的形成,类似现象还有0.27 mol/L NaCl促进金黄色葡萄球菌生物膜形成[16],0.12 mol/L NaCl的环境下恶臭假单胞菌胞外大分子物质(碳水化合物、胞外蛋白、胞外DNA)的分泌量都显著增加,其中以胞外蛋白的增加最为明显[17]。不同的是,利用PVC材料检测基本培养基NaCl浓度由0增加至0.4 mol/L时荧光假单胞菌的生物膜形成,发现当浓度为0.2 mol/L或更高时,生物膜量降低了4倍[18]。生物膜对NaCl响应多样性可能是调控机制与细菌为适应环境共同作用的结果。环境中盐浓度较低时,A1501倾向于生长繁殖,但盐浓度上升不利于其生长时,A1501倾向于合成生物膜以应对胁迫环境。推测由于生物膜具有亲水性,合成更多的胞外多聚物有利助于保持含水环境,从而维持膜内细胞的正常生长。
A1501可以在pH值6.8-10.0范围内生长,pH为酸性时抑制了细菌的生长,但刺激了生物膜的形成。相似的现象,恶臭假单胞菌CZ1的适宜生长pH值为7.0-8.5,pH值5.5-6.5时胞外多聚物显著增加[17]。推测胞外多聚物是一种带电荷的大分子物质,可以为膜内细胞提供一道缓冲屏障,维持细胞内的pH平衡,从而保护细菌在酸性环境下生存。Wolters[19]认为土壤酸碱度可以决定微生物种类的分布,一般来说,细菌、放线菌喜好中性偏碱的土壤并且生长较好,真菌一般较耐酸。巧合的是,施氏假单胞菌A1501与恶臭假单胞菌CZ1都分离自土壤,且在中性偏碱性的条件下长势较好,面临偏酸性的环境时生物膜形成量最多,可以推测土壤细菌的生存环境由中性转变为酸性不利于其生长时,倾向于形成大量生物膜渡过酸性胁迫环境。不同的情况是表皮葡萄球菌[20]与金黄葡萄球菌[21]最适生长pH为7.0,均在pH值为7.0时生物膜形成能力最强。推测二者均寄生在人体,在pH7.0的稳定条件下快速生长,但为了抵御免疫系统的伤害与药物的作用,同时形成大量的生物膜以维持其生存。生物膜对pH响应的多样性是细菌对生存环境适应的结果。
A1501的最适生长温度为30℃,当40℃培养时生物膜形成能力最强。在恶臭假单胞菌中发现了类似的现象,28℃是恶臭假单胞菌CZ1的最适生长温度,生物膜胞外大分子物质(碳水化合物、胞外蛋白、胞外DNA)随温度的升高(15-35℃)都呈上升趋势,至35℃时分泌量最大,其中的主要增长组分为胞外蛋白[17]。推测土壤环境中,高温不利于水分的持留,胞外多聚物分泌有利于形成一系列的含水微环境,从而保护细胞免于干燥而死亡。不同的情况是金黄色葡萄球菌与铜绿假单胞菌最适生长温度为37℃,在20-37℃培养时,随着温度的升高(20-37℃),二者形成生物膜的量均逐渐升高[22]。37℃形成生物膜能力最强可能是为了抵御人体免疫系统的伤害及增强其耐药性。
通过比较3种环境因素对A1501生长速率的影响可以发现,A1501对pH值的变化最敏感:当pH值由7.0降至6.0时,A1501由最快生长速率降低为停止生长,说明pH由中性变为酸性时显著降低了A1501的生长速率。而随着NaCl浓度逐渐升高、温度逐渐降低,A1501长势逐渐变缓,至0.6 mol/L NaCl、20℃仍可缓慢生长,说明A1501对NaCl浓度与温度变化有一定的适应能力。由于pH值可以影响微生物细胞膜的通透性与稳定性,改变细胞内大分子电荷的属性与数量,改变外界可利用营养物质的溶解程度[23]。推测H+对A1501细胞膜、胞内大分子伤害较大或外界营养物质的可利用率下降。通过比较环境对A1501生物膜形成的影响可以发现:0.6 mol/L NaCl、pH值6.0、40℃条件时生物膜形成量依次为最适生长条件的7.8、7.0和2.0倍。3种环境刺激强弱依次为NaCl浓度>pH>温度,说明NaCl浓度的变化对A1501生物膜的刺激效果最强。高盐引起的高渗环境会引起细胞内外渗透压的不平衡,导致细胞脱水从而干扰细菌的正常生理代谢水平。推测面临高浓度Na+或胞外渗透压升高的不利环境时,A1501生物膜的合成效率最快。
生物膜结构由诸多生物大分子组成,如胞外蛋白质、胞外多糖、eDNA等,关于环境对生物膜组分的调控途径已有大量研究,其中胞外多糖报道最多。例如,选取20、30和37℃培养铜绿假单胞菌生物膜,测定温度对藻酸盐合成基因algD转录水平的影响,发现随着温度升高,algD转录水平显著升高[22],温度的升高可以刺激大肠杆菌聚-N-乙酰葡萄糖胺(PNAG)合成基因的表达水平[24],渗透压环境可以调节中华根瘤菌的胞外多糖的合成[25]。说明胞外多糖的合成与胁迫环境有着密切的联系,一定程度揭示了胁迫环境对细菌生物膜的调控机制。通过同源比对分析,预测出A1501基因组中也有大量生物膜相关基因,如纤维素合成基因、脂多糖合成基因、鞭毛菌毛合成基因。这些基因与相关途径在0.6 mol/L NaCl、pH6、40℃等胁迫条件下如何调控或参与了A1501生物膜的形成仍需要后续研究。
4 结论
本研究选取NaCl浓度、pH、温度3个环境因素,测定它们对施氏假单胞菌A1501生长速率及生物膜形成的影响,结果显示NaCl浓度为2 mmol/L、pH值6.8、温度30℃的培养条件最适于A1501的生长,但不适于生物膜的形成;在NaCl浓度为0.6 mol/L,pH值6.0,温度40℃的胁迫条件不利于A1501的生长但刺激了生物膜的形成。说明生物膜的形成与菌体生长负相关。外界环境适宜时,A1501快速生长而形成少量的生物膜,面临非生物胁迫时,A1501生长受到抑制,促进了其生物膜的形成。
[1]Costerton JW. Introduction to biofilm[J]. International Journal ofAntimicrobial Agents, 1999, 11(3):217-221.
[2]Steinberger RE, Holden PA. Macromolecular composition of unsaturated Pseudomonas aeruginosa biofilms with time and carbon source[J]. Biofilms, 2004, 1(1):37-47.
[3]Jefferson KK. What drives bacteria to produce a biofilm?[J]. FEMS Microbiology Letters, 2004, 236(2):163-173.
[4]Wang Y, Dai Y, Zhang Y, et al. Effects of quorum sensing autoinducer degradation gene on virulence and biofilm formation of Pseudomonas aeruginosa[J]. Science in China Series C:Life Sciences, 2007, 50(3):385-391.
[5]Chen Y, Yan F, Chai Y, et al. Biocontrol of tomato wilt disease by Bacillus subtilis isolates from natural environments depends on conserved genes mediating biofilm formation[J]. Environmental Microbiology, 2013, 15(3):848-864.
[6]Smit G, Swart S, Lugtenberg BJJ, et al. Molecular mechanisms of attachment of Rhizobium bacteria to plant roots[J]. Molecular Microbiology, 1992, 6(20):2897-2903.
[7]Karatan E, Watnick P. Signals, regulatory networks, and materials that build and break bacterial biofilms[J]. Microbiology and Molecular Biology Reviews, 2009, 73(2):310-347.
[8]Lee J, Zhang L. The hierarchy quorum sensing network in Pseudomonas aeruginosa[J]. Protein & Cell, 2015, 6(1):26-41.
[9]Götz F. Staphylococcus and biofilms[J]. Molecular Microbiology, 2002, 43(6):1367-1378.
[10]Lin H, Chen G, Long D, et al. Responses of unsaturated Pseudomonas putida CZ1 biofilms to environmental stresses in relation to the EPS composition and surface morphology[J]. World Journal of Microbiology and Biotechnology, 2014, 30(12):3081-3090.
[11]Nielsen L. Novel components of Pseudomonas putida biofilm exopolymeric matrix and a transcriptome analysis of the effects of osmotic and matric stress[M]. 2010.
[12]Rinaudi LV, Giordano W. An integrated view of biofilm formation in rhizobia[J]. FEMS Microbiology Letters, 2010, 304(1):1-11.
[13] 丘元盛, 周淑萍, 莫小真, 等. 稻根联合固氮细菌的研究——Ⅰ. 菌种的分离和鉴定[J]. 微生物学报, 1981, 4:468-472.
[14]Zhan Y, Yan Y, et al. The novel regulatory ncRNA, NfiS, optimizes nitrogen fixation via base pairing with the nitrogenase gene nifK mRNA in Pseudomonas stutzeri A1501[J]. Proceedings of the National Academy of Sciences, 2016:201604514.
[15]Yan Y, Yang J, Dou Y, et al. Nitrogen fixation island and rhizosphere competence traits in the genome of root-associated Pseudomonas stutzeri A1501[J]. Proceedings of the National Academy of Sciences, 2008, 105(21):7564-7569. .
[16]Lim Y, Jana M, Luong TT, et al. Control of glucose-and NaClinduced biofilm formation by rbf in Staphylococcus aureus[J]. Journal of Bacteriology, 2004, 186(3):722-729.
[17]陈光村. 恶臭假单胞菌CZ1非饱和生物膜耐受和累积重金属的分子机制[D]. 杭州:浙江大学, 2011.
[18]O’Toole GA, Kolter R. Initiation of biofilm formation in Pseudomonas fluorescens WCS365 proceeds via multiple, convergent signaling pathways:a genetic analysis[J]. Molecular Microbiology, 1998, 28(3):449-461.
[19]Wolters V, Joergensen RG. Microbial carbon turnover in beech forest soils at different stages of acidification[J]. Soil Biology and Biochemistry, 1991, 23(9):897-902.
[20]Chaieb K, Chehab O, et al. In vitro effect of pH and ethanol on biofilm formation by clinical ica-positive Staphylococcus epidermidis strains[J]. Annals of Microbiology, 2007, 57(3):431-437.
[21]Zmantar T, Kouidhi B, Miladi H, et al. A microtiter plate assay for Staphylococcus aureus biofilm quantification at various pH levels and hydrogen peroxide supplementation[J]. The New Microbiologica, 2010, 33(2):137.
[22]Abdallah M, Khelissa O, Ibrahim A, et al. Impact of growth temperature and surface type on the resistance of Pseudomonas aeruginosa and Staphylococcus aureus biofilms to disinfectants[J]. International Journal of Food Microbiology, 2015, 214:38-47.
[23]陈燕飞. pH对微生物的影响[J]. 太原师范学院学报:自然科学版, 2009, 3:121-124, 131.
[24]Cerca N, Jefferson KK. Effect of growth conditions on poly-N-acetyl glucosamine expression and biofilm formation in Escherichia coli[J]. FEMS Microbiology Letters, 2008, 283(1):36-41.
[25]Breedveld MW, Zevenhuizen L, Zehnder AJB. Osmotically induced oligo-and polysaccharide synthesis by Rhizobium meliloti SU-47[J]. Microbiology, 1990, 136(12):2511-2519.
(责任编辑 马鑫)
Patterns of Biofilm Formation in Pseudomonas stutzei Under Abiotic Stresses
YAN Ning1,2YANG Zhi-min2SHANG Li-guo2DAI Shu-ling1,2ZHAN Yu-hua2LU Wei2LIN Min2YAN Yong-liang2
(1. School of Life Science and Engineering,Southwest University of Science and Technology,Mianyang 621010;2. Biotechnology Research Institute,Chinese Academy of Agricultural Sciences,Beijing 100081)
In order to systematically investigate the effects of abiotic stress factors on the growth and biofilm formation of Pseudomonas stutzeri A1501,we measured the variation patterns of growth and biofilm formation of A1501 under different NaCl concentrations,pH and temperature. The results revealed that above 3 environmental factors did influence the growth and the biofilm formation of A1501 strain with certain extent of regularity. The optimal growth condition of A1501 with those factors was 2 mmol/L NaCl,pH6.8,and 30℃,respectively. However,the biofilm formation reached the maximum in the stress condition of 0.6 mol/L NaCl,pH6.0,and 40℃ with 7.8-,7.0- or 2.0-fold increment compared to the optimal growth condition,respectively. Among the three factors,NaCl showed the most significant effect on the biofilm formation of A1501. In a conclusion,under the tested conditions,the biofilm formation of A1501 strain was negatively correlated with the growth of strain,i.e.,high salt,weak acid and high temperature were adverse to the growth of A1501,however,it stimulated the biofilm formation.
Pseudomonas stutzei A1501;abiotic stress;biofilm formation;growth characteristics;environmental factor
10.13560/j.cnki.biotech.bull.1985.2017.02.025
2016-11-13
国家自然科学基金项目(31470174,31570081,31470205),广东省引进创新创业团队计划项目(2013S033)
闫宁,男,硕士研究生,研究方向:固氮微生物学;E-mail:15701232990@163.com
燕永亮,男,博士,研究方向:固氮微生物分子生物学及基因工程;E-mail:yanyongliang@caas.cn

