高水溶性β-环糊精衍生物对萘胺的包合与洗脱作用
杨成建,李 超,陈兴都,张 璐,郑 直,周 晨,蒋 欣(.西安建筑科技大学环境与市政工程学院,陕西 西安 70055;.哈尔滨工业大学市政环境工程学院,黑龙江 哈尔滨 50090)
高水溶性β-环糊精衍生物对萘胺的包合与洗脱作用
杨成建1*,李 超2,陈兴都1,张 璐1,郑 直1,周 晨1,蒋 欣1(1.西安建筑科技大学环境与市政工程学院,陕西 西安 710055;2.哈尔滨工业大学市政环境工程学院,黑龙江 哈尔滨 150090)
合成了谷氨酸-β—环糊精(GluCD)、甘氨酸-β—环糊精(GlyCD)、乙醇胺-β—环糊精(ChoCD)等3种高水溶性β-环糊精(β—CD)氨基衍生物,并研究了其对溶液中萘胺的包合作用及在低浓度下对土壤中萘胺的洗脱作用.研究结果表明:3种 β—CD氨基衍生物对萘胺的包合能力大于β—CD,大小顺序为:GluCD>ChoCD>GlyCD>β-CD, GluCD的包合常数为270.7L/moL,是β-CD的4.5倍.在低浓度下,3种β-CD氨基衍生物对土壤中的萘胺依然表现出较高的洗脱能力,在浓度为1.0g/L的条件下,GlyCD、ChoCD和GluCD对土壤中萘胺的洗脱率分别高达88%、94%和98%,3种β-CD氨基衍生物对土壤中萘胺的洗脱能力与包合能力成正比;此外,在低浓度下,环糊精在土壤上的吸附也是影响有机物洗脱过程的重要因素之一.
β-环糊精氨基衍生物;萘胺;包合;洗脱
近年来,由于β-环糊精(β-CD )易于获得、价格低廉,同时,与表面活性剂相比,具有无毒、无污染、易降解,无吸附等优点而得到重视,并成为土壤污染修复研究的热点[1-11].但是 β-CD的疏水区域及催化活性有限,使其在应用上受到一定限制[1],为了克服这一缺点,研究人员尝试用某些基团对 β-CD进行修饰,得到水溶性更大、应用更广的 β-CD衍生物,比如,羧甲基-β-CD(CMCD)和羟丙基-β-CD (HPCD)[2-6]、甲基-β-CD(MCD)和羟乙基-β-CD(HECD)等[7-9].虽然部分较高水溶性β-CD衍生物已获得,也取得了较好的洗脱、催化降解效果,但是有人认为[10-11]在今后的若干年内,有关β-CD的化学修饰(比如制成水溶性更强的环糊精衍生物)、包合(增溶去除有毒难溶难降解有机物)以及与其他环境友好材料(比如壳聚糖)的接枝仍是环境治理领域感兴趣的话题,β-CD必将更多地应用于土壤污染修复领域.就 β-CD衍生物与客分子的包合作用而言,有研究发现[12-13],客分子的几何形状与 β-CD衍生物疏水空腔的匹配程度及客分子的疏水性是决定β-CD衍生物能否与客分子形成稳定包合物的主要因素,Wang等[12]认为,这也与 β-CD衍生物的空间位阻效应有关;而Tabushi等[14]研究发现,包合度决定于 β-CD衍生物疏水空腔内部的水分子的“无序化”程度及客分子亲水部分与β-CD衍生物外缘羟基的接触度.因此,β-CD衍生物与客分子的包合机理还没有形成统一的认识.目前,β-CD衍生物对土壤中有机物的洗脱作用得到了大量研究[2-5],与表面活性剂相比,其洗脱能力得到了普遍认可[4],但在这些研究中,所用β-CD衍生物的浓度往往比较高(均在 10g/L以上),针对低浓度(如1g/L以下)的研究至今少见报道,而这些研究对于 β-CD衍生物洗脱技术在有机污染土壤修复中的应用具有实际意义(如降低成本).此外,土壤对β-CD衍生物的吸附是否存在?吸附强度是多少?对有机物洗脱会产生什么影响?这些问题也有待进一步深入研究.
为此,本文合成了3种高水溶性的β-CD氨基衍生物,并研究它们对多环芳烃萘胺的包合作用及低浓度下对萘胺的洗脱作用,以期寻找土壤污染化学修复新技术,并进一步拓宽 β-CD及其衍生物的应用范围.
1 材料与方法
1.1 仪器与试剂
β-CD,纯度为 98%,购自上海麦克林生物化学有限公司;萘胺,分析纯,购自天津永晟精细化工有限公司,使用前进一步纯化;甲醇、乙醇、氢氧化钠、氢氧化钾、谷氨酸钠、2-氮基乙酸、乙醇胺、环氧氯丙烷、硫酸、草酸、中性氧化铝和石英砂均为分析纯,购自天津市福晨化学试剂厂.土壤采集于西安市浐河菜园基地,土壤类型为塿土,将采集的表层土壤自然风干后,研磨过0.6mm孔径筛,土壤pH为5.4,有机质含量为2.5%.
1.2 β-CD氨基衍生物的合成[15]
在具塞三角瓶中加入8.1g β-CD,70mL蒸馏水,4.8g NaOH,搅拌至β-CD全溶解,水浴加热至50℃,加入16.9g谷氨酸钠(或7.5g 2-氮基乙酸或6.1g 乙醇胺),在2h内滴加10.2g环氧氯丙烷,于60℃反应 1h.反应完毕,冷却至室温,用 10%的草酸调 pH=5~6,放置过夜,将草酸钠晶体过滤,加入 150mL无水乙醇,用中性氧化铝柱分离,用60%(体积比)的乙醇作洗脱剂,将滤液中的乙醇蒸出,再浓缩至30mL以下,加人足量的无水甲醇,放置过夜,得到白色沉淀,过滤,真空干燥,得到谷氨酸-β—CD(GluCD)或甘氨酸-β—CD(GlyCD)或乙醇氨-β—CD(ChoCD)的白色固体.
1.3 β-CD氨基衍生物合成的红外光谱(FTIR)分析
用溴化钾压片法在傅里叶变换红外光谱仪(IRPrestige-21,日本岛津)上测定,波数范围4000~400cm-1,分辨率 4cm-1,以溴化钾做空白扣除背景值.
1.4 β-CD氨基衍生物对萘胺的包合实验
在浓度为 10mg/L的萘胺溶液中,加入一系列浓度的 β—CD氨基衍生物溶液,保持溶液中浓度分别为0、0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8、2、2.2g/L,于 305nm处测定吸光值,根据不同 β—CD氨基衍生物浓度下萘胺溶液吸光值的变化,计算β—CD氨基衍生物对萘胺的包合常数.
1.5 β-CD氨基衍生物对土壤中萘胺的洗脱实
验
在淋洗柱(300×40mm)底部放少许脱脂棉,加入0.5cm厚的石英砂,将80g土样加入柱中,轻轻敲打玻璃柱,使土壤在柱中分散均匀、密实,然后在土样上面再加0.5cm厚的石英砂,土壤与石英砂之间分别用一层滤纸隔开.先用 0.01mol/L的CaCl2溶液过柱,至饱和,使顶层石英砂上保持一薄层CaCl2液面.加入200mg/L的萘胺5mL (萘胺的总量为 1mg),静置一段时间,使萘胺吸附在土样上后,用不同浓度的β—CD氨基衍生物溶液(0、0.4、1.0g/L,共200mL)淋洗土壤柱,以具塞刻度管收集洗脱液,每10mL为1个组分.测定时,分别吸取lmL洗脱液于10mL刻度管中,以l:l甲醇/水溶液定容,在紫外分光光度计上于305nm波长处测定萘胺的吸光值,并根据标准曲线计算萘胺的浓度.同时,每组实验平行 3 次,以不加萘胺的空白土壤柱洗脱液为参比,扣除土壤溶解性有机物对萘胺测定的干扰.
1.6 β-CD在土壤上的等温吸附实验
采用振荡平衡法,在50mL 磨口具塞三角瓶中分别加入1.0g土壤,20mL一系列浓度的β-CD和5mL 200mg/L的NaN3微生物抑制剂溶液,塞紧瓶塞;在25±1℃和150r/min条件下,振荡12h,吸附液倒入 20mL离心管中,3000r/min离心20min,移取5mL上清液于25mL比色管中,定容,加KI- I2显色剂,用分光光度计于430nm处,测定β-CD浓度,并计算其在土壤上的吸附量.
1.7 分析方法
β-CD的测定:基于β-CD会引起KI-I2混合液中I3¯、I2吸收光谱增加的原理[16],可采用KI-I2分光光度法测定样品中 β-CD的浓度.将样品移入 25mL 比色管,定容到刻度,加入 0.5mL的KI-I2显色剂(准确称取1g I2和2g KI,加重蒸水溶解,定容至 100mL,避光低温保存,使用前将显色剂稀释4倍),摇匀,静置30min;波长430nm处,1cm比色皿,以试剂空白作参比测定吸光值,根据标准曲线即可求出样品中β-CD浓度.
萘胺的测定:用紫外分光光度法测定,测定前用1:1甲醇溶液稀释,目的是破β-CD及其氨基衍生物与萘胺形成的包合物,保持萘胺的光谱不发生明显变化,测定波长为305nm.
2 结果与讨论
2.1 β-CD氨基衍生物的合成及FTIR光谱分析
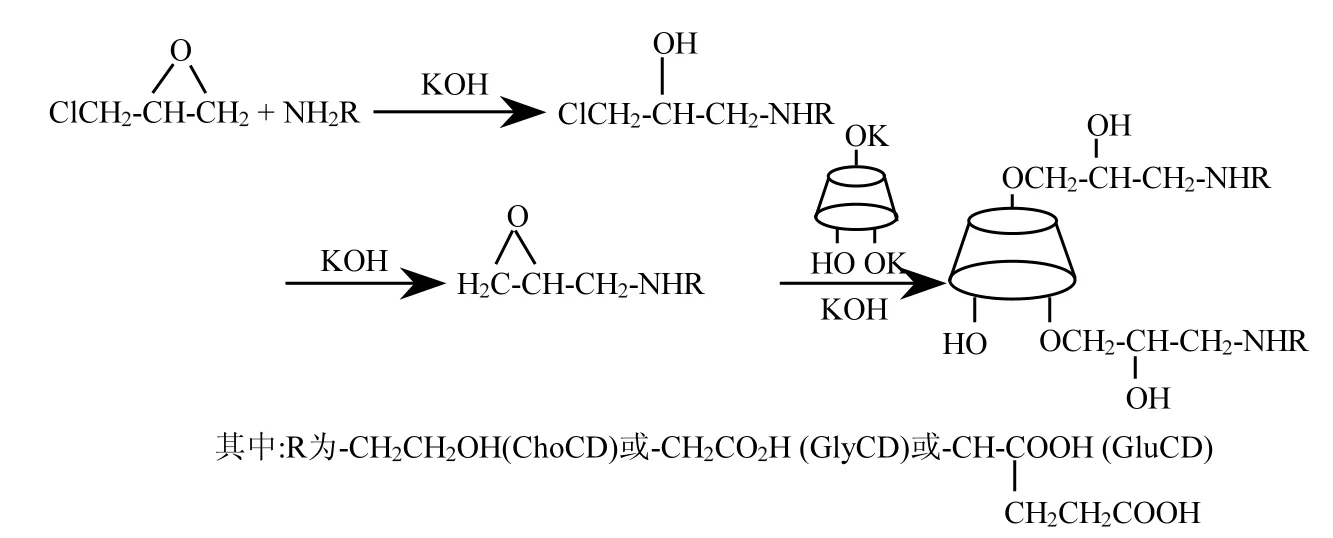
图1 β-CD氨基衍生物的合成过程Fig.1 The synthetic process of three amino acids derived from β-cyclodextrins

图2 β-CD氨基衍生物的FTIR光谱Fig.2 The Fourier transform infrared (FTIR) spectra of amino acids derived from β-cyclodextrins
3种 β-CD氨基衍生物的合成过程如图 1所示,首先,含氨基的化合物在碱性条件下与环氧氯丙烷反应,形成 1-氨基-2-羟基-3-氯丙烷,然后进一步形成 3-氨基-1,2-环氧丙烷,3-氨基-1,2-环氧丙烷再与β-CD反应形成β-CD氨基衍生物.
比较β-CD和ChoCD、GluCD、GlyCD的FTIR光谱图可知(见图2),在ChoCD、GluCD、GlyCD图谱中,1400~1500cm-1处由N—H弯曲振动和 C—N伸缩振动引起的组合吸收峰逐渐增强,证明了 3种 β-环糊精氨基衍生物中 NH及NH2基团的存在,此外,在ChoCD及GlyCD图谱中,900cm-1处新增了 N—H变形吸收峰.在GluCD及GlyCD图谱中,1500~1700cm-1处出现了羰基(—C=O)伸缩振动峰,同时,在GlyCD图谱的1360cm-1处及GluCD图谱的1617cm-1处新增了羧基(COO—)峰,这些证明了GluCD及GlyCD中存在羧基.
2.2 β-CD氨基衍生物对萘胺的包合特性
包合平衡系数K是决定β—CD及其衍生物(CD)与客分子(G)包合性质的一个重要参数[17].通过 K值的测定能对包合平衡作出定量的描述,K值的大小反映了CD与G结合力的强弱.CD与G在水溶液中的包合是一个平衡过程,符合质量作用定律,若采用紫外一可见分光光度法,当形成1:1的包合物时(CD与G的量浓度比),G吸光值的变化与G起始浓度(mol/L)、CD起始浓度(mol/L)之间存在如下关系曲线[17-18]:
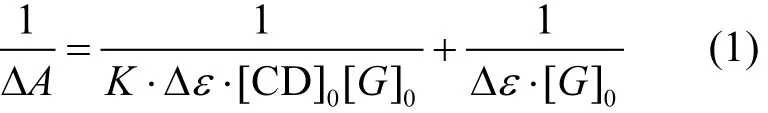
式中:AΔ为加入CD后G吸光值的变化;εΔ为G与 CD形成包合物前后的摩尔消光系数之差,L/moL;为 CD的起始浓度,mol/L;为 G的起始浓度,mol/L;以作图即可求出K值.β—CD和3种β—CD氨基衍生物与萘胺包合物的关系曲线如图 3所示,由线性回归方程可以得β-CD、GlyCD、ChoCD及GluCD的包合常数分别为60.66、97.29、137.8及270.7L/moL, 3种β-CD氨基衍生物对萘胺的包合能力大于β-CD,其中GluCD包合能力最强,约为β-CD的4.5倍.有研究表明[14,19-20]:CD与客分子形成包合物的驱动力是具有高能量的水分子从CD疏水空腔中的移出,CD疏水空腔的水分子间因无法像在溶液中那样彼此间形成氢键而具有较高的焓值,这些高能量的水分子能被极性比它小的合适的客分子所取代;被包合时,客分子通常位于 CD疏水空腔的特定位置以使其疏水部分与 CD的疏水空腔达到最大限度的接触,而其亲水部分则尽可能的留在包合物的外层以确保与溶剂及 CD亲水外缘羟基的最大接触角.因此,β-CD氨基衍生物对萘胺的包合大于β-CD很有可能是因为 β-CD亲水外缘极性氨基的引入使得疏水空腔内部的水分子更加的“无序化”[14],使之具有更高的能量,易移出,易被萘胺分子取代;或者 β-CD亲水外缘极性氨基的引入提高了萘胺分子亲水部分与 CD亲水外缘羟基的接触角,提高了包合物的稳定性.基于上述分析,正是因为GluCD分子的亲水外缘不但有2个氨基,而且还有4个强极性的羧基,使得亲水外缘的亲水性急剧增加,使得GluCD对萘胺的包合能力最强.
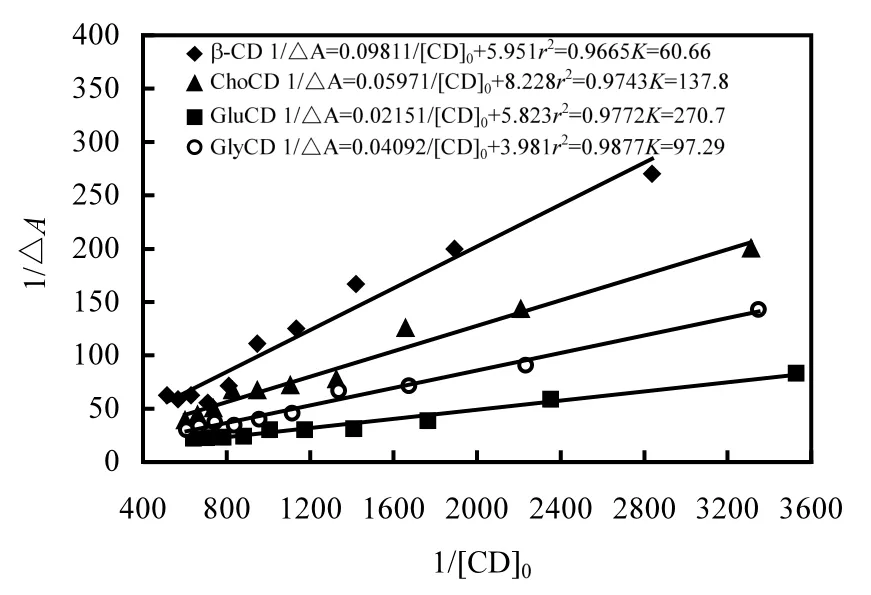
图3 β-CD氨基衍生物对萘胺的特征包合曲线Fig.3 Inclusion characteristic curves of naphthylamine with amino acids derived from β-cyclodextrins
2.3 低浓度β-CD氨基衍生物对萘胺的洗脱作用
采用低浓度的CD溶液(0、0.4、1.0g/L)为淋洗液,用土壤柱淋洗法对土壤中的萘胺进行洗脱,以洗脱液中萘胺的浓度对洗脱液累积体积作图.由图4可知,洗脱过程中,洗脱液中萘胺的浓度迅速增加,达到一个峰值后,又迅速减少到一定值,再缓慢减少,直至达到一个稳定值,这与孔德洋
[2]、钟宁[3]及 Zeng[4]等的研究结果是一致的,他们认为 CD对有机物的洗脱过程是一个非平衡解吸(即速控解吸)过程,在洗脱液中有机物浓度急剧增加,达到最大值以后,开始迅速下降,但要再达到一个稳定值需要较长的时间,也就是洗脱的滞留拖尾现象;同时,在有机物浓度急剧增加的阶段,高浓度洗脱液中有机物浓度增加的速度要大于低浓度洗脱液,而在达到稳定的阶段,低浓度洗脱液的滞留拖尾现象比高浓度洗脱液严重,但是在本研究中这种现象并不明显,在急剧增加的阶段,4种CD洗脱液中的萘胺浓度交替上升,而在达到稳定的阶段,4种CD洗脱液中的萘胺浓度几乎在同一时段达到稳定,即洗脱液累积体积在 280mL左右,这可能与洗脱液浓度过低有关(本研究中CD浓度为0.4、1.0g/L,其他研究中CD浓度为 10、20g/L[3-4]或 10、20、40g/L[2]).其实,在钟宁等[3]和 Zeng等[4]的研究中也有类似的实验现象(CD浓度为0.2、0.5、1.0g/L),只是没有进一步深入分析.
实际上,CD对有机物洗脱过程中还需考虑另外一个因素,即CD在土壤上的吸附,这也是很多研究容易忽视的[2-5].采用振荡平衡法,得到了β-CD在土壤上吸附等温线,如图5所示,土壤对β-CD 存在一定的吸附能力,当平衡浓度为4.5mg/L的时候,开始达到吸附平衡,吸附量约为61mg/g,研究表明[21-22],当吸附质在吸附剂上单层吸附时,等温吸附曲线呈 Langmuir型,当双层吸附时,等温吸附曲线呈S型或LS型,β-CD在土壤上的吸附属于双层吸附,等温吸附曲线呈 LS型,其原因有待进一步研究.正由于土壤对CD的这种吸附行为,当 CD洗脱液浓度高时(20.0g/L左右),土壤对CD的吸附量在洗脱液中所占的比例非常低,CD对土壤中有机物的洗脱呈现与其他研究一样的现象,相反,当CD洗脱液浓度低时(1g/L左右,减少20倍),土壤对CD的吸附量在洗脱液中所占的比例非常高,土壤对 CD、萘胺及CD与萘胺包合物的吸附,使得 CD对土壤中萘胺的洗脱呈现本研究得出的实验现象,弱化了洗脱液浓度变化对萘胺产生的影响.尽管如此,洗脱液的低浓度并不影响 β-CD氨基衍生物对萘胺的最终洗脱率,由图 4可知,达到洗脱平衡时, β-CD、GlyCD、ChoCD及GluCD浓度为0.4g/L和1.0g/L时对土壤中萘胺的洗脱率分别为68%和82%、80%和88%、82%和94%及86%和98%,与β-CD氨基衍生物对萘胺的包合能力成正比,且随着洗脱液浓度的增加而增加;同时,这也说明新合成的 β-CD氨基衍生物在低浓度下对土壤中萘胺表现出较大的洗脱能力,只是在对污染土壤进行洗脱修复时,需要较长的洗脱时间及更多的洗脱液.
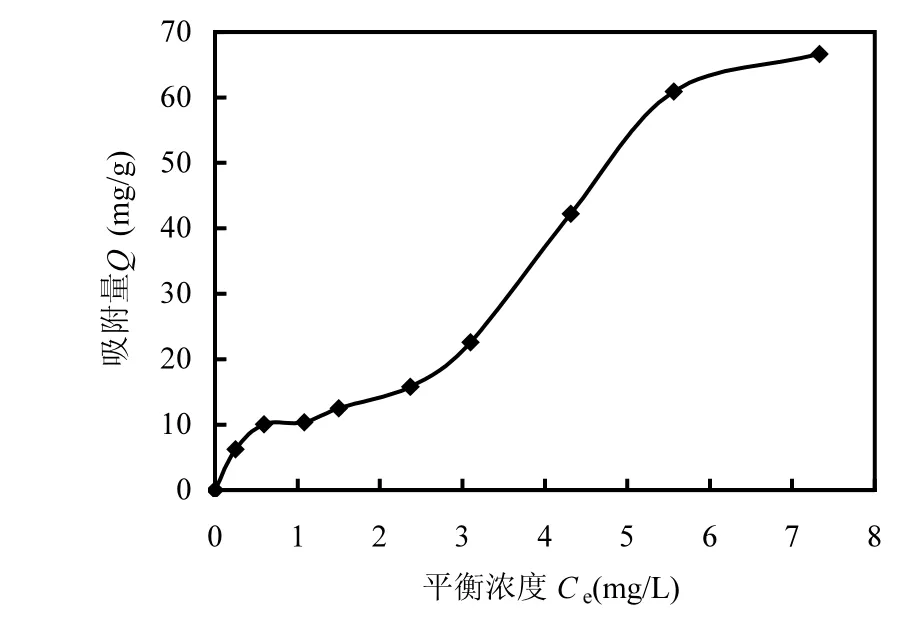
图5 β-CD在土壤上的吸附等温线Fig.5 Isotherms of β-CD on soil
3 结论
3.1 合成的3种高水溶性β-CD氨基衍生物对萘胺的包合及洗脱能力均大于 β-CD,大小顺序均为:GluCD>ChoCD>GlyCD>β-CD,在浓度为1.0g/L的条件下,GlyCD、ChoCD和GluCD对土壤中萘胺的洗脱率分别高达88%、94%和98%.
3.2 β-CD氨基衍生物对萘胺的包合能力大于β-CD,可能是β-CD亲水外缘极性基团的引入使得疏水空腔内部的水分子具有更高的能量,易移出,易被萘胺分子取代,或者提高了包合物的稳定性;同时,在低浓度下,CD在土壤上的吸附是影响有机物洗脱过程的重要因素之一,但低浓度并不影响 CD对萘胺的最终洗脱效率,只是需要较长的洗脱时间及更多的洗脱液.
[1] 李 宁,梅 征.新型环糊精聚合物对 Zn2+的吸附研究 [J]. 中国环境科学, 2012,32(7):1210–1215.
[2] 孔德洋,高士祥,林志芳,等.羧甲基-β-环糊精对土壤中萘的洗脱去除作用 [J]. 环境化学, 2001,20(5):483–488.
[3] 钟 宁,曾清如,廖柏寒,等. HPCD对甲基对硫磷的增溶、洗脱与光降解 [J]. 中国环境科学, 2005,25(1):96–100.
[4] Zeng Q R, Tang H X, Liao B H, et al. Solubilization and desorption of methyl-parathion from porous media: A comparison of hydroxypropyl-β-cyclodextrin and two nonionic surfactants [J]. Water Research, 2006,40:1351–1358.
[5] Brusseau M L, Wang X J. Enhanced transport of low-polarity organic compounds through soil by cyclodextrin [J]. Environmental Science & Technology, 1994,28(5):952–956.
[6] Chatain V, Hanna K, Brauer C D, et al. Enhanced solubilization of arsenic and 2,3, 4,6-tetrachlorophenol from soils by a cyclodextrin derivative [J]. Chemosphere, 2004,57(3):197–206.
[7] 曾清如,罗跃初,刘嫦娥,等.两种高水溶性 β-环糊精衍生物对甲基对硫磷的增溶和光催化降解作用 [J]. 农药学学报, 2003, 5(3):59–63.
[8] Shirin S, Buncel E, Van Loon G W. The use of β- cyclodextrins to enhance the aqueous solubility of trichloroethylene and perch loroethylene and their removal from soil organic matter: Effect of substituents [J]. Canadian Journal of Chemistry, 2003,81(1):45–52.
[9] Chatain V, Hanna K, Brauer C, et al. Enhanced solubilization of arsenic and 2, 3, 4, 6tetrachlorophenol from soils by a cyclodextrin derivative [J]. Chemosphere, 2004,(3):197–206.
[10] 朱顺生,颜冬云,楼迎华,等.环糊精在环境污染治理中的应用分析 [J]. 环境工程, 2011,29(1):21–25.
[11] 孙梦君,柳丽芬,杨凤林.β-环糊精/Ce/TiO2光催化氧化气相甲苯[J]. 中国环境科学, 2008,28(7):593–598.
[12] Wang X J, Brusseau M L. Solubilization of some Low-PolarityOrganic Compounds by Hydroxypropyl-β-cyclodextrin [J]. Environmental Science & Technology, 1993,27(13):2821–2825.
[13] 曾清如,罗跃初,杨仁斌,等.羟乙基-β-环糊精对农药的增溶与毒性影响 [J]. 环境化学, 2002,21(5):471–475.
[14] Tabushi I, Kiyosuke Y, Sugiomoto T, et al. Approach to the aspects of driving force of inclusion by alpha-cyclodextrin [J]. Journal of the American Chemical Society, 1978,100(3):916–919.
[15] Yang C J, Zeng Q R, Wang Y Z, et al. Simultaneous elution of polycyclic aromatic hydrocarbons and heavy metals from contaminated soils by two amino acids derived from β-Cyclodextrins [J]. Journal of Environmental Sciences, 2010, 22(12):1910–1915.
[16] 宋占军,刘炳玉,钱小红,等.应用光谱分析技术研究碘与 β-环糊精结合物的结构特征 [J]. 光谱学与光谱分析, 2001,21(5):603-606.
[17] 何仲贵.环糊精包合物技术 [M]. 北京:人民卫生出版社, 2008: 105-106.
[18] 金征宇,徐学明,陈寒青,等.环糊精化学——制备与应用 [M].化学工业出版社, 2009:20-21
[19] Nishijo J, Nagai M. Inclusion complex of 8-anilinonaphthalene-1 -sulfonate with β-cyclodextrins [J]. Journal of Pharmaceutical Sciences, 1991,80(1):58–62.
[20] Cramer F, Saenger W, Spatz H C. Inclusion compounds. XIX. The formation of inclusion compounds of α-cyclodextrin in aqueous solutions. Thermodynamics and kinetics [J]. Journal of the American Chemical Society, 1967,89(1):14–20.
[21] 詹树娇,田森林,龙 坚,等.阳离子型可逆表面活性剂在膨润土上的吸附行为 [J]. 中国环境科学, 2014,34(7):1831–1837.
[22] 姜德彬,余 静,叶芝祥,等.磁性纳米复合物对水中亚甲基蓝的吸附及其机理 [J]. 中国环境科学, 2016,36(6):1763–1772.
Effects of highly water-soluble β-cyclodextrins derivative on the inclusion and elution of naphthylamine.
YANG Cheng-jian1*, LI Chao2, CHEN Xing-du1, ZHANG Lu1, ZHENG Zhi1, ZHOU Chen1, JIANG Xin1
(1.College of Environmental and Municipal Engineering, Xi’an University of Architecture and Technology, Xi’an 710055, China;2.School of Municipal and Environmental Engineering, Harbin Institute of Technology, Harbin 150090, China). China Environmental Science, 2017,37(1):245~251
Three highly water-soluble amino acids derived from β-cyclodextrins (β-CD), i.e., glutamic acid-β-cyclodextrin (GluCD), glycine-β-cyclodextrin (GlyCD) and cholamine-β-cyclodextrin (ChoCD), were synthesized and were examined for their capacity for inclusion of naphthylamine in aqueous solution and elution removal of naphthylamine in soil at low concentration. The results showed that GluCD, GlyCD and ChoCD had higher inclusion capacity than β-CD, and the inclusion capacity decreased as follow: GluCD>ChoCD>GlyCD>β-CD. GluCD had the highest inclusion constant 270.7L/moL, which was 4.5times higher than that of β-CD. Amino acids derived from β-CD demonstrated a high elution efficiency for naphthylamine in soil even at low concentrations (1.0g/L), and elution efficiency of GluCD, ChoCD and GlyCD were achived as 88%、94% and 98%, respectively, which was proportionate to their inclusion capacity for naphthylamine in aqueous solution. Moreover, the adsorption of cyclodextrin on soil was also a key factor affecting the elution process.
amino acids derived from β-CD;naphthylamine;inclusion;elution
X53
A
1000-6923(2017)01-0245-07
杨成建(1978-),男,湖南益阳人,高级工程师,硕士,主要从事土壤污染化学修复.发表论文30余篇.
2016-04-12
陕西省教育厅专项科研计划项目(15JK1439)
* 责任作者, 高级工程师, yangchengjian09@163.com

