急性脑梗死患者认知障碍与梗死部位的相关研究
吕林利, 张 琛, 尹世敏, 李秋俐, 王 磊
急性脑梗死患者认知障碍与梗死部位的相关研究
吕林利1, 张 琛2, 尹世敏2, 李秋俐2, 王 磊2
目的 分析急性脑梗死患者不同病灶部位认知障碍的特点。方法 采用中文版蒙特利尔认知评估量表(MoCA)对97例单发病灶急性脑梗死患者和20例无脑卒中对照者进行认知功能评估,探讨MoCA 7个分项目(视空间与执行功能EF、命名NAM、注意力ATT、语言功能包括复述与流畅性LANG、抽象概括能力ABS、记忆能力包括瞬时记忆及近记忆MEM、定向力ORT)的评估结果与患者头部MRI影像结果中所示梗死部位之间的关系。结果 (1)97例急性脑梗死患者中MoCA<26分者共73例,血管性认知障碍(VCI)总的发生率约为75.26%。(2)额叶部位梗死患者EF与ATT损害明显;颞叶部位梗死患者MEM、EF与ORT损害明显;丘脑部位梗死可能与ATT、LANG、EF损害有关;顶叶部位梗死可能与ORT、EF损害有关;枕叶、基底节部位梗死可能与EF损害有关。小脑、脑桥部位梗死在MoCA总分及分测验中均未显示有统计学意义的变化(P>0.05)。结论 脑梗死后认知障碍的发生率高;急性脑梗死患者不同梗死部位认知功能损害特点不同。
脑梗死; 认知障碍; 病灶部位; MoCA
脑梗死是高发病、高致残性疾病,可引起包括运动和认知等在内的多方面的功能障碍,是导致血管性认知障碍(vascular cognitive impairment,VCI)的常见原因[1]。VCI具有可逆性,是迄今唯一能够防治的痴呆[2],基于对VCI患者生活质量及家庭、社会和经济负担的考虑,及时发现并早期干预VCI有着重大意义。本研究通过采用中文版蒙特利尔认知评估量表(Montreal Cognitive Assessment,MoCA)对急性脑梗死患者认知功能进行评估,同时结合影像学资料进行相关研究,分析急性脑梗死患者不同病灶部位认知障碍特点,以期能够辅助临床早期识别VCI。
1 对象与方法
1.1 研究对象 选取2014年5月~2015年10月期间于火箭军总医院神经内科就诊发病14 d内的单发病灶急性脑梗死患者97例,根据病灶部位不同分为8组:额叶组14例,颞叶组12例,顶叶组13例,枕叶组10例,丘脑组11例,基底节组14例,脑桥组12例,小脑组11例。同时选取年龄、性别、受教育程度相匹配的无脑卒中者20例作为对照组。
1.1.1 纳入标准 (1)急性脑梗死组:①符合2014年中华医学会神经病学分会脑血管病学组撰写的《中国急性缺血性脑卒中诊治指南》;②头部MRI证实为急性脑梗死,病灶为单发且应在相应脑结构区域内;③年龄35~85岁,均为右利手;④卒中发病14 d内;⑤意识清楚,无明显听、理解障碍及严重失语;⑥取到患者及家属知情同意,评定时间均在卒中发病14 d内。(2)对照组:①无脑卒中病史;②年龄35~85岁;③头部MRI证实无新发卒中病灶;④知情者老年人认知功能减退问卷(Informant Questionnaire on Cognitive Decline in the Elderly,IQCODE)提示正常;⑤配合检查度好。
1.1.2 排除标准 ①有焦虑、抑郁等精神障碍者;②甲状腺疾病、肝肾功能不全、心脏病等;③叶酸、维生素B12缺乏者,酒精、药物滥用者或有CO中毒史;④脑外伤、出血性脑血管疾病、Alzheimer病、癫痫、脑炎、帕金森病、脑积水、多发性硬化、放射性损伤、感染性疾病(艾滋病、梅毒等)、癌症患者;⑤既往有卒中发病史者;⑥头部CT/MRI示中重度脑萎缩或融合成片的白质病变者。
1.2 方法
1.2.1 临床资料收集 详细记录所有研究对象的性别、年龄、受教育程度等基本资料以及有无高血压、糖尿病、高脂血症等既往病史。影像学检查:采取头部MRI检查,记录所有急性脑梗死患者此次发病的责任病灶部位。
1.2.2 神经心理学检查 MoCA是一种非常简单的认知功能筛查工具,其识别轻度认知功能障碍(Mild cognitive impairment,MCI)患者的敏感度高于90%,明显优于简易精神状态评价量表(Mini-mental state examination,MMSE),而且有较好的特异度[3],是多国循证医学已经验证且国际上广泛推荐的MCI和VCI的筛查量表[3,4]。MoCA主要包括视空间与执行功能(Visuospatial and executive function,EF)、命名(Naming,NAM)、注意力(Attention,ATT)、语言功能(Language,LANG)、抽象概括能力(Abstract,ABS)、记忆能力(Memory,MEM包括瞬时记忆及近记忆)、定向力(Orientation,ORT)共7个认知域,满分30分,正常值≥26分,<26分评定为认知障碍,若受教育年限<12 y,则在测试结果上加1分[4]。每位研究对象均由专业的同一位神经心理测验员在安静、独立的房间内一次性完成MoCA 测评。

2 结 果
2.1 一般资料比较 急性脑梗死患者97例(男性53例,女性44例,平均年龄65.23±13.04岁,平均受教育年限10.80±4.35 y。对照组20例(男性11例,女性9例,平均年龄64.40±12.82岁,平均受教育年限10.30±4.52 y)。各不同病灶部位急性脑梗死组及对照组的一般资料经卡方检验或F检验在各组之间差异无统计学意义(均P>0.05)(见表1)。
2.2 不同病灶部位急性脑梗死患者受损认知域比较 对各不同病灶部位急性脑梗死组及对照组间进行单因素方差分析结果显示:MoCA总分多组间比较差异有统计学意义(P<0.05)。EF、ATT、LANG、MEM、ORT五个认知域多组间比较差异有统计学意义(P<0.05)。NAM、ABS多组间比较差异无统计学意义(P>0.05)(见表2)。进一步进行组间多重比较,结果如下。
(1)MoCA总分各组间比较 额叶组、颞叶组、丘脑组与对照组相比差异均有统计学意义(P<0.05),3组之间比较差异无统计学意义(P>0.05)。顶叶组、枕叶组、基底节组、脑桥组、小脑组与对照组相比差异无统计学意义(P>0.05)。结果显示额叶、颞叶、丘脑部位梗死的患者MoCA总分较对照组下降明显,提示额叶、颞叶、丘脑部位梗死可致认知功能损害。
(2)MoCA单项认知域各组间比较 ①EF:额叶组、丘脑组、基底节组、颞叶组及枕叶组与对照组相比差异有统计学意义(P<0.05),且额叶组分别与丘脑组、基底节组、颞叶组、枕叶组相比差异均有统计学意义(P<0.05),颞叶组、枕叶组、丘脑组、基底节组各组之间相比差异无统计学意义(P>0.05);顶叶组、脑桥组、小脑组与对照组相比差异无统计学意义(P>0.05)。②ATT:额叶组、丘脑组与对照组相比差异有统计学意义(P<0.05),两组之间相比差异无统计学意义(P>0.05);其余各病灶组与对照组相比差异无统计学意义(P>0.05)。③LANG:丘脑组与对照组相比差异有统计学意义(P<0.05);其余各病灶组与对照组相比差异无统计学意义(P>0.05)。④MEM:颞叶组与对照组相比差异有统计学意义(P<0.05);其余各病灶组与对照组相比差异无统计学意义(P>0.05)。⑤ORT:颞叶、顶叶组与对照组相比差异有统计学意义(P<0.05),两组之间相比差异无统计学意义(P>0.05);其余各病灶组与对照组相比差异无统计学意义(P>0.05)。结果提示:额叶部位梗死患者EF与ATT损害明显;颞叶部位梗死患者MEM、EF与ORT损害明显;丘脑部位梗死可能与ATT、LANG、EF损害有关;顶叶部位梗死可能与ORT、EF损害有关;枕叶、基底节部位梗死可能与EF损害有关。
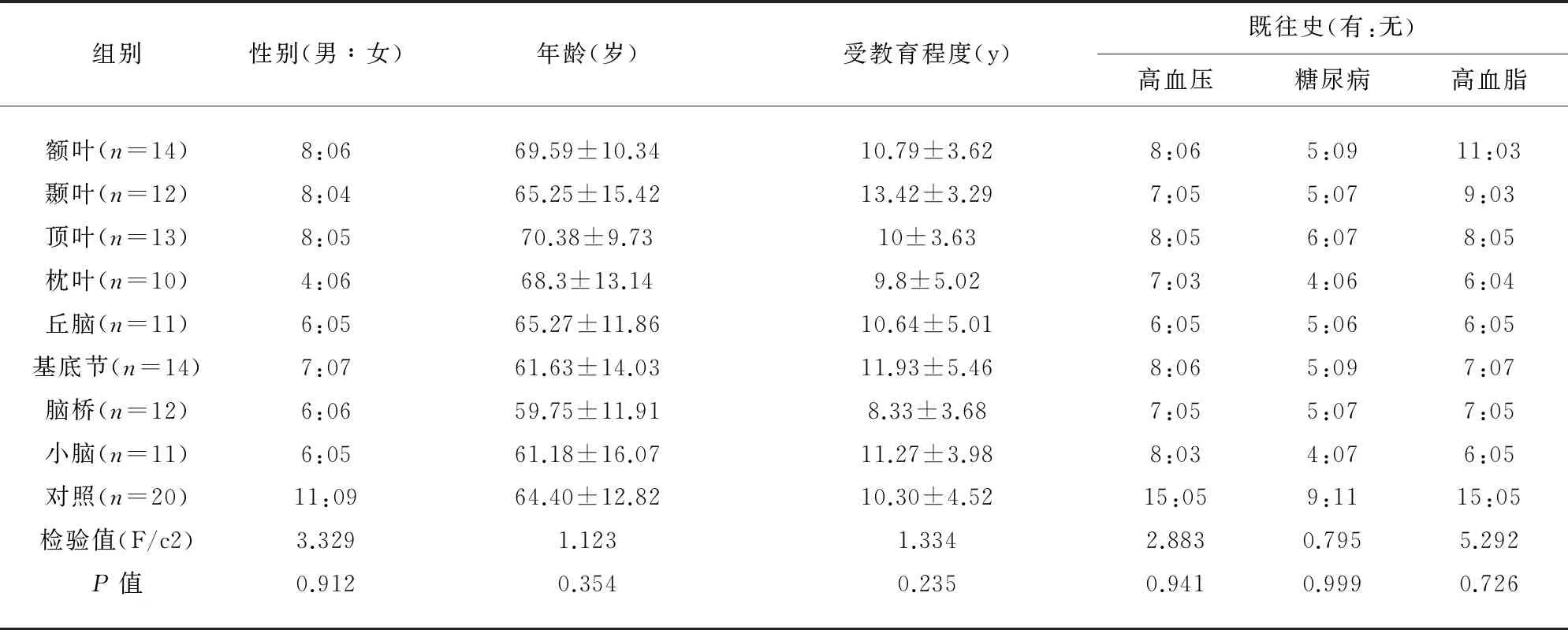
表1 各组间一般资料比较(性别、年龄、受教育程度、既往史)
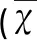
表2 MoCA总分及各分项分值多组间比较±s)
注:*P<0.05
3 讨 论
由于国家、种族和诊断标准存在差异,卒中后认知障碍的发病率在20%~80%之间不等[5]。本研究中急性脑梗死患者97例,MoCA<26分者共73例,认知障碍发生率约为75.26%,接近文献报道范围上限。可见,脑卒中后认知障碍的发生率很高,但一直以来人们对脑卒中后认知障碍的关注度不高,而是将更多的注意力集中于偏瘫肢体的康复。实际上,认知障碍对个人及社会的影响在一定程度上远超过躯体功能障碍所造成的影响。到目前为止,临床上尚无有效治疗痴呆的方法。对于血管源性认知功能损害,如能在早期轻度VCI阶段,就予以积极有效干预措施,将能延缓或阻止血管性痴呆(VD)的发生,这具有重要的临床及社会价值。
本研究结果显示,急性脑梗死患者病灶部位与认知功能损害有关,额叶、颞叶、丘脑、枕叶、顶叶、基底节部位梗死均可导致认知功能损害,小脑、脑桥部位梗死在MoCA总分及分测验中均未显示有意义的变化,与吴景芬等[6]关于认知障碍与脑卒中部位的相关性分析结果一致。尤春景等[7]采用中文版神经行为认知测试(Neurobehavioral Cognitive Status Examination,NCSE)量表对30例脑损伤患者进行认知功能评定,将各认知领域与脑损害部位进行Pearson相关分析结果显示认知障碍与脑损害部位有关,以额、顶叶损害较为明显,而与颞叶、基底节损害无明显关系。廖小平等[8]应用韦氏成人智力量表(Wechsler Adult Intelligence Scale,WAIS-RC)对60例急性脑梗死患者进行认知功能测查,结果表明急性脑梗死患者大脑半球损伤左侧、前部、皮质更可能导致认知障碍。上述两个研究结果与本研究结果存在不同之处,分析原因可能为上述研究入组患者不完全是脑梗死患者以及测评工具亦有不同,这两种因素可能导致研究结果出现差异。NE和5-HT是与认知功能有关的神经递质,大脑皮质负责较高级神经活动,各脑叶与学习功能及认知情感反应有关,大脑半球皮质梗死更容易损害神经递质皮质下环路,因此脑叶损害更容易导致认知障碍[9]。
研究表明,脑卒中可导致多方面的认知障碍。本研究结果显示不同梗死部位认知功能损害特点不同,EF以额叶部位梗死损害最明显,其次颞叶、枕叶、丘脑、基底节部位梗死也可致EF损害。多重研究表明,执行功能主要是额叶皮质的功能,认为其中枢在前额叶外侧皮质。额叶脑损害尤其是左背侧额叶(dorsolateral frontal cortex,DLFC)损害患者,其组织能力明显受损,处理和解决问题能力下降,难以组织和执行计划[10]。脑卒中后的研究显示执行功能与一个广泛联系的网络相关,涉及颞叶、顶叶、枕叶、扣带回、运动前区、丘脑和基底节等,所以与额叶有广泛纤维联系的大部分脑区的损伤都可能呈现执行功能损害。脑卒中后的多重研究也证实了视空间与结构功能也有相关脑结构的系统性和非固定性,双侧半球的额叶、顶叶、枕叶、颞叶以及基底节、丘脑、小脑共同参与其中[11]。基底节由尾状核、黑质、豆状核(壳核和苍白球)及丘脑底核等结构组成,和丘脑共同参与到皮质-纹状体-苍白球-黑质-丘脑-皮质环路系统,该系统与前额叶相关,因此基底节和丘脑部位的梗死可导致额叶前部和皮质下环路的中断,从而出现类似额叶损伤的特点[12,13]。枕叶为视觉皮质中枢,主要负责视觉信息处理,枕叶受损可出现视空间和结构功能障碍。
既往研究显示丘脑与间脑之间有紧密联系,额叶-纹状体-苍白球-丘脑-皮质回路参与了注意力、执行功能和情感的调节[14]。覃莲等[15]研究表明丘脑部位病变与脑梗死后认知障碍呈独立相关性。本研究结果显示丘脑梗死患者MoCA总分及ATT、LANG、EF各分项测评分数较对照组有下降,差异有统计学意义,可导致认知功能损害,吴景芬等[6]的研究结果也表明丘脑卒中可损害LANG。Levasseur等[16]应用PET技术对内侧丘脑梗死患者进行研究发现丘脑损害可引起弥漫性的大脑皮质低代谢,这可能是丘脑部位梗死可导致多个认知域测试得分均下降的原因。
多重研究发现颞叶受损特别是海马部位受损更易出现明显的记忆力(延迟回忆)、定向力、抽象能力和计算力的损害。海马参与海马-穹隆-乳头体-丘脑前核-扣带回记忆环路,双侧海马病变时可出现明显记忆障碍,尤其是近记忆障碍。本研究结果显示颞叶部位梗死可导致近记忆、执行功能以及定向力的损害,与上述研究结果基本一致。既往研究认为海马、内嗅皮质区域的损害只与阿尔兹海默病(AD)相关,但目前研究认为其也与脑卒中后认知功能的损害相关。海马损伤导致卒中后认知功能下降的机制还不是很清楚。Wen等[17]对缺血性脑卒中所致认知功能下降的小鼠模型进行研究发现,具有抑制海马神经元损伤的新型神经递质NaHS的水平是有所下降的。尽管这一发现是基于动物模型的研究,但表明了海马在VCI发病中的重要作用,也为VCI的防治提供了一个新的视角。吴景芬等[6]的研究结果表明顶叶卒中主要损害命名、抽象思维、注意与计算,尤春景等[7]的研究表明顶叶与命名、判断力有关。Paulesu等[18]采用 PET技术发现,顶叶区域,尤其是左侧40区(缘上回)主要负责对言语事实的存贮,而额叶Broca区则主要通过语音重复来保持信息。本研究结果显示,顶叶部位梗死与ORT、EF损害有关,在NAM方面没有显示出有意义的改变。
本研究结果表明急性脑梗死患者不同梗死部位认知功能损害特点不同,且可能存在MoCA总分无明显下降,而局部认知域功能已受损的情况。因此,临床工作者可以早期通过梗死部位来预测认知障碍的发生及其严重程度,在进行总体认知功能评估的同时,有必要根据不同梗死部位认知功能损害的特点,针对性的对相关认知域进行详细评估,这将有助于早期识别VCI。
[1]Rasquin SM,lodder J,Visser PJ,et al. Predictive accuracy of MCI subtypes for Alzheimer’s disease and vascular dementia in subjects with mild cognitive impairment:a 2-year follow-up study[J]. Dement Geriatr Cogn Disord,2005,19(2-3):113-119.
[2]李姗姗,李 斌,张利莎,等. 血管性认知障碍发病机制的研究进展[J]. 中华脑科疾病与康复杂志(电子版),2014,4(5):48-51.
[3]Alagiakrishnan K,Zhao N,Mereu L,et al. Montreal Cognitive Assessment Is Superior to Standardized Mini-Mental Status Exam in Detecting Mild Cognitive Impairment in the Middle-Aged and Elderly Patients with Type 2 Diabetes Mellitus[J]. Biomed Res Int,2013. 186106.
[4]Nasreddine ZS,Philips NA,Bedirian V,et al. The Montreal Cognitive Assessment,MoCA:a brif screening tool for mild cognitive impairment[J]. Am Geriatr Soc,2005,53(4):695-699.
[5]Sun JH,Tan L,Yu JT. Post-stroke cognitive impairment:epidemiology,mechanisms and management[J]. Ann Transl Med,2014,2(8):80.
[6]吴景芬,肖 军,陈祥慧,等. 认知功能障碍与脑卒中部位的相关性分析[J]. 临床合理用药杂志,2009,2(9):1-3.
[7]尤景春,许 涛,欧阳多利,等. 认知障碍与脑损害部位的相关研究[J]. 中华物理医学与康复,2003,25(4):223-225.
[8]廖小平,文国强,陈 涛,等. 急性脑梗死患者认知功能障碍与病灶部位的相关性研究[J]. 中风与神经疾病杂志,2007,24(1):71-72.
[9]Obfien JT,E rkinjunti T,Reisberg B,et al. Vascular cognitive impairment[J]. Lancet Neurol,2003,2(2):89-98.
[10]Fletcher PC,Shallice T,Frith CD,et al. The factional roles of prefrontal cortex in episodic memory Ⅱ. Retrieval[J]. Brain,1998,121(Pt 7):1249-1256.
[11]Finke K,Bublak P,Zihl J. Visual spatial and visual pattern working memory:neuropsychological evidence for a differential role of left and right dorsal visual brain[J]. Neuropsychologia,2006,44(4):649-661.
[12]Cummings JL. Frontal-subcortical circuits and human behavior[J]. Arch Neurol,1993,50(8):873-880.
[13]Alexander GE,Crutcher MD,DeLong MR. Basal ganglia-thalamocortical circuits:parallel substrates for motor,oculomotor,“Prefrontal” and “limbic” functions[J]. Prog Brain Res,1990,85:119-146.
[14]Alexopoulos GS. “The depression-executive dysfunction syndrome of late life”:a specific target for D3 agonists[J]. Am J Geriatr Psychiatry,2001,9 (1):22-29.
[15]覃 莲,黄进瑜,廖宝共,等. 缺血性脑卒中后血管性认知功能损害的临床特征及影像学研究[J]. 中国现代医学杂志,2008,8(18):2398-2401.
[16]Levasseur M,Baron JC,Sette Q. et al. Brain energy metabolism in bilateral paramedian thalamic infarcts. A positron emission tomography study[J]. Brain,1992,115(Pt 3):795-807.
[17]Wen X,Qi D,Sun Y,et al. H2S attenuates cognitive deficits through Akt1/JNK3 signaling pathway in ischemic stroke[J]. Behav Brain Res,2014,269:6-14.
[18]Paulesu E,Frith CD,Frackowiak RS. The neural correlates of the verbal component of working memory[J]. Nature,1993,362(6418):342-345.
Correlation between cognitive impairment and infarct sites of patients with acute ischemic stroke
LVLinli,ZHANGChen,YINShimin,etal.
(DepartmentofNeurology,ThePLARocketForceGeneralHospital,Beijing100088,China)
Objective To analyze the characteristics of cognitive impairment in different infarct locations among patients with acute ischemic stroke. Methods Montreal Cognitive Assessment (MoCA) was used to assess the cognitive function of 97 patients with acute ischemic stroke and 20 people without stroke. MRI was used to locate the infarct sites. Then,we analyzed the correlation between the infarct sites and the results of EF,NAM,ATT,LANG,ABS,MEM,ORT. Results (1) In the 97 patients with acute ischemic stroke,there were 73 patients with the scores of MoCA less than 26,and the incidence of VCI was about 75.26%. (2) Frontal lobe damage obviously decreased EF and ATT;the infarction of temporal lobe could obviously impair MEM,EF,and ORT;the thalamus damage might be related to the ATT,LANG and EF dysfunction;the parietal lobe damage might lead to the ORT and EF dysfunction;the occipital lobe and basal ganglia damage might be related to the EF dysfunction. Compared with control group,the differences of total scores and factor scores of MoCA were not statistically significant in the infarction of cerebellum and pons (P>0.05). Conclusion The incidence of cognitive impairment is high in patients with acute ischemic stroke. And the characteristics of cognitive impairment may be different in patients with different infarct sites.
Ischemic stroke; Cognitive impairment; Infarct sites; MoCA
1003-2754(2017)01-0051-05
2016-07-17;
2016-12-30
全军十二五保健专项科研课题(12BJZ24);军队医学科技青年培育项目(15QNP044)
(1.锦州医科大学火箭军总医院研究生培养基地,北京 100088;2.中国人民解放军火箭军总医院神经内科,北京 100088)
王 磊,E-mail:hellowanglei068@163.com
R743
A

