细胞凋亡通路在小鼠酒精性胰腺炎发展过程中的作用
郭敏 余鹏飞 白槟 邱兆岩 王谦 赵青川 李树钧
·论著·
细胞凋亡通路在小鼠酒精性胰腺炎发展过程中的作用
郭敏 余鹏飞 白槟 邱兆岩 王谦 赵青川 李树钧
目的 探讨细胞凋亡通路在酒精性胰腺炎中的作用。方法 将C57BL/J小鼠随机分为对照组(NC)、酒精组(AC)、急性胰腺炎组(AP)和酒精性胰腺炎组(AAP)。饮酒精方案为10%乙醇喂养2 d,15%乙醇喂养5 d,20%乙醇喂养直到13周。采用腹腔注射雨蛙素50 μg/kg体重,连续7次,每次间隔1 h的方法制备AP模型。取血检测血清淀粉酶、脂肪酶活性;取部分胰腺称湿、干重,计算胰腺组织水含量;取部分胰腺组织常规行病理学检查;采用蛋白质印迹法检测胰腺组织凋亡相关蛋白caspase3、caspase8表达,TUNEL法检测胰腺组织的细胞凋亡。结果 NC组、AC组、AP组、AAP组小鼠血清淀粉酶活性分别为(3 630±259)、(3 196±187)、(35 955±4 607)、(53 607±3 848)U/L,脂肪酶活性为(502±41)、(745±42)、(7 346±665)、(12 764±2 544)U/L,胰腺水含量为(70.2±3.1)%、(69.6±2.0)%、(78.2±1.5)%、(85.0±3.0)%,胰腺组织caspase 3表达量为1.017±0.078、1.287±0.097、2.018±0.078、0.244±0.024,caspase 8表达量为0.829±0.010、0.599±0.074、1.270±0.080、0.145±0.015,凋亡细胞数为1、6、214、97个/10倍视野,胰腺病理评分为0、0、(7.0±0.4)、(12.8±0.3)分。AP组的血清淀粉酶、脂肪酶、胰腺水含量、胰腺病理评分均显著高于NC组,AAP组又均显著高于AP组,差异有统计学意义(P<0.05或<0.01);AP组的caspase3、caspase 8表达量、细胞凋亡数均显著高于NC组,而AAP组的这些指标均显著低于AP组,且caspase3、caspase8表达量均显著低于NC组,差异有统计学意义(P值均<0.05)。结论 长期饮用酒精可加重胰腺炎的严重程度,其机制可能是通过抑制细胞凋亡,促进腺泡细胞坏死所致。
胰腺炎,酒精性; 乙醇; 细胞凋亡; 小鼠
急性胰腺炎(AP)是一种由腺泡细胞损伤起始的胰腺外分泌的炎症反应,其病理特征为腺泡细胞内酶原的活化、炎症细胞的浸润、腺泡细胞内空泡化和胰腺组织的坏死[1]。一般来说,80%的AP表现为轻症(MAP)或中度重症(MSAP),其余患者会发展为重度急性胰腺炎(SAP),伴随着全身多脏器的损伤,包括SIRS 、休克、ARDS 、肾脏衰竭等[2]。酒精是除胆结石之外AP最常见的病因之一[3]。有研究报道,长期饮酒可加重胰腺炎的严重程度,酗酒者更易出现其他器官并发症[4]。本研究旨在探讨细胞凋亡通路在酒精性胰腺炎发展过程的作用。
材料与方法
一、实验动物及分组
20只8周龄C57BL/J小鼠,体重18~20 g,购于第四军医大学实验动物中心。适应环境1周后,按数字表法随机分为对照组(NC)、酒精组(AC)、急性胰腺炎组(AP)和酒精性胰腺炎组(AAP),每组5只。NC组给予正常饮水;AC组给予10%乙醇喂养2 d,15%乙醇喂养5 d,20%乙醇喂养直到13周[5];AP组采用腹腔注射雨蛙素(美国Sigma公司)50 μg/kg体重,连续7次,间隔时间1 h的方法制备AP模型;AAP组则在AC组的饮酒方案基础上制作AP模型。在最后一次雨蛙素注射后1 h处死小鼠。通过眼球取血标本,同时收集胰腺组织,部分甲醛固定,部分液氮保存。
二、方法
1.血清淀粉酶、脂肪酶活性检测:应用全自动生化分析仪检测小鼠血清淀粉酶、脂肪酶含量。
2.胰腺组织水含量检测:取1/3新鲜胰尾组织,分析天平称湿重后置95℃烘烤48 h,称干重,胰腺水含量为干重/湿重的百分比。
3.胰腺组织病理学检查:取甲醛固定的胰腺组织,常规脱水、石蜡包埋、切片,HE染色,由病理科医师盲法读片,并参考Nevalainen和Aho[6]的标准,从水肿、炎性浸润、出血和坏死4方面进行病理评分。
4.胰腺组织caspase 3、caspase 8蛋白表达检测:取各组收集的胰腺组织约12.5 mg,加入含有3%蛋白酶抑制剂和1% EDTA的蛋白裂解液(Thermore公司)制备组织匀浆,4℃离心后取上清。采用BCA试剂盒(Thermore公司)定量蛋白后常规行蛋白质印迹法检测caspase 3、caspase 8蛋白的表达,以β-actin作为内参。抗caspase 3、caspase 8和β-actin一抗购自CST公司,工作浓度1∶1 000。最后采用ECL发光,X片曝光、显影、定影。应用Bio-Rad公司的全自动凝胶成像系统扫描蛋白条带,以目的条带与内参条带的灰度值比表示蛋白相对表达量。
5.胰腺细胞凋亡检测:采用脱氧核糖核酸末端转移酶介导的dUTP缺口末端标记法(TUNEL)试剂盒(Roche公司)检测胰腺组织的细胞凋亡,严格按照说明书操作,以DNAase 处理的切片作阳性对照。最后在共聚焦显微镜下观察,细胞核中出现红色荧光为凋亡细胞。为确定红色荧光是否定位于细胞核部位,采用DAPI染色。
三、统计学处理
结 果
一、小鼠血清淀粉酶、脂肪酶活性及胰腺水含量的变化
AP组小鼠血清淀粉酶、脂肪酶含量及胰腺水含量均较NC组显著升高,AAP组又较AP组显著升高,差异均有统计学意义(P<0.05或<0.01);与NC组比较,AC组小鼠血清淀粉酶显著下降,脂肪酶活性显著升高,差异均有统计学意义(P值均<0.05),而胰腺水含量差异无统计学意义(表1)。
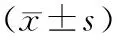
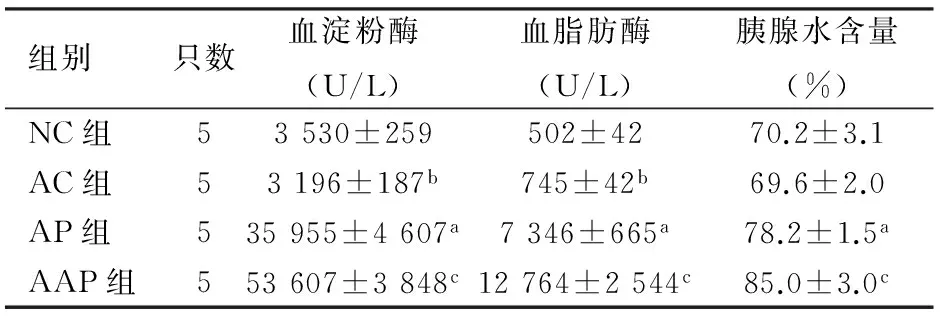
组别只数血淀粉酶(U/L)血脂肪酶(U/L)胰腺水含量(%)NC组53530±259502±4270.2±3.1AC组53196±187b745±42b69.6±2.0AP组535955±4607a7346±665a78.2±1.5aAAP组553607±3848c12764±2544c85.0±3.0c
注:与NC组比较,aP<0.01;bP<0.05;与AP组比较,cP<0.01
二、胰腺病理组织学改变
NC组及AC组小鼠胰腺组织无明显病理改变;AP组小鼠胰腺明显水肿、少量炎细胞浸润;AAP组胰腺坏死明显,且伴有较多炎细胞浸润(图1)。NC组及AC组胰腺病理评分为0分,AP组各个病理指标的评分均较NC组及AC组升高,AAP组评分又较AP组显著升高,差异均有统计学意义(P值均<0.05,表2)。
三、胰腺组织caspase 3、caspase 8蛋白表达量的变化
NC组 、AC组、AP组、AAP组小鼠胰腺组织caspase 3蛋白表达量分别为1.017±0.078、1.287±0.097、2.018±0.078、0.244±0.024;caspase 8蛋白表达量分别为0.829±0.010、0.599±0.074、1.270±0.080、0.145±0.015 (图2),AP组的表达较NC组显著增加(t=9.056,P=0.012;t=5.474 ,P=0.032),而AAP组的表达较AP组显著下降(t=21.75,P=0.012;t=13.820 ,P=0.005),且显著低于NC组(t=9.408,P=0.011;t=38.400,P=0.001),差异均有统计学意义。
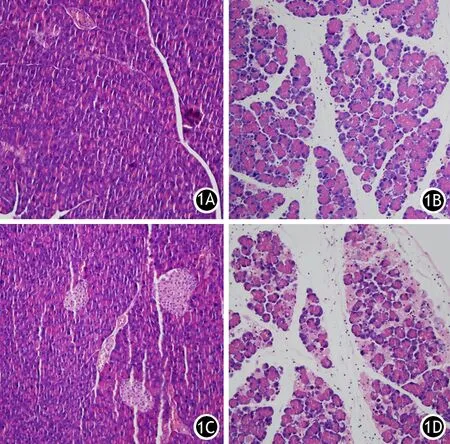
图1 NC组(1A)、AC组(1B)、AP组(1C)、AAP组(1D)小鼠胰腺组织的病理变化(HE ×100)
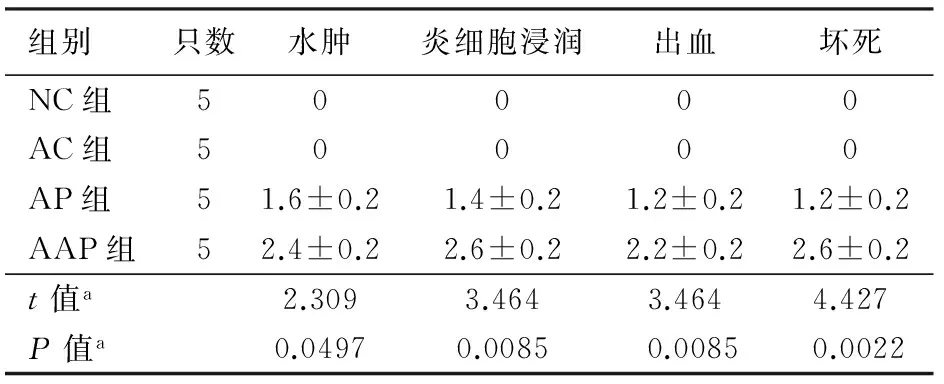
组别只数水肿炎细胞浸润出血坏死NC组50000AC组50000AP组51.6±0.21.4±0.21.2±0.21.2±0.2AAP组52.4±0.22.6±0.22.2±0.22.6±0.2t值a2.3093.4643.4644.427P值a0.04970.00850.00850.0022
注:a:APP组与AP组比较
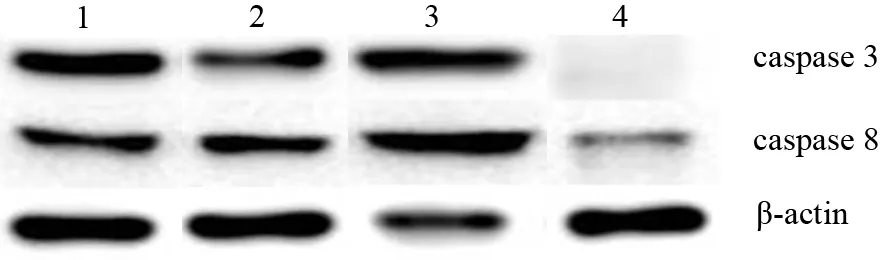
图2 NC组(1)、AC组(2)、AP组(3)、AAP组(4)小鼠胰腺组织caspase 3、caspase 8蛋白表达量
四、胰腺组织细胞凋亡的变化
NC组、AC组、AP组、AAP组小鼠胰腺组织的凋亡细胞数分别为1、6、214、97个/10倍视野(图3)。AP组较NC组显著增加(t=12.80),AAP组较AP组显著减少(t=6.051),但仍显著高于NC组(t=9.654),差异均有统计学意义(P值均<0.01)。
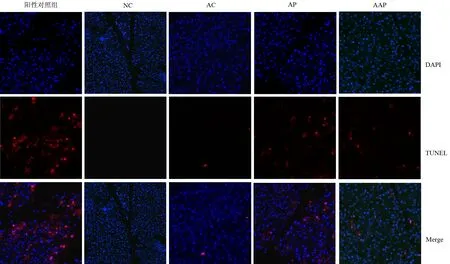
图3 阳性对照组、NC组、AC组、AP组、AAP组小鼠胰腺组织内的凋亡细胞(共聚焦显微镜 ×20,Merge为DAPI染色与TUNEL染色融合图)
酒精是急、慢性胰腺炎发生的常见病因和诱因,然而酒精在胰腺炎严重程度中的作用尚不完全清楚。最新一项比较结石和酒精两种病因在AP中作用的研究结果显示,酒精性胰腺炎较胆源性胰腺炎具有更严重的临床进程和较差的预后,并易出现严重的并发症,例如假性囊肿的形成等[7]。Papachristou等[8]的研究也表明酒精滥用是AP时胰腺组织发生坏死的风险因素。酒精可能是胰腺炎发生重症化的一种原因,而重症胰腺炎又与临床的高死亡率明显相关。以往的许多动物实验研究结果均表明,单纯的酒精喂养并不会引起明显的胰腺实质水肿、腺泡细胞坏死以及胰腺组织内炎细胞的浸润等AP的病理表现,但是酒精能够增敏胆囊收缩素(CCK)的作用,使得生理剂量的雨蛙素(CCK类似物)也可以引起饮酒精的小鼠发生AP[9]。本研究采用饮用酒精一段时间后再诱导AP,结果表明单纯饮用酒精并没有引起胰腺可见的病理损伤,但能够加重雨蛙素诱导的胰腺炎的严重程度,特别是增加了腺泡细胞的坏死和炎细胞的浸润。
细胞常见的死亡方式包括凋亡和坏死。坏死细胞的特征表现为细胞器发生肿胀、细胞膜破坏,最后引起细胞的裂解,随后裂解的细胞通常会释放各种活性物质和炎症因子从而诱发明显的炎症反应瀑布[10]。相反凋亡是一种细胞的程序性死亡方式,是细胞在特定因子的作用下活化细胞内凋亡信号通路,使细胞发生皱缩,形成凋亡小体,随后被吞噬细胞吞噬,因而不会有细胞内成分的泄露,不会诱发组织内的炎症反应[10]。研究表明,在多种不同的实验模型中,重症胰腺炎表现出明显的腺泡细胞坏死和轻度的凋亡,而轻型胰腺炎则以腺泡细胞的凋亡为主,坏死较轻[11]。因此有研究者认为AP时的细胞凋亡可能是一种保护机制,减轻疾病的严重程度。随后一系列的实验结果也验证了通过不同机制和化学药物促进细胞凋亡能够减轻胰腺的坏死程度[12-13]。天冬氨酸特异性半胱氨酸蛋白酶(caspases)家族是经典的细胞凋亡标志物之一。caspases激活后可以酶切底物天冬氨酸羧基端从而促进细胞凋亡发生。已有14种caspases家族成员被认为是凋亡的关键效应酶和分子执行者,其中与凋亡密切相关的成员包括凋亡起始的caspases 2、8、9 、10和凋亡效应的caspases3、6 、7[14]。本研究结果显示,AP组小鼠胰腺内的细胞凋亡通路是活化的,而在AAP组,凋亡相关蛋白的表达和凋亡细胞均显著降低,即细胞凋亡通路被抑制,表明AP的严重程度与胰腺细胞的凋亡呈负相关。
总之,本研究表明酒精的长期使用可以抑制急性应激反应时细胞保护性凋亡通路的活化,使得以凋亡为主的腺泡细胞转为不可逆转性坏死。
[1] Ohmuraya M, Yamamura K. Autophagy and acute pancreatitis: a novel autophagy theory for trypsinogen activation[J]. Autophagy, 2008,4(8):1060-1062. DIO: 10.4161/auto.6825.
[2] Forsmark CE, Baillie J. AGA Institute technical review on acute pancreatitis[J]. Gastroenterology, 2007,132(5):2022-2044. DOI:10.1053/j.gastro.2007.03.065.
[3] Herreros-Villanueva M, Hijona E, Banales JM, et al. Alcohol consumption on pancreatic diseases[J]. World J Gastroenterol, 2013,19(5):638-647. DIO: 10.3748/wjg.v19.i5.638.
[4] Schneider L, Pietschmann M, Hartwig W, et al. Alcohol pretreatment increases hepatic and pulmonary injury in experimental pancreatitis[J]. Pancreatology, 2009,9(3):258-266. DOI: 10.1159/000181176.
[5] Song K, Coleman RA, Zhu X, et al. Chronic ethanol consumption by mice results in activated splenic T cells[J]. J Leukoc Biol, 2002,72(6):1109-1116.
[6] Nevalainen TJ, Aho HJ. Standards of morphological evaluation and histological grading in experimental acute pancreatitis[J]. Eur Surg Res, 1992,Suppl 1:14-23. DIO: 10.1159/000129235.
[7] Cho JH, Kim TN, Kim SB. Comparison of clinical course and outcome of acute pancreatitis according to the two main etiologies: alcohol and gallstone[J]. BMC Gastroenterol, 2015,15:87. DOI: 10.1186/s12876-015-0323-1.
[8] Papachristou GI, Papachristou DJ, Morinville VD, et al. Chronic alcohol consumption is a major risk factor for pancreatic necrosis in acute pancreatitis. Am J Gastroenterol, 2006, 101(11): 2605-2610[PMID: 17029614] DOI: 10.1111/j.1572-0241.2006.00795.
[9] Pandol SJ, Periskic S, Gukovsky I, et al. Ethanol diet increases the sensitivity of rats to pancreatitis induced by cholecystokinin octapeptide[J]. Gastroenterology, 1999,117(3):706-716. DOI: 10.1016/S0016-5085(99)70465-8.
[10] Nikoletopoulou V, Markaki M, Palikaras K, et al. Crosstalk between apoptosis, necrosis and autophagy[J]. Biochim Biophys Acta, 2013,1833(12):3448-3459.DOI: 10.1016/j.bbamcr.2013.06.001.
[11] Fortunato F, Burgers H, Bergmann F, et al. Impaired autolysosome formation correlates with Lamp-2 depletion: role of apoptosis, autophagy, and necrosis in pancreatitis[J]. Gastroenterology, 2009,137(1):350-360. DOI: 10.1053/j.gastro.2009.04.003.
[12] Booth DM, Murphy JA, Mukherjee R, et al. Reactive oxygen species induced by bile acid induce apoptosis and protect against necrosis in pancreatic acinar cells[J].Gastroenterology,2011,140(7):2116-2125.DOI: 10.1053/j.gastro.2011.02.054.
[13] Cai Y, Shen Y, Xu G, et al. TRAM1 protects AR42J cells from caerulein-induced acute pancreatitis through ER stress-apoptosis pathway[J]. In Vitro Cell Dev Biol Anim, 2016,52(5):530-536. DOI: 10.1007/s11626-016-0011-7.
[14] Tibbetts MD, Zheng L, Lenardo MJ. The death effector domain protein family: regulators of cellular homeostasis[J]. Nat Immunol, 2003,4(5):404-409. DOI:10.1038/ni0503-404.
(本文编辑:冀凯宏)
Cell apoptosis pathway in the development of alcoholic pancreatitis in mice
GuoMin,YuPengfei,BaiBin,QiuZhaoyan,WangQian,ZhaoQingchuan,LiShujun.
StateKeyLaboratoryofCancerBiology,XijingHospitalofDigestiveDiseases,FourthMilitaryMedicalUniversity,Xian710032,China
LiShujun,Email:lishujun@fmmu.edu.cn
Objective To explore the role of cell apoptosis pathway in alcoholic pancreatitis. Methods C57BL/J mice were divided into control group(NC) and Alcohol group (AC), Acute pancreatitis group (AP) and Alcoholic acute pancreatitis group(AAP). Alcohol treatment was 10% w/v ethanol feeding for 2 d, 15% w/v ethanol for 5 d, and then 20% w/v ethanol until 13 weeks. AP model was established by the intraperitoneal injection of 50μg caerulein /kg body weight once an hour for a total of 7 times. Blood samples were collected for detecting serum amylase and lipase activity. Part pancreatic tissue was collected and the wet and dry weight were both measured to calculate the water content. The routine pathological examination of the pancreatic tissues were conducted. The expression of apoptosis associated protein caspase3 and caspase8 was determined by Western blot. And cell apoptosis was determined using TUNNEL method. Results The level of serum amylase in NC group, AC group, AP group and AAP group were(3 630±259),(3 196±187),(35 955±4607) and(53 607±3 848)U/L;the level of serum lipase were(502±41),(745±42),(7 346±665)and(12 764±2 544)U/L;the water content were(70.2±3.1)%,(69.6±2.0)%,(78.2±1.5)% and(85.0±3.0)% and (12.75±0.25);the expression of caspase3 were (1.017±0.0784),(1.287±0.097), (178±0.07785) and (0.2443±0.0243); the expression of caspase8 were (0.8289±0.0096), (0.5985±0.0735), (1.27±0.08) and (0.145±0.015);the number of apoptotic cells were 1, 6, 214,97/10 high power field. The pathological score of pancreas injure in NC group, AC group, AP group and AAP group were 0, 0,(7±0.4)and (12.8±0.3), respectively. Serum amylase, lipase, water content and pathological scores in AP group were obviously higher than those in NC group (P<0.05), which in AAP group were also obviously higher than those in AP group, and all the differences were statistically significant (allP<0.05).Compared with NC group, the expressions of apoptosis associated protein caspase3 and caspase8 and the number of apoptotic cells were obviously increased in AP group, which were obviously higher than those in AAP group, but the expression of caspase3 and caspase8 in AAP group were decreased compared with NC group, and all the differences were statistically significant(allP<0.05). Conclusions Chronic alcohol exposure may aggravate the severity of pancreatitis, and the inhibition of apoptosis pathway and the enhancement of acinar cell necrosis may be involved in this process.【Key words】 Pancreatitis, alcoholic; Ethanol; Apoptosis; MiceFund program:Foundation: National Nature Science Foundation of China(81370564); Scientific and Technological Project on Social Development of Shaanxi Province(2014SF2-11)
10.3760/cma.j.issn.1674-1935.2017.01.009
710032 西安,第四军医大学西京消化病医院肿瘤生物学国家重点实验室(郭敏、余鹏飞、白槟、邱兆岩、王谦),消化ICU(赵青川、李树钧)
李树钧,Email: lishujun@fmmu.edu.cn
国家自然科学基金(81370564);陕西省社会发展攻关计划项目(2014SF2-11)
2016-09-01)

