阿特拉津的甘蔗内生菌降解研究
张佳丽,王彦辉,杜良伟
(1. 广西大学 亚热带农业生物资源保护与利用国家重点实验室, 南宁 530004; 2. 广西大学 化学化工学院,南宁 530004; 3. 广西农业科学院 植物保护研究所, 南宁 530007)
阿特拉津的甘蔗内生菌降解研究
张佳丽1,2,王彦辉3,杜良伟1,2
(1. 广西大学 亚热带农业生物资源保护与利用国家重点实验室, 南宁 530004; 2. 广西大学 化学化工学院,南宁 530004; 3. 广西农业科学院 植物保护研究所, 南宁 530007)
从广西长期施用阿特拉津的甘蔗田中的甘蔗根部成功筛选到一株降解阿特拉津的内生菌N-2。根据该降解菌的形态特征,结合其18S rRNA及ITS序列的测定结果,将其鉴定为藤仓镰孢霉菌,该菌株对阿特拉津的降解为首次报道。同时还考察了菌株的降解特性,结果表明其以阿特拉津作为唯一氮源,在pH 7~8,培养温度28℃,初始阿特拉津浓度25 mg/L时,对阿特拉津的降解效果最佳,10 d降解率可达49.6%。利用超高效液相色谱与质谱联用(UPLC-MS)分析了阿特拉津的降解产物,测定结果表明,该菌株降解阿特拉津的产物为氰尿酸。
阿特拉津;生物降解;植物内生菌;降解特性
阿特拉津是一种三氮杂苯类除草剂[1],由于长期广泛地使用,已经对土壤、水体等环境造成了严重污染[2]。其常在土壤[3]、地表水[4]及地下水[5]中被检测到,这些残留将直接影响土壤中植物[6]和水生植物[7]的生长,同时还可通过食物链富集危害动物[8-9]及人类健康[10-11]。目前,可有效去除阿特拉津残留的方法主要包括物理去除、化学降解及生物降解法。物理去除中常用的活性炭吸附法[12]存在机械强度差及不易重复利用的缺点,膜处理技术[13]则对水体要求较高且易造成膜堵塞。常见化学降解有Fenton或类Fenton法[14]、电化学法[15]、臭氧氧化法[16]、γ辐照法[17]等,但因成本较高,反应条件苛刻及易对环境造成二次污染等问题使其在应用上受到了一定的限制。而生物降解法[18-19]成本较低,且无需复杂的处理设备,相较于物理、化学方法所产生的二次污染是更为安全、可行的方法[20]。目前在生物降解方面,国内外研究者主要从土壤或活性污泥中筛选阿特拉津的降解菌株并对其进行相关研究[21],而在寡营养条件下,从植物组织内筛选分离出阿特拉津的降解菌株鲜有报道。本研究从甘蔗根内筛选能够降解阿特拉津的内生菌株,并加以鉴定,考察降解菌株对阿特拉津的降解特性,分析其降解产物,以期为其在生物降解中的应用提供依据。
1 材料与方法
1.1 培养基与试剂
LB培养基;PDA培养基;基础无机盐培养基MS(g/L):KH2PO40.9,Na2HPO42.6,MgSO4·7H2O 0.2,NaCl 0.5,glucose 5;固体无机盐培养基:MS+Agar 15 g/L;提取DNA培养基(g/L):蛋白胨3,酵母提取物0.5,glucose 10,K2HPO44,CaCl20.35,MgSO4·7H2O 0.3。
阿特拉津原药(纯度≥99%)购自Dr. Ehrenstorfer GmbH(Germany);甲醇,HPLC级(New Jersey,USA);其他化学试剂均为分析纯。
1.2 降解菌株的筛选
从广西甘蔗种植区采集甘蔗根样品,对甘蔗根表面灭菌。将冲洗干净后的甘蔗根依次在75%的酒精浸泡3 min、3%的次氯酸钠溶液中浸泡5 min后,用无菌水反复冲洗根表面,无菌滤纸吸干,取最后一次淋洗液涂布于LB和PDA平板中,分别于37℃和28℃下恒温培养5 d,用于检测甘蔗根表面灭菌是否彻底,若LB与PDA平板均未有菌落生成,则说明根表面已彻底灭菌。
将已表面灭菌的甘蔗根置于无菌研钵中,加入灭菌水充分研磨匀浆,静置10 min后,取上清液涂布于含有阿特拉津的固体培养基中,28℃恒温培养。不断改变培养基中阿特拉津的浓度,直至培养基中有菌落生成。将生成的单菌落接种于含有阿特拉津的液体培养基中进行反复多次的培养,直至菌株能稳定地在以阿特拉津作为唯一氮源的液体培养基中生长,从而筛选出具有降解阿特拉津特性的菌株。
1.3 降解菌株的鉴定
用接种针挑取PDA平板上的菌丝在光学显微镜下观察菌丝和孢子形态。18S rRNA和ITS基因克隆参照文献[22]进行。18S rRNA扩增的正向引物NS1:5′-GTAGTCATATGCTTGTCTC-3′,反向引物Fung:5′-ATTCCCCGTTACCCGTTG-3′。ITS扩增的正向引物ITS1:5′-TCCGTAGGTGAACCTGCGC-3′,反向引物ITS4:5′-TCCTCCGCTTATTGATATGC-3′。25 μL PCR反应体系为:10×EXTaqBuffer, 2.5 μL;DNTP(2.5 mmol/L), 1 μL;NS1(10 μmol/L), 1 μL;Fung(10 μmol/L), 1 μL;总DNA 2 ng;EXTaq, 0.25 μL。扩增条件:98℃预变性5 min;98℃变性30 s,58℃/55℃退火30 s,72℃延伸1 min,循环30次;72℃再延伸10 min。扩增产物送至北京华大公司测定基因序列。将测序结果在GeneBank数据库中进行同源性比对分析。
1.4 阿特拉津降解率的测定
为考察菌株的降解特性,分别设置不同的降解条件后接种菌株进行培养,包括降解时间、pH值、培养温度、初始阿特拉津浓度。待菌株降解完成后,加入等体积氯仿进行萃取,收集有机相用旋转蒸发仪于45 ℃下浓缩至近干,用色谱纯的甲醇定容后用HPLC检测。参考文献[23]设定检测条件:250 mm × 4.6 mm C18不锈钢色谱柱,流动相甲醇/水(80/20,V/V),流速1.0 mL/min,柱温30℃,Waters 2495紫外检测器,检测波长222 nm。检测结束后,记录吸收峰面积,根据阿特拉津的标准曲线计算残余阿特拉津浓度,从而计算出降解率。
1.5 阿特拉津降解产物的测定
待降解完成后,用UPLC-MS测定产物。参考文献[24]设定MS条件:离子源为ESI,模式为Positive/Negative,离子捕获器范围为80~250m/z,雾化器电压为30 V(N2温度350℃),毛细管电压3.5 kV。
2 结果与分析
2.1 降解菌株的筛选与鉴定
从甘蔗根组织内筛选到一株内生菌株N-2,能利用阿特拉津作为唯一氮源稳定地生长。该降解菌株在PDA平板上为白色菌丝体,气生菌丝呈棉絮状致密生长,在平板表面产生少量淡紫红色色素。在光学显微镜下对该菌株的菌丝体及孢子进行观察,该菌株的菌丝体呈长杆状,有短分枝无规则分布于杆状体上,产生的孢子为杆柱型,两端稍尖。18S rRNA和ITS序列的扩增产物用1%的琼脂糖凝胶电泳检测,结果如图1所示。测序后进行BLAST比对,结果显示该菌株的18S rRNA和ITS序列与藤仓镰孢菌的相似性达99%以上。结合该菌株的形态特征,初步将其鉴定为藤仓镰孢霉菌(Fusariumfujikuroi)。
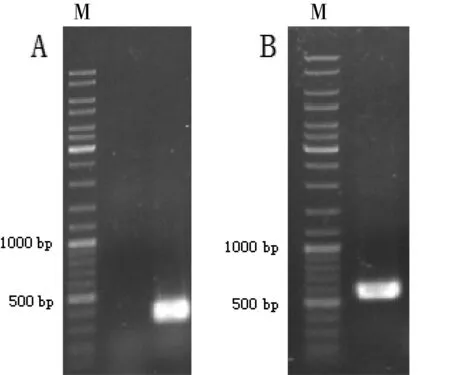
图1 菌株PCR产物Fig 1 The PCR products of the strain
A:18S rRNA序列;B:ITS序列
2.2 菌株的降解特性研究
2.2.1 培养时间对菌株降解的影响
配制含有25 mg/L阿特拉津的无机盐培养基,将1×106CFU/mL的孢子悬液以接种量1%于培养基中接入N-2,于28℃下180 r/min振荡培养,分别于第0、2、4、6、8、10及第12天取样,经过萃取预处理后,用HPLC检测残余阿特拉津浓度,计算降解率。结果表明(图2),前6天内,其降解率处于较低水平,第6~8天内,降解率以较高的速率增长,随后阿特拉津的降解速率开始下降,第10天时,其降解率为45.86%,随后降解速率已十分缓慢。根据此实验结果,将后续实验中阿特拉津的降解天数设定为10 d。
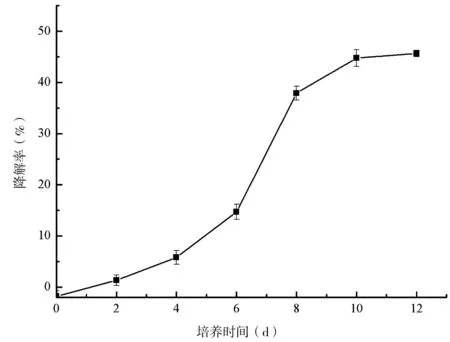
图2 培养时间对降解阿特拉津的影响Fig 2 Effect of incubation time on degradation rate
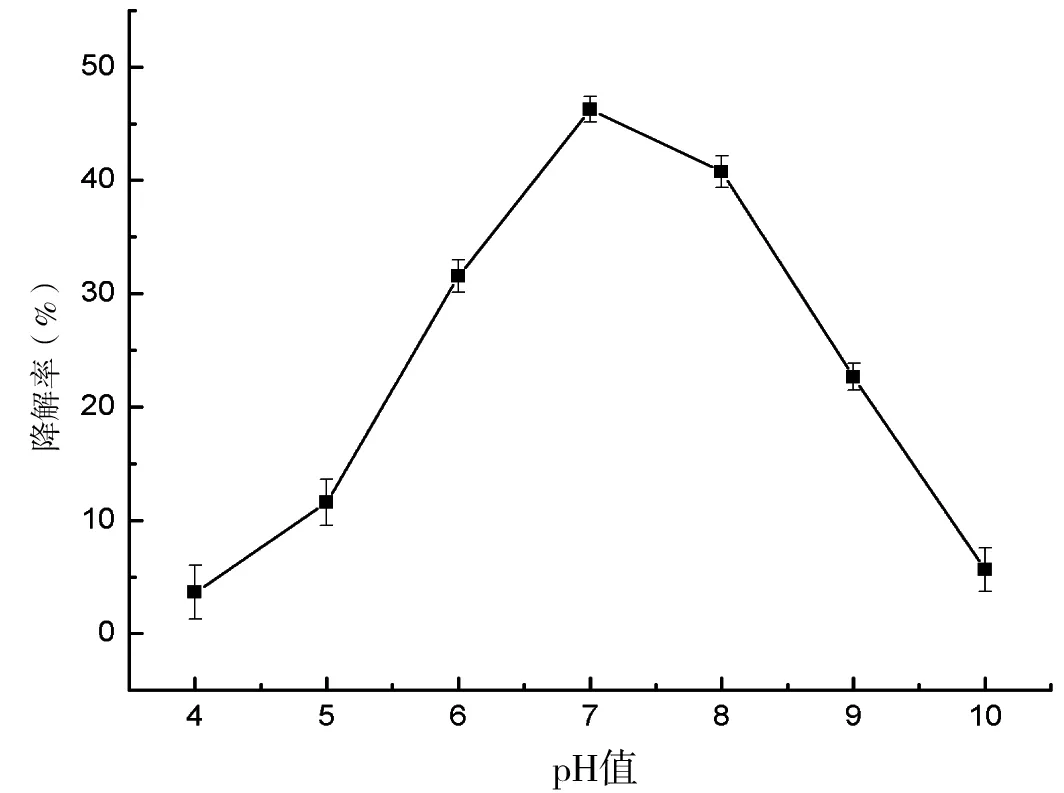
图3 pH值对降解阿特拉津的影响Fig 3 Effect of pH on degradation rate
2.2.2 pH值对菌株降解效果的影响
将培养液调节pH值分别为4.0、5.0、6.0、7.0、8.0和9.0,接菌培养10 d后计算降解率。结果表明(图3),在pH 4.0~7.0的范围内,阿特拉津的降解率随着pH值的增加而增加,在pH 7.0时,降解率达到峰值为44.07%,在pH 7.0~10.0的范围内,阿特拉津的降解率随着pH值的增加而减少。由此可见,N-2在中性环境中降解阿特拉津的效率最佳。
2.2.3 温度对菌株降解效果的影响
将接菌后的培养液分别置于16℃、22℃、28℃、34℃和40℃下培养10 d后计算降解率。结果显示(图4),N-2在16℃~34℃的条件下对阿特拉津均有一定程度的降解,温度由16℃逐渐升高至28℃时,阿特拉津的降解率逐渐增加至48.44%,之后随着温度的继续升高,降解率呈迅速下降的趋势,至40℃时,N-2对阿特拉津的降解效果已微乎其微。
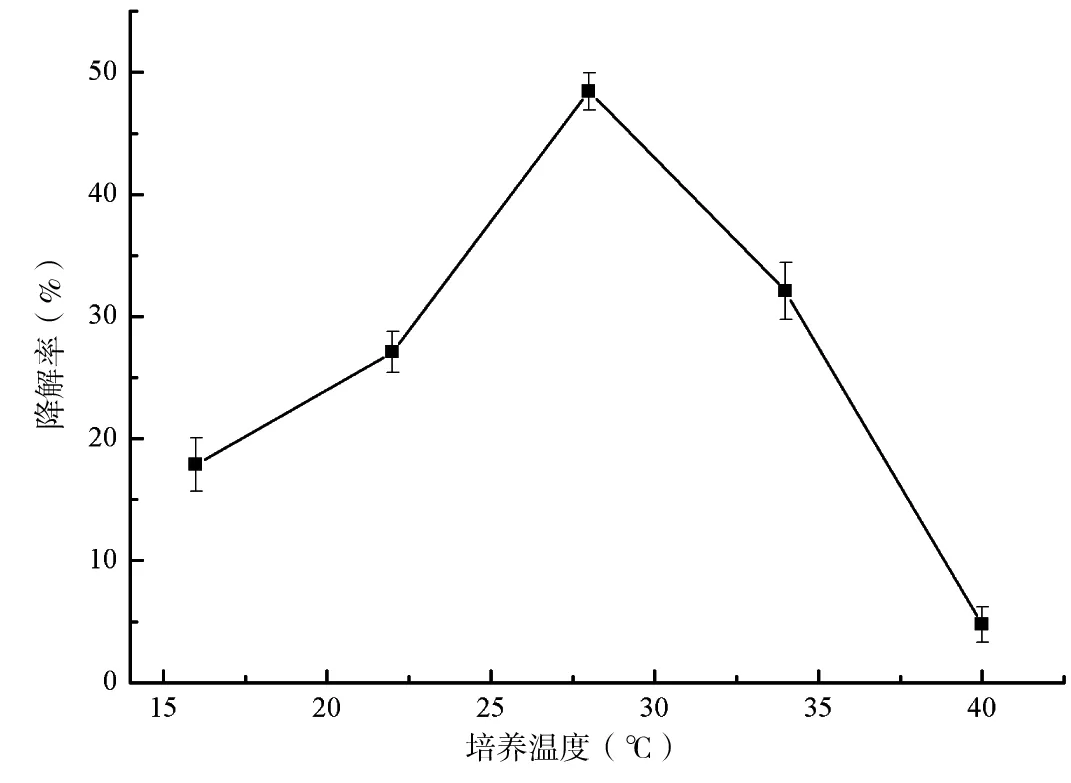
图4 培养温度对降解阿特拉津的影响Fig 4 Effect of temperature on degradation rate
2.2.4 阿特拉津的初始浓度对N-2降解的影响
分别配制阿特拉津初始浓度为5、10、25、40和60 mg/L的培养液,接菌培养10 d后计算降解率。结果表明(图5),当阿特拉津的初始浓度为5 mg/L时,阿特拉津几乎没有被降解,10 mg/L时的降解率只有4.42%,分析可能是由于培养基中较低浓度的阿特拉津并不能给降解菌提供足够的营养,影响了其生长与繁殖,间接影响了其对阿特拉津的利用与降解率。当阿特拉津的初始浓度达到25 mg/L时,阿特拉津已能被降解菌株有效地降解。随后继续增大培养基中阿特拉津的初始浓度,降解率呈下降趋势,到60 mg/L时,降解率只剩9.16%,表明该降解菌株对浓度较高的阿特拉津的耐受性较弱。
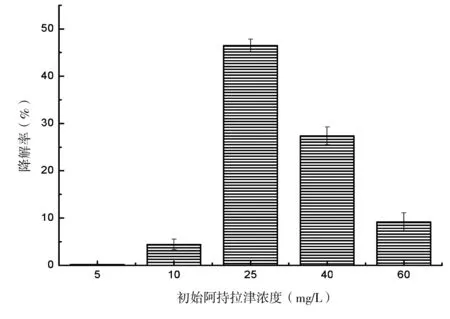
图5 阿特拉津初始浓度对降解的影响Fig 5 Effect of initial concentration on degradation rate
2.3 阿特拉津降解产物的测定
阿特拉津的降解产物用UPLC-MS进行测定,结果表明(图6),在培养液中检测到了一种产物,离子大小为M-1=128.01(m/z)。参考相关文献[25-26],通过阿特拉津的降解途径结合其分子量大小可以推测出该产物为氰尿酸。随后继续增加培养时间并未检测到新物质的出现,说明该降解菌株只能将阿特拉津最终降解为氰尿酸,不能使其进一步发生开环反应甚至完全矿化。另外,在已设定的MS操作条件下,未能在培养液中检测到降解过程的中间产物,推测其可能在生成的同时被快速降解,无法在培养液中进行大量累积,检测时间一旦延后就无法检测到它的存在。
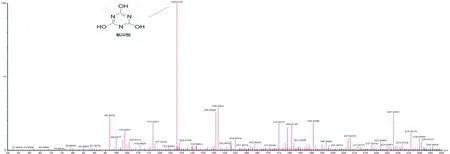
图6 降解产物的质谱图
Fig 6 The mass spectrogram of cyanuric acid
3 结论
阿特拉津作为一种分子结构稳定的三嗪类农药,其生物降解一直受到环境保护领域的关注。与国内外主要从土壤或活性污泥中筛选阿特拉津降解菌株的研究不同,本研究利用广西特色农作物甘蔗从其根部组织内筛选到一株以阿特拉津为唯一氮源生长的降解菌株N-2,根据其形态特征及18S rRNA和ITS基因序列比对分析,将其初步鉴定为藤仓镰孢霉菌(F.fujikuroi),该菌种对阿特拉津的降解尚未见报道,为新型降解菌株。研究考察了该菌株降解阿特拉津的最佳条件,测定了阿特拉津的降解产物,为今后对菌株特性进行更深入的研究和利用基因工程手段进行相应生物降解工作提供理论依据和技术支持。
[1]陈建军,何月秋,祖艳群,等.除草剂阿特拉津的生态风险与植物修复研究进展[J].农业环境科学学报,2010,29:289-293.
[2]史 伟,李香菊,张宏军.除草剂莠去津对环境的污染及治理[J].农药科学与管理,2009,30(8):30-33.
[3]DOS SANTOS E V, SEZ C, MARTNEZ-HUITLE C A, et al.Combined soil washing and CDEO for the removal of atrazine from soils [J].Journal of Hazardous Materials, 2015, 300:129-134.
[4]WU W D, ZHOU C, GUO J J, et al.Determination of atrazine surface water and drinking water by HPLC [J].Arid Environmental Monitoring, 2011, 32:79-84.
[5]YUE G, JING M A, RAN J, et al.Impact of long-term atrazine use on groundwater safety in Jilin province, China [J].Journal of Integrative Agriculture, 2013, 12(2):305-313.
[6]ZHANG K, LI Y, ZU Y Q, et al.Effects of atrazine stress on the growth of pennisetum hydridum [J].Agricultural Science&Technology, 2011, 12(11):1653-1656.
[7]徐小花,肖 铭,潘慧云,等.阿特拉津对铜绿微囊藻和四尾栅藻生长的影响[J].生态与农村环境学报,2008,24(1):72-76.
[8]赛林霖,贾 强,李兰波.除草剂阿特拉津对两栖类动物发育影响的研究进展[J].环境与健康杂志,2010,27(7):647-649.
[9]VICTOR-COSTA A B, BANDEIRA S M, OLIVEIRA A G, et al.Changes in testicular morphology and steroidogenesis in adult rats exposed to atrazine [J].Reproductive Toxicology, 2010, 29(3):323-331.
[10]许人骥,邢小茹,叶新强, 等.阿特拉津暴露对女性生殖健康影响研究[J].安全与环境学报,2011,11(5):19-22.
[11]何书海,张鸣珊,李腾崖,等.海南饮用水源地水体中阿特拉津健康风险评价[J].中国环境监测,2015,31(2):12-16.
[12]ZHAO X, OUYANG W, HAO F, et al.Properties comparison of biochars from corn straw with different pretreatment and sorption behavior of atrazine [J].Bioresource Technology, 2013, 147:338-344.
[13]李邵峰,秦蓁蓁,陈 雷.膜生物反应器去除原水中微量阿特拉津的研究[J].水处理技术,2009,35(4):52-56.
[14]陈芳艳, 耿文英, 唐玉斌.Fenton氧化法降解内分泌干扰物阿特拉津的研究[J].环境科学与技术,2009, 32(6):59-61.
[15]李文进.纳米金修饰的电化学传感器检测阿特拉津的研究[D].长沙:湖南农业大学,2014.
[16]黄先锋,姜成春,苑宝玲.羟基氧化铁催化臭氧氧化去除水中阿特拉津[J].环境工程学报,2010(9):2042-2046.
[17]WANG J Q, ZHANG J B, MA Y.Degradation of atrazine in water by Gamma-ray irradiation [J].Fresenius Environmental Bulletin, 2012, 21(9):2778-2784.
[18]崔燕玲,刘丹丹,刘长风,等.土壤农药污染的微生物修复研究概况[J].安徽农业科学,2015(16):75-76.
[19]陈建军,李明锐,张 坤,等.几种植物对土壤中阿特拉津的吸收富集特征及去除效率研究[J].农业环境科学学报,2014,33(12):2368-2373.
[20]李 威.农药污染的生物降解与生物修复分析[J].资源节约与环保,2015(8):171-172.
[21]周 宁,孟庆娟,王荣娟,等.除草剂阿特拉津微生物降解研究进展[J].东北农业大学学报,2008,39(9):136-139.
[22]王 惠,湛东锐,李连强,等.18S rDNA和ITS相结合鉴定一株盐生海芦笋内生真菌的研究[J].食品科学,2012,31(21):173-176.
[23]刘春光,杨峰山,肖延臣,等.HPLC与生测联合法对阿特拉津高效降解菌株的筛选[J].黑龙江大学自然科学学报,2010,27(4):535-541.
[24]卢浙军,赵 林.利用UPLC-MS/MS检测水中阿特拉津[J].现代科学仪器,2013(5):120-123.
[25]董新凤.色谱与质谱联用技术用于除草剂多残留检测及莠去津降解规律的研究[D].保定:河北大学,2015.
[26]范晓旭,宋 鸽,宋福强,等.阿特拉津污染水体净化技术与降解机理[J].环境工程,2015,33(9):10-15.
The study of atrazine degraded by endophytic fungus from sugarcane
ZHANG Jia-li1,2, WANG Yan-hui3, DU Liang-wei1,2
(1. State Key Laboratory for Conservation and Utilization of Subtropical Agro-bioresources, Guangxi University,Nanning 530004; 2. College of Chemistry and Chemical Engineering, Guangxi University, Nanning 530004;3. Plant Protection Research Institute, Guangxi Academy of Agricultural Sciences, Nanning 530007, China)
An endophytic fungus strain of degrading atrazine was isolated from the roots of sugarcane in Guangxi farmland which has been sprayed by atrazine for a long time. It was preliminarily identified asFusariumfujikuroiaccording to its morphological characteristics and the analysis of its 18S rRNA and ITS gene sequences. The degradation characteristics were also investigated. The results showed that the strain could use atrazine as sole nitrogen source and had the best degradation property under those conditions: pH 7-8, temperature 28℃, atrazine primary concentration 25 mg/L. The degradation rate could reach 49.6% after 10 days. The degradation products were determined by ultra performance liquid chromatography-mass spectrometry (UPLC-MS). The results showed that the degradation product was cyanuric acid.
atrazine; biodegradation; endophyte; degrading characteristics
2016-04-07;
2016-04-14
国家自然科学基金项目(31660524,31460479)
张佳丽,硕士,研究方向为环境与生物分析化学,E-mail:tcdgaga@live.cn
杜良伟,博士,副教授,研究方向为环境与生物化学分析,E-mail:dulily6@163.com
X172;X592
A
2095-1736(2017)01-0030-04
doi∶10.3969/j.issn.2095-1736.2017.01.030

