不同剂量地塞米松对人骨髓间充质干细胞脂联素及PPARγ-2表达影响的研究
巩 凡,王立峰,程锁利,高 俊,马 峰,汪玉海,赵 飞
·论 著·
不同剂量地塞米松对人骨髓间充质干细胞脂联素及PPARγ-2表达影响的研究
巩 凡,王立峰,程锁利,高 俊,马 峰,汪玉海,赵 飞
目的 观察不同剂量地塞米松对人骨髓间充质干细胞中脂联素、过氧化物酶增殖物激活受体γ-2(PPARγ-2)的影响,探索糖皮质激素对人骨髓间充质干细胞中脂肪代谢的影响。方法 用人骨髓间充质干细胞,分为空白组、成脂细胞分化组、地塞米松组;将地塞米松组再分为:10-10mol/L组、10-9mol/L组、10-8mol/L组、10-7mol/L组、10-6mol/L组、10-5mol/L组。分别培养1、3、7、9 d取材,进行脂联素、PPARγ-2、碱性磷酸酶、甘油三酯的检测。结果 不同浓度地塞米松对人骨髓间充质干细胞具有不同的影响,在10-8mol/L组、10-7mol/L组,具有一定的成骨作用。但随着地塞米松浓度的增加,脂联素的表达逐渐减少、PPARγ-2的表达逐渐增多。结论 地塞米松的浓度对脂联素、PPARγ-2的表达具有影响,并影响人骨髓间充质干细胞的分化。
人骨髓间充质干细胞;地塞米松;脂联素;PPARγ-2
在人体的骨组织中,骨髓间充质干细胞(BMSCs)可以根据人体的各种需要向多种细胞分化,是人体重要的干细胞之一。然而有文献研究表明糖皮质激素对于BMSCs的生长及活性具有一定的影响[1],现在已经证实糖皮质激素对于BMSCs具有诱导分化的作用。多年的临床观察已经明确,糖皮质激素作为股骨头缺血性坏死的致病因素之一已经被广泛的科研人员接受,然而其致病原因至今仍没有一个定论,在众多的理论中,骨髓中脂肪代谢紊乱是其中重要的理论之一。脂联素是一种脂肪源性的细胞因子,近年的实验已经表明,脂联素与骨代谢有着密切关系。脂联素在人体内含量丰富,其中血清中的浓度较高。已经有实验表明脂联素直接影响成骨和破骨细胞的增殖与分化,与骨的重建存在着一定的相关性。过氧化物酶增殖物激活受体(PPARs)的信号转导途径是脂代谢中重要的信号转导途径之一[2]。在没有PPARγ的时候,前脂肪细胞很难分化为脂肪细胞,大部分PPARγ的目标基因都直接或间接参与脂肪的合成途径。本实验希望通过在不同浓度糖皮质激素中人骨髓间充质干细胞的生长及人骨髓间充质干细胞表达脂联素及PPARγ-2的差异,探讨糖皮质激素对人骨髓间充质干细胞中脂代谢的影响。
1 材料与方法
1.1 材料:人骨髓间充质干细胞 (美国sciencell);地塞米松(Sigma)公司;间充质干细胞脂肪分化培养基(Hyclone);油红O;O’YMPUS IX71倒置显微镜);Trizol 试剂盒、RT-PCR试剂盒(Invitrogen 公司,美国)。
1.2 试验方法
1.2.1 细胞培养:取人骨髓间充质干细胞计P0代生长融合达90%时,吸出原培养基,PBS冲洗。加入0.25%胰蛋白酶消化,显微镜下观察细胞已经完全脱离瓶壁,收集悬浮的细胞加入L-DMEM(10%FBS)培养基混合,调整细胞密度为1×105/mL;以1∶2传代培养,记作Pl代,以后的传代细胞依此类推。传代细胞置于37 ℃、5%CO2培养箱中孵育,隔天换液,倒置相差显微镜下观察培养细胞的生长状况。
1.2.2 实验细胞分组方法:实验细胞分为空白组、成脂细胞分化组、地塞米松组,将地塞米松组(D组)再分为:10-10mol/L组、10-9mol/L组、10-8mol/L组、10-7mol/L组、10-6mol/L组、10-5mol/L组。空白组:细胞按正常程序传代及培养;成脂细胞分化组:取生长状态良好的P3期细胞,待细胞融合90%,加入间充质干细胞脂肪分化培养基,3 d更换培养基1次,37 ℃、5%、CO2条件下培养;地塞米松组:取生长状态良好的P3期细胞,待细胞融合90%,加入含不同浓度地塞米松(10-10mol/L、10-9mol/L、10-8mol/L、10-7mol/L、10-6mol/L、10-5mol/L)的培养基,3 d更换培养基1次。分别于分组培养后1 d、3 d、7 d、9 d 取材行检测,每组取10份细胞。
1.2.3 细胞特性观察:倒置相差显微镜下观察细胞生长情况。
1.2.4 细胞油红“O”染色及茜素红染色:培养9 d后取空白组、成脂细胞分化组、地塞米松组,细胞行油红“O”染色及茜素红染色。
油红“O”染色,倒去培养皿中培养液,PBS漂洗1次,95%乙醇固定10 min,油红“O”稀释液染色10 min,75%酒精脱色,显微镜观察并照相。
茜素红染色,倒去培养皿中培养液,PBS漂洗2次,95%乙醇固定10 min,PBS冲洗2次;0.1%茜素红染液染色6 min,PBS冲洗2次,观察并照相。
1.2.5 细胞中碱性磷酸酶、三酰甘油的检测:取空白组、成脂细胞分化组、地塞米松组细胞,收集细胞,通过反复冻融裂解细胞,使用氯仿+甲醇提取液提取5 min,37 ℃水浴后使用三酰甘油试剂盒在全自动生化分析仪上测定。
取空白组、成脂细胞分化组、地塞米松组细胞,收集细胞,通过反复冻融裂解细胞,离心取上清液后使用碱性磷酸酶试剂盒在全自动生化分析仪上测定。
1.2.6 细胞中PPARγ-2、脂联素、碱性磷酸酶基因转录水平检测:于细胞培养第7天,取空白组、成脂细胞分化组、地塞米松组细胞,提取总RNA,用紫外分光光度计进行RNA定量,用A260与A280的比值确定RNA的纯度。设计引物并经行逆转录反应,取反应产物经行PCR扩增。PCR 反应条件:94 ℃ 预变性2 min,94 ℃ 变性20 s,54 ℃ 退火20 s(ALP 为50 ℃),72 ℃延伸30 s,共45个循环。采用Quantity One软件测定条带净灰度值,并与β-actin内参进行比较,计算其比值作为目的基因mRNA的相对表达量。每组3 个样本,引物委托北京奥科鼎盛生物科技有限公司合成,见表1。
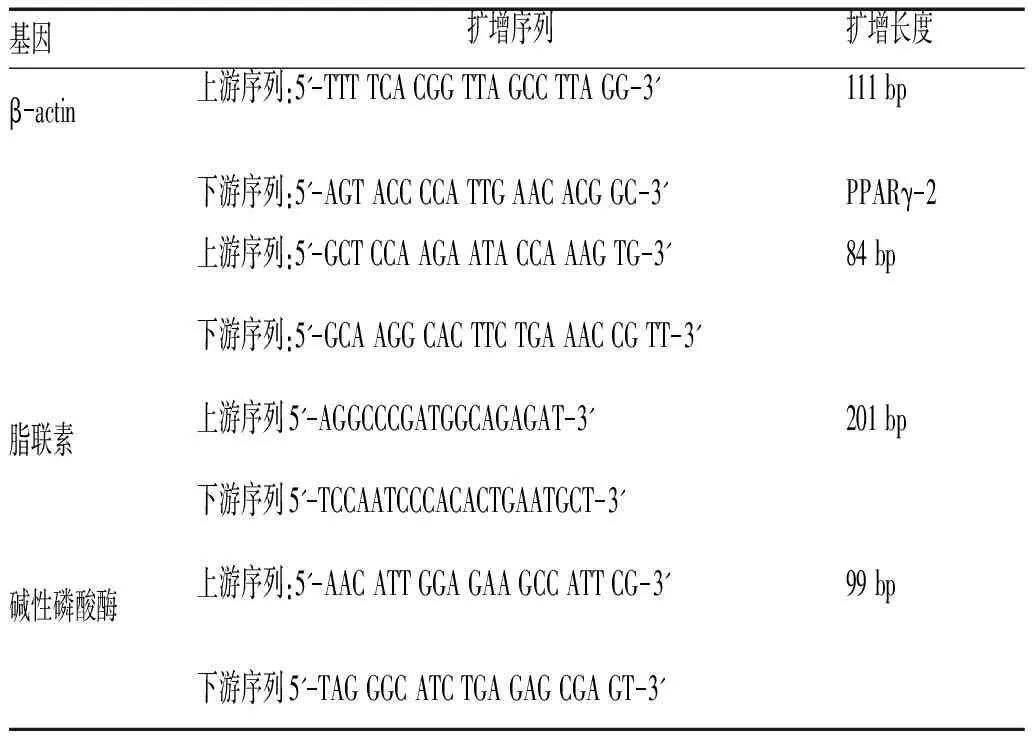
表1 PPARγ-2、脂联素、碱性磷酸酶基因引物

2 结果
2.1 细胞学检查:倒置相差显微镜下观察见P0代细胞贴壁生长,呈梭形或多边形;成脂细胞分化组:在加入间充质干细胞脂肪分化培养基后4d,细胞内开始出现小的脂滴。地塞米松组:10-10mol/L组和10-9mol/L组培养9 d后未见明显细胞学变化,偶见细胞增大;10-8mol/L组第7天细胞较前增大,第9天见细胞内颗粒增多;10-7mol/L组、10-6mol/L组、10-5mol/L组第7天细胞内见小脂滴。
2.2 细胞中碱性磷酸酶、三酰甘油的检测:各组细胞在第1天仅有10~8 mol/L组碱性磷酸酶较高,余各组均未见明显差异;第3天空白组、成脂细胞分化组、10-5mol/L组、10-6mol/L组未见明显增高,余各组均出现碱性磷酸酶升高;第7天10-8mol/L组碱性磷酸酶明显升高;第9天10-8mol/L组碱性磷酸酶仍较其他组高。随着时间的推移,地塞米松各组细胞均可表达碱性磷酸酶,但10-8mol/L组表达最多,较其他组比较差异有统计学意义,见表2。
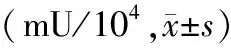
表2 各组细胞中碱性磷酸酶的检测
各组细胞在第1天未见三酰甘油明显差异。第3天成脂细胞分化组三酰甘油含量明显增高,较各组明显增高并差异有统计学意义。第7天10-10mol/L组至10-5mol/L组三酰甘油逐渐升高,其中10-5mol/L组与成脂细胞分化组含量最多且与其他组差异有统计学意义,但2组间差异无统计学意义。第9天地塞米松各组三酰甘油仍较高,且10-5mol/L组升高最多,见表3。
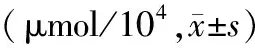
表3 各组细胞中三酰甘油的检测
2.3 细胞中PPARγ-2、脂联素、碱性磷酸酶基因转录水平检测: 各组细胞培养7 d后10-8mol/L组、10-7mol/L组碱性磷酸酶表达量较其他组增高,且差异有统计学意义。随着地塞米松浓度的增加细胞脂联素表达的水平逐渐减低,10-7mol/L组、10-6mol/L组、10-5mol/L组脂联素降低最明显,且差异有统计学意义,同时随着地塞米松浓度的增加细胞,PPARγ-2的表达量逐渐在增加,地塞米松组间差异有统计学意义,见表4。
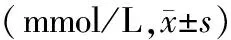
表4 第7天各组PPARγ-2、脂联素、碱性磷酸酶的表达
3 讨论
PPARs是核激素受体超家族的成员之一[3],这是一种属于Ⅱ型核激素受体超家族的一种,包括PPARα、PPARβ/δ 和PPARγ 3 种表型。PPARs是一种参与调节糖类、脂类以及脂肪储存的基因,是一种参与代谢的重要基因。PPARs参与脂肪细胞的代谢已经被相关实验室证实。目前过氧化物酶增殖物激活受体-γ的研究比较多,同时也是最重要的是一种受体。PPARγ具很多种生物学功能,并积极参与脂肪细胞的分化过程[4]。目前有研究人员发现PPARγ的表达主要分布在脂肪细胞中。有文献报道表明PPARγ在不同物种中的脂肪细胞均具有重要的表达[5-6]。近些年有研究人员研究发现,这种基因的表达量与脂肪细胞的分化程度、大小、体积均呈正相关性[7]。PPARγ之所以非常重要,是因为在没有其的情况下,目前研究结果还没有发现有另一种信号可以诱导脂肪细胞的分化,而且PPARγ能够诱导脂肪前体细胞向脂肪细胞分化。PPARγ在前脂肪细胞中其并不表达,但如果前脂肪细胞需要分化时其先于其他脂肪基因的表达。没有PPARγ,其他细胞因子不可能将前脂肪细胞分化成脂肪细胞,所以PPARγ在细胞的分化中起着关键性作用[8-9]。目前研究表明,PPARγ可以使骨髓间充质干细胞分化为脂肪细胞,已有实验证明PPARγ的表达增加将抑制成骨的发生[10],而使用雷奈酸锶治疗大鼠股骨头坏死时可以降低PPARγ的表达。因此,PPARγ 是人骨髓间充质干细胞成脂分化必须的调控因子。目前文献报道,大部分PPARγ的目标基因都直接参与脂肪合成途径,包括脂蛋白脂肪酶、脂肪酸结合蛋白、乙酰辅酶A 合成酶和脂肪酸转运蛋白。
目前的研究已经在人类股骨和胫骨的成骨细胞中发现了脂联素及其受体AdipoR1/2的表达,同时使用免疫染色等试验方法证实了,即骨肉瘤细胞和正常成骨细胞中均可检测到脂联素基因的表达。有实验研究表明,在体外成骨细胞培养的过程中,检测脂联素蛋白的分泌及脂联素mRNA的表达均增加[11]。国外研究人员[12]发现,在小鼠成骨细胞及破骨细胞表面有脂联素及其受体的表达。
已有实验研究发现,脂联素分别通过AdipoR/JNK和AdipoR/p38两个细胞通道促进成骨细胞的增殖和分化,并且对时间和剂量具有依赖性。如果使用siRNA抑制AdipoRl,就可以阻止脂联素对人骨髓间充质干细胞诱导成骨细胞以及其细胞增殖和ALP的表达[13]。有实验研究发现[14],脂联素可以通过自分泌或旁分泌的方式促进成骨细胞增殖、分化和矿化。将成骨细胞、破骨细胞、单核细胞共培养的实验中,脂联素可以通过AdipoRl/p38 MAPK径路诱导成骨细胞,从而间接地诱导破骨细胞分化[15]。曾有学者总结,骨骼局部产生的脂联素以自分泌或旁分泌的途径促进骨形成,而循环中脂联素则以内分泌的形式抑制骨形成,同时脂联素通过影响胰岛素信号通路间接促进骨的形成[16]。脂联素与骨代谢关系密切。
既往的实验研究表明,人骨髓间充质干细胞在适当的条件下可以用地塞米松、3-异丁基-1-甲基黄嘌呤、胰岛素和吲哚美辛诱导分化为脂肪细胞,用地塞米松、β-甘油磷酸钠、维生素C 可诱导其定向分化为成骨细胞,而脂肪细胞的特点是能够在细胞内合成并储存三酰甘油。因此,本实验通过检测三酰甘油含量作为细胞成脂能力的方法,碱性磷酸酶是人骨髓间充质干细胞成骨形成所必需的酶。
本实验结果显示,人骨髓间充质干细胞在地塞米松浓度改变时表达的基因有所不同。此次实验中发现,低浓度地塞米松使细胞碱性磷酸酶含量增高,但随地塞米松浓度的增高,碱性磷酸酶含量降低,但三酰甘油的含量逐渐增高,说明大剂量地塞米松诱导骨髓基质细胞分化为脂肪细胞。正常人体血液中生理浓度的糖皮质激素为10~8 mol/L、10~7 mol/L,所以对成骨分化而言,10~8 mol /L 的地塞米松可以促使人骨髓间充质干细胞表达很高的碱性磷酸酶。但当浓度继续增加时,大剂量地塞米松则促进细胞分化为脂肪细胞而造成骨髓内脂肪堆积。高浓度的地塞米松促进PPARγ的表达同时抑制脂联素表达,由此说明骨髓间充质干细胞已经向脂肪细胞开始转变。
[1] 王佰亮,李子荣,娄晋宁,等.激素性股骨头坏死骨髓基质干细胞增殖活性的检测[J].中华关节外科杂志(电子版),2008,2(2):25-28.
[2] 李龙江,余瑜.脂代谢的信号转导途径[J].儿科药学杂志,2005(1):7-9.
[3] Ryan KK,Li B,Grayson BE,et al.A role for central nervous system PPAR-(Jgamma) in the regulation of energy balance[J].Nat Med,2011,17(5):623-626.
[4] 樊月圆.肉牛PPARs 家族和PLIN 基因遗传变异及其与秦川牛胴体、肉质性状相关分析[D].杨凌:西北农林科技大学,2010.
[5] 王丽,那威,王宇祥,等.鸡PPARγ 基因的表达特性及其对脂肪细胞增殖分化的影响[J].遗传,2012,34(5):454-464.
[6] Lee EK,Lee MJ,Abdelmohsen K,et al.miR-130 suppresses adipogenesis by inhibiting peroxisome proliferator activated receptor γ expression [J].Mol Cell Biol,2011,31(4):626-638.
[7] 王义生,刘沛霖,殷力,等.葛根素对乙醇性股骨头坏死的预防作用[J].中华实验外科杂志,2007,24(4):479.
[8] 吴学建,尹万乐,李月白,等.乙醇对人骨髓间充质干细胞成脂转录因子C和骨钙素mRNA 表达的影响[ J] .郑州大学学报(医学版),2006,41(6):1098.
[9] Ali AA,Weinstein RS,Stewart SA,et al.Rosiglitazone causes bone loss in mice by suppressing osteoblast differentiation and bone formation.Endocrinology,2005,1 46(3):1226-1235.
[10] Muruganandan S,Roman AA,Sinal CJ.Adipocyte ifferentiation of bone marrow derived mesenchymal stem cells:ross talk with the osteoblastogenic program[J].Cell Mol Life Sci,2009,66(2):236.
[11] Yusuke Shinoda,Masayuki Yamaguchi,Naoshi ogata.Regulation of bone formation by adiponectin through autocrine/paracrine and endocrine pathways[J].Journal of Cellular Biochemistry,2006,99:196-208.
[12] Xiang Hang Luo,Li Juan Guo,Ling Qing Yuan,et al.Adiponectin stimulates human osteoblasts proliferation and differentiation via the MAPK signaling pathway[J].Experimental Cell Research,2005,309:99-109.
[13] Ippei Kanazawa,Toru Yamaguchi,Shozo Yano,et al.Adiponectin and AMP kinase activator stimulate proliferation,differentiation,and mineralization of osteoblastic MC3T3-E1 cells[J].BMC Cell Biology,2007,33:12.
[14] Xiang Hangluo,Li Juanguo,Hui Xie,et a1.Adiponectin stimulates RANKL and inhibits OPG expression in human osteoblasts through the MAPK signaling pathway[J].Journal of Bone and Mineral Research,2006,21(10):1648-1656.
[15] 谭振,康鹏德,谢小伟,等.雷奈酸锶对大鼠激素性股骨头坏死的作用及其机制的研究[J].中国矫形外科学杂志,2015,23(1):70-76.
[16] Zhao XY,Chen XY,Zhang ZJ,et al.Expression patterns of transcription factor of PPARγ and C/EBP family members during in vitro adipogenesis of human bone marrow mesenchymal stem cells[J].Cell Biol Int,2015,39(4):457-465.
Peroxisome proliferator activated receptorsgamma expression in rabbit hormone osteonecrosis
GONGFan,WANGLifeng,CHENGSuoli,GAOJun,MAFeng,WANGYuhai,ZHAOFei.
DepartmentofOrthopedics,NingxiaPeople'sHospital,Yinchuan750011,China
Correspondingauthor:ZHAOFei,Email:88652588@qq.com
Objective To observe the PPARγ expression in avascular necrosis of femoral headinduced by glucocorticoid,and to explore the effects of hormones on avascular necrosis of femorallipid metabolism disorder.Methods The animal model were established by prednisolone acetate.The PPARγin the hip-joint was detectedby using Western-Blot and the bone marrow fat cellswas examined by using the histopathology.Results The expression of PPAR γin bone tissue were higher in normal tissue(P<0.05).The differences of the empty bone lacuna rate,bone marrow fat cells area and diameter were statistically significant between the two groups (P<0.05).Conclusion The differentiation signal transduction pathway of PPAR γ in fat cells plays an important role in glucocorticoid induced avascular necrosis of the femoral head in lipid metabolism-2.
Rabbit;Steroid-inducedavascularnecrosisofthefemoralhead;PPARγ-2
10.13621/j.1001-5949.2017.01.0009
宁夏自然科学基金资助项目(NZ13185)
宁夏人民医院骨科,宁夏 银川 750002
巩凡(1982-),男,宁夏籍,硕士研究生,主要从事骨科学研究方向。
赵飞,Email:88652588@qq.com
http://www.cnki.net/kcms/detail/64.1008.R.20170116.1122.006.html
R681.8
A
2016-09-20 [责任编辑]王凯荣

