Sanger测序法和突变扩增阻滞系统法检测非小细胞肺癌EGFR基因19、21号外显子突变的临床价值比较
王建华 李纪鹏 金明威 李珊凤
Sanger测序法和突变扩增阻滞系统法检测非小细胞肺癌EGFR基因19、21号外显子突变的临床价值比较
王建华 李纪鹏 金明威 李珊凤
目的 比较Sanger测序法和突变扩增阻滞系统(ARMS)法检测非小细胞肺癌(NSCLC)EGFR基因19、21号外显子突变的临床价值。方法收集经病理组织学确诊的NSCLC患者肺部原发或转移癌标本102例,其中石蜡包埋组织75例,病理活检标本27例;采用Sanger测序法和ARMS法检测上述标本EGFR基因19、21号外显子突变情况,分析其与患者临床病理学特征的关系。结果ARMS法突变检出率为48.0%(49/102),高于Sanger测序法的32.3%(31/96),两者比较差异有统计学意义(P<0.05)。病理活检组织ARMS法突变检出率为57.1%(12/21),明显高于Sanger测序法的23.8%(5/21),差异有统计学意义(P<0.05);石蜡包埋组织ARMS法和Sanger测序法突变检出率分别为49.3%(37/75)和34.7%(26/75),两者比较差异无统计学意义(P>0.05)。女性患者EGFR基因突变检出率68.0%高于男性患者的28.8%,未吸烟患者突变检出率65.5%高于吸烟患者的27.7%,腺癌患者突变检出率62.3%高于鳞癌患者的26.8%,差异均有统计学意义(均P<0.05);但EGFR基因突变检出率和有无淋巴结转移及年龄比较差异均无统计学意义(均P>0.05)。结论EGFR基因19、21号外显子突变好发于女性、未吸烟患者和腺癌患者,Sanger测序法对大组织样本及未知突变检测更有优势,ARMS法对病理活检、微小样本及要求灵敏度高的样本检测更为适合,结合2种方法检测结果更为全面可靠。
非小细胞肺癌 表皮生长因子受体 基因突变 外显子 Sanger测序 ARMS法
【Key words】Non-small lung cancerEpidermal growth receptorGene mutation Exon Sanger sequencing Amplification refractory mutation system assay
肺癌是我国发病率及病死率最高的恶性肿瘤之一,其中80%以上为非小细胞肺癌(non-small cell lung cancer,NSCLC),患者5年生存率不足20%[1]。研究发现表皮生长因子受体(epidermal growth factor receptor,EGFR)酪氨酸激酶结构域存在突变的肺癌患者对靶向药物具有高度敏感性[2]。EGFR基因突变是临床药物治疗选择的一个重要因素[3-4],突变主要集中在EGFR基因19、21号外显子上。晚期肺癌患者主要采用放疗加化疗加靶向药物治疗模式[5],因而需要明确EGFR基因突变类型及其相关临床病理学特征以便筛选出受益的优势人群。本文通过Sanger测序法和突变扩增阻滞系统(amplification refractory mutation system,ARMS)法对102例NSCLC患者组织标本进行EGFR基因突变检测,比较不同肿瘤组织标本的EGFR基因中19、21号外显子突变情况及其临床病理学特征,为临床选择最佳治疗方案提供实验依据。
1 对象和方法
1.1 对象 收集2013年10月至2015年5月在本院就诊且经病理组织学确诊的NSCLC患者肺部原发或转移癌标本102例,其中男52例,女50例;年龄36~85岁,中位年龄65岁;石蜡包埋组织75例,病理活检标本27例;病理分型依据肺癌WHO分型标准:腺癌61例,鳞癌41例;淋巴结转移87例,未转移15例。样本入组标准:5~10μm石蜡切片要求不少于10片,石蜡块中组织区域占30%及以上,新鲜组织细胞不少于0.5g。
1.2 主要仪器及试剂 Mastercycler nexus梯度PCR仪(德国Eppendorf公司),ABI3500测序仪(美国ABI公司)、ABI7500实时荧光定量PCR仪(美国ABI公司)、日立双光束紫外分光光度计U-2900(日本日立公司)、石蜡组织DNA提取试剂盒(56404)(QIAamp DNA FFPE Tissue Kit)(德国Qiagen公司),人类EGFR基因3种突变检测试剂盒ADx-EG04(荧光PCR法)(厦门艾德生物公司),2×Taq PCR Master Mix扩增试剂盒(KT-201)(北京天根生化科技有限公司),琼脂糖凝胶DNA回收试剂盒普通离心柱型(DP209-02)(北京天根生化科技有限公司),Bigdye terminator V3.1(美国ABI公司),扩增合成引物(上海生工生物工程有限公司)。
1.3 研究方法 石蜡或新鲜组织装入1.5ml EP管,分别按照石蜡组织DNA提取试剂盒和新鲜组织DNA提取试剂盒说明书操作提取DNA,紫外分光光度计检测DNA浓度,提取的目的DNA在-20℃保存。
1.3.1 Sanger测序法 采用2×Taq PCR Master Mix试剂盒分别扩增EGFR基因19、21号外显子,引物扩增序列设计见表1,由上海生工生物工程有限公司合成。PCR扩增反应体积为50μl,包括目的DNA 2μl、2×PCR反应缓冲液25μl、正反向引物(10μM)各2μl,ddH2O补足至50μl。循环参数:94℃预变性5min;94℃30s,55℃30s,72℃1min,共35个循环;72℃延伸5min。反应结束后,取50μl扩增后产物进行1.5%琼脂糖凝胶电泳,切胶回收PCR扩增产物,于-20℃保存,以进行后续的操作。采用Bigdye terminator V3.1试剂盒进行测序反应,反应总体积为 5μl,Bigdye 0.2μl,5×Bigdye sequence buffer 1μl,正反向引物0.5μl,PCR纯化产物 1μl,用ddH2O补足到5μl。测序反应程序为96℃ 1min;96℃10s,50℃5s,60℃4min,共30个循环;60℃保温。测序产物纯化程序为2μl 125mM EDTA(pH 8.0)加入15μl无水乙醇,避光4℃静置15min,4℃3 800g离心30min,倒置安放离心1min,加入70%无水乙醇70μl,离心15min,重新洗1次离心8min,倒置离心5s,静置安放,待乙醇蒸发干净。加入10μl HiDi溶解DNA,95℃变性5min,4℃10min,在ABI3500基因测序仪上进行双向测序,测序结果用Blast软件对比分析。在高质量测序峰图的前提下进行结果判读,野生型为高质量单峰;突变型为测序峰图中出现套峰或双峰,序列出现缺失或错义。

表1 EGFR基因19、21号外显子PCR扩增引物序列
1.3.2 ARMS法 将收集的样本根据人类EGFR基因突变检测试剂盒(荧光PCR法)说明书进行突变检测,每次检测程序都作阳性和阴性质控对照。每个8连管孔中待测样本DNA浓度调整为:石蜡包埋切片样本2~3ng/μl(即每单个反应管添加DNA量为10~15ng),病理活检组织0.4~1ng/μl(即每单个反应管添加DNA量为2~5ng),样品DNA使用TE(pH 8.0)稀释,ABI7500实时荧光定量PCR仪进行检测。PCR扩增参数为:95℃预变性5min;95℃25s,64℃20s,72℃20s,共15个循环;93℃25s,60℃35s,72℃20s,共26个循环。根据试剂说明书对检测结果进行判断:突变检测管中FAM信号扩增曲线的Ct值<29,则样品为阳性;若FAM扩增信号曲线的Ct值≥29,则样品为阴性。
1.3.3 EGFR基因突变与临床病理特征的关系 以ARMS法检测结果为前提,对EGFR基因突变与临床病理特征(包括性别、年龄、有无吸烟、组织类型及有无淋巴结转移)的关系进行分析。
1.4 统计学处理 采用SPSS 13.0统计软件。计数资料组间比较采用χ2检验或配对χ2检验。
2 结果
2.1 2种方法突变检出情况比较 ARMS法成功检测102例标本,其中49例(48.0%)为EGFR突变;Sanger测序法成功检测96例标本,其中31例(32.3%)为EGFR突变;ARMS法突变检出率高于Sanger测序法,两者比较差异有统计学意义(P<0.05),见表2。ARMS法检出的49例突变标本中,29例为19号外显子缺失突变,20例为21号外显子的错义突变,见图1。Sanger测序法检出的31例突变标本中,17例为19号外显子缺失突变,14例为21号外显子错义突变,见图2。

表2 2种方法检测EGFE基因19、21号外显子突变结果比较
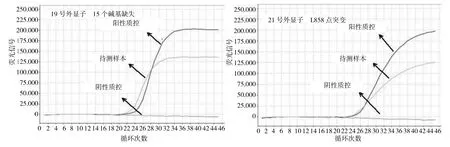
图1 ARMS法检测EGFR基因19、21号外显子突变结果
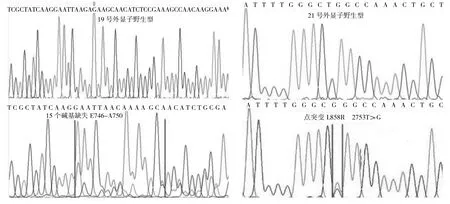
图2 Sanger测序法检测EGFR基因19、21号外显子突变结果
2.2 2种方法检测不同组织标本突变检出情况比较为较好比较2种方法,排除Sanger测序法测序失败的6例病理活检标本。对病理活检标本的检测结果显示,ARMS法突变检出率为57.1%(12/21),明显高于Sanger测序法的23.8%(5/21),差异有统计学意义(χ2=4.842,P<0.05);对石蜡包埋组织的检测结果显示,ARMS法突变检出率为49.3%(37/75),Sanger测序法突变检出率为34.7%(26/75),两者比较差异无统计学意义(χ2=3.311,P>0.05)。
2.3 EGFR基因突变检出率与临床病理特征的关系女性患者EGFR基因突变检出率明显高于男性患者,未吸烟患者EGFR基因突变检出率明显高于吸烟患者,腺癌患者EGFR基因突变检出率明显高于鳞癌患者,差异均有统计学意义(均P<0.05);但EGFR基因突变检出率和有无淋巴结转移及年龄比较差异均无统计学意义(均P>0.05),见表3。

表3 EGFR基因突变检出率与临床病理特征关系分析
3 讨论
本研究结果显示Sanger测序法检测出31例发生EGFR基因突变,突变检出率为32.3%;ARMS法检测出49例发生EGFR基因突变,突变检出率为48.0%。EGFR基因突变好发于女性、未吸烟患者和腺癌患者,这与孙孟红等[6]报道结果一致。董刚强等[7]对394例肺癌EGFR基因突变情况进行检测,结果发现EGFR基因突变主要发生在19和21号外显子,以19号外显子的del-E746-A750缺失突变和21号外显子的L858R点突变为最常见的突变形式,其中19号外显子del-E746-A750缺失突变约占其总突变率的74%,21号外显子的L858R点突变约占其总突变的94.4%,而19号外显子的del-L747-P753insS突变和21号外显子的L861Q突变仅占各自突变的2.7%和3.7%。本研究采用Sanger测序法和ARMS法均只检测到19号外显子del-E746-A750缺失突变和21号外显子L858R点突变,这可能与检测样本量偏少和其他类型突变发生率本身较低有关。
Sanger测序法被认为是检测EGFR基因突变的金标准,其优势在于对已知和未知突变都有良好的检测重复性,其局限是灵敏度低,要求突变细胞不低于总标本的20%以上,操作耗时长,结果判读复杂[8],并且测序结果判读依赖于测序峰中是否出现突变波峰。在获得目的片段时,目的基因的突变与非突变区域都被扩增,因此当组织中肿瘤细胞少,或突变肿瘤克隆少时,引起突变峰低甚至无法检测,导致结果假阴性。ARMS法其优势在于检测灵敏度高,检测周期短,操作简便,尤其适合微小组织标本[9];其局限性在于检测成本高,只针对已知突变进行检测。
2种方法对不同标本类型检测结果来看,Sanger测序法和ARMS法对于含有效肿瘤组织标本的检测有较好的检测一致性,而对于小的活检标本,ARMS法检测优势更为明显。本研究中,Sanger测序法对6例病理活检标本检测失败,分析原因可能是:(1)对标本处理及获得目的片段过程中引起标本DNA片段化,其扩增长度低于测序检测要求;(2)肿瘤取材越少对肿瘤整体基因代表性越差,因而肿瘤细胞比例较低的活检标本无法达到测序检测下限。为了得到较为准确的结果,需选用灵敏度较高、对标本质量要求低的检测方法。赵婧雅等[10]采用Sanger测序法和ARMS法对NSCLC活检小标本EGFR基因进行检测,发现Sanger测序法突变检出率低,且检出结果对临床TKI疗效可靠性下降,因此对活检标本应选择检出率及灵敏度更高的ARMS法。
综上所述,比较NSCLC的EGFR基因突变的2种检测方法,Sanger测序法对大组织样本及未知突变检测更有优势,ARMS法对病理活检、微小样本及要求灵敏度高的样本检测更为适合,2种方法结合检测结果更为可靠。
[1]Chen W,Zheng R,Baade P D,et al.Cancer statistics in China, 2015[J].CA Cancer J Clin,2016,66(2):115-132.
[2]Tanaka T,Matsuoka M,Sutani A,et al.Frequency of and vari-ables associated with the EGFR mutation and its subtypes[J].Int J Cancer,2010,126(3):651-655.doi:10.1002/ijc.24746.
[3]Douillard J Y,Shepherd F A,Hirsh V,et al.Molecular predictors of outcome with gefitinib and docetaxel in previously treated non-small-cell lung cancer:Data from the randomized phase m INTEREST trial[J].J Clin Oncol,2010,28(5):744-752.doi:10. 1200/JCO.2009.24.3030.
[4]Maemondo M,Inoue A,Kobayashi K,et al.Gefitinib or chemotherapyfor non-small-cell lung cancer with mutated EGFR[J].N Engl JMed,2010,362(25):2380-2388.doi:10.1056/NEJMoa0909530.
[5]郑国平,王思本,李岱,等.适形调强放疗联合EGFR-TKI治疗晚期非小细胞肺癌的临床观察[J].浙江医学,2015,37(6):473-476.
[6]孙孟红,杨飞,沈磊,等.非小细胞肺癌中表皮生长因子受体基因突变直接测序分析及其与临床病理特征的相关性[J].中华病理学杂志, 2011,40(10):655-659.
[7]董刚强,黄进肃,黄建,等.肺癌靶向治疗研究与我国肺癌的EGFR基因突变概况[J].肿瘤,2005,25(6):625-628.
[8] 张静,高洁,梁智勇,等.非小细胞肺癌表皮生长因子受体基因突变检测的经验总结分析[J].中华病理学杂志,2011,40(10):712-714.
[9]孙宇晶,刘畅,龙彦,等.ADx-ARMS法与PCR-Sanger测序法检测非小细胞肺癌微小标本EGFR基因突变的比较[J].临床检验杂志, 2014,32(7):485-489.
[10]赵婧雅,王笑影,曾海英,等.直接测序法与蝎形探针扩增阻滞突变系统检测肺癌小活检标本EGFR因突变的比较[J].中国癌症杂志, 2013,23(2):106-113.
Detection of EGFR gene 19 and 21 exons mutations in non-small cell lung cancer by Sanger sequencing versus amplification refractory mutation system assay
ObjectiveTo compare Sanger sequencing and amplification refractory mutation system(ARMS)assay in detection of EGFR gene 19 and 21 exons mutations in non-small cell lung cancer(NSCLC).MethodsOne hundred and two NSCLC specimens,including 75 paraffin tissue samples and 27 biopsy specimens were collected.Mutations of EGFR gene 19 and 21 exons were detected by Sanger sequencing and ARMS assay.The association of gene mutations with clinicopathological features of NSCLC was analyzed.ResultsThe mutation rates of ARMS assay and Sanger sequencing were 48.0%(49/102)and 32.3%(31/96),respectively(P<0.05).In biopsy tissue samples,the mutation rate detected by ARMS(57.1%,12/21)was significantly higher than that by Sanger sequencing(23.8%,5/21,P<0.05),however,there was no significant difference in mutation rate of paraffin embedded specimens between two methods(49.3%,37/75 vs 34.7%,26/75,P>0.05).According to ARMS results,the EGFR mutation rate was higer in female patients(68.0%)than in male patients(28.8%),in non-smoking patients (65.5%)higher than that in smoking patients(27.7%),in adenocarcinomas(62.3%)higher than that in squamous cell carcinomas (26.8%)(allP<0.05).The EGFR mutation rate was not correlated with the age and lymphatic metastasis of patients(allP>0.05).ConclusionThe mutation rates of EGFR 19 and 21 exons were higher in NSCLC patients,especially in non-smoking,female and adenocarinoma patients.Sanger sequencing method has more advantages for large tissue samples,and the ARMS method is more suitable for biopsy and small samples.Therefore,the combination of two methods may provide more reliable and comprehensive test results.

2016-09-09)
(本文编辑:陈丽)
315040 宁波市鄞州人民医院中心实验室
王建华,E-mail:wjhua530@163.com

