长牡蛎精子超低温冷冻后超微结构损伤研究
韩龙江刘清华许 飞温海深李 军
(1. 中国科学院海洋研究所, 中科院实验海洋生物学重点实验室,青岛 266071; 2. 中国海洋大学, 青岛 266009; 3. 海洋生态养殖技术国家地方联合工程实验室, 青岛 266071; 4. 青岛海洋科学与技术国家实验室,
海洋生物学与生物技术功能实验室 青岛 266237)
长牡蛎精子超低温冷冻后超微结构损伤研究
韩龙江1,2刘清华1,3,4许 飞1,3,4温海深2李 军1,3,4
(1. 中国科学院海洋研究所, 中科院实验海洋生物学重点实验室,青岛 266071; 2. 中国海洋大学, 青岛 266009; 3. 海洋生态养殖技术国家地方联合工程实验室, 青岛 266071; 4. 青岛海洋科学与技术国家实验室,
海洋生物学与生物技术功能实验室 青岛 266237)
采用程序降温仪分步降温冷冻保存长牡蛎(Crassostrea gigas)精液, 并用扫描电镜、透射电镜研究了精子的超微结构损伤。超低温冷冻保存后长牡蛎精子的运动率、受精率及孵化率与鲜精无显著差异。鲜精中84.5%的精子形态结构正常, 冻精中73%的精子形态结构正常。形态结构正常的精子表现为顶体、质膜、线粒体与鞭毛结构完整、染色质形状规则, 顶体、线粒体及中心粒结构正常, 鞭毛形态完整、微管结构清晰; 形态结构异常的精子表现为顶体脱落、解体, 精子头部质膜膨胀、破裂、染色质肿胀、破裂、解体, 线粒体移位、脱落、膨胀, 嵴退化或消失, 鞭毛弯折、断裂, 微管解聚。结果显示, 以10% DMSO为抗冻保护剂, HBSS溶液为稀释液, 1∶4的稀释比例, 添加海藻糖, 采用分步降温法冷冻保存, 对长牡蛎精子具有较好的抗冻保护作用, 合适的冻存方法可以有效的保护太平洋牡蛎精子冷冻过程中结构损伤。研究有助于长牡蛎种质资源的收集保存及应用。
长牡蛎; 精子; 扫描电镜; 透射电镜; 超微结构
检测精子超低温冷冻保存前后超微结构损伤已被应用于真鲷(Pagrosomus major)[1]、 中华鲟(Acipenser sinensis)[2]、大黄鱼(Pseudosciaena crocea)[3]、太平洋牡蛎(Crassostrea gigas)[4]、 虾夷扇贝(Patinopecten yessoensis)[5]、太平洋鳕(Gadus macrocephalus)[6]、香港巨牡蛎(Crassostrea hongkongensis)[7]等鱼、贝类的精子质量检测中。研究发现,精子超低温冷冻保存不可避免的会造成其超微结构的损伤, 而精子超微结构的完整与否又直接与精子活力相联系, 进而影响精子的受精能力。因此,研究精子超低温冷冻保存前后超微结构损伤变化情况对于精子冷冻保存方法的改善具有重要意义。长牡蛎(Crassostrea gigas)主要分布于中国大陆、中国台湾地区、韩国等, 常栖息在潮间带及浅海的岩礁海底, 在我国养殖范围十分广泛, 经济价值较高。最近一段时间, 随着我国海水养殖业的不断发展, 长牡蛎养殖规模呈不断增大趋势, 累代养殖与近亲交配的加剧, 不可避免地造成了长牡蛎种质退化的现象, 开展长牡蛎精液的超低温冷冻保存技术的研究具有重要意义[8,9]。有关长牡蛎精子的超低温冻存的研究已有报道, 如李赟等[10]以渗透性抗冻保护剂超低温冻存太平洋牡蛎精子, 复苏后得到了较高的运动率, 并通过电子显微镜初步观察了其超微结构的变化; Dong等[11,12]在以2%聚乙二醇(PEG)及两种不同抗冻保护剂间的组合为抗冻剂冷冻保存太平洋牡蛎, 获得了最高的运动率及受精率。但上述报道的降温过程多以液氮面以上一定高度来控制, 稳定性差, 复温解冻后精子运动率不高, 其精子超微架构损伤较为严重, 以程序降温仪精准控制降温程序超低温冷冻保存长牡蛎精子, 并采用扫描电镜和透射电镜观察其超微结构损伤的研究尚未见报道。本研究以无钙HBSS为稀释液, 10% DMSO为抗冻剂, 添加0.45 mol/L海藻糖, 程序降温仪精准控制分步降温超低温冷冻保存长牡蛎精子, 采用扫描电镜、透射电镜技术研究了长牡蛎精子冻存前后超微结构损伤情况, 探索超低温冻存及解冻过程对长牡蛎精子损伤情况, 以期为长牡蛎精子超低温冻存技术的改进及冻精质量的评价提供参考。
1 材料与方法
1.1 实验材料
实验所用的长牡蛎由中国科学院海洋研究所海洋贝类增养殖与生物技术实验室提供, 提前一周暂养于水族楼循环水系统的水族箱中, 暂养期间水温控制在16—18℃, 每天上午10时换水一次, 实验时选择性腺饱满的雄性长牡蛎(壳高8.8—10.5 cm,壳宽6.1—7.0 cm)通过人工解剖取精液, 解剖过程中尽量避免性腺组织的混入, 纱网过滤后放入50 mL离心管里, 显微镜观察精子活力良好(运动率≥80%)置于4℃冰箱中用作精子超低温冷冻保存。
1.2 实验方法
精子的超低温冻存及解冻将精液稀释液即无钙HBSS溶液[13]与抗冻剂DMSO混合配制成抗冻液(DMSO占10%), 长牡蛎精液和抗冻液按1∶4比例加入到1.8 mL冻存管中, 并添加0.45 mol/L的海藻糖, 轻轻上下颠倒数次使其充分混匀后置于4℃的冰箱中预冷20min。在此期间, 打开程序降温仪,设定好降温程序(0℃开始, -15℃/min降温至-60℃,停留120s后以-20℃/min降温至-150℃, 停留300s),待程序降温仪运行稳定后, 迅速将预冷过的冻存管装入程序降温仪中, 开始降温。程序运行结束后,采用37℃水浴锅水浴解冻, 解冻期间用镊子轻轻摇晃冻存管使其受热均匀, 解冻后检测冻精活力。
鲜精与冻精的活力测定按刘清华等[14]的方法检测新鲜精液和解冻复苏后精子活力, 具体操作为: 载玻片上滴加40 μL混有5% BSA的新鲜过滤灭菌海水, 采用灭菌后的牙签轻轻沾取少量精液与其混匀, 置于显微镜下, 通过计算机辅助精液分析系统(Computer-assisted sperm analysis, CASA)采集6个视野的视频图像, 统计运动率, 精液运动率为一个视野内快速运动精子数目占全部精子数目的百分比。实验设3个重复。
受精率和孵化率的测定分别取鲜精、冷冻保存解冻精子与新鲜解剖的长牡蛎卵子人工授精, 测定其受精率和孵化率[15], 实验设3个重复。
鲜精与冻精的超微结构观察扫描电镜(Scanning electron microscope, SEM)观察: 电镜制片与观察在青岛大学医学院完成, 具体操作为: 取鲜精与刚解冻的精液, 用新鲜配制的电镜缓冲液配成2.5%的戊二醛避光条件下固定1d (4℃), 采用磷酸缓冲液(0.2 mol/L, pH=7.4)漂洗数次后用1%新鲜配制的锇酸溶液4℃固定2h, 经梯度酒精脱水后采用醋酸异戊脂置换, 最后离子镀膜制成成片, 采用日本电子株式会社(JEOL公司)的JSM-840型扫描电镜下观察、拍照。
透射电镜(Transmission electron microscopy, TEM)观察: 取鲜精与冻融精液, 用新鲜配制的电镜缓冲液配成的2.5%的戊二醛(0.2 mol/L, pH=7.4)避光条件下进行前固定, 然后用1%新鲜配制的锇酸溶液4℃固定2h, 依次采用不同梯度酒精脱水, Epon-812渗透包埋, 超薄切片机切片, 醋酸铀和柠檬酸铅双重染色后制成成片, 置于透射电子显微镜(日立H-7000)下观察、拍照。
1.3 数据处理
数据采用SPSS17.0进行处理, 并对数据进行单因素方差分析(ANOVA), 显著性水平检验采用Duncan氏比较分析, 所有结果均以平均值±标准差的形式进行表示, P<0.05表示差异显著。
2 结果
2.1 长牡蛎鲜精及冻精的运动率、受精率和孵化率
鲜精和解冻后长牡蛎精子运动率、受精率和孵化率结果见表 1。结果表明, 鲜精与解冻后精子的活力相比差异不显著(P>0.05)。
2.2 长牡蛎鲜精及冻精的超微结构
扫描电子显微镜观察结果表明, 鲜精中形态结构异常的精子占全部精子数量的15.5%, 形态结构正常的精子占全部精子占84.5%; 解冻后精子中形态结构异常的精子占全部精子数量的27%, 形态结构正常的精子占全部精子的73%。

表 1 长牡蛎鲜精及冻精的运动率、受精率及孵化率 (n=3, X± SD)Tab. 1 Motility, fertilization rate and hatching rate of fresh sperm and frozen-thawed sperm of Crassostrea gigas (n=3, X±SD)
长牡蛎精子冷冻前后扫描电镜超微结构
由图 1可知, 长牡蛎精子超微结构主要由头部和尾部两部分组成, 精子全长约32 μm, 颈部不明显。头部呈近似圆形, 前端有一突出结构为顶体, 头部下方线粒体紧邻头部很清晰, 呈圆形, 4个紧密排列,围绕在鞭毛周围, 精子的鞭毛细长, 近头部较粗远端渐细, 主段均匀, 尾端逐渐变细。
超低温冷冻保存解冻后对长牡蛎精子超微结构的损伤主要表现在鞭毛脱落、弯折(图 2A), 顶体直接消失, 质膜皱缩, 鞭毛脱落(图 2B); 线粒体变形、肿胀, 移位脱落, 头部表面膜凹凸不平(图 2C)精子头部细胞膜破损凹陷, 质膜间断破裂、脱落,线粒体外膜膨胀、破裂, 内容物流出, 尾部鞭毛肿胀(图 2D)。
长牡蛎精子冷冻前后透射电镜超微结构
由图 3可知, 长牡蛎精子超微结构主要由头部和尾部组成。头部结构主要包含顶体、亚顶体腔、染色质、囊泡、中心体及线粒体等结构, 鞭毛由质膜及微管组成(图 3A、图 3B), 头部的主要部分由染色质组成, 中心体由近端中心粒和远端中心粒垂直排列构成, 近端中心粒靠近染色质, 远端中心粒靠近鞭毛向后延伸出轴丝, 两中心粒呈垂直排列, 囊泡镶嵌于染色质中(图 3B), 4个线粒体呈环形排列,内有大量致密嵴状结构, 中心粒位于4个线粒体中间(图 3C), 精子尾部为细长的鞭毛结构, 呈现典型的“9+2”微管轴丝结构, 外面包有质膜结构, 轴丝由双连体和中央微管组成, 9组双连体微管均匀分布在外面, 一组中央微管位于中间, 二联体微管致密,结构清晰可辨(图 3D)。电镜观察显示, 鲜精形态结构正常的精子表现为染色质结构完整、无破裂变形现象, 质膜无膨胀破裂, 中心粒结构正常, 线粒体形态完整、嵴较发达, 鞭毛结构完整、清晰(图 3)。
透射电镜形态结构异常的精子表现在质膜、核内部结构、线粒体、染色质和鞭毛等结构。超低温冷冻对部分长牡贩精子造成了严重的影响, 具体表现为头部染色质的破裂变形, 核变形、核内空泡增多, 甚至整体分解, 质膜破裂消失, 头部顶体处质膜破损, 头部核质膜破损缺失, 核膜间断或局部破裂、脱落, 裙皱增多且膜的连续性遭到破坏, 线粒体肿胀、大小不一(图 4A), 顶体结构受损伤、变松散、解体, 质膜肿胀, 头部质膜与内部间隙加大,线粒体破裂变形, 鞘外质膜缺损, 线粒体膜不完整,内部嵴结构损伤、疏松, 球形的线粒体缺失、结构松散甚至脱落, 内容物流出, 尾部断裂及中心粒结构消失等(图 4B), 长牡蛎头部顶体内含多种酶类,对于精子入卵具有重要作用, 顶体结构的损伤会对精子功能产生一定的影响。在超低温冷冻过程中发现的顶体结构的损伤甚至缺失, 表明超低温冷冻过程一定程度上会对对精子产生损伤, 进而影响其生理功能。超微结构观察发现, 超低温冷冻过程对长牡蛎精子头部造成的损伤主要表现在顶体松散、变形, 染色质缺失, 核顶变形、染色质侧面出现凹陷, 核表面不均勾, 内部结构弥散, 线粒体部分或全部脱落消失(图 4C), 冷冻对精子尾部损伤主要表现为: 精子尾部肿胀变形, 形状不规则, 变形严重, 二联微管解聚、弥散(图 4D)。

图 1 长牡蛎鲜精扫描电镜观察Fig. 1 The ultrastructure of fresh spermatozoa of Crassostrea gigas by SEMA. 鲜精整体扫描电镜照片; B、D. 单个精子扫描电镜图, 示精子头部近似圆形, 顶体位于头部前方, 部分线粒体整齐排列, 鞭毛细长; C. 示精子头部结构, 顶体、头部、线粒体及鞭毛依次排列; h: 头; t: 鞭毛; a: 顶体; mi: 线粒体A. Fresh sperm of SEM; B, D. Single sperm of SEM, The sperm head approximate circular, acrosome located in the front of head, Some mitochondria ranked neatly, flagella slender; C. The structure of sperm head, head, acrosome mitochondria and flagella lined. h: head; t: flagellum; a: acrosome; mi: mitochondria
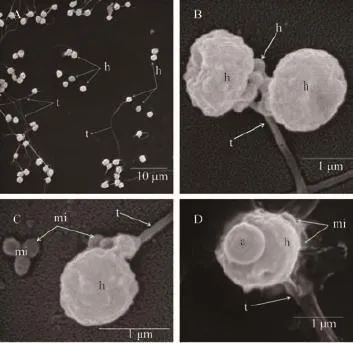
图 2 长牡蛎冻精扫描电镜观察Fig. 2 The ultrastructure of cryopreserved spermatozoa of Crassostrea gigas by SEMA. 冻精整体扫描电镜照片, 示鞭毛脱落、折断; B. 两个精子扫描电镜图, 示头部顶体脱落, 质膜皱缩变形; C、D. 单个精子扫描电镜图, 示部分线粒体脱落、破损, 质膜皱缩, 胞膜冻裂, 细胞液外流; h: 头; a: 顶体; t: 鞭毛; mi: 线粒体A. The whole frozen sperm of SEM, flagellum fall off, bend; B. Two frozen sperm of SEM, acrosome fall off head, plasmalemma collapse; C, D. Single frozen sperm of SEM, some of mitochon dria fall off, damaged, plasmalemma plasmolysis, cell membrane frost cleft, cytosol outflow; h: head; a: acrosome; t: flagellum; mi: mitochondria
3 讨论
3.1 长牡蛎精子超微结构特点
电子显微镜观察长牡蛎精子冷冻前后的形态和超微结构发现, 长牡蛎精子主要由头部、中段和尾部组成。头部近似圆形, 与大多数鱼类和贝类精子相似[11,16]。头部顶端有顶体, 向后依次为亚顶体腔、染色质、线粒体、中心粒和鞭毛。精子中段不明显, 由4个线粒体围绕中心粒组成, 与香港牡蛎等精子的超微结构相似[7]。超微结构观察发现, 牡蛎精子尾部鞭毛结构细长, 其长度与几种常见贝类精子长度基本相似, 但与鸟类、鱼类和哺乳类精子鞭毛长度相差较大[17,18]。鞭毛轴丝呈典型的“9+2”结构, 与香港巨牡蛎、皱纹盘鲍(Haliotis discus hannai)和虾夷扇贝等精子相同[5,7,19], 解冻后精子中有一定比例的精子形态结构发生了不同程度的损伤,主要损伤表现为顶体全部或部分消失, 染色质破裂损伤, 甚至整体分解, 核变形、质膜破裂损伤, 线粒体结构弥散, 内嵴结构破裂, 膜内物质外流, 嵴疏松变形, 甚至脱落。鞭毛肿胀、弯折, 精子鞭毛中间位置膨胀、断裂, 二联微管解聚等。扫描电镜和透射电镜能从精子超微结构的变化程度来表示超低温冷冻前后精子结构上的变化。长牡蛎精子冻融后超微结构观察发现部分精子顶体结构破裂甚至缺失、精子细胞膜肿胀甚至破裂; 线粒体破裂, 体内嵴结构变形, 膜结构破损肿胀变形, 内容物流出;鞭毛弯折、断裂[18]。与其他海洋动物精子超低温冷冻过程中超微结构的损伤基本一致。

图 3 长牡蛎鲜精透射电镜观察Fig. 3 The ultrastructure of fresh spermatozoa of Crassostrea gigas by TEMA. 鲜精纵切, 示单个精子整体纵切; B. 鲜精头部纵切, 示鲜精头部超微结构; C. 鲜精横切, 示线粒体超微结构; D. 鲜精鞭毛横切, 示鞭毛典型“9+2”结构; a: 顶体; b: 亚顶体腔; c: 中心体; t:鞭毛; cm:中央微管; dm: 双连体; pm: 质膜; mi: 线粒体; nu: 核A. Fresh sperm rip cutting; B. Fresh sperm head rip cutting, show ultrastructure; C. Fresh sperm rip cutting, show mitochondria ultrastructure; D. Fresh sperm flagellum crosscut, show “9+2”structure. a: acrosome; b: cavity; c: centrosome; t: flagellum; cm: central microtubules; dm: double conjoined; pm: plasma membrane; mi: mitochondria; nu: nucleus
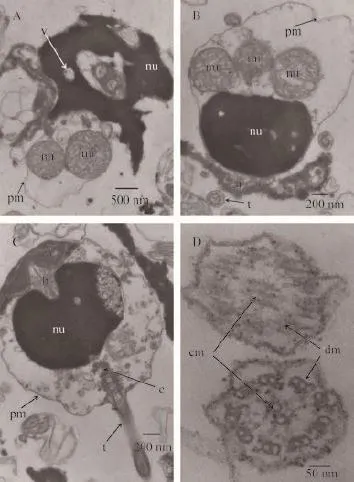
图 4 长牡蛎冻精透射电镜观察Fig. 4 The ultrastructure of fresh spermatozoa of Crassostrea gigas by TEMA. 冻精纵切, 示胞膜破裂, 染色质破损、变形, 鞭毛脱落; B. 冻精斜切, 示质膜肿胀, 顶体解体, 线粒体损伤; C. 鲜精纵切, 示线粒体脱落, 染色质破损; D. 冻精鞭毛横切, 下部鞭毛示精子典型“9+2”, 上部鞭毛示微管解聚, 膜皱缩变形; a: 顶体; b: 亚顶体腔; c: 中心体; t: 鞭毛; cm: 中央微管; dm: 双连体; pm: 质膜; mi: 线粒体; nu: 核A. Frozen sperm rip cutting show membrane rupture, chromatin damaged, flagellum fall off; B. Frozen sperm bevel, show plasma membrane swollen, disintegration of acrosome, mitochondria damage; C. Frozen sperm rip cutting, show mitochondrial loss, chromatin damaged; D. Frozen sperm flagellum crosscut, show“9+2” structure. a: acrosome; b: cavity; c: centrosome; t: flagellum; cm: central microtubules; dm: double conjoined; pm: plasma membrane; mi: mitochondria; nu: nucleus
3.2 精子结构损伤与精子功能之间的关系
一般认为, 冻精结构改变的主要原因是细胞内冰晶造成的损伤[20,21]。虽然抗冻保护剂对精子超低温冷冻过程具有一定的保护作用, 在一定程度上能够有效避免精子超微结构的损伤, 但仍有部分精不可避免的会发生结构上的变化, 影响其生理功能,最终体现为影响精卵识别与受精[22]。在实验过程中发现精子超微结构的变化主要有: 精子内部染色质的变化, 如染色质弥散或肿胀[23,24]; 细胞器的损伤, 如线粒体消失、破损或内嵴损伤[25]; 精子质膜的变化, 如破裂、消失或肿胀; 鞭毛结构的损伤, 如鞭毛肿胀、轴丝断裂、微管解聚等[26]。牡蛎精子的向前运动主要是由尾部鞭毛的摆动完成, 而精子鞭毛完成这一功能是由线粒体来提供能量的, 线粒体是大多数动物细胞主要的的供能细胞器。超微结构观察发现, 解冻后精子中有部分精子线粒体受损伤, 其生理功能降低甚至丧失, 表现为精子活力下降甚至完全失活, 长牡蛎精子线粒体及鞭毛是精子完成运动功能主要结构, 它们的损伤不可避免地会造成精子功能的下降, 进而影响精子入卵[27]。精子内部存在众多由膜包被而成的细胞器, 发挥着重要的生理功能, 由于精子内部膜结构主要有磷脂双分子层和镶嵌在其中的蛋白质组成, 其结构的不稳定性也决定了其对外界温度变化比较敏感, 加之冷冻、复温过程中冰晶的产生, 致使其在超低温冷冻保存过程中极易受到损伤, 精子冷冻及复温过程中细胞膜的损伤, 破坏了精子正常的生理结构, 不可避免地造成精子功能的紊乱。与之相反的, 精子的非膜性结构和细胞核染色质等结构在超低温冷冻过程中抗冻能力较强。目前大部分精子超低温冷冻保存研究, 不同学者在研究不同物种精子冻存过程中采用了不同的冻存方法, 但超低温冻存过程对精子超微结构损伤主要集中在精子相对脆弱的膜系统上[28]。章龙珍等[29]在鲟鱼精子超低温冻存研究中发现, 超低温冻存对精子超微结构的损伤主要集中在精子细胞膜结构的破损, 从而改变了精子细胞内部特有的相对稳定的内环境, 精子细胞膜上膜脂发生晶格化的一种现象, 影响了精子细胞的功能,最终影响了精子活力, 致使其受精能力的下降。程顺等[3]以Cortland溶液为稀释液, 10% DMSO为抗冻剂冷冻大黄鱼精子过程中发现, 大黄鱼精子超低温冷冻及水浴复温过程中, 鞭毛轴丝内结构并未发生明显改变, 精子冷冻保存过程并未对轴丝结构产生大的影响。张莲蕾等[1]对真鲷精子冷冻的研究中发现, 复苏后的冻融精子中, 超微结构观察发现70%以上的精子具有相对完整的线粒体结构和完整且均匀的精子细胞膜结构, 剩余精子细胞不同程度上存在结构的变化和损伤, 并指出真鲷精子超微结构的受损, 尤其是相关功能蛋白结构的变化时导致精子活力及生理机能变化的重要原因。李赟等[10]以10% DMSO为抗冻剂, 采用距液氮面以上不同高度的方法控制降温速率冷冻保存太平洋牡蛎精子,并采用电子显微镜观察其超微结构损伤情况, 研究表明, 在解冻后的精子中有一部分超微结构发生了不同程度的变化, 超低温冷冻和升温解冻, 对牡蛎部分精子的膜结构损伤严重, 导致精子活力和受精能力下降。超低温冷冻保存也会对鞭毛造成一些不可逆的伤害, 破坏了许多功能蛋白的作用, 对精子尾部的损伤造成轴丝结构破坏, 从引起精子运动功能的丧失, 线粒体和鞭毛在精子运动过程中主要起着供能和提供向前动力的作用, 线粒体通过消耗精子细胞内部的ATP为鞭毛摆动提供能量, 鞭毛摆动给精子提供了一种向前的动力[30]。研究表明, 大部分鱼类精子在性腺中是不运动的, 只有当精子收到外界(渗透压、离子、蛋白质)的刺激后, 精子才能激活, 鞭毛开始摆动并提供一种向前的动力[31]。于海涛等[32]以10% DMSO为抗冻剂, 分段冷冻法保存红鳍东方鲀[Fugu rubripes (Temminck et Schlegel)]精子, 电镜观察发现鞭毛断裂或被膜膨胀脱落, 导致了精子活力下降。因此在精子超低温冷冻保存过程中, 我们多选择那些毒性低、渗透性较好的抗冻保护剂来保护精子冻存过程中的损伤[33,34]。韩龙江等[6]在超低温冷冻太平洋鳕精子时发现, 超低温冷冻及复温过程对精子鞭毛结构的损伤多集中于精子鞭毛中段, 并指出这可能是因为鞭毛中段特殊结构造成的, 膜结构的脆弱使其在冷冻过程中更易受到损伤。朱豪磊等[7]在香港牡蛎精子冷冻过程中发现, 精子膜的损伤对保存精子的活力影响很大,精子超微结构异常主要表现为精子细胞膜及核膜的破损肿胀, 线粒体缺失或破损, 鞭毛弯折、断裂甚至脱落, 染色质弥散解体等, 与本研究观察到的的长牡蛎精子超微结构冷冻损伤情况基本一致。
4 小结
本研究表明长牡蛎精子冷冻保存前后运动率差异不显著, 其受精能力亦无显著差异, 解冻后长牡蛎精子超微结构形态正常的占84.5%, 说明以10% DMSO作为抗冻保护剂, 添加海藻糖HBSS作为稀释液, 对长牡蛎精子超低温冷冻保存具有较好的保护作用。实验组冻融后精子受精率、孵化率高于鲜精。我们猜测一方面可能是由于在精子冷冻过程中, 质量差的精子被冻死, 质量好的精子存活了下来, 存活下来的优质精子提高了精子的受精率及孵化率。另一方面, 在长牡蛎受精实验中我们还发现, 过多或者过少的精子围绕在卵子周围均对卵子的受精及孵化产生一定的影响, 鲜精精子密度不可避免的会高于冻精。因此, 在本实验中, 可能由于活力差、运动速率慢的精子死亡, 存活下来的精子质量提高及围绕在卵子周围精子数量更加适合卵子的受精导致了精子受精率、孵化率略高于鲜精, 但二者之间差异不显著。电子显微镜技术,可以用于探索长牡蛎精子超低温保存及复温过程中冷冻损伤情况, 有助于筛选更加有效的精子冻存方法, 推动精子超低温冷冻损伤机理的研究。今后可以采用流式细胞仪、单细胞凝胶电泳及高效色谱技术继续深入分析长牡蛎精子冷冻前后膜结构、染色质及细胞内各生化成分的变化, 以便探讨超低温冻存精子细胞性结构损伤的机制。
[1]Chen Y K. The effect of cryopreservation on sperm quality of red seabream (Pagrus major) [D]. Thesis for Master of Science. Institute of Oceanology, Chinese Academy of Sciences. 2010 [陈亚坤. 超低温保存对真鲷(Pagrus major)精子质量的影响. 中国科学院海洋研究所. 2010]
[2]Li P. Cryopreservation and ultrastructure of Acipenser sinensis gray [D]. Huazhong Agricultural University. 2007 [厉萍. 中华鲟精子结构特征及其精液超低温冷冻保存技术研究. 华中农业大学. 2007]
[3]Cheng S, Yan J Q, Zhu J Q, et al. Vitality and ultrastructure observation of fresm and cryopreservated sperm in Pseudosciaena crocea [J]. Oceanologia et Limnologia Sinica, 2013, 44(1): 56—61 [程顺, 闫家强, 竺俊全, 等.大黄鱼(Pseudosciaena crocea)精子冷冻前后的活力及超微结构变化. 海洋与湖沼, 2013, 44(1): 56—61]
[4]Adams S L, Roberts R D, Webb S C, et al. Cryopreservation of sperm of the Pacific oyster (Crassostrea gigas): development of a practical method for commercial spat production [J]. Aquaculture, 2004, 242(1—4): 271—282
[5]Yang P M, Yang A G, Liu Z H, et al. Ultrastructure and cryodamage studies of Patinopecten yessoensis sperm by electron microscopy [J]. Marine Fishery Research, 2008, 29(1): 98—102 [杨培民, 杨爱国, 刘志鸿, 等. 虾夷扇贝精子形态结构和超低温冷冻损伤的电镜观察. 海洋水产研究, 2008, 29(1): 98—102]
[6]Han L J, Liu Q H, Yu D D, et al. Cryopreservation and ultrastructure of Gadus macrocephalus sperm [J]. Oceanologia et Limnologia Sinica, 2014, 45(4): 789—797 [韩龙江, 刘清华, 于道德, 等. 太平洋鳕(Gadus macrocephalus)精液超低温冷冻方法的建立及精子超微结构分析.海洋与湖沼, 2014, 45(4): 789—797]
[7]Zhu H L. Study on the sperm of Crassostrea hongkongensis using cold-store technology [D]. Guangxi University. 2013 [香港牡蛎精子冷冻保存的研究. 广西大学. 2013]
[8]Yang H, Hu E, Cuevas-Uribe R, et al. High-throughput sperm cryopreservation of eastern oyster Crassostrea virginica [J]. Aquaculture, 2012, 344(3):223-230.
[9]Vitiello V, Carlino P A, Del Prete F, et al. Effects of cooling and freezing on the motility of Ostrea edulis (L., 1758) spermatozoa after thawing. [J]. Cryobiology, 2011, 63(2):118—124.
[10]Li Y, He G Z. The morphological and ultrastructural variation of pacific oyster Crassostrea gigas (Thunberg) sperm after cryopreservation [J]. Journal of Ocean University of Qingdao (Natural Science), 2002, (4): 526-532 [李赟, 贺桂珍. 超低温保存存前后太平洋牡蛎精子Crassostrea gigas (Thunberg)超微结构观察. 青岛海洋大学学报(自然科学版), 2002, (4): 526—532]
[11]Dong Q, Huang C, Eudeline B, et al. Systematic factor optimization for cryopreservation of shipped sperm samples of diploid Pacific Oysters, Crassostrea gigas [J]. Cryobiology, 2005, 51(2): 176—197
[12]Dong Q, Huang C, Eudeline B, et al. Systematic factor optimization for sperm cryopreservation of tetraploid Pacific oysters, Crassostrea gigas [J]. Theriogenology, 2006, 66(2): 387—403
[13]Hanks J H. Hanks' balanced salt solution and pH control [J]. Methods in Cell Science, 1975, 1(1): 3—4
[14]Liu Q, Li J, Zhang S, et al. An efficient methodology for cryopreservation of spermatozoa of red seabream, Pagrus major, with 2-mL Cryovials [J]. Journal of the World Aquaculture Society, 2006, 37(3): 289—297
[15]Teng S S. The study of Crassostrea gigas crossbreeding [D]. Ocean University of China. 2009 [滕爽爽. 长牡蛎杂交育种的研究. 中国海洋大学. 2009]
[16]Wang M F, Bin C Y, Dou W, et al. The detection and evaluation and evaluation on the sperm quality of mollusk: the evaluation of sperm survival rate of pinctada maternalI stained by eosin y and typan blue [J]. Acta Hydrobiologica Sinica, 2013, 32(5): 803—809 [王梅芳, 宾承勇, 豆伟, 等. 贝类精子质量检测与评价方法研究I: 染色法检测马氏珠母贝精子的存活率的研究. 水生生物学报, 2013, 32(5): 803—809]
[17]Vidal A H, Batista A M, Silva E C B D, et al. Soybean lecithin-based extender as an alternative for goat sperm cryopreservation [J]. Small Ruminant Research, 2013, 109(1): 47—51
[18]Babiak I, Ciereszko A, Litvak M. Semen characteristics and their ability to predict sperm cryopreservation potential of Atlantic cod, Gadus morhua L [J]. Theriogenology, 2011, 75(7): 1290—1300
[19]Hassan M M, Qin J G, Li X. Sperm cryopreservation in oysters: A review of its current status and potentials for future application in aquaculture [J]. Aquaculture, 2015, 438(1): 24—32
[20]Tiersch T R, Yang H, Jenkins J A, et al. Sperm cryopreservation in fish and shellfish [J]. Society of Reproduction & Fertility Supplement, 2007, 65: 493—508
[21]Chen D H, Li Y D, Jia Z L, et al. Cryopreservation of Eriocheir sinensis sperms (In vitro) with different cryoprotective solutions and prefreezing time [J]. Acta Hydrobiologica Sinica, 2008, 32(4): 579—585 [陈东华, 李艳东, 贾林芝, 等. 冷冻保护剂及预冷时间对河蟹精子体外冷冻保存的影响. 水生生物学报, 2008, 32(4): 579—585]
[22]Dai T, Zhao E, Lu G, et al. Sperm cryopreservation of yellow drum Nibea albiflora: A special emphasis on postthaw sperm quality [J]. Aquaculture, 2012, s 368—369(1): 82—88
[23]Shi Y X, Cheng S, Zhu J Q, et al. Sperm cryopreservation and enzyme activity detection in Lateolabrax maculates [J]. Acta Hydrobiologica Sinica, 2015, 39(6): 1241—1247 [史应学, 程顺, 竺俊全, 等. 中国花鲈精子的超低温冷冻保存及酶活性检测. 水生生物学报, 2015, 39(6): 1241—1247]
[24]Dreanno C, Fauvel C, Cosson J, et al. Cryopreservation of sperm in marine fish [J]. Aquaculture Research, 2000, 31(3): 231—243
[25]Yao Z, Crim L W, Richardson G F, et al. Motility, fertility and ultrastructural changes of ocean pout (Macrozoarces americanus L.) sperm after cryopreservation [J]. Aquaculture, 2000, 181(3): 361—375
[26]Wang X G, Luo J, Yin S W, et al. Investigation of spermatozoa motility of Epinephelus malabaricus and comparison of the spermatozoa ultrastructure before and after ultra-low temperature freeze [J]. Marine Science, 2013, 37(2): 70—75 [王小刚, 骆剑, 尹绍武, 等. 点带石斑鱼的精子活力及超低温冷冻前后精子超微结构的比较. 海洋科学, 2013, 37(2): 70—75]
[27]Cabrita E, Engrola S, Conceição L E C, et al. Successful cryopreservation of sperm from sex-reversed dusky grouper, Epinephelus marginatus [J]. Aquaculture, 2009, 287(1—2): 152—157
[28]Pérez-Cerezales S, Martínez-Páramo S, Cabrita E, et al. Evaluation of oxidative DNA damage promoted by storage in sperm from sex-reversed rainbow trout [J]. Theriogenology, 2009, 71(4): 605—613
[29]Zhang L Z, Liu P, Zhuang P, et al. Observing on cryodamage of spermatozoa of Siberian sturgeon (Acipenser b. baerii) [J]. Journal of Fisheries of China, 2008, 32(4): 558—565 [章龙珍, 刘鹏, 庄平, 等. 超低温冷冻对西伯利亚鲟精子形态结构损伤的观察. 水产学报, 2008, 32(4): 558—565]
[30]Kudo S, Linhart O, Billard R. Ultrastructural studies of sperm penetration in the egg of the European catfish, Silurus glanis [J]. Aquatic Living Resources, 1994, 7(2):93—98
[31]Kopeika J, Kopeika E, Zhang T, et al. Effect of DNA repair inhibitor (3-aminobenzamide) on genetic stability of loach (Misgurnus fossilis) embryos derived from cryopreserved sperm [J]. Theriogenology, 2004, 61(9): 1661—1673
[32]Yu H T, Zhang X M, Chen C, et al. Changes in ultrastructures of Takifugu rubripes spermatozoa before and after cryopreservation [J]. Marine Science, 2007, 31(2): 17—19 [于海涛, 张秀梅, 陈超, 等. 红鳍东方鲀精子超低温保存前后的超微结构观察. 海洋科学, 2007, 31(2): 17—19]
[33]Peng L Y, Xiao Y M, Liu Y. Effect of cryopreservation and short-term storage of Chinese giant salamander sperm [J]. Acta Hydrobiologica Sinica. 2011, 35(2): 325—332 [彭亮跃, 肖亚梅, 刘筠. 低温和超低温保存对中国大鲵成熟精子的影响. 水生生物学报, 2011, 35(2): 325—332]
[34]Liu Y, Li X. Successful oocyte cryopreservation in the blue mussel Mytilus galloprovincialis [J]. Aquaculture, 2015, 438: 55—58
STUDY ON ULTRASTRUCTURE OBSERVATION OF FRESH AND CRYOPRESERVATED SPERM IN CRASSOSTREA GIGAS
HAN Long-Jiang1,2, LIU Qing-Hua1,3,4, XU Fei1,3,4, WEN Hai-Shen2and LI Jun1,3,4
(1. Key Laboratory of Experimental Marine Biology, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 2. College of Fisheries, Ocean University of China, Qingdao 266009, China; 3. National & Local Joint Engineering Laboratory of Ecological Mariculture, Qingdao 266071, China; 4. Laboratory for Marine Biology and Biotechnology, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266237, China)
A step-wise cooling schemes was employed to cryopreserve Crassostrea gigas sperm, and the sperm ultrastructure was observed by scanning electron microscopy and transmission electron microscopy. The results showed that there were no significant differences between frozen-thawed sperm and fresh sperm in the motility, fertilization rate and hatching rate. Both the fresh sperm and cryopreserved sperm had ultrastructural damages. The normal rates of the fresh and cryopreservated sperms were 84.5% and 73%, respectively. The cryopreserved sperm without damage had normal morphology in the plasma membrane, mitochondria and nuclear, the acrosome, and centriole, and the mitochondrion obtained integrity with well-developed cristae. The sperm cryodamages with damages had swelled or disrupted plasma and nuclear membrane, partially damaged nucleus and swelled, dislocated or disarticulated mitochondrion with degenerated or vanished cristae. The results showed that HBSS with at 1∶4 dilution trehalose and 10% DMSO is the best condition for extender and cryoprotecant and for protecting the frozen-thawed C. gigas sperm, which will benefit the preservation of C. gigas and application of sperm cryopreservation skills.
Crassostrea gigas; Sperm; Cryopreservation; Vitality; Ultrastructure
S917
A
1000-3207(2017)01-0220-08
10.7541/2017.28
2016-02-19;
2016-06-21
国家高技术研究发展计划(863计划)项目(2012AA10A402); 海洋经济创新发展区域示范项目(12PYY001SF08); 国家重点基础研究发展计划(973计划)项目(2010CB126401); 鳌山科技创新计划(2015ASKJ02,2015ASKJ02-03-03)水产种质资源平台运行服务项目; 中国科学院青促会项目资助 [Supported by the National High Technology Research and Development Program of China (863 Program) No (2012AA10A4020); Regional Demonstration Project of Marine Economic Innovation and Development (12PYY001SF08); National Basic Research Program of China (2010CB126401); Qingdao National Laboratory for Marine Science and Technology (No.2015ASKJ02, 2015ASKJ02-03-03); Aquatic Germplasm Resources Platform Running Services; Youth Innovation Promotion Association CAS]
韩龙江(1989—), 男, 山东潍坊人; 理学硕士; 主要从事海洋动物种质资源保藏与海水鱼类繁殖生理研究。E-mail: hanlong jiang1989@163.com; 刘清华为并列第一作者
温海深, wenhaishen@ouc.edu.cn; 李军, 研究员, 主要从事鱼类繁育研究。E-mail: junli@qdio.ac.cn

