黄芪根际促生菌(PGPR)筛选与特性研究
马骢毓,张英,马文彬,李建宏,姚拓*
(1.甘肃农业大学草业学院,草业生态系统教育部重点实验室,中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070;2.青海大学农牧学院草业科学系,三江源生态与高原农牧业国家重点实验室,青海 西宁810016)
黄芪根际促生菌(PGPR)筛选与特性研究
马骢毓1,张英2,马文彬1,李建宏1,姚拓1*
(1.甘肃农业大学草业学院,草业生态系统教育部重点实验室,中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070;2.青海大学农牧学院草业科学系,三江源生态与高原农牧业国家重点实验室,青海 西宁810016)
为获得黄芪根际PGPR菌株并明确其促生特性,可为其在生产中的应用提供依据,本研究以黄芪的根瘤、根系及根际土壤为材料,利用选择性培养基分离筛选根瘤菌与溶磷菌,测定根瘤菌固氮酶活性、溶磷菌株的溶磷能力及分泌3-吲哚乙酸(IAA)的能力,从中筛选出综合性能优良的菌株,并运用生理生化鉴定和16S rDNA分子生物学鉴定相结合的方法鉴定优良菌株的种属。结果发现,溶磷菌数量的分布具有根系表面(RP)>根表土壤(RS)>远根土(NRS)>根内(HP)的规律,有明显的根际效应;经分离纯化获得76 株PGPR菌,其中根瘤菌1株、溶解无机磷菌株42 株和溶解有机磷菌株33 株,其中可分泌IAA能力的溶磷菌株有7株;筛选出综合性能优良,有进一步开发应用潜力的溶磷菌株7株,根瘤菌1株,经鉴定溶磷菌中3株为Pseudomonassp.,3株为Bacillussp.和1株为Klebsiellaoxytoca,根瘤菌为Rhizobiumsp.,这为研制生物菌肥提供优良菌种,同时丰富优良根际促生菌资源库。
黄芪;根际促生菌(PGPR);促生特性;菌株鉴定
黄芪(Astragalusmembranaceus)是常用的大宗中药材之一,具有利尿消肿、固表补气、生肌托毒之功效,在临床各科中都有广泛的应用,中成药中,以黄芪为原料的达200余种,因此有“十药八芪”之誉[1]。国内市场对黄芪的需求量极大,年产量(人工栽培)达230000 t之多,其中用于饮片生产和深加工(包括提取物、制剂、中成药)各半[2]。我国也是世界上唯一的黄芪出产国和出口国,在国际植物药材市场上占有重要地位,黄芪是我国中药材出口中排在1000万美元的7个品种之首[3]。强劲的需求导致了野生黄芪资源的枯竭,栽培黄芪是目前商品黄芪的主要来源。近些年来黄芪价格居高不下,农民大量施用化肥以追求较高的产量,调查发现,在黄芪主产区甘肃省的渭源、陇西、岷县、宕昌等地,黄芪种植过程化肥施用量普遍很大,这不仅推高了生产成本,而且大量的化肥施用造成土壤板结、土壤功能退化以及微生态失调,影响了可持续发展;此外,化学肥料的大量使用也为药品安全带来了巨大的隐患。因此,探寻其他更为安全环保的增肥剂以部分替代化肥的作用,实现高效益的循环农业已迫在眉睫。
近些年研究表明,植物根际促生菌(plant growth promoting rhizobacteria,简称PGPR或促生菌)不但可以固定空气中的氮气,同时一些菌还兼具溶解土壤中不能被植物直接利用的磷元素,分泌植物生长调节物质,促进植物根系生长和矿物质吸收,增强植物抗病性的功能[4]。用从不同环境、不同植物群落根际分离获得的特定促生菌株生产的生物菌肥与化肥相比具有成本低、使用安全、持续效果好、增产稳定、非再生能源消耗少、经济效益高、无环境和食品污染等优点,同时,还可改善土壤结构、提高土壤有机质含量和改良盐碱地[5-6]。纵观世界生物肥料研究与应用现状,发达国家(如美国)仍然是世界上研究、生产和使用生物肥料的大国。我国化肥年产量、总产量和单位面积使用量均居世界第一,而微生物肥料年生产量不足化肥的1‰,且品种单一。虽然国外已有规模化的促生菌肥产品,但不同生境的植物根际生存着不同的菌株,而不同菌株对环境的适应性不同。因此,只能借鉴国外的成功经验,从我国特定气候、植物及生境中不断地分离筛选高效菌株,以生产出适合我国特定气候、植物及生境的生物菌肥[7-9]。
综上所述,筛选黄芪根际PGPR菌,并将其运用于黄芪专用生物肥料的研制和生产,不仅对促进我国黄芪种植业发展具有重要意义,而且对发展绿色农业,保护生态环境具有重要意义。
1 材料与方法
1.1 材料
黄芪,选取陇芪一号。样品采集于2014年7月,采样地位于甘肃省渭源县会川镇。采集生长健壮、无病虫害、结瘤正常且呈粉红色的黄芪根瘤及黄芪根际(根系和土壤)样品,装入无菌采样袋中低温运输至实验室立即进行PGPR 菌株分离。
1.2 培养基
LB(Luria Bertani)培养基用于分离和保存根际细菌[10];酵母菌形态琼脂(YMA)培养基用于根瘤菌的分离与纯化[11];PKO(Pikovskaya)培养基用于溶解无机磷菌株的分离与纯化[12];蒙金娜有机磷培养基用于溶解有机磷菌株的分离与纯化[10,13];纤维素(CCM)培养基用于植物生长激素(IAA)的测定[12,8]。具体组成如下:
LB培养基组成:蛋白胨 10 g;NaCl 5 g;酵母膏 5 g;琼脂 18 g;总体积1000 mL;pH 7.0~7.2。
YMA培养基配方:CaCO33 g;K2HPO40.5 g;酵母粉 1 g;NaCl 0.1 g;MgSO4·7H2O 0.2 g; 甘露醇 10 g; 0.25%刚果红10 mL;琼脂(agar) 18 g;总体积1000 mL;pH 7.0~7.2。
PKO无机磷培养基组成:NaCl 0.5 g;KCl 0.2 g;MgSO4·7H2O 0.1 g;Ca3(PO4)23 g;(NH4)2SO40.1 g;FeSO4(微量)0.004 g/L;MnSO4(微量)0.004 g/L;蔗糖 10 g;酵母膏 0.5 g;琼脂(Agar)18 g;总体积 1000 mL;pH 7.0~7.2。
蒙金娜有机磷培养基组成:葡萄糖(glucose) 10 g; (NH4)2SO40.5 g; NaCl 0.3 g; KCl 0.3 g; FeSO4·7H2O 0.03 g;MnSO4·4H2O 0.03 g;蛋黄卵磷脂(lecithin) 0.2 g;CaCO35 g;酵母膏(yeast extract paste) 0.4 g;琼脂(agar) 18 g;总体积 1000 mL;pH 7.0~7.5。
CCM培养基及组成:MgSO4·7H2O 0.2 g; KH2PO40.2 g;甘露醇5 g; K2HPO40.8 g; CaCl2·2H2O 0.06 g;蔗糖5.0 g;NaMoO4·2H2O 2.5 mg;酵母粉 0.1 g;乳酸 0.5 mL;NaCl 0.1 g;1.64%乙二胺四乙酸钠铁(Na·Fe·EDTA) 4 mL;总体积 1000 mL;pH 7.0(注:灭菌时将MgSO4·7H2O、CaCl2·2H2O和EDTA分开灭菌,否则会产生沉淀)。
1.3 根瘤菌分离纯化
将所采集新鲜的黄芪根瘤置于培养皿中,用无菌水洗净,用0.1%升汞消毒3 min后,用无菌水冲洗3~4次,用扁平的镊子压破上述灭过菌的根瘤,在YMA平板上点接或划线后,将培养皿置于28 ℃培养箱中倒置培养,分离得到的菌株进一步纯化保存于冰箱中备用。
1.4 根瘤固氮菌固氮特性测定
色谱条件:玻璃柱内径 0.4 cm,长2 m,担体为 GDX-502,检测器温度 170 ℃,进样器温度 150 ℃,柱温 180 ℃,气体流量:空气 0.15 kg/cm,N20.3 kg/cm,H20.08 kg/cm,检测器为氢火焰离子化检测器(FID)。
根瘤样品测定:用橡胶塞封口装有约0.2~1.0 g新鲜根瘤的小玻璃瓶。先用注射器从瓶中抽出1 mL空气,再向瓶中注入1 mL乙炔气。在28 ℃条件下使根瘤与乙炔气体反应1 h后。用微量进样器从每个小瓶中抽取50 μL气体注入气相色谱仪(GC 7890F)。测定后称取根瘤重量。
酶活计算:乙炔还原活性测定固氮酶活性,也称ARA法[14]。
1.5 溶磷菌分离纯化
将根际分为4个部分,即根表土壤(soil adhering to roots, RS)、根系表面(rhizoplan or surface of roots, RP)、远根土(soil away from roots, NRS)与根内(histoplan or interior of roots, HP)4个区域[12]。
称取样品2 g,置于50 mL离心管中,注入18 mL 0.85% 无菌生理盐水,振荡2 min并静置后即为10-1根表土壤稀释液,然后依次制备成浓度为10-3、10-4及10-5的稀释液,备用。
用微量移液器分别吸取50 μL上述已制备好的4个根系区域的10-3、10-4和10-5稀释液,接种于灭菌的PKO平板培养基上,立即用无菌玻璃涂布器涂抹均匀,每区域的每个浓度均重复3次。28 ℃培养5~7 d后观察,用接种针挑取具有溶磷透明圈的菌落在PKO平板上以划线法纯化细菌,并在LB斜面培养基上接种于4 ℃冰箱中保存。
1.6 溶磷菌溶磷能力测定
1.6.1 定性测定 将活化后的菌株点接种于PKO固体培养基上,于28 ℃恒温培养,在7~10 d时观察每菌株是否出现溶磷透明圈,并测量每菌株溶磷圈直径(diameter of phosphate solution, D)和菌落直径(diameter of colony, d)的比值(D/d),由比值大小初步判定菌株的溶磷能力。
1.6.2 定量测定 在已灭菌的PKO培养液中接种0.5 mL各菌株菌悬液(OD值为0.5)。每菌株3 次重复,不接种为对照。28 ℃、140 r/min振荡培养12 d后,用酸度计测定各个培养液pH 值,后将培养液在10000 r/min、4 ℃离心15 min后,取其上清液5 mL于150 mL锥形瓶中并加入45 mL 0.5 mol/L NaHCO3和约1.5 g无磷活性炭,封口振荡 30 min,无磷滤纸过滤。在50 mL容量瓶中加入滤液1 mL、0.5 mol/L NaHCO35 mL以及蒸馏水约30 mL,最后加入5 mL钼锑抗显色剂,定容摇匀。显色30 min后,进行比色,测定700 nm下的吸光度,计算磷浓度(μg/mL)。
1.7 溶磷菌分泌植物激素(IAA、GA)能力测定
配制含1 g/L 硝酸铵和100 mg/L 色氨酸的CCM 液体培养基,分装于150 mL 锥形瓶中,灭菌后接种供试菌株的菌悬液(108cfu/mL)1 mL,每菌株重复3次,不接种为对照。将接种后的培养液于28 ℃,125 r/min摇床上培养12 d待用。
1.7.1 定性测定 在白色比色板上滴加上述培养液50 μL,加等量的Spot 比色液,另取50 μL IAA标样(50 μg/mL)与等量比色液混合作为对照。比色板在黑暗条件下静置10 min后观察混合液颜色变化。与对照相比(对照为粉红色),若出现粉红色,说明菌株具有分泌IAA能力,且颜色越深,其分泌IAA的能力相对越强;否则判定菌株不具有分泌IAA能力。
1.7.2 定量测定 将培养液于4 ℃,10000 r/min下离心10 min,收集上清液于锥形瓶中,调pH值至2.8。用乙酸乙酯萃取后转入50 mL磨口烧瓶中,置于30 ℃真空蒸发浓缩近干,用甲醇溶解并定容至2 mL。0.45 μm有机系滤膜后于液相色谱仪上测定。色谱条件:温度 25 ℃;流动相为甲醇∶0.6%乙酸 (45∶55,V/V)(使用前过0.45 μm有机系滤膜);流速0.6 mL/min;紫外检测波长254 nm,进样量10 μL。色谱柱:ZORBAX SB-C18 柱,规格:4.6 mm×150 mm,填料细度:5 μm。
标准曲线的制作:配制不同浓度混合标准溶液。配制的标液经0.45 μm有机系滤膜过滤,进样10 μL,获得不同浓度时IAA 和GA的峰面积并绘制标准曲线。
1.8 PGPR菌株鉴定
1.8.1 溶磷菌形态观察 将供试菌株接种于LB培养基表面,30 ℃培养,观察记录各细菌菌落形状、大小、生长速度、颜色及边缘形状度等特征。
1.8.2 细菌生理生化特性测定 细菌生理生化测定方法参考文献[15-17]。
1.8.3 细菌16S rDNA分子生物学鉴定
1)细菌总DNA的提取:参照试剂盒说明书方法。
2)DNA浓度的测定:紫外分光光度法。
3)DNA纯度分析:琼脂糖凝胶电泳法。
4)16S rDNA扩增。选用扩增引物:选取16S rDNA扩增的通用引物27F-1492R(由上海生工生物科技公司合成),其序列分别为27F:5-AGAGTTTGATCCTGGCTCAG-3,1492R:5-GGTTACCTTGTTACGACTT-3;PCR 扩增条件:扩增反应由梯度PCR仪完成;反应体系及反应程序参考马文彬[15];检测扩增产物:由琼脂糖凝胶电泳检测扩增产物;序列测定:扩增产物的测序工作由上海生工生物科技公司完成。
5)DNA序列分析:将测得的序列在 NCBI 数据库(http://www.ncbi.nlm.nih.gov/BLAST/)中用 megablast进行相似性搜索,与已报道细菌菌株的 16S rDNA 序列进行同源性比较,并利用MEGA 5.0 生物学软件构建进化距离树图,用 Neighbor-Joining 法进行系统发育分析。
1.9 数据处理
采用 Excel 2007进行数据整理及制图,采用 SPSS 17.0进行数据分析。
2 结果与分析
2.1 黄芪根瘤及溶磷菌的分离纯化
如表1所列,利用YMA培养基从黄芪根瘤中分离得到1株根瘤菌优势菌株,同时利用PKO 和蒙金娜选择培养基从黄芪根际分离出了生长速度快、菌落较大,且具有溶解有机磷、无机磷功能的菌株。纯化后获得菌株76株,其中根瘤菌1株,溶解无机磷菌株42株,溶解有机磷菌株33株。除根瘤菌外,其余菌株在根际不同部位数量不同,但均表现出根表(RP)>根表土(RS)>远根土(NRS)>根内(HP)的数量分布规律,即表现出很强的根际效应。
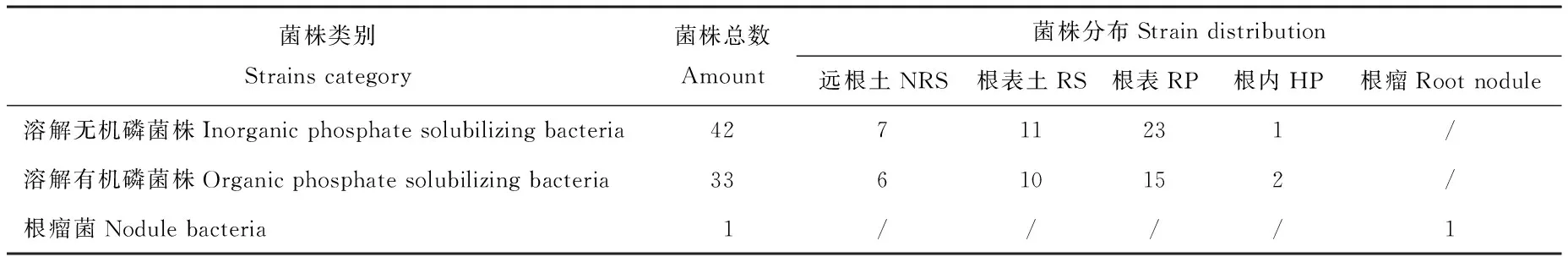
表1 黄芪根际促生菌株来源及分布Table 1 Source and distribution of A. membranaceus rhizosphere strains
2.2 根瘤固氮酶活性
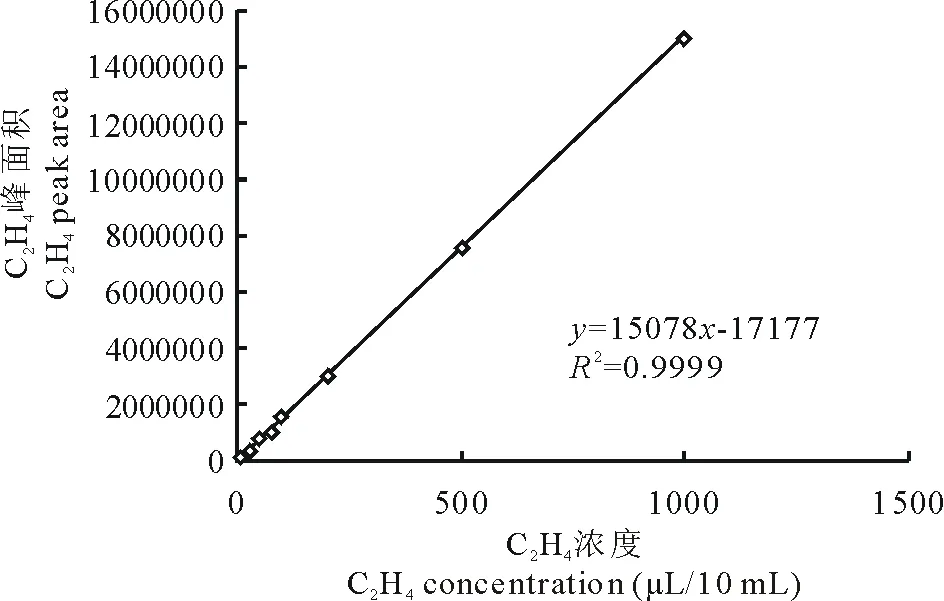
图1 乙烯标准曲线Fig.1 Standard curve of C2H4
如图1所示,用不同浓度的乙烯混合气体作为横坐标,峰面积值作为纵坐标作图,得到下列乙烯标准曲线。其中回归方程为y=15078x-17177,相关系数值为0.9999,说明此测量值与拟合得到的公式之间的接近程度较好,公式较可靠。黄芪植株根瘤颜色呈粉红,说明其为有效根瘤。通过乙炔还原法测定根瘤固氮酶活性为11.21 μmol C2H4/(g·h)。
2.3 溶磷菌溶磷能力
2.3.1 菌株溶解无机磷能力 选取溶磷圈较大,生长速度较快的16株菌株,测定其溶磷量并研究其溶解无机磷的能力。结果如表2所列,通过溶磷圈法定性测定菌株的溶磷圈大小发现,各菌株D/d值在1.89~3.61之间,D/d值最大的菌株为HRW-31,达3.61,最小的菌株是HRW-14,其D/d值仅为1.89。利用钼锑抗比色法对磷进行定量测定的结果也发现供试的16株菌均具有溶解无机磷的能力,不同菌株的溶磷能力不同,溶磷量在45.21~423.84 μg/mL之间,各菌株溶磷能力差异显著(P<0.05)。其中溶磷量最大的是菌株HRW-41,达423.84 μg/mL,溶磷量最小的是菌株HRW-14,其溶磷量为45.21 μg/mL。
注:D/d为溶磷圈直径比菌落直径。下同。
Note: D/d means ratio of phosphate solution diameter and colony diameter. The same below.
2.3.2 菌株溶解有机磷能力 选取溶磷圈较大,生长速度较快的10株菌进行进一步的实验,研究其溶解有机磷的能力。通过测定分离自黄芪根际的溶有机磷菌的溶磷量,结果表明(表3),通过溶磷圈法定性测定菌株的溶磷圈大小发现,各菌株D/d值在1.36~3.65之间,D/d值最大的菌株为HRY-7,达3.65,最小的菌株是HRY-12,其D/d值仅为1.36。定量测定的结果也发现供试的10株菌均具有溶解有机磷的能力,不同菌株的溶磷能力不同,溶磷量为5.92~31.52 μg/mL之间,各菌株溶磷能力差异显著(P<0.05)。其中溶磷量最大的菌株为HRY-7,达31.52 μg/mL,最小的菌株是HRY-12,为5.92 μg/mL,这一趋势与D/d的一致。
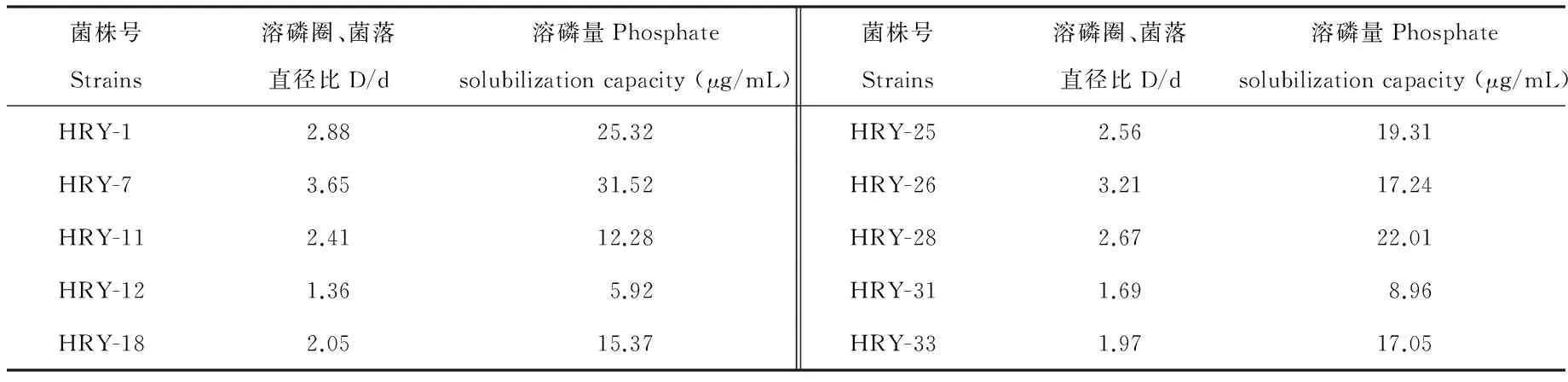
表3 菌株溶解有机磷能力测定Table 3 Capacity of strains on organic culture medium

表4 溶磷菌株分泌IAA和GA的数量Table4 ConcentrationofIAAandGAofphosphatesolubilizationstrains菌株号Strains显色反应Chromogenicreaction3-吲哚乙酸IAA(μg/mL)赤霉素GA(μg/mL)HRW-12---HRW-13+-8.02HRW-16+++15.9210.84HRW-31++21.627.21HRW-36+14.57-HRW-41+++9.82-HRW-24---HRY-1+++28.519.52HRY-7++12.348.52HRY-28--- 注:IAA显色反应中,-、+、++和+++符号表示不显色、浅红色、粉红色和深红色。 Note:-,+,++and+++indicatenocolourandredcolourtakeitsturesfromlighttoheavy.
2.4 溶磷菌分泌IAA和GA
选取溶磷能力较好的10株菌株,利用Spot比色法和高效液相色谱法测定其分泌IAA、GA能力。结果表明(表4),利用比色法测定有7株供试菌株出现了显色反应,其中有6株具分泌IAA能力,5株具分泌GA能力。但并不是所有显色反应的菌株均具分泌IAA能力;不同菌株分泌IAA量及GA量不同,其中有4株菌既具有分泌IAA能力,也兼具分泌GA 的能力。
2.5 菌株鉴定结果
2.5.1 生理生化鉴定结果 综合上述试验结果,选取总体性能较好的7株溶磷菌HRW-13、HRW-16、HRW-31、HRW-36、HRW-41、HRY-1、HRY-7及1株根瘤菌H-GL进行鉴定。根据生理生化实验结果,结合菌株革兰氏染色特性、菌落特征(表5~7),查阅《伯杰细菌鉴定手册》[16]以及《常见细菌系统鉴定手册》[17]得到结果,经鉴定HRW-13、HRW-31、HRW-41为假单胞菌属(Pseudomonas sp.),HRW-16、HRW-36和HRY-7为芽孢杆菌属,HRY-1暂无法确定,H-GL为根瘤菌属。
2.5.2 分子生物学鉴定结果 综合生化实验结果和分子鉴定结果,发现本研究中所分离的菌株形态及生化鉴定结果和分子鉴定结果能很好地吻合,说明本研究的鉴定结果准确可靠。鉴定结果如表8和图2、3所示,H-GL为根瘤菌属(Rhizobiumsp.),7株溶磷菌分别属于3个属6个种,其中,HRW-13、HRW-31和HRW-41为假单胞菌属,HRY-7、HRW-36和HRW-16为芽孢杆菌属(Bacillussp.),HRY-1为克雷伯菌(Klebsiellaoxytoca)。
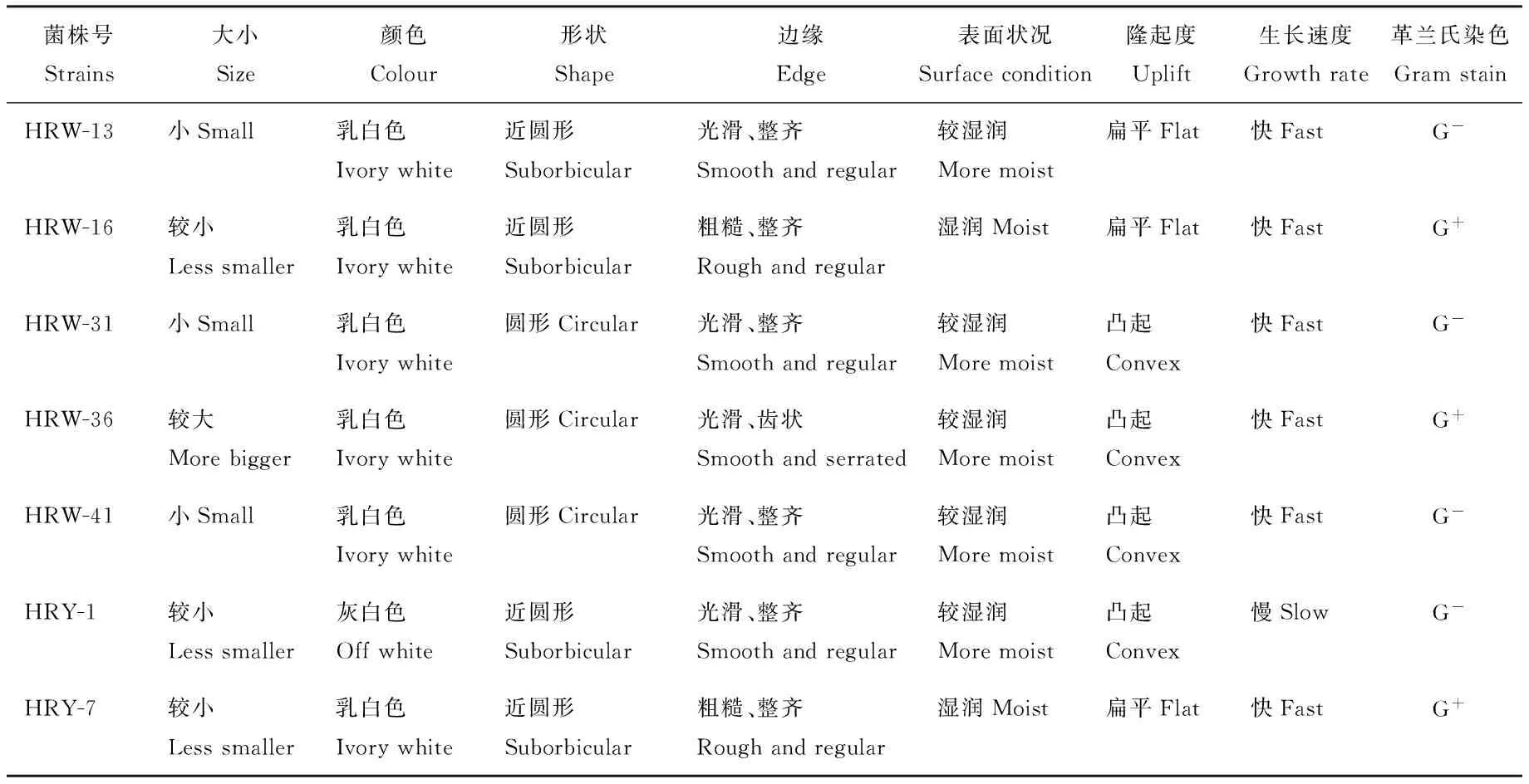
表5 各菌株的表型特征及革兰氏染色结果Table 5 Colony morphologies and gram staining of strains
注:革兰氏染色法中,G+表示阳性、G-表示阴性。
Note: G+means positive and G-means negative in Gram staining method.
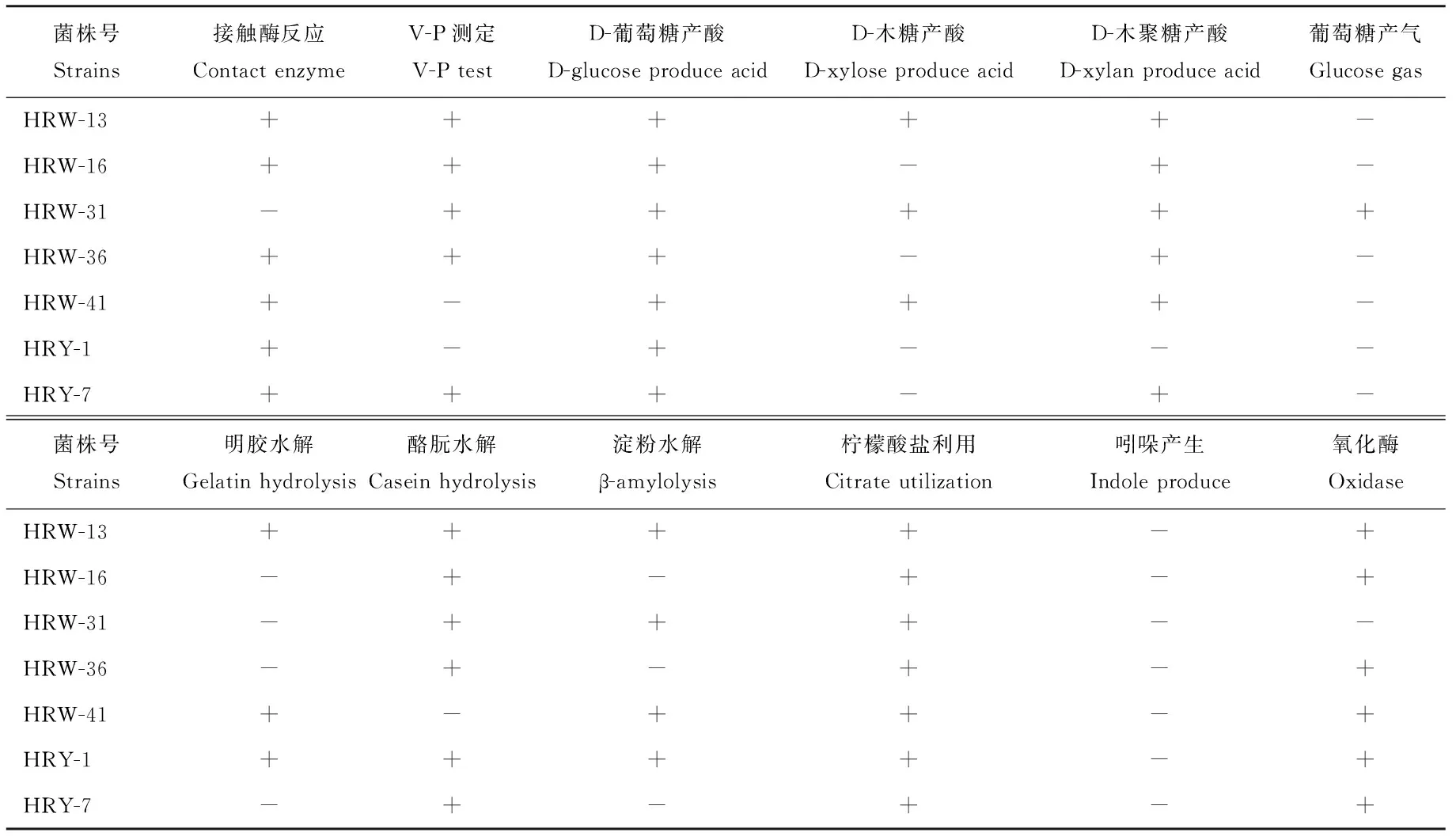
表6 菌株生理生化反应结果(一)Table 6 Physio-biochemical characteristics of strains (1)
注:表格中的符号与《伯杰氏细菌鉴定手册(第八版)》和《常见细菌鉴定手册》保持一致,“+”代表该反应为阳性,“-”代表该反应为阴性。下同。
Note: Symbols in the table as same as Bergey’s Manual of Determinative Bacteriology (eighth edition) and Common Bacteria Identification Manual, “+” on behalf of the reaction is positive, “-” on behalf of the reaction is negative. The same below.

表7 菌株生理生化反应结果(二)Table 7 Physio-biochemical characteristics of strains (2)
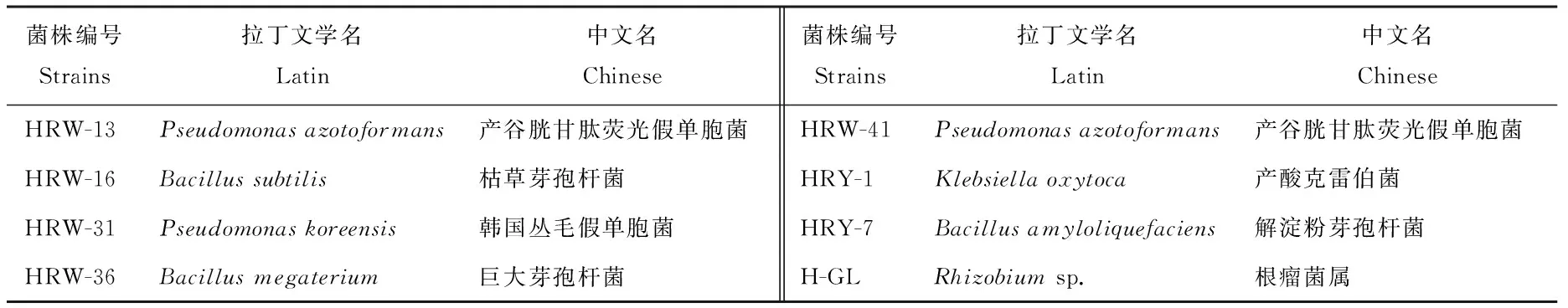
表8 优良PGPR菌株鉴定结果Table 8 Identification of PGPR

图2 所分离的根瘤菌株分子系统进化树Fig.2 Phylogenetic tree of the isolated rhizobium strains
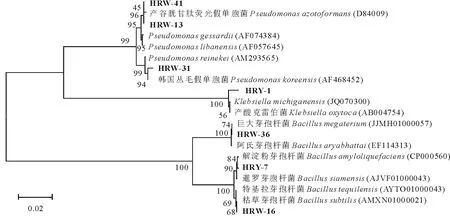
图3 所分离的溶磷菌株分子系统进化树Fig.3 Phylogenetic tree of the isolated phosphate solubilizing bacteria strains英文名称后的序号为登录号。The serial number which were in the back of English names were accession number.
3 讨论
国内外的很多研究者在筛选高效溶磷菌株的过程中,以溶磷圈的有无及大小为标准判断菌株溶磷能力的有无及高低[18-19]。但本研究中发现,溶磷圈的大小和溶磷量不完全呈正相关,也有学者研究中发现了相似的现象[10,20-22],分析其原因是菌株的溶磷机理的复杂性[23],溶磷圈的出现主要是体现溶磷微生物产酸而造成的,现有研究表明,产酸是微生物溶磷的主要途径[24],产生的酸性物质包括葡萄糖酸、2-酮戊二酸、乳酸、草酸、氨基酸、延胡索酸、苹果酸、柠檬酸和琥珀酸等有机酸[25]和H2S、H2SO4等无机酸[26],在酸类物质作用下,培养基中Ca3(PO4)2或CaCO3等成分溶解,出现溶磷圈;但除了产酸外,微生物还通过酶解作用和蛋白质作用[27]溶解土壤中的难溶性磷,因此,溶磷圈的大小并不能完全反应溶磷能力的高低。本研究中,以溶磷圈法作为定性测定,钼锑抗比色法作为定量测定,两个相结合,来确定菌株的溶磷能力,能降低误差。
土壤中生存有多种根瘤菌,豆科植物根际也有大量根瘤菌,对根瘤菌的分离方法有多种,但是最直接有效的分离方法则是采集生长良好的豆科植物,选取个大、饱满并带粉红色的根瘤在相应的培养基上进行分离,本研究利用该方法从黄芪根瘤中分离出1株根瘤菌。由于利用豆科共生固氮的植物种类只占豆科植物种类的1%,而其中仅对15%的种进行过结瘤调查[28],因此,豆科植物优良根瘤菌的选育以及开发利用未知的根瘤菌资源具有巨大潜力。
本研究在分离、纯化具有固氮能力、溶解无机磷和溶解有机磷能力菌株时,发现各菌株数量均表现出“根表>根表土>远根土>根内”的根际分布趋势,此研究结果与马文文等[29]、张英[30]以及赵小蓉等[20-21]的研究结果相一致,由此说明PGPR菌株在土壤中的数量除了受土壤理化性质、肥力、类型及其耕作措施等因素外,PGPR菌的分布同时也受植物强烈的根际效应的影响。据此可以推测,不同植物根际促生菌的组成必然不同,因此,要开发效果良好的促生菌产品,就必须从相应环境中相应植物的根际分离,当然,选育出适应性广的优良菌株也是一个好的研究方向。
除本研究的固氮、溶磷、分泌生长素等功效外,PGPR另外一个重要的功能就是用于防治农作物病害[31]。用于生防研究的细菌中,假单胞杆菌(Pseudomonassp.)是研究报道最多的一种生物防治细菌,它们大量存在于植物根际,繁殖迅速、能分泌嗜铁素和抗生素,而成为植物位点和空间微环境的有力竞争者,从而对多种植物病原菌有抑制作用。孙广正等[31]研究发现促生菌LHS11对黄瓜枯萎菌(Fusariumoxysporiumf. sp.cucumerinum)、西瓜尖镰孢菌(Fusariumoxysporumf.niveum)抑制效果达80%以上,具有较好的应用潜力。而本研究分离出的Pseudomonassp.和Bacillussp.,参考前人文献推测其有拮抗病原菌的潜力,这一方面研究将是下一步工作的重点。此外,本研究中分离获得一株只在韩国土壤环境中发现的韩国丛毛假单胞菌(Pseudomonaskoreensis),这证明该种群具有更广泛的地理分布性[32]。
4 结论
黄芪根际有大量PGPR菌,分布特征表现出根表(RP)>根表土(RS)>远根土(NRS)>根内(HP)的根际效应;最终获得76 株PGPR菌,其中根瘤菌1株,溶解无机磷42 株,有机磷33 株;优良菌株中,有分泌IAA能力的菌株7株。筛选出综合性能优良,有进一步开发应用潜力的菌株7株,经鉴定其中3株为Pseudomonassp.,3株为Bacillussp.,Klebsiellaoxytoca1株;黄芪PGPR菌分布呈根际效应,最终筛选出7 株综合性能良好、有进一步开发利用价值的PGPR。
References:
[1] Qin X M, Li Z Y, Sun H F,etal. Status and analysis ofAstragalusmembranaceusresource in China. China Journal of Chinese Materia Medica, 2013, 38(19): 3234-3238. 秦雪梅, 李震宇, 孙海峰, 等. 我国黄芪药材资源现状与分析. 中国中药杂志, 2013, 38(19): 3234-3238.
[2] Zhang L T, Guo B L, Zhu S C,etal. Investigation report on germplasm resources ofAstragalusmembranaceus. Chinese Herbal Medicine Magazine, 2006, 29(8): 771-773. 张兰涛, 郭宝林, 朱顺昌, 等. 黄芪种质资源调查报告. 中药材, 2006, 29(8): 771-773.
[3] Dong Q. Countermeasures of Chinese export of traditional Chinese medicine. Chinese Herbal Medicine Magazine, 2001, 24(1): 6. 董庆. 我国中药出口的对策. 中药材, 2001, 24(1): 6.
[4] Yao T. Research progress of plant growth promoting rhizobacteria. Grassland and Turf, 2002, 4(2): 3-5. 姚拓. 促进植物生长菌的研究进展. 草原与草坪, 2002, 4(2): 3-5.
[5] Rong L Y, Yao T, Feng J,etal. Effect of partly replacing chemical fertilizer by PGPR biofertilizer on pea growth. Grassland and Turf, 2014, 34(1): 7-12. 荣良燕, 姚拓, 冯今, 等. PGPR微生物肥代替部分化肥对豌豆生长的影响. 草原与草坪, 2014, 34(1): 7-12.
[6] Chen L, Yao T, Chai Q,etal. Effect of chemical fertilizer partly replaced by microbial fertilizer on maize growth and quality. Grassland and Turf, 2016, 36(1): 20-25, 30. 陈龙, 姚拓, 柴强, 等. 微生物肥料替代部分化学肥料对玉米生长及品质的影响. 草原与草坪, 2016, 36(1): 20-25, 30.
[7] Kumar N, Sowmyamala B V, Kumar S. Effect of plant growth promoting rhizobacteria (PGPR) on growth and yield of bitter gourd. International Journal of Applied Biology and Pharmaceutical Technology, 2012, 3(1): 1-7.
[8] Yao T. Associative nitrogen-fixing bacteria in the rhizosphere ofAvenasativain an alpine regionⅡPhosphate-solubilizing power and auxin production. Acta Prataculturae Sinica, 2004, 13(3): 85-90. 姚拓. 高寒地区燕麦根际联合固氮菌研究Ⅱ固氮菌的溶磷性和分泌植物生长素特性测定. 草业学报, 2004, 13(3): 85-90.
[9] Hu J C, Xue D L, Ma C X,etal. Research advances in plant growth-promoting rhizobacteria and its application prospects. Chinese Journal of Applied Ecology, 2004, 15(10): 1963-1966. 胡江春, 薛德林, 马成新, 等. 植物根际促生菌(PGPR)的研究与应用前景. 应用生态学报, 2004, 15(10): 1963-1966.
[10] Li F X, Zhang D G, Yao T. Study on cultural conditions of plant growth promoting rhizobacteria in rhizosphere of oat in alpine region. Journal of Gansu Agricultural University, 2004, 39(3): 316-320. 李凤霞, 张德罡, 姚拓. 高寒地区燕麦根际高效PGPR菌培养条件研究. 甘肃农业大学学报, 2004, 39(3): 316-320.
[11] Li P, Yang H Q, Li T L,etal. Selection and optimization ofSinorhizobiumfrediimedium. Journal of Heilongjiang Bayi Agricultural University, 2007, 19(6): 71-74. 李萍, 杨会清, 李泰仑, 等. 费氏中华根瘤菌培养基的选择及优化. 黑龙江八一农垦大学学报, 2007, 19(6): 71-74.
[12] Hafeez F Y, Yasmin S, Ariani D,etal. Plant growth-promoting bacteria as biofertilizer. Agronomy for Sustainable Development, 2006, 26(2): 143-150.
[13] Chen J, Lu J K, Kang L H,etal. Preliminary identification and phosphate-solubilizing ability of the mangrove forest, and its optimum culture. Microbiology China, 2009, 36(81): 1183-1188. 陈俊, 陆俊馄, 康丽华, 等. 红树林溶磷菌的初步鉴定、溶磷能力测定及其优化培养. 微生物学通报, 2009, 36(81): 1183-1188.
[14] Dou X T. Biological Nitrogen Fixation[M]. Beijing: Agricultural Press, 1989. 窦新田. 生物固氮[M]. 北京:农业出版社, 1989.
[15] Ma W B. Screening Plant Growth Promoting Rhizobacteria Resources and Their Characteristics of Legumes[D]. Lanzhou: Gansu Agricultural University, 2015. 马文彬. 9种豆科牧草根际促生菌筛选及特性研究[D]. 兰州: 甘肃农业大学, 2015.
[16] Buchanan R E, Gibbons N E. Bergey’s Manual of Determinative Bacteriology[M]. 8th Edition. Williams & Wilkins, 1994: 520-521.
[17] Dong X Z, Cai M Y. Handbook of Common Bacterial System Identification[M]. Beijing: Science Press, 2001. 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001.
[18] Cheng B S, Fang Y L, Liu Y L,etal. Screening and promotion effect of phosphate-solubilizing bacteria from grapevine rhizosphere in Weibei Semi-arid Plateau. Acta Agriculturae Boreali-occidentalis Sinica, 2009, 4: 185-190. 程宝森, 房玉林, 刘延林, 等. 渭北旱塬葡萄根际解磷细菌的筛选及其对葡萄促生效应研究. 西北农业学报, 2009, 4: 185-190.
[19] Wu F, Cui P, Xia S Y,etal. Identification and the phosphate solubilizing capacity of mulberry rhizosphere phosph bacteria. Science of Sericulture, 2007, 33(4): 521-527. 吴凡, 崔萍, 夏尚远, 等. 桑树根际解磷细菌的分离鉴定及解磷能力的测定. 蚕业科学, 2007, 33(4): 521-527.
[20] Zhao X R, Lin Q M, Li B G. The relationship between rock phosphate solubilization and pH and organic acid production of microorganisms. Journal of Microbiology, 2003, 23(3): 5-7. 赵小蓉, 林启美, 李保国. 微生物溶解磷矿粉能力与pH及分泌有机酸的关系. 微生物学杂志, 2003, 23(3): 5-7.
[21] Zhao X R, Lin Q M, Li B G. The solubilization of four insoluble phosphates by some microorganisms. Acta Microbiologica Sinica, 2002, 42(2): 236-241. 赵小蓉, 林启美, 李保国. 溶磷菌对4种难溶性磷酸盐溶解能力的初步研究. 微生物学报, 2002, 42(2): 236-241.
[22] Narsian V. Aspergillus aculeatus as a rock phosphate solubilization. Soil Biology and Biochemistry, 2000, 32(4): 559-565.
[23] Tang Z, Yang H Y, Li L L. Advance and application prospect of phosphate-solubilizing fungi. Journal of Anhui Agricultural Science, 2014, 42(32): 11287-11288, 11296. 唐哲, 杨洪一, 李丽丽. 解磷真菌的研究进展与应用前景. 安徽农业科学, 2014, 42(32): 11287-11288, 11296.
[24] Patel D K, Archana G, Naresh K G. Variation in the nature of organic acid secretion and mineral phosphate solubilization byCitrobactersp. DHRSS in the presence of different sugars. Current Microbiology, 2008, 65: 168-174.
[25] Gyaneshwar P, Naresh Kumar G, Parekh L J,etal. Role of soil microorganisms in improving P nutrition of plants. Plant Soil, 2002, 24(5): 83-93.
[26] Prasanna N D, Vijayalakshmi K, Shaheen S K,etal. Screening and isolation of phosphate solubilizingPseudomonasstutzeri(EGB3) from gut of earthworm (Eiseniafoetida): solubilization as influenced by organic acids. Journal of Pure & Applied Microbiology, 2010, 4(2): 717-723.
[27] Delvasto P, Ballester A, Munoz J A,etal. Mobilization of phosphorus from iron ore by the bacterium burkholderia caribensis FeGL03. Minerals Engineering, 2009, (22): 1-9.
[28] Guan G L. Biological Resources of Nitrogen Fixation in the Arid Area of Xinjiang[M]. Beijing: Science Press, 1991: 3. 关桂兰. 新疆干旱区固氮生物资源[M]. 北京: 科学出版社, 1991: 3.
[29] Ma W W, Yao T, Pu X P,etal. Screening and characteristics of phosphate-solubilizing bacteria in rhizosphere of 7 grasses on eastern Qilian Mountains. Pratacultural Science, 2015, 32(4): 515-523. 马文文, 姚拓, 蒲小鹏, 等. 东祁连山7种禾草根际溶磷菌筛选及其溶磷特性.草业科学, 2015, 32(4): 515-523.
[30] Zhang Y. Screening and Promoting Growth Mechanism of Four Species of Grass Roots in the Alpine Grassland of Tibet[D]. Lanzhou: Gansu Agricultural University, 2013. 张英. 西藏阿里高寒草原四种牧草根际促生菌资源筛选及促生机理研究[D]. 兰州: 甘肃农业大学, 2013.
[31] Sun G Z, Yao T, Zhao G Q,etal. Research progress and prospects in controlling plant diseases usingPseudomonasfluorescens. Acta Prataculturae Sinica, 2015, 24(4): 174-190. 孙广正, 姚拓, 赵桂琴, 等. 荧光假单胞菌防治植物病害研究现状与展望. 草业学报, 2015, 24(4): 174-190.
[32] Chen Q. Molecular Characterization of Pina Gene in Einkorn Wheat and Biocontrol Agents of Wheat-Pseudomonasfluroscence[D]. Ya’an: Sichuan Agricultural University, 2011. 陈庆. 一粒系小麦Pina基因与小麦生防细菌荧光假单胞菌研究[D]. 雅安: 四川农业大学, 2011.
Identification of plant growth promoting rhizobacteria Astragalus membranaceus and their effectives
MA Cong-Yu1, ZHANG Ying2, MA Wen-Bin1, LI Jian-Hong1, YAO Tuo1*
1.CollegeofPratacultureScience,GansuAgriculturalUniversity;KeyLaboratoryofGrasslandEcosystem,MinistryofEducation;Sino-U.S.CentersforGrazinglandEcosystemSustainability,Lanzhou730070,China; 2.DepartmentofGrasslandScience,AgricultureandAnimalHusbandryCollege;StateKeyLaboratoryofPlateauEcologyandAgriculture,QinghaiUniversity,Xining810016,China
In order to obtain and study the performance of plant growth promoting rhizobacteria (PGPR) inAstragalusmembranaceus, the root nodule, root morphology and rhizosphere soil ofA.membranaceuswere collected. Strains of rhizobium and phosphate solubilizing bacteria were isolated and assessed for the potentially useful characteristics of high nitrogenase activity in the rhizobium and high phosphate solubilisation and ability to secrete 3-indoleacetic acid (IAA) in the phosphate solubilizing bacteria. Potential PGPR strains were then identified using physiological and biochemical characteristics and 16S rDNA sequence analysis. Results showed there are large amounts of phosphorus-dissolving bacteria in the rhizospheres ofA.membranaceus. The quantitative distribution of bacteria and PGPR shows a strong rhizosphere effect, with rhizosplan or surface of roots (RP)>soil adhering to roots (RS)>soil away from roots (NRS)>histoplan or interior of roots (HP). We have isolated 76 PGPR strains, composed of 1 rhizobium, 42 inorganic phosphate solubilizing and 33 organic phosphate solubilizing bacteria strains. There are 7 phosphate solubilizing strains with the ability to secrete IAA. A further 8 potential PGPR strains were identified (1 rhizobium and 7 phosphate solubilizing). 3 phosphate solubilizing strains were identified asPseudomonassp., 3 phosphate solubilizing strains asBacillussp., 1 phosphate solubilizing strain asKlebsiellaoxytoca, 1 rhizobium strain asRhizobiumsp. This study has identified potential PGPR for the development of microbial fertilizers forA.membranaceus.
Astragalusmembranaceus; plant growth promoting rhizobacteria (PGPR); characteristics of the growth; strains identification
10.11686/cyxb2016263
http://cyxb.lzu.edu.cn
2016-06-27;改回日期:2016-10-19
国家自然基金(31360584和31260025)资助。
马骢毓(1987-),女,甘肃兰州人,在读博士。E-mail:1401893955@qq.com*通信作者Corresponding author. E-mail: yaotuo@gsau.edu.cn
马骢毓, 张英, 马文彬, 李建宏, 姚拓. 黄芪根际促生菌(PGPR)筛选与特性研究. 草业学报, 2017, 26(1): 149-159.
MA Cong-Yu, ZHANG Ying, MA Wen-Bin, LI Jian-Hong, YAO Tuo. Identification of plant growth promoting rhizobacteriaAstragalusmembranaceusand their effectives. Acta Prataculturae Sinica, 2017, 26(1): 149-159.

