日本大豆引种四川盆地的品质评价研究
吴海军,杨才琼,Nasir Iqbal,邓俊才,戴炜,刘卫国,2,杨峰,舒凯,2,杜俊波,杨文钰*,刘江,2*
(1.四川农业大学农学院,农业部西南作物生理生态与耕作重点实验室,四川 成都 611130;2.四川农业大学生态农业研究所,四川 成都 611130)
日本大豆引种四川盆地的品质评价研究
吴海军1,杨才琼1,Nasir Iqbal1,邓俊才1,戴炜1,刘卫国1,2,杨峰1,舒凯1,2,杜俊波1,杨文钰1*,刘江1,2*
(1.四川农业大学农学院,农业部西南作物生理生态与耕作重点实验室,四川 成都 611130;2.四川农业大学生态农业研究所,四川 成都 611130)
将原产于日本的17个大豆种质资源引种至我国四川盆地栽培,并对其引种前后的籽粒品质性状进行分析评价,探究引种大豆在四川盆地的适应性,以期为丰富西南大豆种质资源提供参考。品质性状变异分析结果表明,大豆异黄酮的变异系数大,除苷元外均达到30%以上,而其余性状的变异系数也均大于10%。与引种前相比,各供试大豆的可溶性蛋白含量普遍升高,而脂肪酸、可溶性多糖和异黄酮含量普遍降低。基于引种大豆11个品质性状的主成分聚类分析,将供试的17份种质资源划分为五大类,其中,Ⅰ类大豆为高脂肪酸品种,其生育期适中,亚油酸含量大于55‰,可作为高油脂杂交育种亲本材料加以利用;Ⅲ类大豆为高蛋白型品种,可作为豆制品开发原材料加以利用;Ⅴ类大豆为高异黄酮型品种,可作为功能性成分原料来源加以利用。
日本大豆;引种;品质性状;综合评价
大豆(Glycinemax)为一年生草本植物,原产我国,至今已有5000多年的种植历史,最初由朝鲜和日本逐步传向世界各国,成为许多国家和地区的主要粮食作物[1],也是重要的饲草植物之一[2]。日本作为最早引种大豆的国家,拥有2000多年的大豆栽培历史,在不同的生态环境下,经长期自然选择和人工选育,形成了具有不同特点的大豆品种。近年来,日本成功选育出具有诸多优质特性的大豆新品种,如脂肪氧化酶缺失大豆品种“Suzusayaka”、A型皂苷缺失品种“Kinusayaka”、高异黄酮含量品种“Yukipirika”、高蛋白抗倒伏品种“Satonohohoemi”、高抗病早熟小粒大豆品种“Suzuhonoka”等,并根据其品质特性,对其进行了功能划分,如:豆腐用大豆、豆乳用大豆、纳豆用大豆等[3-6]。我国大豆育种以高产为主,高蛋白、高异黄酮特用大豆品种的选育已有诸多实践,也有饲草大豆研究的相关报道[2]。
国外引种是既快捷又经济实惠的种质创新途径,在大豆育种中直接或间接地利用优异、配合力高的种质资源作亲本,不仅有利于优良大豆品种的选育,还有利于丰富我国大豆育成品种的遗传基础[7]。20世纪70年代以来,我国相继从日本成功引进多个大豆品种,直接或间接地在国内各地加以利用,如:由日本引种的大豆种质“十胜长叶”,已在国内北方多地区育成了许多优良品种,为我国东北大豆育种发挥了重要作用[7-8];日本大豆品种“白千成”、“塞凯20(西海20)”在四川的成功引种成为日本大豆引种我国西南地区的典型范例,其种质的直接利用(引种)不仅为四川提供了优质的大豆品种,其间接利用(杂交)也为后来四川大豆新品种的育成,提供了优质的遗传基础[9]。
丰富的种质资源是作物育种研究的重要前提,国外高产优质大豆品种的引进是促进我国大豆生产的有效措施之一。本研究将搜集到的17个日本大豆品种引至四川盆地栽培,对其品质特性进行了初步的比较研究,以期为南方大豆种质创新提供参考。
1 材料与方法
1.1 供试材料
日本大豆种质资源于2013年分别采自日本北海道、冈山县、富山县、滋贺县等地,共17份材料(表1),储藏于四川农业大学作物栽培与耕作学系大豆种质资源库。
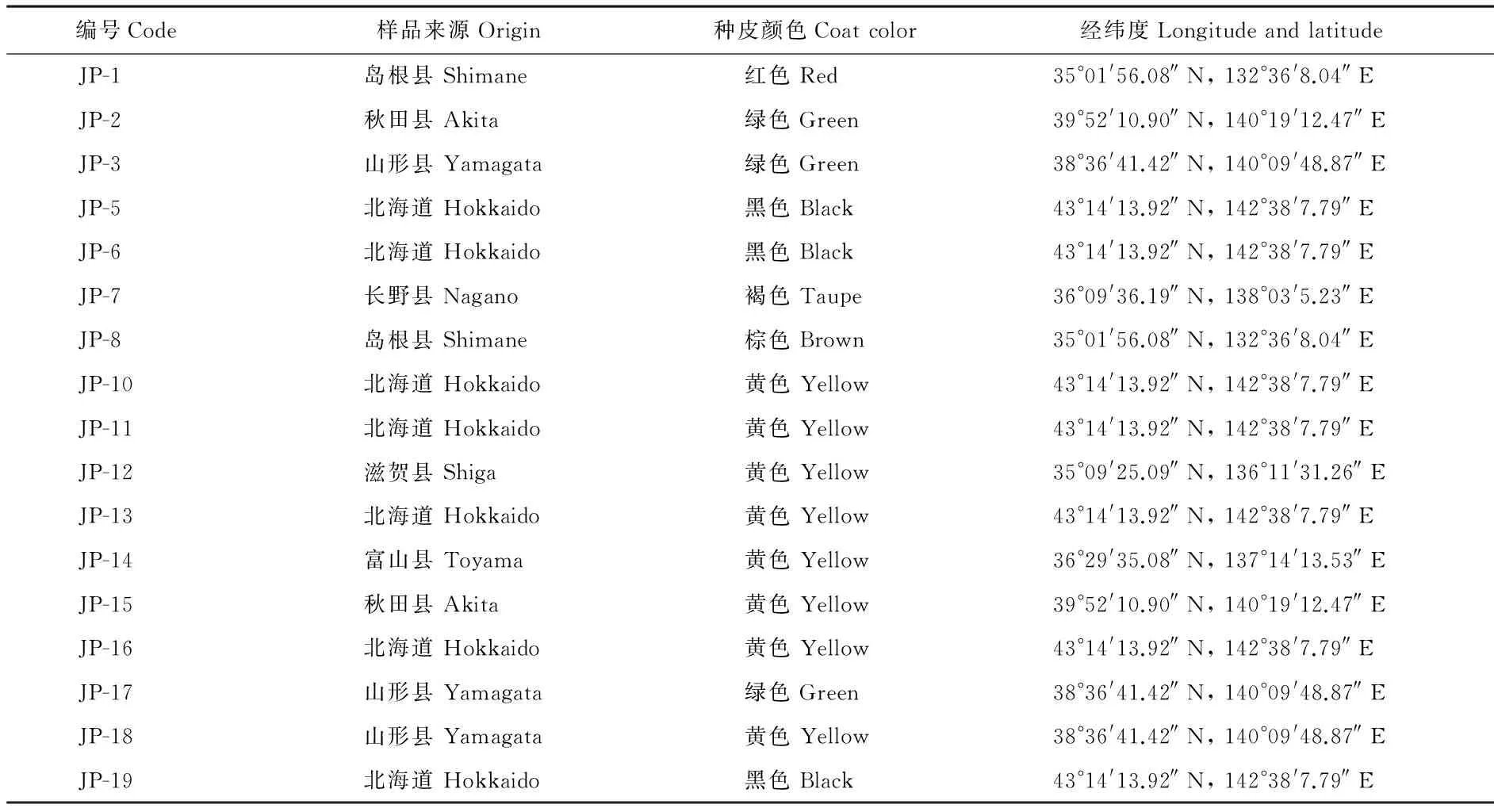
表 1 供试大豆信息Table 1 Information of Japanese soybean varieties
1.2 试验区概况
田间试验于2014年春季在四川农业大学(雅安)教学科研园区进行。其地处北纬30°08′,东经103°00′,海拔620 m,年均气温16.2 ℃,极端高温37.7 ℃,极端低温-3 ℃,年降水量1774.3 mm,年均相对湿度79%,年均日照时数1039.6 h,日均温≥5 ℃的年积温5770.2 ℃,为典型的亚热带季风性湿润气候。试验地土壤为紫色土,土壤pH值为5.46,有机质含量为1.46%,速效氮、磷、钾含量分别为100.63,4.73和338.24 mg/kg[10]。
1.3 试验设计
本试验采用随机区组设计,重复5次,小区面积为20 m2,行长10 m,行距0.4 m,穴距为0.2 m;2014年4月4日播种,人工穴播,每穴播种量为3粒,于真叶展开期间苗,每穴留2株,其他管理同大田生产。
1.4 取样方法
大豆收获阴干后脱粒粉碎过60目筛(孔径0.25 mm),于真空干燥箱40 ℃下干燥48 h,用于蛋白质、脂肪酸、异黄酮和可溶性多糖等品质性状的测定。
1.5 测定项目及方法
本试验对可溶性蛋白、可溶性多糖,饱和脂肪酸和不饱和脂肪酸、异黄酮等成分进行了检测。可溶性蛋白含量采用考马斯亮蓝G-250法测定[11];可溶性多糖含量采用硫酸苯酚法测定[12];脂肪酸含量采用气相色谱质谱联用法测定(岛津GCMS-QP2010)[13];异黄酮含量采用高效液相色谱法测定(Agilent 1100)[14]。各测试项目分别设置生物学重复和技术重复各3次。
1.5.1 异黄酮含量的测定 样品提取:准确称量100 mg大豆粉放入离心管中;加入80%的甲醇5 mL,超声提取3 h;6000 r/min离心10 min,取上清液过0.22 μm滤膜过滤,4 ℃冰箱保存备用。
色谱条件:色谱柱为C18反相色谱柱YMC-pack ODS-AQ(4.6 mm×250 mm, 5 μm, 12 nm);进样量5 μL;柱温30 ℃;流动相为100%乙腈(A)和0.1%(V/V)乙酸水溶液(B);流速0.8 mL/min;梯度洗脱程序:0 min, 15% A; 0~30 min, 15%~20% A; 30~60 min, 20%~40% A; 60~70 min, 40% A;延迟时间5 min; 检测波长260 nm。
1.5.2 脂肪酸含量的测定 样品提取:称取大豆粉末100 mg,置于离心管①中,加入1.5 mL正己烷超声30 min后,室温浸提5 h,6000 r/min离心5 min,移取上清液于离心管②中,再加入1.5 mL正己烷超声30 min,离心取上清液合并于离心管② 中,加入3 mL 0.4 mol/L KOH-MeOH进行酯化反应。室温涡旋30 s,静置60 min,在6000 r/min离心5 min。取上清液定容于5 mL容量瓶,过0.45 μm滤膜后进气相色谱-质谱联用仪(gas chromatography-mass spectrometer, GC-MS)测定。
色谱柱:RTX-5MS (30 m×0.25 mm×0.25 μm);进样量:1 μL;分流比:10∶1;进样口温度:270 ℃;载气:氦气40 mL/min;程序升温的方式:130 ℃ 保持2 min,以6.5 mL/min升到170 ℃,保持6 min;然后以3 mL/min升到215 ℃ 保持13 min; 以3 mL/min升到230 ℃保持10 min;信号采集模式:选择离子监控 (selected ions monitoring, SIM)。
1.5.3 可溶性多糖含量的测定 将上述离心管①敞放于通风橱内24 h,挥尽离心管中残留的正己烷。待正己烷挥尽后,向其中加入蒸馏水8 mL,于40 ℃条件下超声提取30 min,6000 r/min离心5 min,取上清液于100 mL容量瓶中,再次向离心管①中加8 mL蒸馏水,超声提取30 min,6000 r/min离心5 min后合并上清液至容量瓶,定容至100 mL。于50 mL试管中加入0.5 mL大豆水提液并补充1.5 mL蒸馏水,再加入1 mL 5%的苯酚溶液,充分摇匀后,缓慢向每支试管中加入5 mL浓硫酸,立即盖上活塞,迅速以涡旋仪振荡10 s摇匀。放入40 ℃水浴锅中水浴15 min,取出后冷却摇匀,以蒸馏水做参比,490 nm波长下测定吸光度值。
1.5.4 可溶性蛋白含量的测定 可溶性蛋白提取液与上述1.5.3相同,于50 mL试管中加入0.5 mL大豆水提液并补充0.15 mol/L的NaCl 溶液1.5 mL,涡旋混匀后加入考马斯亮蓝G-250溶液5 mL,涡旋30 s,静置2 min后,于595 nm波长下测定吸光度值。
1.6 数据分析
采用Excel 2013进行数据整理,采用SPSS 20.0和Origin 8.5进行统计分析和绘图。
2 结果与分析
2.1 引种大豆品质性状分析
通过对供试的17个大豆材料品质分析结果表明(表2, 图1),引种后可溶性多糖含量以JP-1为最高,达到11.240%,JP-13为最低,为7.215%,普遍达到8.99%水平,变异系数为10.866%;可溶性蛋白含量以JP-18为最高,达到30.925%,JP-6含量为最低,达到18.970%,变异系数为12.637%,普遍达到26.49%水平;脂肪酸含量以JP-2为最高,达到100.521‰,JP-16含量最低,达到47.175‰,普遍达到74.512‰水平,变异系数为16.905%;异黄酮含量以JP-8为最高,达到3.024‰,JP-19含量最低,大于2.5‰的材料有JP-1、JP-2、JP-7、JP-8。
对9个品质性状统计分析结果表明,丙二酰基化糖苷、葡萄糖苷、乙酰化糖苷、总异黄酮在所有供试材料中变异幅度较大,变异系数为37.644%,34.080%,31.948%和31.472%(表2);其余品质性状的变异幅度较小,变异系数为10.866%~29.504%(表2,组间变异)。由此可见,17个引种大豆的9个品质性状的差异主要集中在大豆功能性成分异黄酮方面。
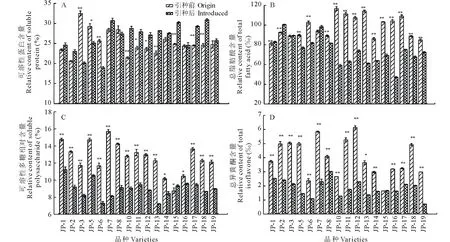
图 1 引种前后大豆品质性状的差异性比较Fig.1 Difference comparison of quality characters between origin and introduced Japanese soybeans **表示在0.01水平上差异极显著,*表示在0.05水平上差异显著。**show significance at the level of 0.01, *show significance at the level of 0.05.
2.2 引种前后大豆品质性状的差异性分析
对17个日本大豆资源引种前后可溶性蛋白、多糖、脂肪酸、异黄酮含量等品质性状进行差异性比较分析,结果如图1所示。由图1A可知,多数供试大豆材料的可溶性蛋白含量在引种后均呈现不同程度的增加,其中JP-10、JP-13、JP-15、JP-17、JP-18的可溶性蛋白含量较引种前极显著(P<0.01)增加,JP-11、JP-12较引种前显著(P<0.05)增加,仅有JP-3、JP-5、JP-6这3个供试材料的可溶性蛋白含量较引种前显著降低。由图1B可知,供试大豆引种后总脂肪酸含量均呈不同程度的降低,以JP-10、JP-11、JP-12、JP-13、JP-14、JP-15、JP-16、JP-17这8个供试材料降低幅度最大,达极显著水平(P<0.01),JP-1和JP-2供试材料的脂肪酸含量均较引种前极显著升高(P<0.01)。 由图1C可知, 供试大豆引种后可溶性多糖含量均出现不同程度的降低,JP-14、JP-16两个供试材料呈显著(P<0.05)降低其余14个供试材料呈极显著(P<0.01)降低,仅JP-15呈显著(P<0.05)的升高;引种后各大豆材料异黄酮含量均呈不同程度的降低(图1D),除JP-15不显著和JP-13呈显著(P <0.05)外,其余均呈极显著降低。
2.3 引种大豆品质性状综合评价
2.3.1 主成分分析 对供试材料的11个品质指标进行主成分分析,由表3可知,第1主成分的效应PC1为32.610%,第2主成分的效应PC2为28.010%,第3主成分的效应PC3为16.560%,第4主成分的效应PC4为8.360%,前4项主成分的累积贡献率为85.640%,累计率大于85%,前4个主成分可代表各供试材料的品质信息。在第1主成分中棕榈酸、硬脂酸等指标的贡献较大,说明该类指标主要反映饱和脂肪酸的含量特征;第2主成分中的苷元、乙酰苷、可溶性蛋白等的贡献较大,主要反映大豆异黄酮和蛋白的含量特征;第3主成分中的亚油酸、油酸、α-亚麻酸等的贡献较大,主要反映大豆不饱和脂肪酸的含量特征;第4主成分中的可溶性多糖的贡献最大,主要反映大豆可溶性多糖的含量特征。
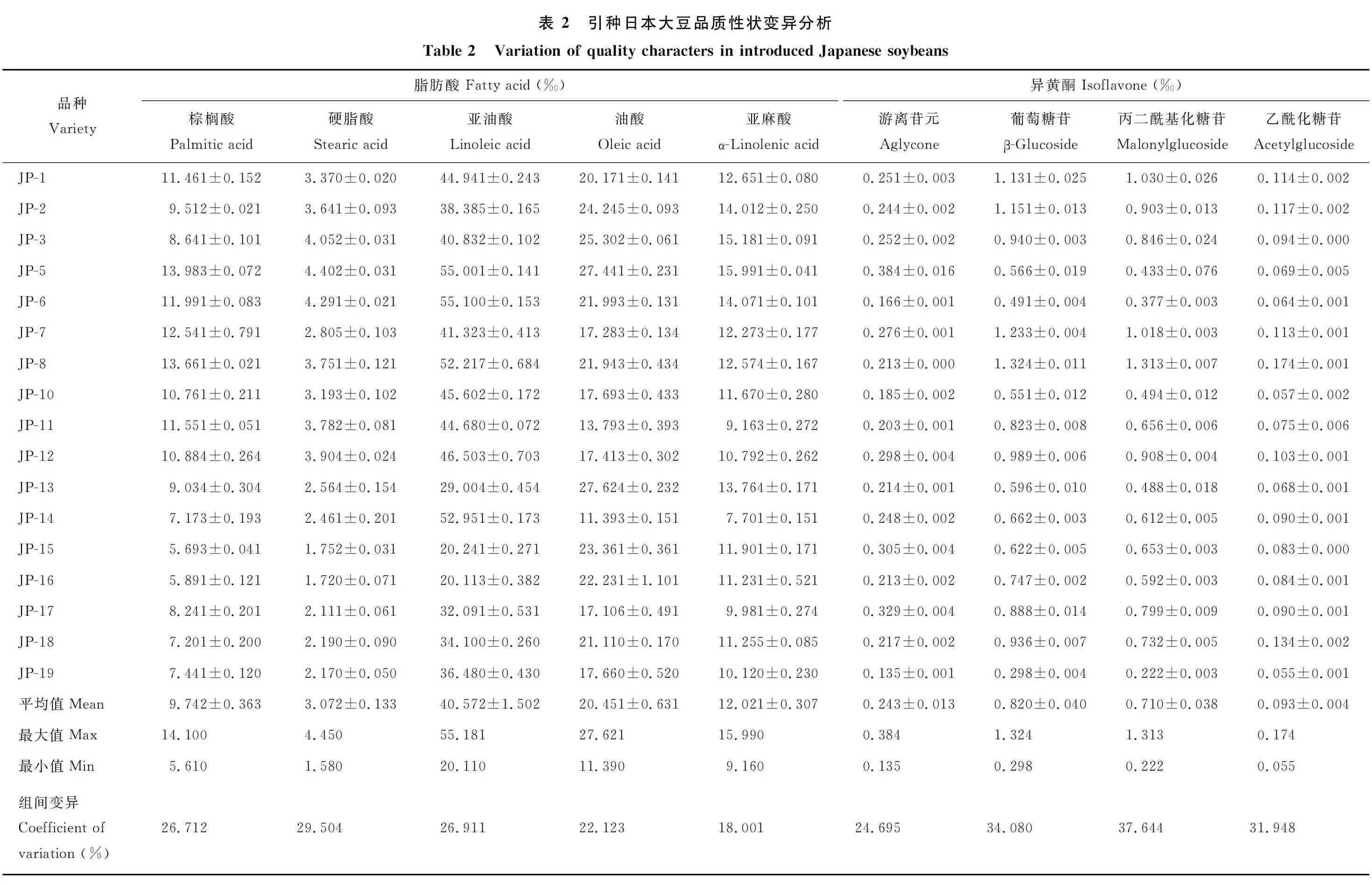

表3 各主成分的特征向量及累积贡献率Table3 Eigenvectorsandaccumulatedcontributionofprincipalcomponents项目Item特征向量EigenvectorPC1PC2PC3PC4棕榈酸Palmiticacid0.403-0.185-0.2620.081硬脂酸Stearicacid0.415-0.284-0.149-0.028亚油酸Linoleicacid0.315-0.222-0.472-0.077油酸Oleicacid0.148-0.1950.6370.060α-亚麻酸α-linolenic0.283-0.2890.4680.046苷元Daidzein0.0410.4160.160-0.052葡萄糖苷Glucoside0.4070.3380.060-0.061丙二酰苷Malonylglycosides0.3850.3740.043-0.083乙酰苷Acetylglycosides0.3180.3680.064-0.226可溶性多糖Solublepolysac-charides0.1250.164-0.0450.957可溶性蛋白Solubleprotein-0.1770.353-0.1560.041特征值Eigenvalue3.5873.0911.8220.919方差贡献率Variancecontri-butionrate(%)32.61028.01016.5608.360方差累计贡献率Accumula-tedcontributionrate(%)32.61060.62077.18085.540 PC1:第1主成分Firstprincipalcomponent;PC2:第2主成分Secondprin-cipalcomponent;PC3:第3主成分Thirdprincipalcomponent;PC4:第4主成分Fourthprincipalcomponent.
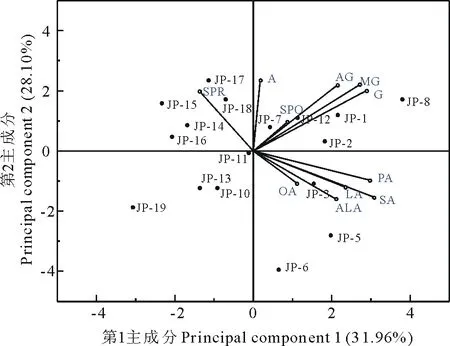
图2 引种大豆各性状之间的关系Fig.2 Relationships between quality characters of introduced soybeansSPR:可溶性蛋白Soluble protein;SPO:可溶性多糖Soluble polysaccharide;A:苷元Daidzein;AG:乙酰苷Acetyl glycosides;MG:丙二酰苷Malonyl glycosides;G:葡萄糖苷Glucoside;PA:棕榈酸Palmitic acid;SA:硬脂酸Stearic acid;LA:亚油酸Linoleic acid;OA:油酸Oleic acid;ALA:α-亚麻酸α-linolenic.
在主成分分析的基础上根据第1和第2主成分的载荷值和得分值绘制双标图(图2)。从图2中可同时得到与品种及其品质性状有关的信息,各品质性状的相关性用特征向量夹角反映,其夹角的余弦值代表相关系数。当夹角小于90°时,夹角越小,则其正相关关系越显著;当夹角大于90°时,夹角越大负相关关系越显著[15]。双标图显示,供试材料的脂肪酸含量与可溶性蛋白含量之间有显著的负相关关系,而与可溶性多糖和异黄酮糖苷含量间存在正相关关系。5类脂肪酸之间、4类异黄酮之间分别存在不同程度的正相关关系。而主成分分析将17份供试材料划分为4部分,其中位于PC1负轴的JP-10、JP-13、JP-14、JP-15、JP-16、JP-17、JP-18、JP-19等8份材料的可溶性蛋白含量较高,是蛋白类食品开发的可选材料;而位于PC1正轴的8份材料中,以JP-1、JP-2、JP-8的异黄酮含量较高,可用于功能性食品开发原料加以利用;而JP-5、JP-6的脂肪酸含量较为丰富,可作为高油脂类大豆品种的育种亲本。
2.3.2 聚类分析 基于11个品质性状,采用系统聚类法对17份供试材料进行聚类分析(图3),当欧氏距离为14时,可将供试材料分为5类。其中,类群Ⅰ包含JP-5和JP-6两个材料,为高脂肪酸类型,其不饱和脂肪酸含量大于55‰,可作为高油脂大豆加以利用;类群Ⅲ包括JP-13、JP-15、JP-17、JP-18等材料,这部分材料普遍具有较高含量的可溶性蛋白,其含量在27.57%~30.92%之间,并且该部分材料的脂肪酸含量普遍低于80‰,这类材料可作为植物蛋白制品原料来源加以利用;另一方面,已有研究表明,可溶性蛋白较高的大豆资源的抗性潜力更大,蛋白的含量对植株持水性有重要影响,在植株受到干旱胁迫时,植物体内的可溶性蛋白含量显著升高,渗透调节物质增加,以维持渗透压,保持水分抵御干旱[16];因此,该类大豆还可作为高蛋白抗性大豆的育种基础材料加以利用。类群V的总异黄酮含量均在2‰以上,葡萄糖苷和丙二酰苷的含量普遍大于1‰,并且其他性状适中,可用于功能保健食品原料加以开发。
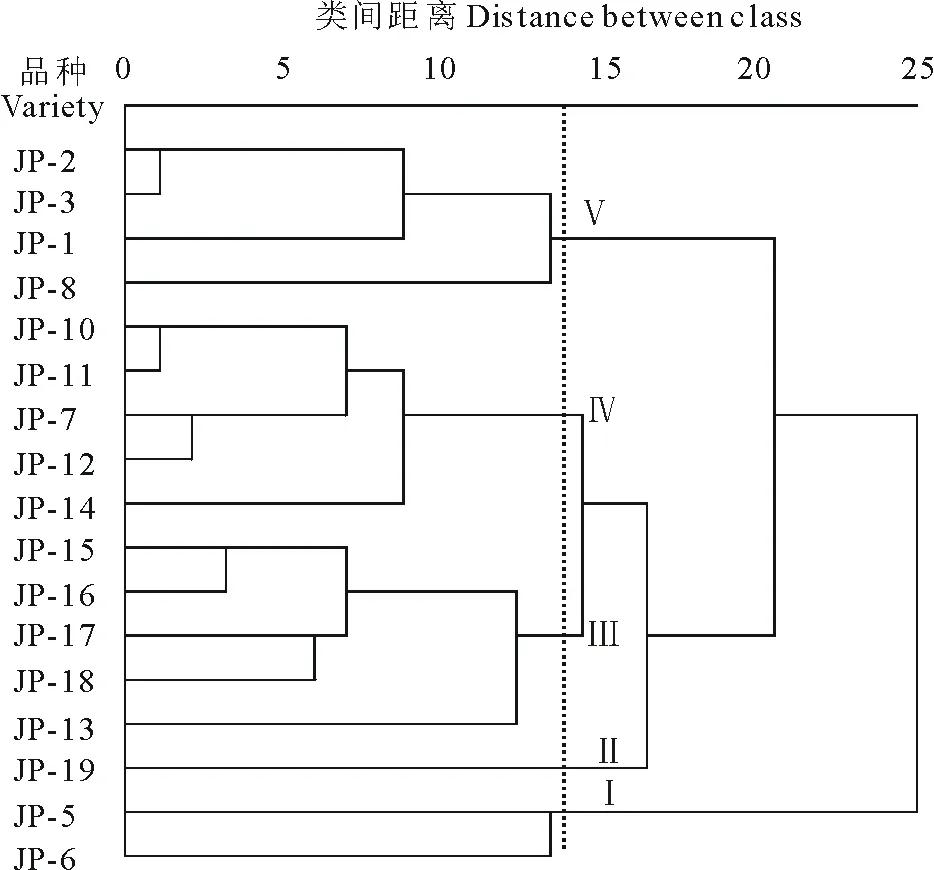
图3 引种大豆供试材料聚类树状图Fig.3 Dendrogram of clusters for introduce soybean material
3 讨论
丰富的种质资源是作物育种的基础,特异性种质资源的获得及有效评价更是育种的关键,对作物品种改良具有重要的现实意义[17]。由国外直接引进新品种,是拓宽中国大豆遗传基础的有效措施[18]。本试验中,从日本不同产地引种的17份大豆种质,其性状差异大、遗传基础丰富,为大豆育种过程中亲本选配遗传背景的拓宽奠定了种质基础。
大豆种质资源引种后,因所处地理环境的改变而影响其产量和品质,大豆蛋白、脂肪、异黄酮的积累与纬度、海拔等环境因素影响密切相关[19-20]。我国北方、黄淮海、南方三大生态区大豆蛋白含量呈现自北向南递增的趋势,而脂肪含量呈现递减趋势[21],大豆脂肪含量与纬度、降水量呈显著的负相关[22]。大豆异黄酮含量与纬度、海拔呈高度的正相关,与各产地的平均气温和降水量呈负相关[23],高纬度,低气温更有利于大豆异黄酮的积累[20]。本研究发现,供试大豆引种后的可溶性蛋白含量较引种前均呈现不同程度的增加,可溶性多糖、脂肪酸、异黄酮含量却呈现不同程度的降低。本研究中引种的日本大豆原产地所处纬度与我国华北地区相近,纬度高于四川盆地,同时,四川盆地雨量充沛、湿度大,日照较少,“北种南移”和四川适宜的气候使大豆蛋白质含量增加,脂肪酸、异黄酮及可溶性多糖含量普遍降低,这一结果与其他研究结果一致[19,24-25]。但与多数材料不同的是,供试的17个大豆资源中,JP-3、JP-5和JP-6引种后的可溶性蛋白含量较引种前显著降低,JP-2的脂肪酸含量较引种前显著升高,这与多数“北种南移”大豆品质变化的“普遍规律”相异,而JP-2、JP-3均为绿皮大豆,JP-5、JP-6均为黑皮大豆,其引种后蛋白、脂肪含量变化的差异可能与其种皮颜色有关,这有待进一步研究。
各性状间的相关性分析结果表明,引种后大豆的可溶性蛋白与脂肪酸的含量呈极显著负相关,可溶性多糖与异黄酮之间呈正相关关系;而作为大豆的主要功能性成分,大豆异黄酮具有多种结构类型,其在大豆籽粒中主要以糖苷形式存在,尤以酰化异黄酮苷的含量最高[26]。本研究表明,大豆可溶性多糖与乙酰化糖苷含量,游离苷元与丙二酰基化糖苷含量呈显著正相关,符合大豆异黄酮合成的代谢规律[27-28]。
引种后种质资源的综合评价是衡量引种材料利用价值的重要环节。本研究通过主成分分析和聚类分析,将17个引种日本大豆分为五大类,不同的分析方法所获分类结果基本一致,表明种质资源的分类结果可靠。生产实践中,可根据不同大豆种质资源独特的品质特征加以充分利用。四川春大豆生产典型品种成豆8号和南豆8号,其生育期为95~110 d,分枝3~4个,单株有效荚数为32个以上,单株粒重13~18 g,脂肪酸含量为16%~21%,蛋白含量达44%以上[29]。17份引种大豆种质资源中,JP-5、JP-8、JP-12、JP-15、JP-16等材料在其引种四川盆地后较上述品种的产量更高、品质更好,且生育期合理,可作为优质种质资源在四川盆地进行春季种植。
References:
[1] Zhang R J, Shi Y, Mu Z X,etal. Present situation of soybean breeding and development countermeasures. Shanxi Agricultural Sciences, 2008, 36(12): 20-22. 张瑞军, 师颖, 穆志新, 等. 我国大豆育种的现状与发展对策. 山西农业科学, 2008, 36(12): 20-22.
[2] Li M L, Zheng L. A study on the major components and feeding value of Wuhe (Glycinesoja) seed. Acta Prataculturae Sinica, 2011, 20(4): 137-142. 李孟良, 郑琳. 五河野生大豆种子营养成分及饲用价值研究. 草业学报, 2011, 20(4): 137-142.
[3] Kato S, Yumoto S, Takada Y. A new soybean (Glycinemax) cultivar ‘Kinusayaka’ lacking three lipoxygenase isozymes and group A acetyl saponin. Bulletin of the National Agricultural Research Center for Tohoku Region, 2007, 107: 29-42.
[4] Tanifuji K, Miyoshi T, Suzuki C,etal. Effect of temperature during the seed-filling period and varietal differences in soybean isoflavone content and components in cold districts. Japanese Journal of Crop Science, 2009, 78(1): 74-82.
[5] Kikuchi A, Kono Y, Kato S,etal. A new soybean cultivar “Satonohohoemi”, with high protein content, lodging resistance, large seed size and good quality. Bulletin of the National Agricultural Research Center for Tohoku Region, 2011, 113: 1-15.
[6] Takada G, Kono M, Kato S. A new soybean cultivar,“Suzuhonoka” with small seeds for Natto (fermented soybean), early maturing and resistance to soybean mosaic virus. Bulletin of the National Agricultural Research Center for Tohoku Region, 2008, 109: 31-40.
[7] Guo J J, Chang R Z, Zhang J X,etal. Contribution of Japanese soybean germplasm tokachi-nagaha to Chinese soybean cultivars. Soybean Science, 2007, 26(6): 807-812, 819. 郭娟娟, 常汝镇, 章建新, 等. 日本大豆种质十胜长叶对我国大豆育成品种的遗传贡献分析. 大豆科学, 2007, 26(6): 807-812, 819.
[8] Chang R Z, Qiu L J, Xu Z Y,etal. Present situation and direction of international and national soybean scientific research. Soybean Bulletin, 2004, (1): 28-29. 常汝镇, 邱丽娟, 许占友, 等. 国内外大豆科研现状及走势(续一). 大豆通报, 2004, (1): 28-29.
[9] Wang X B, Jiang Z H. Utilization of Japanese soybean varieties in Sichuan province. Southwest China Journal of Agricultural Sciences, 1996, (S1): 183-185. 王小波, 姜治华. 日本大豆品种在四川的利用. 西南农业学报, 1996, (S1): 183-185.
[10] Liu J, Chen X F, Yang W Y,etal. A study on morphological variation of germplasm resources ofOphipogonjaponicusin the Sichuan basin. Acta Prataculturae Sinica, 2010, 19(1): 143-150. 刘江, 陈兴福, 杨文钰, 等. 四川盆地麦冬种质资源的形态特征变异分析. 草业学报, 2010, 19(1): 143-150.
[11] The State Administration of Quality Supervision, Inspection and Quarantine. Determination of Coomassie Brilliant Blue SN Export Milk Proteins Beans Protein Content, SN/T3926, People’s Republic of China Entry-exit Inspection and Quarantine Industry Standards[S]. 2014. 国家质量监督检验检疫总局.出口乳蛋豆类食品中蛋白质含量的测定考马斯亮蓝法,SN/T3926,中华人民共和国出入境检验检疫行业标准[S]. 2014.
[12] Deng J C, Liu J, Lei T,etal. Effect of seed mildew in field on yield and quality of soybean during harvest season. Chinese Journal of Oil Crop Sciences, 2015, 37(1): 77-82. 邓俊才, 刘江, 雷婷, 等. 收获期籽粒田间霉变对大豆产量和品质的影响. 中国油料作物学报, 2015, 37(1): 77-82.
[13] Liu J, Yang C Q, Zhang Q,etal. Partial improvements in the flavor quality of soybean seeds using intercropping systems with appropriate shading. Food Chemistry, 2016, 207(15): 107-114.
[14] Yan W, Xiang D B, Ye M Y,etal. Isoflavonoid accumulation pattern as affected by shading from maize in soybean (Glycinemax) under relay strip intercropping system. Plant Production Science, 2015, 18(3): 302-313.
[15] Yang J W, Zhu J G, Wang S G,etal. Drought-resistance of local wheat varieties in Shanxi province of China: A comprehensive evaluation by use GGE bipolt and subordinate function. Chinese Journal of Applied Ecology, 2013, 24(4): 1031-1038. 杨进文, 朱俊刚, 王曙光, 等. 用GGE双标图及隶属函数综合分析山西小麦地方品种抗旱性. 应用生态学报, 2013, 24(4): 1031-1038.
[16] Gao Y P, Feng Y, Ma Z J,etal. Stomatal character changes of soybean leaves under water stress. Agricultural Research in the Arid Areas, 2007, 25(2): 77-79. 高彦萍, 冯莹, 马志军, 等.水分胁迫下不同抗旱类型大豆叶片气孔特性变化研究.干旱地区农业研究, 2007, 25(2): 77-79.
[17] Zhang Y F, Yan Y L, Wang H F,etal. Preliminary analysis of genetic diversity of introduced soybean germplasm in Xinjiang ecological region. Xinjiang Agricultural Sciences, 2012, 49(11): 1966-1972. 章艳凤, 严勇亮, 王宏飞, 等. 外引大豆种质资源在新疆生态区的遗传多样性分析. 新疆农业科学, 2012, 49(11): 1966-1972.
[18] Zhang J, Zhao T J, Gai J Y. Genetic diversity, specificity and population differentiation of soybean cultivars in Asia. Scientia Agriculture Sinica, 2008, 41(11): 3511-3520. 张军, 赵团结, 盖钧镒. 亚洲大豆栽培品种遗传多样性、特异性和群体分化研究. 中国农业科学, 2008, 41(11): 3511-3520.
[19] Pei Y F, Luan H H, Liu C Y,etal. Correlation analysis between soybean protein and oil content and environmental factors in Heilongjiang province. Crops, 2013, (2): 37-41. 裴宇峰, 栾怀海, 刘春燕, 等. 黑龙江省大豆蛋白质和油分含量与环境因素的相关分析. 作物杂志, 2013, (2): 37-41.
[20] Wang H L, Chen S G, Xiang S P,etal. Effects of climate factors on the relative contents of major storage protein fractions and its subunits in soybean seeds. Chinese Journal of Oil Crop Sciences, 2007, 29(4): 431-437.
[21] Li W X, Zhu Z H, Liu S C,etal. Quality characters of Chinese soybean (Glycinemax) varieties and germplasm resources. Plant Genetic Resources, 2004, 5(2): 185-192. 李为喜, 朱志华, 刘三才, 等. 中国大豆(Glycinemax)品种及种质资源主要品质状况分析. 植物遗传资源学报, 2004, 5(2): 185-192.
[22] Chen X. The effect of different ecogeographic environment on protein and fat content of soybean. Soybean Science, 2001, 20(4): 280-284. 陈霞. 不同生态区域环境对大豆蛋白质、脂肪含量的影响. 大豆科学, 2001, 20(4): 280-284.
[23] Jaakola L, Hohtola A. Effect of latitude on flavonoid biosynthesis in plants. Plant, Cell & Environment, 2010, 33(8): 1239-1247.
[24] Li J Y, Yao W Q, Gong S B,etal. The research progress of the circumstance factors on the effect of soybean isoflavones content. Chinese Agricultural Science Bulletin, 2010, 26(9): 167-170. 李菊艳, 姚文秋, 宫绍斌, 等. 环境因素对大豆异黄酮的影响研究进展. 中国农学通报, 2010, 26(9): 167-170.
[25] Tsukamoto C, Shimada S, Igita K,etal. Factors affecting isoflavone content in soybean seeds: changes in isoflavones, saponins, and composition of fatty acids at different temperatures during seed development. Journal of Agricultural & Food Chemistry, 1995, 43: 1184-1192.
[26] Wan Y, Yan Y, Xiang D,etal. Isoflavonoid accumulation pattern as affected by shading from maize in soybean (Glycinemax) under relay strip intercropping system. Plant Production Science, 2015, 18(3): 302-313.
[27] Zhang H J, Li L, Su L T,etal. Analysis of correlation and grey relation between isoflavone content and soybean quality from soybean cultivars in Heilongjiang province. Journal of Xihua University: Natural Science Edition, 2011, 30(6): 73-76. 张海军, 李琳, 苏连泰, 等. 黑龙江省栽培大豆品种(系)异黄酮含量测定与主要性状相关性分析及灰色关联度分析. 西华大学学报: 自然科学版, 2011, 30(6): 73-76.
[28] Li H, Dai C J, Lan J,etal. Primary analyses of isoflavones contents in Heilongjiang province soybean cultivars. Chinese Cereals and Oils Association, 2007, 22(1): 38-40. 李辉, 戴常军, 兰静, 等. 黑龙江省栽培大豆异黄酮含量的初步分析. 中国粮油学报, 2007, 22(1): 38-40.
[29] Wu H Y, Zhang M R. Selection of new soybean cultivar Nandou No.8 with high yield and high protein content. Soybean Bulletin, 2006, (5): 9-10. 吴海英, 张明荣. 高产、高蛋白大豆新品种南豆8号的选育. 大豆通报, 2006, (5): 9-10.
Evaluation of Japanese soybean varieties in the Sichuan Basin, China
WU Hai-Jun1, YANG Cai-Qiong1, Nasir Iqbal1, DENG Jun-Cai1, DAI Wei1, LIU Wei-Guo1,2, YANG Feng1, SHU Kai1,2, DU Jun-Bo1, YANG Wen-Yu1*, LIU Jiang1,2*
1.CollegeofAgronomy,SichuanAgriculturalUniversity,KeyLaboratoryofCropEcophysiologyandFarmingSysteminSouthwest,MinistryofAgriculture,Chengdu611130,China; 2.InstituteofEcologicalAgriculture,SichuanAgriculturalUniversity,Chengdu611130,China
In this study 17 soybean genotypes were introduced from Japan to the Sichuan Basin with an aim to assess their adaptability. Comparison of quality traits showed that variation in isoflavone content was highest; the coefficient of variation values were generally greater than 30% (apart from aglycone), while the coefficient variation for other seed compounds was around 10%. The soluble protein contents of the tested soybean seeds were relatively high while fatty acids, soluble polysaccharides and isoflavone were low. Principal component analysis and cluster analysis divided the 17 germplasms into five groups. Individually, Group-Ⅰ comprised high-oil varieties, their linoleic acid content were>55‰, suggesting that they could be used to produce high-oil hybrid varieties. Group-Ⅲ comprised high-protein varieties, potentially useful for developing varieties to produce soy raw materials; Group-Ⅴ comprised high-isoflavone varieties, which could potentially be used to produce varieties useful for functional food or fodder.
Japanese soybean; introduce; quality character; synthetic evaluation
10.11686/cyxb2016084
http://cyxb.lzu.edu.cn
2016-03-03;改回日期:2016-04-13
国家自然科学基金青年科学基金项目(31401329)和中国博士后科学基金面上项目(2014M560724)资助。
吴海军(1988-),男,四川巴中人,在读硕士。E-mail:wuhaijun1988@126.com*通信作者Corresponding author. E-mail:jiangliu@sicau.edu.cn, mssiyangwy@sicau.edu.cn
吴海军, 杨才琼, Nasir Iqbal, 邓俊才, 戴炜, 刘卫国, 杨峰, 舒凯, 杜俊波, 杨文钰, 刘江. 日本大豆引种四川盆地的品质评价研究. 草业学报, 2017, 26(1): 81-89.
WU Hai-Jun, YANG Cai-Qiong, Nasir Iqbal, DENG Jun-Cai, DAI Wei, LIU Wei-Guo, YANG Feng, SHU Kai, DU Jun-Bo, YANG Wen-Yu, LIU Jiang. Evaluation of Japanese soybean varieties in the Sichuan Basin, China. Acta Prataculturae Sinica, 2017, 26(1): 81-89.

