12例静脉滴注甘露聚糖肽致不良反应报告
司可意,王利杰
(河南理工大学第一附属医院/焦作市第二人民医院药学部,河南 焦作 454001)
12例静脉滴注甘露聚糖肽致不良反应报告
司可意*,王利杰
(河南理工大学第一附属医院/焦作市第二人民医院药学部,河南 焦作 454001)
目的:了解静脉滴注甘露聚糖肽发生不良反应的情况,探讨其不良反应发生的规律及临床表现,为临床合理用药、防范不良反应提供参考。方法:对2012年3月—2016年6月河南理工大学第一附属医院/焦作市第二人民医院临床药学室收集上报的12例静脉滴注甘露聚糖肽致不良反应报告进行回顾性调查分析。结果:甘露聚糖肽致不良反应多在用药后30 min内发生;主要表现为过敏反应和呼吸系统损害;严重的不良反应主要为过敏性休克和哮喘。结论:静脉滴注甘露聚糖肽可引起严重不良反应,用药过程中医护人员应严密观察,一旦发生不良反应,应及时抢救处理。
甘露聚糖肽; 不良反应; 过敏; 休克; 哮喘
甘露聚糖肽是从正常人咽喉部分离的甲型溶血性链球菌株深层培养液中提取的一种生物反应修饰物[1],其能调节机体自身免疫功能,刺激骨髓造血功能,提高机体免疫能力,具有激活免疫细胞、升高白细胞计数的作用[2]。随着甘露聚糖肽在临床上的广泛应用,其所引起药品不良反应(adverse drug reaction,ADR)的报道也日益增多,并有致死性的严重ADR的报道。甘露聚糖肽修订后的药品说明书适应证为用于恶性肿瘤放、化疗中改善免疫功能低下的辅助治疗。河南理工大学第一附属医院/焦作市第二人民医院(以下简称“我院”)近年来ADR报告及监测情况显示,甘露聚糖肽致ADR报告中严重的ADR所占比例偏高,个别报告病例存在不合理用药现象。为深入了解甘露聚糖肽致ADR的原因、临床特点,保证患者用药安全,现对12例静脉滴注甘露聚糖肽致ADR报告进行调查分析。
1 资料与方法
对2012年3月—2016年6月我院临床药学室收集上报的ADR报告资料进行筛查,获取与甘露聚糖肽相关的ADR报告12例,分别对患者的基本信息、原患疾病、过敏史、用药情况、ADR发生时间、ADR类型等情况进行统计分析。本次统计资料中的甘露聚糖肽有粉针剂和水针剂2种剂型,其中粉针剂由国药一心制药有限公司生产,商品名为力尔凡,规格为10 mg,批准文号:国药准字H19990029,涉及批号120514、120812-1、1404011172、1511021;水针剂由成都利尔药业有限公司生产,规格为5 mg,批准文号:国药准字H20003633,涉及批号20120308、20120530(2)、140803、140822、B150904(2)、016016。
2 结果
2.1 发生ADR患者的年龄、性别分布
12例发生ADR的患者中,男性5例,女性7例;年龄方面,40~<50岁2例,50~<60岁6例,60~<70岁、70~<80岁各2例。
2.2 发生ADR患者的原患疾病及既往药物过敏史
12例发生ADR患者的原患疾病方面,除1例为糖尿病性视网膜病变外;其余均为恶性肿瘤,分别为肝癌2例,乳腺癌3例,宫颈癌、卵巢癌各2例,肠癌、肺癌各1例。既往药物过敏史方面,1例患者对青霉素类抗菌药物过敏,1例患者对头孢菌素类抗菌药物过敏,1例患者对多种药物过敏,6例患者无药物过敏史,3例患者不详。
2.3 发生ADR患者的用药情况及ADR临床表现、发生时间
12例ADR报告中,给药途径均为静脉给药,10例为首次用药,另2例分别为连续用药第2日及第5日。部分患者在静脉滴注甘露聚糖肽前静脉滴注了其他液体;ADR的临床表现有相似,也有不同;ADR发生时间为用药后2~30 min内,5例严重的ADR在用药后10 min内发生,见表1—2。
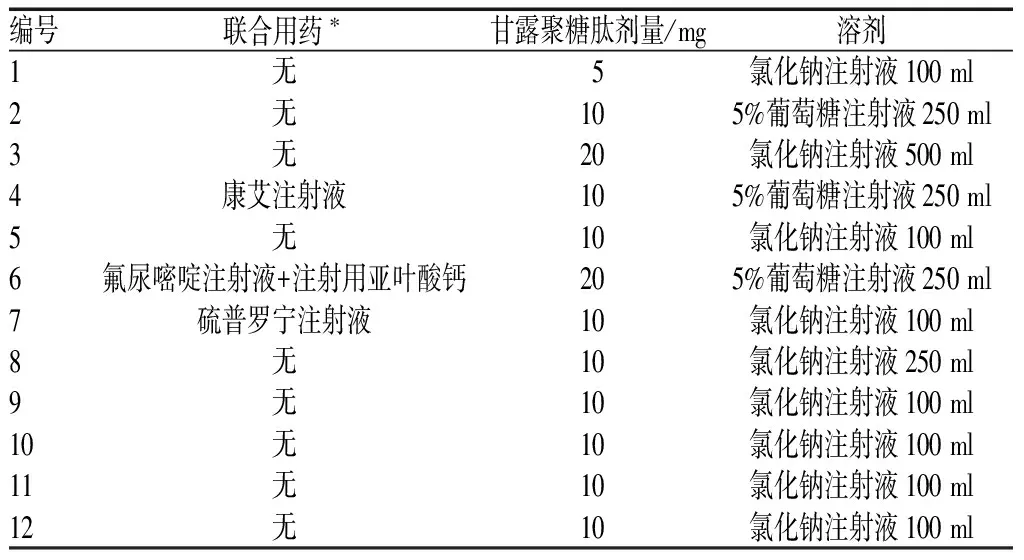
表1 12例静脉滴注甘露聚糖肽发生ADR患者的用药情况
注:*联合用药均为静脉滴注,所有药物均单独滴注,无同瓶混合滴注情况
Note:*drug combination are in intravenous drip, all drugs are separate drip without any mixed drip
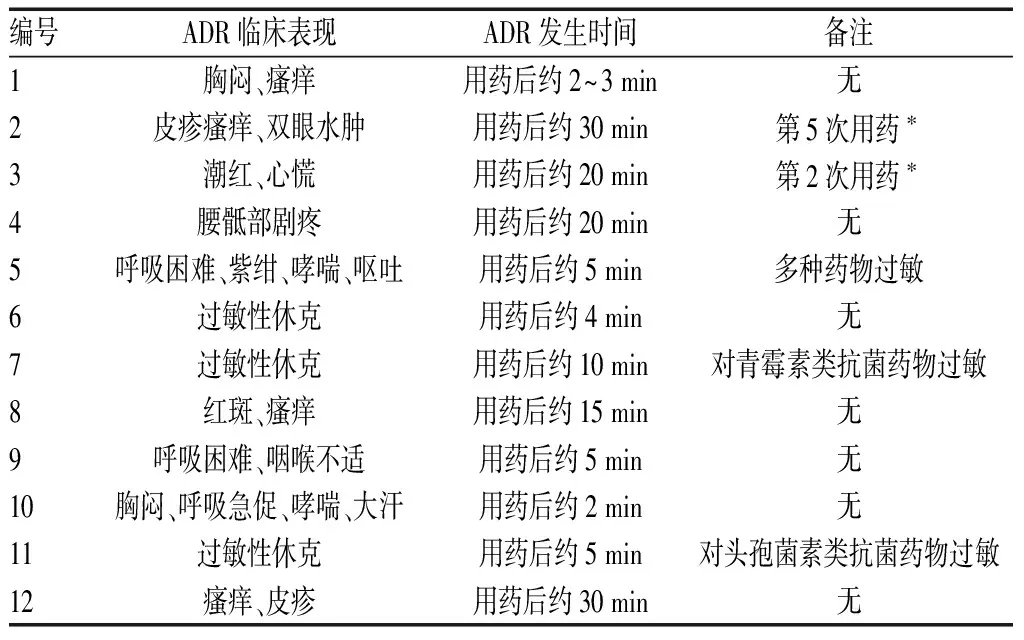
表2 12例静脉滴注甘露聚糖肽致ADR的临床表现及发生时间
注:*该例ADR为非首次用药发生,其他ADR均为首次用药即发生
Note:*this case of ADR does not occur for the first time of administration, yet anther ADR occur for the first time of administration
2.4 ADR处理方法及转归
12例患者一经发现ADR,立即停用甘露聚糖肽,均进行了抗过敏治疗,其中7例进行吸氧,2例进行扩张支气管、松弛支气管平滑肌、保护胃黏膜治疗;1例好转,11例治愈。
3 讨论
3.1 甘露聚糖肽引起ADR的相关因素
发生ADR的女性患者略多于男性患者,但资料样本量较少;50~<60岁患者居多。可能由于药品说明书规定的适应证为恶性肿瘤,12例患者中,除1例为非适应证用药外,其余患者的适应证均符合要求,所以甘露聚糖肽致ADR与性别、年龄、原患疾病的相关性相对较小[3]。1例ADR为超药品说明书用量给药,药品说明书规定1次5~10 mg,该病例给药剂量为1次20 mg,可能与ADR的发生有关。
12例静脉滴注甘露聚糖肽致ADR均发生在给药后30 min内,5例严重的ADR均发生在给药后10 min内。提示静脉给药初期,应严密观察患者的反应,一旦发生不适,应立即进行处理。此外,1例患者连续用药第2日出现潮红、心慌等不适,另1例患者连续用药第5日出现皮疹瘙痒、双眼水肿等不适,提示在整个治疗过程中都要做好安全性监测,以便发现问题及时处理。这也和相关文献一致[4]。
3例患者静脉滴注甘露聚糖肽前使用了其他药物,这些药物对所发生的ADR有多大影响尚不得而知。
12例ADR报告中,5例为严重的ADR,提示严重的ADR所占比例偏高。临床表现为过敏性休克和哮喘,其中3例患者有过敏史,其中1例对多种药物过敏,提示有药物过敏史的患者使用甘露聚糖肽更容易发生严重的ADR。
3.2 甘露聚糖肽的临床不合理使用
调查发现临床存在不合理使用甘露聚糖肽的情况。(1)1例超药品说明书剂量用药,药品为成都利尔药业有限公司生产的甘露聚糖肽水针剂,其说明书用量为5~10 mg、1日1次,临床使用20 mg、1日1场,可能与ADR的发生有关。(2)1例为超适应证用药,患者的原患疾病为糖尿病性视网膜病变,相关文献也曾报道类似问题[5]。2003年4月,国家食品药品监督管理总局发布的《关于修订甘露聚糖肽注射剂说明书的通知》中规定,甘露聚糖肽注射剂型的适应证为用于恶性肿瘤放、化疗中改善免疫功能低下的辅助治疗[6]。(3)1例为禁忌证下用药,患者为对多种药物过敏的高敏体质者,静脉滴注甘露聚糖肽后出现呼吸困难、紫绀、哮喘、呕吐。甘露聚糖肽的说明书及《新编药物学》(17版)[7]均明确载明,对该药过敏者、风湿性心脏病、支气管哮喘、气管炎患者禁用,高敏体质者禁用。
3.3 安全使用甘露聚糖肽的建议
(1)甘露聚糖肽为辅助用药,且用药风险大,因此,医护人员应仔细阅读药品说明书,严格依据药品说明书的适应证、用法与用量、注意事项用药[8],严禁超适应证、超剂量、禁忌证下用药。(2)用药前询问患者既往药物过敏史和病史,有既往过敏史的患者应尽量避免使用,高敏体质患者禁用,对甘露聚糖肽过敏者、风湿性心脏病、支气管哮喘、气管炎患者禁用。虽然药品说明书未作特殊说明,但《中国医师药师临床用药指南》[9]明确推荐初次使用甘露聚糖肽的患者,需做皮肤过敏试验,取甘露醇注射液0.1 ml(约0.25 mg)皮内注射,30 min内观察红肿面积,如 红肿面积在3 cm×3 cm以上者则不宜使用。(3)从低剂量开始给药,控制滴注速度[10],初次用药时应<40滴/min,之后逐渐调至60滴/min[11],滴注前15 min加强观察和巡视,用药过程中随时做好异常情况的诊断和处理,以防严重的ADR危及患者生命。(4)药品说明书及相关文献[12-13]均载有该药有因过敏反应及呼吸骤停而死亡的报告,故应在医师严密监护并有抢救措施的条件下用药,尤其是首次给药30 min内应严密观察,一旦出现过敏反应相关症状,应立即停药,并给予对症及抗过敏治疗[14]。临床医护人员使用甘露聚糖肽时要有防范ADR的意识。(5)在医院信息系统医师工作站中插入提示窗口,将甘露聚糖肽说明书中的禁忌内容作为提示语,医师在开具甘露聚糖肽时,电脑将显示其说明书“注意事项”及禁忌提示[15]。(6)本次统计资料中的甘露聚糖肽涉及2个厂家的不同剂型,成都利尔有限公司的药品说明书中用量为1次5~10 mg,加入100 ml氯化钠注射液中静脉滴注,1日1次;国药一心制药有限公司的药品说明书中用量为1次10~20 mg,1日1次或隔日1次。不同厂家的同种药品说明书中的给药剂量相差1倍,容易造成临床超剂量用药,建议厂家规范药品说明书用量。
[1]胡其乐,王浴生.一种新的生物反应修饰物多抗甲素[J].中国抗生素杂志,1991,16(2):151-156.
[2]高宁,刘德俊,王晨,等.甘露聚糖肽不良反应分析[J].中国药师,2011,14(1):121.
[3]张景文,杨梅珍.甘露聚糖肽致严重过敏反应相关因素分析[J].中国医院药学杂志,2014,34(11):946-949.
[4]李运景,李雪芹.甘露聚糖肽注射液致不良反应文献分析[J].中国药房,2011,22(10):919-921.
[5]段露芬,武新安,王松原,等.甘露聚糖肽注射液致不良反应1例[J].中国医院药学杂志,2014,34(21):1878-1879.
[6]国家食品药品监督管理总局.关于修订甘露聚糖肽注射剂说明书的通知[EB/OL].[2003-04-11].http://www.sda.gov.cn/WS01/CL0055/9827.html.
[7]陈新谦,金有豫,汤光.新编药物学[M].17版.北京: 人民卫生出版社,2011:707.
[8]韩志云,杨骅,赵燕菊.甘露聚糖肽注射液严重药品不良反应原因分析[J].海峡药学,2015,27(1):241-242.
[9]卫生部合理用药专家委员会.中国医师药师临床用药指南[M].重庆:重庆出版社,2009:4.
[10] 申乐.甘露聚糖肽药品不良反应文献分析[J].中国药业,2014,23(1):48-49.
[11] 金淑君,赵艳.甘露聚糖肽注射液致过敏性休克[J].中国药物应用与监测,2014,11(3):189-190.
[12] 乔逸,徐焕春,廖悠悠,等.甘露聚糖肽注射液致过敏性休克2例[J].抗感染药学,2015,12(1):76-78.
[13] 刘小光,徐柳新,陈伟.疑似甘露聚糖肽注射液致死亡1例[J].中国药物警戒,2014,11(4):251-252.
[14] 殷喆,罗艳丽.甘露聚糖肽注射液致速发型过敏性休克的抢救体会一例[J].华西医学,2016,31(5):996-997.
[15] 黄晓梅,陈宇星,冯淑玲.甘露聚糖肽不良反应与用药安全[J].海峡药学,2015,27(9):246-247.
12 Cases of Adverse Drug Reaction Reports Induced by Mannatide in Intravenous Drip
SI Keyi, WANG Lijie
(Dept.of Pharmacy, Jiaozuo the Second People’s Hospital, the First Affiliated Hospital of Henan Polytechnic University, Henan Jiaozuo 454001, China)
OBJECTIVE:To investigate the adverse drug reactions(ADR) induced by mannatide in intravenous drip, and to probe into the regularity and clinical manifestations of ADR, so as to provide reference for the rational drug use and avoid ADR in clinic. METHODS: Retrospective analysis was conducted on 12 cases of ADR induced by mannatide in intravenous drip collected by the First Affiliated Hospital of Henan Polytechnic University/Jiaozuo the Second People’s Hospital(hereinafter referred to as “our hospital”) from Mar. 2012 to Jun. 2016. RESULTS: ADR mainly occurred within 30 min after mannatide injection, performed as allergic reactions and respiratory system disorders. Sever ADR were performed as allergic shock and asthma. CONCLUSIONS: Mmannatide in intravenous drip can induce severe ADR, which should be paid close attention during application. Effective rescue measures should be given in time when ADR appears.
Mannatide; ADR; Allergy; Shock; Asthma
R969.3;R979.5
A
1672-2124(2017)01-0116-03
2016-08-03)
*副主任药师。研究方向:临床药学和医院药学。E-mail:sky1934@126.com
DOI 10.14009/j.issn.1672-2124.2017.01.042

