高效液相色谱法测定疏清浸膏中靛玉红的含量
张微微,谭晓川,车宏伟,方夏琴,张宇佳,郑稳生
(中国医学科学院北京协和医学院药物研究所药物制剂室,北京 100050)
高效液相色谱法测定疏清浸膏中靛玉红的含量
张微微*,谭晓川,车宏伟,方夏琴,张宇佳,郑稳生#
(中国医学科学院北京协和医学院药物研究所药物制剂室,北京 100050)
目的:建立高效液相色谱法测定疏清浸膏中靛玉红的含量。方法:采用高效液相色谱法,色谱柱为WondaSil C18(250 mm×4.6 mm,5 μm),流动相为甲醇-水(V∶V=75 ∶25),流速为0.8 ml/min,检测波长289 nm。结果:靛玉红质量浓度在0.201 2~20.120 0 μg/ml范围内线性关系良好;样品溶液在12 h内保持稳定,RSD=1.48%;重复性试验的RSD=1.38%;平均加样回收率为101.9%,RSD=1.77%。结论:该方法操作简便,结果准确,可作为靛玉红的质量控制方法。
高效液相色谱法; 靛玉红; 疏清浸膏; 质量控制; 提取物
疏清颗粒是由甘草、芦根、桑叶、大青叶等中药组成的复方制剂,其功能主治为清热解毒、宣泄肺胃,用于小儿急性上呼吸道感染属风热证。在原方基础上设计制成疏清口服溶液,经提取后,保留了原方中各药材有效成分,用药途径与原方相同,制成口服液后方便使用,同时还能增加儿童顺应性。该方中大青叶的作用为清热解毒、凉血消斑,用于温病高热、神昏、发斑发疹、痄腮、喉痹、丹毒、痈肿[1],是该方的主要药材,靛玉红为该药的质量控制成分。本研究建立了疏清浸膏中靛玉红的含量测定方法。
1 材料
1.1 仪器
高效液相色谱仪(普析L600,UVD,北京普析通用公司); BSA4235-C型电子天平(赛多利斯科学仪器有限公司)。
1.2 试剂
靛玉红对照品(批号: 110717-200204,中国食品药品检定研究院提供);疏清浸膏由吉林华康药业股份有限公司提供;甲醇为色谱纯,水为蒸馏水,其他试剂为分析纯或色谱纯。
2 方法与结果
2.1 疏清浸膏的制备
取大青叶、芦根、桑叶、甘草药材(质量比为3∶3∶3∶1)适量,粉碎[2],按照《中华人民共和国药典·四部》(2015年版)流浸膏剂项下渗漉法[3],加75%乙醇浸渍72 h,收集渗漉液,减压回收乙醇,并浓缩为相对密度1.35~1.38(75 ℃)的浸膏。
2.2 溶液的制备
2.2.1 对照品溶液:取靛玉红对照品约5 mg,精密称定,置100 ml量瓶中,加少量三氯甲烷溶解并用甲醇稀释至刻度[4],摇匀,作为对照品贮备液。精密量取对照品贮备液1 ml,置5 ml量瓶中,加甲醇至刻度,摇匀,即得每1 ml中约含10.00 μg的对照品溶液。
2.2.2 供试品溶液:取“2.1”项下疏清浸膏约2 g,精密称定,置25 ml量瓶中,加甲醇适量,超声处理30 min[5],于室温(25 ℃)中放置,用甲醇稀释至刻度[6],摇匀。
2.2.3 阴性对照溶液:按照处方比例,取缺少大青叶的药材按照制备工艺制备浸膏,精密称取该浸膏约2 g,按照“2.2.2”项下供试品溶液的制备方法制备,即得阴性对照品溶液。
2.3 色谱条件
色谱柱为WondaSil C18柱(250 mm×4.6 mm,5 μm);流动相为甲醇-水(V∶V=75 ∶25);检测波长为289 nm[7];柱温为35 ℃;色谱图见图1。
2.4 线性关系考察
分别精密量取靛玉红对照品贮备液0.1、2.0、4.0、8.0、10.0 ml置25 ml量瓶中,加甲醇至刻度,摇匀,即得质量浓度为0.201 2、4.024 0、8.048 0、16.096 0、20.120 0 μg/ml的对照品溶液,精密量取上述溶液各10 μl,按照“2.3”项下色谱条件进样测定,测定峰面积。以靛玉红峰面积为纵坐标(Y)、靛玉红含量为横坐标(X)进行线性回归,回归方程为Y=8×107X-10 382(r=0.999 5,n=5)。表明靛玉红质量浓度在0.201 2~20.120 0 μg/ml范围内[8]有良好的线性关系。
2.5 精密度试验
精密吸取质量浓度为10.000 0 μg/ml的对照品溶液10 μl,重复进样6次,测定靛玉红的峰面积。结果表明,靛玉红峰面积的RSD=0.608%,仪器精密度良好。
2.6 重复性试验
精密量取“2.2.2”项下供试品溶液,共6份,按照“2.3”项下色谱条件进样测定,测定峰面积。结果靛玉红的平均含量为120.67 μg/g,RSD=1.38%,表明本方法重复性良好。
2.7 稳定性试验
精密称取新配制的“2.2.2”项下供试品溶液适量,分别于室温下放置0、2、4、6、8、10、12 h时进样测定,记录峰面积[9]。靛玉红峰面积的RSD=1.48%,表明供试品溶液在12 h内稳定。
2.8 加样回收率试验
精密称取已知含量的疏清浸膏6份,分别准确加入靛玉红对照品,按照“2.2.2”项下方法制备供试品溶液,再按“2.3”项下色谱条件进样测定,计算加样回收率,见表1。
2.9 样品含量测定
取疏清浸膏2 g,精密称定,按照“2.2.2”项下方法制备供试品溶液,取供试品溶液和“2.2.1”项下对照品溶液各10 μl,按照“2.3”项下色谱条件进样测定,按外标法计算,见表2。
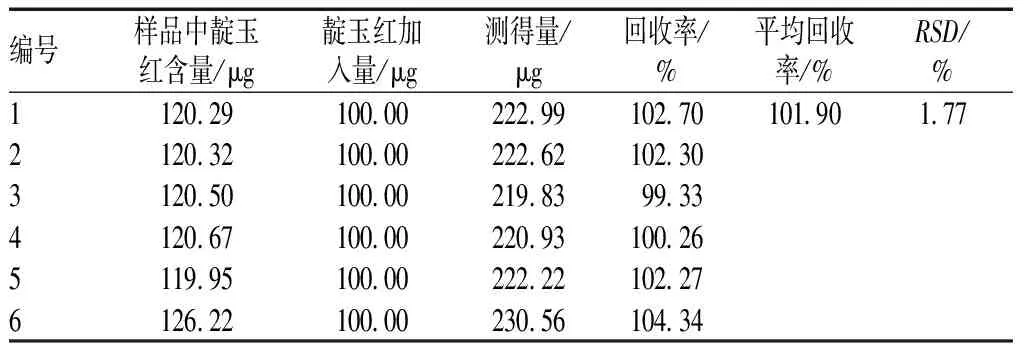
表l 加样回收试验结果(n=6)

表2 靛玉红含量测定结果(n=10)
3 讨论
靛玉红的含量测定方法有氧化滴定法、直接比色法、薄层色谱法、双波长分光光度法、高效液相色谱法等[10]。本研究采用高效液相色谱法[11],该方法能够准确测定清膏中的靛玉红含量,方法简便、便于操作,重现性、回收率良好,可作为靛玉红的质量控制方法。
采取不同提取方法处理浸膏,(1)二氯甲烷超声提取,抽滤;(2)二氯甲烷超声提取,加水萃取[12],水层用二氯甲烷提取2次,1次10 ml,合并二氯甲烷液;(3)二氯甲烷超声提取,加8%盐酸萃取,酸层用二氯甲烷提取2次,1次10 ml,合并二氯甲烷液;(4)甲醇溶解,超声提取。结果表明,以上4中方法的提取效果相近。同时,考察超声时间和提取次数对提取效率的影响[13],超声时间为15、30、45 min时,提取效果无明显差别;提取次数为1、2、3次时,分别测定靛玉红含量,结果显示,提取1次就可将其中的靛玉红提取完全[14]。因此,样品前处理方式确定为直接加甲醇溶解,超声30 min,甲醇定容。超声提取法利用超声振动来提高提取效率,具有操作简单、省时高效、污染小、适用范围广等特点[15]。
[1]国家药典委员会.中华人民共和国药典:一部[S].2015年版.北京:中国医药科技出版社,2015:22.
[2]黄昆.黄芩煎煮工艺及最佳粉碎粒度的研究[D].武汉:华中科技大学,2005.
[3]汪兰芳,方优妮,韩建伟,等.正交试验优选橘红贴膏的乙醇渗漉提取工艺[J].中国实验方剂学杂志,2011,17(6):38-40.
[4]余陈欢,吴巧凤,盛振华,等.大青叶中靛玉红的提取工艺研究[J].中药材,2006,29(7):721-723.
[5]李锁,苏明,王光函,等.芩双颗粒中甘草酸铵含量测定方法研究[J].赤峰学院学报:自然科学版,2015,31(9):39-40.
[6]王虹霞,梁剑平,李雪虎,等.大青叶中靛玉红HPLC测定方法的建立[J].江苏农业科学,2012,40(2):236-237.
[7]肖英华,夏叶,程佩佩,等.反相高效液相色谱法同时测定大青叶中靛蓝与靛玉红含量[J].医药导报,2015,34(11):1506-1507.
[8]崔娟.蒲地蓝缓释胶囊的提取工艺研究[D].武汉:武汉理工大学,2012.
[9]罗巍伟,贺英菊,王凌,等.HPLC测定板蓝根提取物中靛蓝和靛玉红的含量[J].华西药学杂志,2004,19(6):455-456.
[10] 陆晶.大青叶药材的含量测定方法研究[J].黑龙江医药,2009,22(6):769.
[11] 刘世杰.毛支清口服液的质量控制、制备工艺及抗炎作用研究[D].北京:中央民族大学,2013.
[12] 刘迎春,张莹,段丽颖,等.RP-HPLC法测定复方大青叶颗粒中靛玉红含量[J].化学世界,2009,50(12):712-714.
[13] 李丹.植物药提取工艺中提取次数考察方法的比较与分析[J].中成药,2004,26(11):943-944.
[14] 王虹霞.大青叶中生物碱靛玉红的提取、分离及毒理学研究[C]//2013年中国畜牧兽医学会兽医病理学分会暨中国病理生理学会动物病理生理学专业委员会学术研讨会论文集,2013:198.
[15] 王长远,许凤,张敏.超声时间对米糠蛋白理化和功能特性的影响[J].中国粮油学报,2014,29(12):43-47.
Content Determination of Indirubin in Shuqing Extractives by HPLC
ZHANG Weiwei, TAN Xiaochuan, CHE Hongwei, FANG Xiaqin, ZHANG Yujia, ZHENG Wensheng
(Dept.of Pharmaceutical Preparation in Drug,Institute of Materia Medica, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100050, China)
OBJECTIVE:To establish a method to determine indirubin contents in shuqing extractives by HPLC. METHODS: HPLC method was adopted, the chromatographic column was WondaSil C18(250 mm×4.6 mm,5 μm), the mobile phase was methanol-water(V∶V=75 ∶25)with the flow rate of 0.8 ml/min and UV detection wavelength at 289 nm. RESULTS: The good linear indications had been shown for indirubin within 0.201 2 μg/ml-20.120 0 μg/ml, the sample solution remained in a stable condiction within 12 h, withRSDat 1.48%; theRSDof reproducibility was 1.38%; and the samples recovery rate was 101.9%, theRSDwas 1.77%. CONCLUSIONS: The method is simple, rapid and accurate, which can be used for quality control of indirabin.
HPLC; Indirubin; Shuqing extractives; Quality control; Extractive
R927.2
A
1672-2124(2017)01-0088-03
2016-10-28)
*硕士研究生。研究方向:中药质量控制。E-mail:15210845386@163.com
#通信作者:研究员。研究方向:毫微粒载药系统关键技术研究。E-mail:zhengwensheng@imm.ac.cn
DOI 10.14009/j.issn.1672-2124.2017.01.032

