水杨酸浓硫酸比色法测定浒苔中硝酸盐含量
赵倩,石晓勇,3,陈月红,王丽莎,唐洪杰*
(1.中国海洋大学 化学化工学院,山东 青岛 266100;2.中国海洋大学 海洋化学理论与工程技术教育部重点实验室,山东 青岛 266100;国家海洋局海洋减灾中心,北京 100194)
水杨酸浓硫酸比色法测定浒苔中硝酸盐含量
赵倩1,2,石晓勇1,2,3,陈月红1,2,王丽莎1,2,唐洪杰1,2*
(1.中国海洋大学 化学化工学院,山东 青岛 266100;2.中国海洋大学 海洋化学理论与工程技术教育部重点实验室,山东 青岛 266100;国家海洋局海洋减灾中心,北京 100194)
浒苔是我国绿潮的主要肇事物种,测定其体内硝酸盐含量对研究浒苔对硝酸盐的同化和吸收有着重要意义。本文采用水杨酸浓硫酸比色法对浒苔体内硝酸盐含量进行了测定,并对该方法中样品预处理、显色剂使用量及工作曲线选择等步骤进行了相应的探讨及优化,使其更适用于测定浒苔体内的硝酸盐含量,同时确定了该方法的检出限、精确度和准确度。研究结果表明本文所确定的方法适用于浒苔样品中硝酸盐含量的快速测定。
浒苔;水杨酸浓硫酸比色;硝酸盐
1 引言
自2007年以来,黄海海域每年都会暴发大规模绿潮灾害,主要肇事物种为浒苔(Ulvaprolifera)[1—2]。浒苔绿潮暴发会改变生态系统的结构[3],降低生物多样性[4],对海洋生态环境造成极大危害。氮作为浮游植物生命活动中不可缺少的营养元素,其代谢也是浮游植物营养代谢的重要部分[5—6],对海洋植物生长繁殖有重要影响。而海水中的氮主要以NO3-N形态存在[7],浮游植物的生长与其对硝酸盐的同化和吸收能力密切相关。因此,测定浒苔体内硝酸盐的含量有利于浒苔对硝酸盐同化过程的研究,可以为浒苔暴发防治措施的建立提供一定的理论依据。
目前,检测植物体内硝酸盐浓度的方法主要有高效液相层析法[8—9]、离子色谱法[10—11]、液相色谱法[12]、分光光度测定法[13—14]、极谱法[15]、电位测定法[16]、毛细管电泳法[17]和酚二磺酸法[18]等。其中光谱法和色谱法都需将硝酸根离子经镉柱还原成亚硝酸根离子间接测定,前处理操作繁琐,而应用较为广泛的酚二磺酸法操作条件要求严格,耗时较长,不适宜大批量样品的检测。相比于上述其他方法,水杨酸浓硫酸比色法具有不需要复杂的前处理过程、准确性高等优点,适用于快速测定植物体内硝酸盐含量,在测定蔬菜体内硝酸盐的含量方面得到了一定的应用[19]。该方法的原理是基于硝酸根与水杨酸在浓硫酸的作用下所生成的硝基水杨酸在碱性环境中会呈现黄色,并且一定浓度范围内,颜色深浅与硝酸盐含量成正比[20]。因此,通过测定此黄色溶液在其最适波长(410 nm)下的吸光度,即可计算得到相应的硝酸盐浓度。目前,已有研究者[21]将该方法应用于浒苔体内硝酸盐含量的测定,但在测定过程中,某些实验条件的改变会直接影响到测定结果,为此,本文对该方法的测定条件进行了优化,以确保其测定浒苔体内硝酸盐含量时的准确性和稳定性。
2 材料与方法
2.1 主要仪器
UV2550紫外-可见分光光度计、分析天平、恒温水浴锅、移液枪等。
2.2 所用试剂
100 mg/L硝酸盐标准溶液;4%醋酸锌溶液;8%氢氧化钠溶液;5%水杨酸浓硫酸(所用试剂均为优级纯)。
2.3 实验材料及培养
本实验选取黄海绿潮暴发区常见的绿潮肇事藻种浒苔(Ulvaprolifera)为研究对象。藻体取自苏北紫菜养殖筏架区,现场用天然海水反复冲洗干净,带回陆地实验室培养,挑选绿色健康藻体,在质量分数0.2%的KI溶液中浸泡1 min[22],用过滤灭菌的天然海水反复冲洗,暂养于温度为(15±1)℃、光照强度283 μmol photons/(m2·s)、光照周期12L∶12D[23]的光照培养箱中。NaNO3和KH2PO4作为唯一的外加氮源和磷源,浓度分别为80 μmol/L和5 μmol/L,其余营养液等同于f/2配方,接种指数生长期的浒苔于上述培养基。实验所用海水为天然海水,经GF/F膜过滤后,蒸汽灭菌备用。
2.4 样品预处理及测定
称取约3 mg新鲜浒苔样品于组织研磨器,加入1 mL 4% 醋酸锌溶液将浒苔充分研磨,并用1 mL去离子水冲洗组织研磨器,将研磨液转移至加有5 mg活性炭粉末的离心管中。然后将离心管置于70℃恒温水浴中加热30 min[21],待冷却至室温,离心力为3 800×g的条件下离心10 min后,取上清液用于测定。
取0.4 mL上清液于10 mL比色管中,加入5%水杨酸浓硫酸溶液,室温放置显色25 min,用质量分数8% NaOH溶液定容至10 mL,冷却至室温后,于最适波长410 nm下测定其吸光度。
2.5 检测方法的改进
在使用水杨酸浓硫酸比色法进行浒苔体内硝酸盐含量测定时,样品预处理方法、显色剂用量、工作曲线的选择等因素均会对测定结果产生一定程度的影响[24],因此本文将对上述影响因素进行探讨,进而确定适宜的实验条件,并得到该方法的检出限、准确度及精密度。
2.5.1 显色剂-5%水杨酸浓硫酸体积的影响
按2.4节中的方法,取一定量上清液,加入5%水杨酸浓硫酸溶液,设定其体积范围为0.2~0.6 mL,考察显色剂体积对硝酸盐含量测定的影响,以期获得显色剂的最佳用量,每个显色剂体积设3组平行实验。
2.5.2 工作曲线的选择
在采用水杨酸浓硫酸比色法测定浒苔体内硝酸盐含量时,样品的预处理过程可能会对硝酸盐产生吸附,从而对结果的准确度产生影响。因此,本文分别采用未经过及经过2.4节中所述处理过程的硝酸盐标准溶液来绘制标准曲线和工作曲线,以确定样品的预处理方法是否会对样品硝酸盐含量的测定产生影响。同时选取5.035 mg/L、20.140 mg/L、25.175 mg/L的硝酸盐溶液,按照2.4处理方法进行处理,测定其浓度,计算硝酸盐的回收率。
2.5.3 检出限及准确度、精密度的确定

取空白样(即0.4 mL去离子水)按2.5.2小节中确定的工作曲线测定方法进行处理,测定样品的A410,每组设20个平行样,设置3组,确定其检出限。

2.5.4 浒苔中硝酸盐的提取效率
浒苔经预处理后经离心分离得到上清液和残渣,将残渣以去离子水进行洗涤、震荡后离心取其上清液。分别测定两份上清液中硝酸盐含量,拟检验残渣中是否有硝酸盐残留。共设置10组平行样。
2.5.5 浒苔体内硝酸盐测定方法准确性验证
为了验证采用水杨酸浓硫酸比色法测定浒苔体内硝酸盐的准确性,本文对浒苔样品进行加标回收试验,即在浒苔样品研磨液中加入一系列浓度梯度的硝酸盐标准溶液(0~25 mg/L),依据2.5.4小节中的操作,依次测定各组样品上清液和离心后残渣中硝酸盐的浓度。其中,将上清液中的硝酸盐浓度记为测定值1,将上清液和残渣中的硝酸盐浓度之和记为测定值2,分别计算每个标准浓度的硝酸盐回收率,每个标准浓度设定3组平行实验。
2.6 实际样品测定
在浒苔的一个培养周期内,每天定点取样,按照2.4节所述对浒苔样品进行预处理后,参照2.5确立的水杨酸浓硫酸比色法测定浒苔处理液中硝酸盐的浓度,计算其体内硝酸盐的含量(单位为μg/g,以鲜质量计)。每组实验设置3个平行样,所得数据以平均值±标准差(mean±SD)表示。具体计算公式如下:
(1)
式中,w代表浒苔体内硝酸盐的含量(μg/g,以湿质量计),co代表测定浒苔处理液中硝酸盐浓度(mg/L),v代表处理液的体积(mL),M代表浒苔测定样品的鲜质量(g)。
3 结果与讨论
3.1 显色剂用量的确定
浒苔体内硝酸盐的提取液在加入显色剂(5%水杨酸浓硫酸溶液)后,其在410 nm的吸光度(A410)随着显色剂用量的不同发生变化:当显色剂体积范围为0.2~0.5 mL时,实验可正常显色;而当显色剂体积大于0.6 mL时,反应产物出现白色针状物,干扰了A410的获得。不同用量显色剂对A410的影响结果见图1。由图1可知,显色剂体积在0.2~0.4 mL时,随着显色剂用量的增大,A410值呈上升趋势,并且在显色剂的加入量为0.4 mL时,其A410值达到最大;之后,随着显色剂体积的加大,A410并未出现上升反而呈现下降趋势。因此,在能正常显色的范围内,当显色剂体积为0.4 mL时,所得A410值最大,显色效果最佳,故而可确定显色剂的最适用量为0.4 mL。
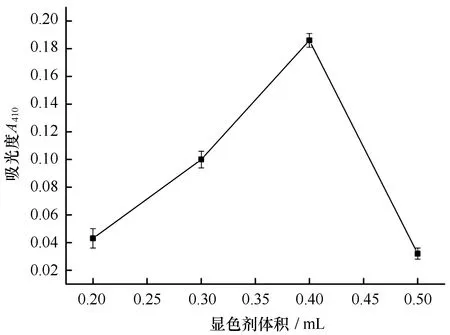
图1 不同显色剂用量下的吸光度Fig.1 Absorbance vs dosage of reagent
3.2 工作曲线的选择
未经过处理和经过处理的硝酸盐标准溶液浓度和吸光度A410之间的关系如图2所示。由图2可知,当硝酸盐浓度为3 mg/L左右时均存在较明显的拐点,因此,将0~25.175 mg/L浓度范围内分为两个浓度区间后,分别进行线性拟合(其中0~3 mg/L为低浓度范围,3~ 25.175 mg/L为高浓度范围),得到图2所示的两组线性回归方程。
拟合结果显示,两种方式所得线性回归方程均存在着较好的相关性(r2>0.99)。为选取最适宜的校准曲线,分别取浓度为5.035 mg/L、20.140 mg/L和25.175 mg/L的硝酸盐溶液,按照2.4处理方法处理后,进行浓度测定,计算硝酸盐的回收率(表1)。由回收率结果可知,当硝酸盐浓度为5.035 mg/L时,未处理组所得回收率很低,仅为47.21%±2.66%,而处理组计算所得的回收率可达94.50%±5.78%。推测其原因,可能是对浒苔进行预处理时,在采用活性炭吸附色素的过程中及在使用醋酸锌沉淀浒苔体内蛋白质的过程中造成了部分硝酸盐于活性炭或者蛋白质沉淀上的附着,引起了硝酸盐的损失。当以未处理组所得标准曲线进行硝酸盐浓度测定时,预处理过程中硝酸盐的损耗并未考虑在内,故而使得所测得的结果产生了一定的偏差。当硝酸盐浓度为20.140 mg/L和25.175 mg/L时,两种方式均得到了较高的回收率,接近于100%,样品的预处理过程几乎未对测定结果带来影响。由此可见,样品预处理过程中由于吸附所产生的硝酸盐损耗对高硝酸盐含量样品的测定结果影响较小,但当样品中硝酸盐含量较低时,所带来的影响不可忽视。现有的研究表明,浒苔经处理后所得处理液的硝酸盐浓度大多分布在本文所设硝酸盐标准溶液的中低浓度范围内[21],因此,为保证实验结果的准确性,在后续实验中应选择对标准溶液进行相应预处理的标准曲线为工作曲线。

图2 未经处理(a)及经过处理(b)的硝酸盐标准溶液浓度和吸光度A410的关系Fig.2 Absorbance vs the concentration of untreated(a) and treated(b) nitrate standard solution

真实浓度/mg·L-1标准溶液未经处理组标准溶液经过处理组实测浓度/mg·L-1回收率/%实测浓度/mg·L-1回收率/%5.0352.377±0.13447.21±2.664.758±0.29294.50±5.7820.14021.733±0.747107.91±3.7120.994±0.733104.24±3.6425.17526.993±0.501107.22±1.9926.162±0.491103.92±1.95
3.3 方法的检出限、精密度和准确度
3.3.1 检出限
3组空白样测定结果A410的平均值及标准偏差见表2。参考《仪器分析》[25]中关于检出限的定义,qm=3SD/m(m-方法灵敏度),得出其检出限分别为0.373 mg/L、0.370 mg/L、0.362 mg/L,其均值为0.368 mg/L,该方法的检出限低于文献报道的浒苔体内硝酸盐最低浓度[21]。

表2 3组空白样的A410及检出限
3.3.2 准确度和精密度


表测定方法的准确度及精密度
综上所述,该方法的检出限、精密度和准确度均可满足浒苔中硝酸盐的测定。
3.4 硝酸盐的提取效率
10组浒苔上清液和残渣中硝酸盐的检出值显示,上清液中硝酸盐所占比例为73.92%±14.77%(范围是43.08%~92.44%),残渣中硝酸盐的比例可达26.08%±14.77%(范围为7.56% ~56.92%)(如图3所示)。由此可见,上清液和残渣中硝酸盐各自占总体比例的最大值与最小值相差49.36%,存在较大波动性。这说明虽然上清液中硝酸盐所占比重总体高于残渣所占比重,但残渣中吸附和残留的硝酸盐仍不能忽略,并且由于二者硝酸盐比例的波动范围大,上清液中硝酸盐含量也难以反映浒苔样品中硝酸盐的真实情况,因此,在实际测定时尚需将残渣中硝酸盐的含量考虑在内。

图3 浒苔上清液和残渣中硝酸盐占总体的比重Fig.3 The proportion of nitrate between supernatant and the residue in the whole Ulva prolifera
3.5 浒苔体内硝酸盐测定方法的准确性验证
与2.5.4小节的实验所得结果类似,对浒苔样品的加标回收实验结果显示(表4),当仅考虑样品预处理后上清液中硝酸盐含量时,所得硝酸盐回收率为73.45%~96.59%,平均值为89.37%,标准偏差为6.58%,回收率较低,特别是当外加的硝酸盐浓度较低时,所测结果明显偏低,进一步提示仅以上清液中硝酸盐含量不能完全表征浒苔中硝酸盐的含量。结合3.4节所述的实验结果,将浒苔处理后残渣中硝酸盐含量同时考虑在内,此时硝酸盐回收率可达到90.04%~102.28%,平均值可达97.80%,接近于100%,表明残渣中含有一定量的硝酸盐,且经过一次再处理后基本提取完全,可以满足浒苔体内硝酸盐测定的需要。将测定值1和测定值2进行显著性差异分析,结果显示测定值2的精密度明显高于测定值1(F检验,α=0.05);进一步的t检验(成对双样本均值分析)结果显示,t>tα,f(tα,f查表可得,自由度f=9),两者在置信区间95%时存在显著性差异。由上述分析可知,将残渣中硝酸盐含量兼顾在内的方法的确优于仅考虑上清液中硝酸盐含量的方法。当外加硝酸盐浓度较低(0~3 mg/L)时,对比测定值1和测定值2的结果可知,将残渣中硝酸盐含量计算在内时,所得结果更加接近于真实浓度并且波动性相对较小(测量值1的平均值及标准偏差分别为85.45%、7.22%;测量值2的平均值和标准偏差分别为98.02、4.64%),可得到较好的回收率。t检验结果也表明,当硝酸盐外加浓度在0~3 mg/L时,测定值1和测定值2间差异显著(t>tα,f,其中显著性水平α=0.01,自由度f=4)。由于浒苔体内硝酸盐在测定时所得硝酸盐浓度多出现在低浓度范围内,因此,考虑残渣中硝酸盐的量尤为重要。
综上所述,在测定浒苔中硝酸盐的含量时,为确保实验结果真实有效,应分别测定上清液和残渣中硝酸盐的含量,并且对残渣中的硝酸盐经过一次处理即可满足实际测定需求。
表4 两种处理方法的回收率实验结果Tab.4 The result of recovery experiments under two treatment methods

表4 两种处理方法的回收率实验结果Tab.4 The result of recovery experiments under two treatment methods
样品编号标准加入值/mg·L-1测定值1*/mg·L-1回收率/%测定值2*/mg·L-1回收率/%10.5040.438±0.14786.90±29.100.500±0.04499.21±8.7221.0070.875±0.19386.89±19.191.000±0.10799.30±10.6431.5111.313±0.39286.90±25.961.500±0.05899.27±3.8142.0141.875±0.42493.10±21.052.060±0.202102.28±10.0353.0212.219±0.48673.45±16.092.720±0.36390.04±12.0265.0354.594±0.33891.24±6.725.030±0.39299.90±7.7878.0567.781±1.00896.59±12.517.910±0.35298.19±4.38810.079.594±0.98995.27±9.8210.090±0.326100.20±3.23915.10514.031±0.61992.89±4.1014.341±0.68794.94±4.541025.17522.781±1.23590.49±4.9123.841±0.63994.70±2.53平均值89.37±6.5897.80±3.57低浓度平均值**85.45±7.2298.02±4.64RSD7.363.65
注:测定值1*为上清液中硝酸盐浓度;测定值2*为上清液和残渣中硝酸盐含量之和;低浓度平均值**为添加浓度在0~3 mg/L的范围时的平均值。
3.6 浒苔实际样品的测定结果
实验培养条件下(N浓度80 μmol/L, P浓度5 μmol/L;温度:15℃),浒苔一个生长周期内硝酸盐含量变化如图4所示。实验结果表明,无论是否将预处理过程中残渣所含的硝酸盐考虑在内,浒苔体内硝酸盐含量的变化趋势一致,即在培养实验初始阶段浒苔体内硝酸盐的含量最高,随着培养时间的延长,硝酸盐的含量迅速降低,当到达浒苔培养中后期时,浒苔体内硝酸盐含量较低。但在研究浒苔对硝酸盐的同化作用时,除了要得到浒苔体内硝酸盐含量的变化趋势外,还需要得到准确的变化量。而当仅测定上清液中硝酸盐含量时,所得实验结果明显偏低,特别是在浒苔培养初期浒苔体内硝酸盐快速消耗的阶段(见表5),这种偏差不容忽视。因此,在实际测定中应选用同时考虑上清液和残渣中硝酸盐含量的测定结果作为实验最佳结果。

图4 两种处理方法下浒苔体内硝酸盐含量在一个培养周期中的变化Fig.4 Variation of nitrate contents of Ulvaprolifera dur-ing a culture cycle under two different treatment methods
4 实验结论
本文探究了水杨酸浓硫酸比色法测定浒苔中硝酸盐的条件,结论如下:
(1)经探讨可知制作校准曲线时,标准溶液需与样品分析步骤进行完全相同的处理,即经添加活性炭粉末、水浴加热、冷却等处理,消除实际测定过程中带来的误差。

表5 两种处理方式下浒苔体内硝酸盐含量的变化
注:变化值以鲜质量计;变化值1*为同时考虑上清液和残渣中硝酸盐含量时硝酸盐含量的日变化值;变化值2**为仅考虑上清液中硝酸盐含量时硝酸盐含量的日变化值。
(2)确定了实验影响因素显色剂溶液的最佳用量为0.4 mL,该方法的检出限是0.368 mg/L,且精密度和准确度较高,基本满足大多数样品的测定。
(3)通过外加标准实验可知,浒苔残渣中残留一定量的硝酸盐,对残渣进行一次处理,可提高实验结果准确性,满足测定需求。回收率结果表明,方法优化后,回收率介于90.04%~102.28%之间,RSD为3.65%。因此,该方法对浒苔中硝酸盐的测定是可行的,结果准确可靠。
[1] Li Yan, Xiao Jie, Ding Lanping, et al. Community structure and controlled factor of attached green algae on thePorphyrayezoensisaquaculture rafts in the Subei Shoal, China[J]. Acta Oceanologica Sinica, 2015, 34(8): 93-99.
[2] 丁兰平, 栾日孝. 浒苔(Enteromorphaprolifera)的分类鉴定、生境习性及分布[J]. 海洋与湖沼, 2009, 40(1): 68-71.
Ding Lanping, Luan Rixiao. The taxonomy, habit, and distribution of a green algaEnteromorphaprolifera(Ulvales, Chlorophyta)[J]. Oceanologia et Limnologia Sinica, 2009, 40(1): 68-71.
[3] Raffaelli D G, Raven J A, Poole L J. Ecological impact of green macroalgal blooms[J]. Oceanography & Marine Biology, 1998, 36: 97-125.
[4] Valiela I, McClelland J, Hauxwell J, et al. Macroalgal blooms in shallow estuaries: controls and ecophysiological and ecosystem consequences[J]. Limnology and Oceanography, 1997, 42(5 part 2): 1105-1118.
[5] Wu Lifen, Chen P C, Lee C M. The effects of nitrogen sources and temperature on cell growth and lipid accumulation of microalgae[J]. International Biodeterioration & Biodegradation, 2013, 85: 506-510.
[6] Li Ji, Glibert P M, Zhou Mingjiang. Temporal and spatial variability in nitrogen uptake kinetics during harmful dinoflagellate blooms in the East China Sea[J]. Harmful Algae, 2010, 9(6): 531-539.
[7] Grasshoff K, Ehrhardt M, Kremling K. Methods of Seawater Analysis[M]. 2nd ed. Wienhien: Verlag Chemie, 1983: 180-182.
[8] Dennis M J, Key P E, Papworth T, et al. The determination of nitrate and nitrite in cured meat by HPLC/UV[J]. Food Additives & Contaminants, 1990, 7(4): 455-461.
[9] Cheng C F, Tsang C W. Simultaneous determination of nitrite, nitrate and ascorbic acid in canned vegetable juices by reverse-phase ion-interaction HPLC[J]. Food Additives & Contaminants, 1998, 15(7): 753-758.
[10] Siu D C, Henshall A. Ion chromatographic determination of nitrate and nitrite in meat products[J]. Journal of Chromatography A, 1998, 804(1/2): 157-160.
[11] Zhou Meisu, Guo Donglong. Simultaneous determination of chloride, nitrate and sulphate in vegetable samples by single-column ion chromatography[J]. Microchemical Journal, 2000, 65(3): 221-226.
[12] Butt S B, Riaz M, Iqbal M Z. Simultaneous determination of nitrite and nitrate by normal phase ion-pair liquid chromatography[J]. Talanta, 2001, 55(4): 789-797.
[13] Andrade R, Viana C O, Guadagnin S G, et al. A flow-injection spectrophotometric method for nitrate and nitrite determination through nitric oxide generation[J]. Food Chemistry, 2003, 80(4): 597-602.
[14] Usher C D, Telling G M. Analysis of nitrate and nitrite in foodstuffs: a critical review[J]. Journal of the Science of Food and Agriculture, 1975, 26(11): 1793-1805.
[15] Ximenes M I N, Rath S, Reyes F G R. Polarographic determination of nitrate in vegetables[J]. Talanta, 2000, 51(1): 49-56.
[16] Pérez-Olmos R, Herrero R, Lima J L F C, et al. Sequential potentiometric determination of chloride and nitrate in meat products[J]. Food Chemistry, 1997, 59(2): 305-311.
[17] Öztekin N, Nutku M S, Erim F B. Simultaneous determination of nitrite and nitrate in meat products and vegetables by capillary electrophoresis[J]. Food Chemistry, 2002, 76(1): 103-106.
[18] 国家环保局. 水和废水监测分析方法[M]. 北京: 中国环境科学出版社, 1997: 259-261.
National Environmental Protection Agency. Water and Wastewater Monitoring and Analysis Methods[M]. Beijing: China Environmental Science Press, 1997: 259-261.
[19] 于立红, 康立娟, 于晓斌, 等. 蔬菜中硝酸盐污染程度快速测定方法的研究[J]. 吉林农业大学学报, 2005, 27(1): 76-78.
Yu Lihong, Kang Lijuan, Yu Xiaobin, et al. Study on fast determination method of nitrite pollution in vegetable[J]. Journal of Jilin Agricultural University, 2005, 27(1): 76-78.
[20] Yang J E, Kim J J, Skogley E O, et al. A simple spectrophotometric determination of nitrate in water, resin, and soil extracts[J]. Soil Science Society of America Journal, 1998, 62(4): 1108-1115.
[21] 李俭平. 浒苔对氮营养盐的响应及其氮营养盐吸收动力学和生理生态研究[D]. 青岛: 中国科学院海洋研究所, 2011.
Li Jianping. The response to nitrogen nutrient, and the uptake kinetics mechanism of nitrogen and Ecophysiological analysis ofEnteromorphaprolifera[D]. Qingdao: Institute of Oceanology, Chinese Academy of Sciences, 2011.
[22] 叶静, 张喆, 李富超, 等. 大型绿藻浒苔转化表达系统选择标记的筛选[J]. 生物技术通报, 2006(3): 63-67.
Ye Jing, Zhang Zhe, Li Fuchang, et al. Screening of selectable marker for transformation and expression system of green seaweedEnteromorphaclathrata[J]. Biotechnology Bulletin, 2006(3): 63-67.
[23] 张寒野, 吴望星, 宋丽珍, 等. 条浒苔海区试栽培及外界因子对藻体生长的影响[J]. 中国水产科学, 2006, 13(5): 781-786.
Zhang Hanye, Wu Wangxing, Song Lizhen, et al. Trial and field cultivation ofEnteromorphaclathrataand effects of ecological factors on its growth[J]. Journal of Fishery Sciences of China, 2006, 13(5): 781-786.
[24] 李帮秀, 张贺翠, 王三根, 等. 蔬菜硝酸盐含量测定方法的改进[J]. 植物生理学报, 2014, 50(11): 1749-1752.
Li Bangxiu, Zhang Hecui, Wang Sangen, et al. An improved testing method for determining nitrate contents in fresh vegetable[J]. Plant Physiology Journal, 2014, 50(11): 1749-1752.
[25] 赵文宽, 贺飞, 方程, 等. 仪器分析[M]. 北京: 高等教育出版社, 2000: 5-6.
Zhao Wenkuan, He Fei, Fang Cheng, et al. Instrument Analysis[M]. Beijing: Higher Education Press, 2000: 5-6.
Salicylic acid-concentrated sulfuric acid colorimetry method for determination of nitrate content in Ulva prolifera
Zhao Qian1,2,Shi Xiaoyong1,2,3,Chen Yuehong1,2,Wang Lisha1,2,Tang Hongjie1,2
(1.CollegeofChemistryandChemicalEngineering,OceanUniversityofChina,Qingdao266100,China;2.KeyLaboratoryofMarineChemistryTheoryandTechnology,MinistryofEducation,OceanUniversityofChina,Qingdao266100,China;3.NationalMarineHazardMitigationService,Beijing100194,China)
Green-tide events occurred in the Yellow Sea successively in recent years. The marine macrophyteUlvaproliferais the dominant green-tide-forming seaweed. It is necessary to study the nitrogen contents in the algal tissue, which contributes to knowing the uptake and assimilation of nitrate byUlvaprolifera. In this study, the method of salicylic acid-concentrated sulfuric acid colorimetry was employed to investigate the nitrate contents inUlvaprolifera. The influenced factors, including sample pretreatment, the amount of chromogenic reagent addition and the selection of performance curve, were examined and optimized during the determinations. The detection limit, precision and accuracy of this method were also established simultaneously. Our results indicated that this method was applicable for the fast examination of the nitrate contents in the algal tissue.
Ulvaprolifera; salicylic acid-concentrated sulfuric acid colorimetry; nitrate
10.3969/j.issn.0253-4193.2017.02.011
2016-08-30;
2016-11-04。
黄渤海海洋动力环境和生态调查(2012FY112200)。
赵倩(1990—),女,山东省莱西市人,从事海洋生态污染生态化学的研究。E-mail:zhqian0807@163.com
*通信作者:唐洪杰,女,副教授,主要研究海洋生态污染及生态化学。E-mail:thjie@ouc.edu.cn
Q945
A
0253-4193(2017)02-0112-08
赵倩,石晓勇,陈月红,等. 水杨酸浓硫酸比色法测定浒苔中硝酸盐含量[J].海洋学报,2017,39(2):112—119,
Zhao Qian,Shi Xiaoyong,Chen Yuehong, et al. Salicylic acid-concentrated sulfuric acid colorimetry method for determination of nitrate content inUlvaprolifera[J]. Haiyang Xuebao,2017,39(2):112—119, doi:10.3969/j.issn.0253-4193.2017.02.011

