铃木氏果蝇触角和下颚须感器的超微形态特征及分布
廖任娅, 张金平, 唐 睿, 董文霞, 肖 春,杨群芳, 张 峰*
(1. 四川农业大学农学院,成都 611130; 2. 中国农业科学院植物保护研究所,农业部-CABI生物安全联合实验室,植物病虫害生物学国家重点实验室,北京 100193; 3. CABI东亚中心,北京 100081; 4. 中国科学院动物研究所农业虫鼠害综合治理研究国家重点实验室,北京 100101; 5. 云南农业大学植物保护学院,昆明 650201)
铃木氏果蝇触角和下颚须感器的超微形态特征及分布
廖任娅1,2, 张金平2,3, 唐 睿2,4, 董文霞5, 肖 春5,杨群芳1*, 张 峰2,3*
(1. 四川农业大学农学院,成都 611130; 2. 中国农业科学院植物保护研究所,农业部-CABI生物安全联合实验室,植物病虫害生物学国家重点实验室,北京 100193; 3. CABI东亚中心,北京 100081; 4. 中国科学院动物研究所农业虫鼠害综合治理研究国家重点实验室,北京 100101; 5. 云南农业大学植物保护学院,昆明 650201)
铃木氏果蝇Drosophilasuzukii(Matsumura)是近年来在世界各地备受关注的一种重要入侵害虫,主要为害各种软皮水果和浆果。本研究采用扫描电镜技术观察了铃木氏果蝇雌、雄成虫的触角及下颚须上感器的超微形态。结果发现,铃木氏果蝇触角鞭节上分布着3种表面多孔的感器,分别为锥形、腔锥形和毛形感器。下颚须上分布着锥形和刺形感器。触角和下颚须上的感器形态和数量均无性二型现象。根据锥形感器的大小及表面孔口的形状和大小,又将锥形感器分为小感锥和大感锥。小感锥表面有序排列着凹陷的小孔。大感锥表面成行排列着“一”字形大孔。大感锥仅分布于触角鞭节上,推测是铃木氏果蝇独有的一类感器,或许是长期进化过程中为感受健康新鲜果实的气味而形成的特殊感器。
铃木氏果蝇; 触角鞭节; 下颚须; 感器; 扫描电镜
铃木氏果蝇Drosophilasuzukii(Matsumura),属于双翅目Diptera,果蝇科 Drosophilidae,果蝇属Drosophila,又称为斑翅果蝇或樱桃果蝇。日本学者提出该虫可能在20世纪初期传入日本[1-2],在孟加拉国[3]、中国、泰国、韩国、朝鲜和印度等国家被认为是本地种[4]。铃木氏果蝇在缅甸和巴基斯坦等亚洲其他国家也有广泛分布,现已入侵到欧洲和北美洲等地定殖为害[4]。
铃木氏果蝇寄主范围广泛,主要为害软皮水果和浆果[5-6],如树莓、蓝莓、杨梅、樱桃、草莓、葡萄、黑莓、桃、李和桑葚等,特定条件下甚至能以橡树、野茉莉和山茶花作为寄主[7-8]。在新的入侵地,由于缺乏自然天敌的有效控制,铃木氏果蝇成为果树上最严重的害虫之一[8]。在美国,铃木氏果蝇每年造成至少5.11亿美元的经济损失[5]。在意大利的特伦托省(Trento Province), 400 hm2的软皮水果在2010年和2011年遭受的经济损失约为50万和300万欧元[9]。
铃木氏果蝇之所以对水果产业造成严重危害,主要是因为铃木氏果蝇偏爱在成熟或即将成熟的新鲜水果上产卵[2,7,10],其坚硬的锯齿状产卵器可将卵产于果肉内,卵发育至幼虫后在果实内直接为害,这与黑腹果蝇Drosophilamelanogaster将卵产在腐烂水果上的行为不同[11]。另外,该虫繁殖力高,每雌平均产卵400粒[12]。还有,产卵器对水果造成的物理损伤成为其他昆虫或病原体(细菌、真菌、病毒)侵染的通道,进一步造成危害和损失[8,12]。嗅觉在铃木氏果蝇寄主选择中发挥着极其重要的作用[13],尤其是铃木氏果蝇可以寻找到隐蔽在树冠中的果实并产卵,这与交配雌虫感知水果散发的挥发性气味相关[13-14]。
昆虫触角是其感受外界信号的一种重要感觉器官,其上密布各种感器,如毛形感器(sensilla trichodea)、刺形感器(sensilla chaetica)、锥形感器(sensilla basiconica)和板形感器(sensilla placodea)等,这些感器在昆虫的寄主选择、觅偶、交配等行为过程中发挥重要的作用[15]。不同昆虫的触角感器在种类、数目和分布上有所不同[16-18];同一种昆虫在触角感器的类型、数量和分布上通常具有明显的雌雄性二型现象[18-20]。随着电子显微技术的兴起,国内外已对多种昆虫的触角感器超微结构进行了研究,如鳞翅目[21]和鞘翅目[22-23]、膜翅目昆虫[18,24-25]。对于双翅目昆虫,目前对黑腹果蝇的嗅觉研究较多[26-28],但鲜有文献对铃木氏果蝇的感器类型、分布及数量进行研究报道[29]。本研究应用电镜扫描技术对铃木氏果蝇雌、雄成虫触角和下颚须上分布的感器进行了观察,对各类感器的功能进行了探讨,为进一步研究各种感器的生理功能、探寻铃木氏果蝇寄主定位机制奠定基础。
1 材料和方法
1.1 虫源
铃木氏果蝇采集于北京市阳台山,收集成熟的野樱桃Cerasuspseudocerasus果实置于实验室养虫箱(树脂玻璃箱25 cm×25 cm×25 cm)中饲养,养虫室的温湿度和光周期条件为25℃、60% RH、L∥D=16 h∥8 h。每日观察并收集新羽化的铃木氏果蝇以备制样。
1.2 样品的制备与扫描
取当日羽化的铃木氏果蝇雌、雄各5头在解剖镜下切下触角或下颚须,将切下的触角或下颚须置于70%乙醇中固定,然后分别用85%和95%的乙醇各脱水1次,再用100%的乙醇脱水3次,每次15 min。脱水后的触角或下颚须利用CPD 030(BAL-TEC)临界点干燥仪干燥2.5 h。干燥后将样品用导电胶贴于样品台上,再利用E-1045(HITACHI)离子镀膜仪进行喷金约3 min。在SU8010(HITACHI)型扫描电镜下观察触角和下颚须上的感器。感器的鉴定和命名主要参照Stocker等[30]、Shanbhag等[31]和马瑞燕等[16]。
1.3 数据统计与图像处理
使用Adobe Photoshop CS5测量触角及感器的长度,至少6个重复。雌、雄成虫触角的长度、感器数量及长度的差异显著性分析均采用t检验,应用IBM SPSS 22.0软件进行分析。在对感器的计数过程中,将鞭节上有“感觉坑和触角芒”的一侧视为“外侧”,无“感觉坑”的一侧视为“内侧”。
2 结果与分析
2.1 触角
2.1.1 触角的一般形态结构
铃木氏果蝇雌、雄成虫触角为具芒状,其上密布感觉毛,由柄节(scape)、梗节(pedicel)和鞭节(flagellum)组成,鞭节上生有触角芒(arista)(图1)。雌成虫触角各节的长度分别为(67.6±1.92)、(126.3±1.42)和(195.9±3.21)μm,触角总长度为(379.6±7.73)μm(表1);雄成虫触角各节的长度分别为(65.3±2.40)、(114.7±2.42)和(193.9±4.53)μm,触角总长度为(368.6±10.83)μm。雌、雄成虫触角梗节长度差异极显著(t=4.012,P=0.001),柄节(t=0.734,P=0.474)、鞭节(t=1.097,P=0.286)及触角全长(t=1.097,P=0.286)在雌雄虫间均未观察到显著差异(表1)。

图1 铃木氏果蝇成虫触角Fig.1 Antenna of Drosophila suzukii

部位Part长度/μm Length(mean±SE)雄虫Male雌虫Female柄节Scape(67.6±1.92)a(65.3±2.40)a梗节Pedicel(126.3±1.42)a(114.7±2.42)b鞭节Flagellum(195.9±3.21)a(193.9±4.53)a触角总长度Totalofantennae(379.6±7.73)a(368.6±10.83)a下颚须Maxillarypalpi(225.0±4.23)a(192.7±4.41)b
1) 同行数据后不同字母表示不同性别间差异显著(t-test,P<0.05)。 Different letters in the same row indicate significant difference between sexes (t-test,P<0.05).
2.1.2 触角鞭节上感器的形态、数量和分布
铃木氏果蝇触角鞭节上的感器主要有3种类型,即锥形感器(sensilla basiconica,SB)、腔锥形感器(sensilla coeloconica,SC)和毛形感器(sensilla trichodea,ST),锥形感器又分为大感锥(large sensilla basiconica,LSB)和小感锥(small sensilla basiconica,SSB)(图2)。
锥形感器: 该类感器是铃木氏果蝇触角上最为丰富的一类感器,分布在鞭节上。大感锥主要分布在鞭节基部,小感锥散布于鞭节中间区域,所有锥形感器数量从鞭节基部到端部呈递减趋势(图2a)。大感锥和小感锥均由圆柱形基部伸出,呈棒状,表面多孔且成行排列(图2b)。
大感锥表面具有大量“一”字形大孔,孔长0.25 μm、宽0.038 μm,孔间距0.12 μm,行间距0.17 μm(图2c)。小感锥表面具有大量小孔,孔直径0.027 μm,孔间距0.11 μm,行间距0.23 μm(图2d)。雌成虫鞭节上锥形感器的数量(249.3±14.7个,n=3)与雄成虫(214.3±10.0个,n=4)无显著差异(t=2.063,P=0.094)(表2)。
表2 铃木氏果蝇雌、雄成虫鞭节及下颚须上各种感器分布的数量1)
Table 2 Abundance and distribution of sensilla on the flagella and maxillary palpi of female and maleDrosophilasuzukii

感器Sensilla触角鞭节Flagellum雌Female(n=3)雄Male(n=4)下颚须Maxillarypalpi雌Female(n=7)雄Male(n=6)锥形感器SB(249.3±14.67)a(214.3±9.95)a(73.3±2.72)a(71.2±2.48)a腔锥形感器SC(37.0±1.53)a(41.8±4.39)a--毛形感器ST(129.7±7.54)a(146.3±15.87)a--刺形感器CH--(17.4±1.51)a(15.2±1.19)a总计Total(416.0±14.80)a(402.4±21.42)a(90.7±4.05)a(86.3±2.16)a
1) 表中数值为均值±标准误,同一行数据后字母不同代表鞭节或下颚须上的感器数量在不同性别间差异显著(t-test,P<0.05)。 Data are mean±SE; different letters in the same row indicate significant difference between genders in the number of sensilla on the flagellum or maxillary palpi (t-test,P<0.05).
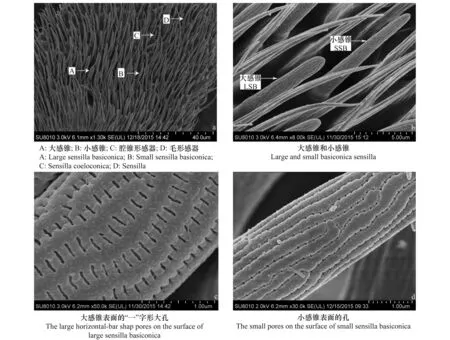
图2 铃木氏果蝇触角鞭节上的感器Fig.2 Sensilla on the flagellum of Drosophila suzuki antenna

图3 腔锥形感器的“指状”结构 图4 毛形感器表面的微孔 Fig.3 The “finger-shaped” structure of sensilla coeloconica Fig.4 Tiny pores on sensilla trichodea
雌、雄成虫大感锥长度分别为(12.12±0.16)μm和(12.09±0.16)μm(n=40),大感锥基部直径分别为(2.43±0.05)μm和(2.33±0.03)μm(n=40),且大感锥长度(t=0.146,P=0.884)和基部直径(t=1.718,P=0.090)无性别差异。雌、雄成虫小感锥长度分别为(9.60±0.19)μm(n=27)和(10.76±0.26)μm(n=27),小感锥基部直径分别为(1.52±0.03)μm(n=32)和(1.64±0.04)μm(n=27),且小感锥长度(t=3.578,P=0.001)和基部直径(t=2.656,P=0.010)也没有性别差异(表3)。
腔锥形感器:该感器是铃木氏果蝇最小的感器,也是数量最少的一类感器,散布于触角鞭节的中间区域。腔锥形感器从凹陷的底部伸出(图2a),伸出部分由几根“指状”结构愈合而成,“指状”结构表面无孔(图3)。雌、雄成虫的腔锥形感器数量分别为(37.0±1.5)(n=3)和(41.8±4.4)个(n=4),两性间无差异(t=0.889,P=0.415)(表2)。雌成虫腔锥形感器长度和基部直径分别为(5.30±0.12)和(1.27±0.04)μm(n=40),雄成虫的分别为(5.37±0.10)和(1.19±0.03)μm(n=40),长度(t=0.498,P=0.620)和基部直径(t=1.784,P=0.078)在两性间无差异(表3)。

图5 铃木氏果蝇雌成虫下颚须Fig.5 Maxillary palp of female Drosophila suzukii

图6 下颚须上的感器Fig.6 The sensilla on maxillary palpi
毛形感器:毛形感器主要集中于触角鞭节末端侧缘,从鞭节基部到端部呈递增趋势。毛形感器是鞭节上最大的感器,整体似毛,表面多孔,从基部向端部渐细,每个毛形感器都从圆柱形基部伸出,这一圆柱形基部被命名为“底鼓(basal drum,BD)”(图2a)。毛形感器表面具散布着的微孔(图4),且中部最多,向两端逐渐减少,孔直径0.007 μm。雌、雄虫的毛形感器数分别为(129.67±7.54)(n=3)和(146.25±15.87)个(n=4),两性间无差异(t=0.837,P=0.441)(表2)。雌成虫毛形感器长度和基部直径分别为(23.18±0.45)和(1.99±0.03)μm(n=40),雄成虫的分别为(23.21±0.27)和(2.06±0.04)μm(n=40),长度(t=0.065,P=0.948)和基部直径(t=1.348,P=0.181)无性别差异(表3)。
表3 铃木氏果蝇雌、雄成虫鞭节及下颚须上各种感器的长度与基部直径1)
Table 3 Length and basal diameter of sensilla on the flagellum and maxillary palpi of female and maleDrosophilasuzukii

感器Sensillum长度/μmLength雌Female雄Male基部直径/μmBasaldiameter雌Female雄Male大感锥LB(12.12±0.16)a(12.09±0.16)a (2.43±0.05)a (2.33±0.03)a 小感锥SB(9.60±0.19)b(10.76±0.26)a (1.52±0.03)b (1.64±0.04)a 腔锥形感器SC(5.30±0.12)a(5.37±0.10)a (1.27±0.04)a (1.19±0.03)a 毛形感器ST(23.18±0.45)a(23.21±0.27)a (1.99±0.03)a (2.06±0.04)a 刺形感器CH(53.81±5.99)a(69.55±7.30)a(4.38±0.35)a(4.56±0.34)a
1) 表中长度、直径为均值±标准误,同一行数据后字母不同代表感器的长度或基部直径在不同性别间差异显著(t-test,P<0.05)。 Length/diameter are mean±SE (μm); different letters in the same row indicate significant difference between genders in length or basal diameter of a sensillum (t-test,P<0.05).
2.2 下颚须
2.2.1 下颚须的形态特征
铃木氏果蝇雌、雄成虫下颚须呈镰刀状(图5),其上密布感觉毛。雌、雄成虫下颚须的平均长度分别为(225.0±4.23)和(192.7±4.41)μm,差异极显著(t=5.275,P<0.001)(表1)。
2.2.2 下颚须上感器的类型、形态和分布
下颚须上主要有两种类型的感器,即小感锥(small sensilla basiconica)和刺形感器 (sensilla chaetica)。在对感器进行计数时,将下颚须上有刺形感器存在的一面视为“正面”,无刺形感器存在的一面视为“反面”(图5a和b)。
锥形感器:下颚须上的锥形感器为小感锥,形态和孔口均与触角鞭节上小感锥相似(图6a、b),主要分布于下颚须中部和端部。雌、雄成虫下颚须上锥形感器数量分别为(73.3±2.72)(n=7)和(71.2±2.48)个(n=6),两性间无差异(t=0.567,P=0.582)(表2)。
刺形感器:刺形感器主要分布于下颚须上,且只分布于下颚须正面,数量很少,刺形感器形似刚毛状,笔直如刺,基部有一向上突起的臼状窝(图6c),刺表面具纵槽且无孔(图6d)。雌、雄成虫刺形感器数量分别为(17.4±1.51)(n=7)和(15.2±1.19)个(n=6),雌雄虫间无差异(t=1.146,P=0.276)(表2)。雌成虫下颚须上刺形感器长度和底部直径分别为(53.81±5.99)(n=24)和(4.38±0.35)μm(n=32),雄成虫的分别为(69.55±7.30)(n=24)和(4.56±0.34)μm(n=25),长度(t=1.578,P=0.120)和底部直径(t=0.355,P=0.724)无性别差异(表3)。
3 讨论与结论
3.1 讨论
本文描述了4类感器,其中锥形感器中的小感锥在铃木氏果蝇触角鞭节及下颚须上均有分布,锥形感器中的大感锥、腔锥形感器及毛形感器分布在触角鞭节上,刺形感器则只分布在下颚须上。锥形感器从鞭节基部到端部呈递减趋势,毛形感器与之相反,腔锥形感器则散布于鞭节中间区域。感器的类型、数量与分布在雌、雄成虫上未发现显著差异。黑腹果蝇也具有这4大类感器,且分布趋势与铃木氏果蝇一致[30,32-33]。
目前对果蝇的文献报道中,均未发现具有“一”字形大孔结构的锥形感器[30-32],因此推测该结构感器为铃木氏果蝇所特有。已有研究表明黑腹果蝇触角鞭节上的锥形感器为单壁多孔型,表面具纵槽[30,32];Shanbhag将黑腹果蝇的锥形感器分为大感锥、细感锥和小感锥3种类型[31]。Lin和Potter[34]利用荧光定位结合单感器记录(single sensillum recording,SSR)技术进一步验证了黑腹果蝇锥形感器分类的正确性。黑腹果蝇触角鞭节上的锥形感器内部有2~4个嗅觉神经元,具分支树突,为嗅觉感器[30,32],其对短链醇和脂肪酸[35]、乙酸乙酯(ethyl acetate)和3-辛醇(3-octanol)等挥发性物质[33](樱桃、桃等水果气味的组成成分)均有嗅觉反应,因此锥形感器与感受寄主气味化合物有关。本研究发现铃木氏果蝇触角鞭节上锥形感器也具有大量孔口,孔口的形状和大小与黑腹果蝇有差异,推测这与两者感应寄主不同发育阶段的化学气味有关,铃木氏果蝇触角鞭节上的大感锥可能是长期进化过程中为感受健康新鲜果实的气味而形成的特殊感器。
铃木氏果蝇触角鞭节上的腔锥形感器在外部形态和结构上与黑腹果蝇相似。主要起嗅觉和温湿度感受作用[32,36]。Clyne 等通过电生理试验证明黑腹果蝇触角鞭节上的腔锥形感器是许多醇类和醛类的感受器官[33],Park 等进一步研究发现腔锥形感器对丙酸(propionic acid)和丁酸(butyric acid)反应强烈[37]。
毛形感器是铃木氏果蝇触角鞭节上数量最多的感器,形态上与黑腹果蝇相似。最初的研究认为毛形感器是单壁无孔型,内部神经元无树突分支,可能是温湿度感器或其他感器[32]。然而,Stocker等[30]的研究发现毛形感器表面有大量小孔存在,无末端开口,且有一个灵活的“底鼓”,这表明毛形感器可能是一种嗅觉感器,而不是味觉或机械型感器。Clyne等[33]及Shanbhag等[31]利用电生理技术发现毛形感器存在内部的嗅觉神经元和嗅觉受体,从而进一步证实了毛形感器是一种嗅觉感器。并且有研究表明黑腹果蝇毛形感器T1里的嗅觉受体Or67d能够感受雄性信息素(cVA),调节果蝇的交配行为[11,38]。
铃木氏果蝇下颚须上主要有两种类型的感器,即锥形感器中的小感锥和刺形感器。铃木氏果蝇下颚须上锥形感器与触角鞭节上小感锥的形态结构一致,而且与黑腹果蝇下颚须表面的锥形感器相似[31]。刺形感器较长、表面无孔,可能起机械感觉作用,这与黑腹果蝇下颚须上刺形感器的结构和功能基本一致[30,32]。而黑腹果蝇下颚须上锥形感器可能对于感知具有抑制作用的雌性信息物质十分重要[39],也对短链醇和脂肪酸有反应,且这种行为受鞭节锥形感器的控制[40]。
除了上述几种感器外,铃木氏果蝇触角和下颚须上还分布有大量的微刺,微刺较小,在形态上与毛形感器相似,但表面无孔,这与黑腹果蝇的情况相同,并不被认为是一种感器[33]。也有研究表明黑腹果蝇触角“感觉坑”里也分布有大量的感器[37],本文未对触角感觉坑进行细致观察和研究。
3.2 结论
综上所述,铃木氏果蝇和黑腹果蝇的触角及下颚须上的感器种类和分布极其相似。但是,本研究发现铃木氏果蝇触角鞭节上的大感锥表面具有独特的“一”字形大孔,而黑腹果蝇无此结构,这或许与铃木氏果蝇定位取食健康新鲜水果而黑腹果蝇选择腐烂果实有关。新鲜水果的挥发性气味与腐烂水果及其共生菌的挥发性气味均具有特定的化学信息物质指纹图谱,铃木氏果蝇触角鞭节上的大感锥可能是长期进化过程中为感受健康新鲜果实的气味而形成的特殊感器。但是其具体功能和嗅觉感受机制还需要结合透射电镜、电生理及分子生物学等技术作进一步研究。
[1] Kanzawa T.Studies onDrosophilasuzukiiMats[J]. Journal Plant Protection, 1936, 23(1): 66-70.
[2] Kanzawa T.Studies onDrosophilasuzukiiMats[C]. Yamanashi Agricultural Experimental Station, Kofu, Japan, 1939: 1-49.
[3] Pansa M G, Frati S, Baudino M, et al. First record ofDrosophilasuzukiiin Piedmont[J]. Protezione delle Colture, 2011, 2: 108.
[4] CABI/EPPO.Drosophilasuzukii[Distribution map]. Distribution Maps of Plant Pests [C]. Wallingford, UK, 2012.
[5] Bolda M P, Goodhue R E, Zalom F G.Spotted wing drosophila: potential economic impact of a newly established pest [J]. Agricultural and Resource Economics Update, 2010, 13(3): 5-8.[6] Dreves A J, Bruck D, Lee J, et al. Spotted-wing drosophila: prevention tools are underway [C]. Research Reports 71st Annual Pacific Northwest Insect Management Conference, 2012: 43-44.
[7] Biosecurity Australia. Draft pest risk analysis report forDrosophilasuzukii[R]. Canberra: Australian Government Biosecurity Australia, 2010.
[8] Walsh D B, Bolda M P, Goodhue R E, et al.Drosophilasuzukii(Diptera: Drosophilidae): Invasive pest of ripening soft fruit expanding its geographic range and damage potential [J]. Integrated Pest Management, 2011, 2(1): 1-7.
[9] de Ros G, Anfora G, Grassi A, Ioriatti C.The potential economic impact ofDrosophilasuzukiion small fruits production in Trentino (Italy)[J]. IOBC-WPRS Bull, 2013, 91:317-321.
[10]Mitsui H, Takahashi K H, Kimura M T.Spatial distributions and clutch sizes ofDrosophilaspecies ovipositing on cherry fruits of different stages [J]. Population Ecology, 2006, 48(3): 233-237.
[11]Stensmyr M C, Dweck H K M, Farhan A, et al. A conserved dedicated olfactory circuit for detecting harmful microbes inDrosophila[J]. Cell, 2012, 151(6): 1345-1357.
[12]Cini A, Ioriatti C, Anfora G.A review of the invasion ofDrosophilasuzukiiin Europe and a draft research agenda for integrated pest management [J]. Bulletin of Insectology, 2012, 65(1): 149-160.
[13]Revadi S, Vitagliano S, Stacconi M R, et al. Olfactory responses ofDrosophilasuzukiifemales to host plant volatiles[J]. Physiological Entomology, 2015, 40(1): 54-64.
[14]Keesey L W, Knaden M, Hansson B S.Olfactory specialization inDrosophilasuzukiisupports an ecological shift in host preference from rotten to fresh fruit [J]. Journal of Chemical Ecology, 2015, 41(2): 121-128.
[15]Schneider D.Insect antennae [J]. Annual Review of Entomology, 1964, 9: 103-122.
[16]马瑞燕, 杜家纬. 昆虫的触角感器[J]. 昆虫知识, 2000, 37(3): 179-183.
[17]Chen L, Fadamiro H Y.Antennal sensilla of the decapitating phorid fly,Pseudacteontricuspis(Diptera: Phoridae)[J]. Micron, 2008, 39(5): 517-525.
[18]Onagbola E O, Fadamiro H Y.Scanning electron microscopy studies of antennal sensilla ofPteromaluscerealellae(Hymenoptera: Pteromalidae)[J]. Micron, 2008, 39(5): 526-535.
[19]滕莹, 舒金平, 刘剑, 等. 黄脊竹蝗触角感器的电镜扫描观察[J]. 生态学杂志, 2012, 31(5): 1225-1232.
[20]Carle T, Toh Y, Yamawaki Y, et al. The antennal sensilla of the praying mantisTenoderaaridifolia: a new flagellar partition based on the antennal macro-, micro-and ultrastructures [J]. Arthropod Structure & Development, 2014, 43(2): 103-116.
[21]王霞, 徐静, 刘凤英, 等. 豆野螟触角感器的电镜超微结构及嗅觉功能[J]. 昆虫学报, 2008, 51(12): 1225-1234.
[22]Ren L L, Wu Y, Shi J, et al. Antenna morphology and sensilla ultrastructure ofTetriguslewisiCandeze(Coleoptera: Elateridae)[J]. Micron, 2014, 60: 29-38.
[23]Mutis A, Palma R, Parra L, et al. Morphology and Distribution of Sensilla on the Antennae ofHylamorphaelegansBurmeister (Coleoptera: Scarabaeidae)[J]. Neotropical Entomology, 2014, 43(3): 260-265.
[24]宋月芹, 董钧锋, 林克剑, 等. 柑橘粉虱触角超微结构特征研究[J]. 植物保护, 2012, 38(2): 124-126.
[25]孙虹霞, 胡新军, 舒迎花, 等. 白背飞虱触角感器的扫描电镜观察[J]. 昆虫学报, 2006, 49(2): 349-354.
[26]Hansson B S, Stensmyr M C.Evolution of insect olfaction [J]. Neuron, 2011, 72(5): 698-711.
[27]Matsuo T.Contribution of olfactory and gustatory sensations of octanoic acid in the oviposition behavior ofDrosophilamelanogaster(Diptera: Drosophilidae)[J]. Applied Entomology and Zoology, 2012, 47(2): 137-142.
[28]Dweck H K M, Ebrahim S A M, Kromann S, et al. Olfactory preference for egg laying on citrus substrates inDrosophila[J].Current Biology, 2013, 23(24): 2472-2480.
[29]Dekker T, Revadi S, Mansourian S, et al. Loss ofDrosophilapheromone reverses its role in sexual communication inDrosophilasuzukii[J].Proceedings of the Royal Society B Biological Sciences, 2015, 282: 1-9.
[30]Stocker R.The organization of chemosensory system inDrosophilamelanogaster: a review [J]. Cell & Tissue Research, 1994, 275(1): 3-26.
[31]Shanbhag S R, Müller B, Steinbrecht R A.Atlas of olfactory organs ofDrosophilamelanogaster: 1. Types, external organization, innervation and distribution of olfactory sensilla[J]. International Journal of Insect Morphology and Embryology, 1999, 28(99): 377-397.
[32]Venkatesh S, Singh R N.Sensilla on the third antennal segment ofDrosophilamelanogasterMeigen (Diptera: Drosophilidae)[J]. International Journal of Insect Morphology and Embryology, 1984, 13(1): 51-63.
[33]Clyne P J, Grant A, O’Connell R, et al. Odorant response of individual sensilla on theDrosophilaantenna [J]. Invertebrate Neuroscience, 1997, 3: 127-135.
[34]Lin C C, Potter C J.Re-classification ofDrosophilamelanogasterTrichoid and intermediate sensilla using fluorescence-guided single sensillum recording [J]. PLoS ONE, 2015, 10(10):1-14.
[35]Venard R, Stocker R F.Behavioral and electroantennogram analysis of olfactory stimulation in lozenge: aDrosophilamutant lacking antennal basiconic sensilla [J]. Journal of Insect Behavior, 1991, 4(6): 683-705.
[36]Altner H, Prillinger L.Ultrastructure of invertebrate chemo-, thermo-and hygroreceptors and its functional significance [J]. International Review of Cytology, 1980, 67(8): 69-139.
[37]Park S K, Shanbhag S R, Dubin A E, et al. Inactivation of olfactory sensilla of a single morphological type differentially affects the response ofDrosophilato odors [J]. Journal of Neurobiology, 2002, 51(3): 248-260.
[38]Kurtovic A, Widmer A, Dickson B J.A single class of olfactory neurons mediates behavioural responses to aDrosophilasex pheromone [J]. Nature, 2007, 446: 542-546.
[39]Stocker R F, Gendre N.Courtship behavior ofDrosophilagenetically and surgically deprived of basiconica sensilla [J]. Behavior Genetics, 1989, 19(3): 371-385.
[40]Ferveur J F, Cobb M, Jallon J M.Complex chemical messages inDrosophila[J]. Neurobiology of Sensory Systems, 1989: 397-409.
(责任编辑:田 喆)
Ultrastructural morphology and distribution of sensilla on the antennae and maxillary palpi ofDrosophilasuzukii(Matsumura)
Liao Renya1,2, Zhang Jinping2,3, Tang Rui2,4, Dong Wenxia5,Xiao Chun5, Yang Qunfang1, Zhang Feng2,3
(1.CollegeofAgronomy,SichuanAgriculturalUniversity,Chengdu611130,China; 2.MoA-CABIJointLaboratoryforBio-safety,InstituteofPlantProtection,ChineseAcademyofAgriculturalSciences,Beijing
100193,China; 3.CABIEastAsia,Beijing100081,China; 4.StateKeyLaboratoryofIntegratedManagementofPestInsectsandRodents,InstituteofZoology,ChineseAcademyofSciences,Beijing100101,China; 5.CollegeofPlantProtection,YunnanAgriculturalUniversity,Kunming650201,China)
Drosophilasuzukiiis becoming a world-wide serious pest. It is a highly polyphagous pest, mainly causing damages to soft fruits. The sensilla on the antennae and maxillary palpi were observed by scanning electron microscope technology. The results showed that there were three types of sensilla on flagellum of the antennae, including sensilla basiconica, sensilla coeloconica and sensilla trichodea. Only sensilla basiconica and sensilla chaetica were observed on the maxillary palpi. Sexual dimorphism in structure, distribution and numbers of the other sensilla was not observed. Large and small subtypes of sensilla basiconica were further distinguished. A number of large horizontal bar-shaped pores were distributed on the surface of large sensilla basiconica, while numerous small pores on the surface of small sensilla basiconica. Large sensilla basiconica, a unique type of sensillum not yet observed in otherDrosophilaspecies, was only distributed on the flagellum ofD.suzukii. It might be evolved as a specific type of sensillum forD.suzukiito smell volatiles emitted by healthy and fresh fruits.
Drosophilasuzukii; flagellum; maxillary palpi; sensillum; scanning electron microscope
2016-03-17
2016-05-09
欧盟第七框架计划 (Dropsa, 613678);中国捐赠CABI发展基金
Q 964
A
10.3969/j.issn.0529-1542.2017.01.011
* 通信作者 E-mail:qunfagnyang@hotmail.com; f.zhang@cabi.org

