活动期炎症性肠病患者血清内脂素水平及其临床意义*
包文霞 李 岭 陶丽华 刘 忆 张海玲 庞 智
苏州大学附属第一医院消化科1(215006) 苏州市立医院北区消化科2
活动期炎症性肠病患者血清内脂素水平及其临床意义*
包文霞1#李 岭1陶丽华1刘 忆1张海玲1庞 智2&
苏州大学附属第一医院消化科1(215006) 苏州市立医院北区消化科2
背景:近年炎症性肠病(IBD)的发病率呈逐年增长趋势,但其发病机制目前仍不明确。既往研究发现一些脂肪因子在肠道炎症调节中起关键作用。目的:探讨脂肪细胞因子内脂素(visfatin)在IBD中的作用及其临床意义。方法:收集2015年5月—2015年12月苏州大学附属第一医院和苏州市立医院91例活动期IBD患者,包括61例克罗恩病(CD)和30例溃疡性结肠炎(UC),以ELISA法检测血清内脂素水平。48名健康体检者作为对照组。分析血清内脂素水平与IBD患者临床特征的关系,以ROC曲线评估血清内脂素水平对IBD的诊断效能。结果:活动期CD和UC患者的血清内脂素水平显著高于对照组[(385.24±112.64) pg/mL和(378.91±118.57) pg/mL对(321.11±96.27) pg/mL,P均<0.05]。血清内脂素水平与UC患者的疾病活动性Mayo评分呈显著正相关(r=0.398,P<0.05),与CD患者的疾病活动性以及IBD患者的临床常用炎性指标CRP、ESR和病变部位均无关(P均>0.05)。血清内脂素水平诊断CD和UC的ROC曲线下面积(AUC)分别为0.654和0.622,诊断准确性较低。结论:血清内脂素水平可能与IBD炎症活动有一定关联,并可能成为活动期UC的临床指标。
内脂素; 脂肪因子类; Crohn病; 结肠炎,溃疡性; 诊断
炎症性肠病(inflammatory bowel disease, IBD)是一组病因不明的慢性非特异性胃肠道炎性疾病,主要包括克罗恩病(Crohn’s disease, CD)和溃疡性结肠炎(ulcerative colitis, UC)。近年IBD发病率呈逐年增长趋势,但其发病机制目前仍不明确,可能与遗传易感人群在持续肠道感染、肠黏膜屏障缺陷、环境改变等多种因素的作用下出现肠道免疫系统异常有关。很早以前就有研究发现CD患者存在肠系膜脂肪肥厚和爬行脂肪(creeping fat,指肠系膜附着处的异位脂肪组织延伸并覆盖50%以上的结直肠和小肠表面),有学者指出肠系膜脂肪肥厚和肠道脂肪包裹(fat-wrapping,即爬行脂肪)是CD的特征性表现[1]。组织学分析显示,CD患者的肠系膜脂肪组织中有巨噬细胞和T细胞浸润,表明存在活动性炎症[2],提示脂肪组织可能在肠道炎症反应中发挥一定作用。脂肪组织能产生多种细胞因子和脂肪因子,亦为肠系膜脂肪参与肠道炎症反应提供了一定依据。巨噬细胞集落刺激因子(M-CSF)、移行抑制因子(MIF)等在CD患者的肠系膜脂肪组织中呈特异性高表达[3],一些脂肪因子在肠道炎症调节中亦起关键作用,目前研究较多的有趋化素(chemerin)、瘦素(leptin)、脂联素(adiponectin)、抵抗素(resistin)等,而本研究旨在探讨脂肪因子内脂素(visfatin)在IBD中的作用及其临床意义。
对象与方法
一、研究对象
收集2015年5月—2015年12月在苏州大学附属第一医院和苏州市立医院住院或门诊就诊、临床资料完整、彼此间无血缘关系的活动期IBD患者91例,其中CD患者61例,UC患者30例,IBD的诊断和疾病活动性的评估均采用我国IBD诊治共识中的相关标准[4]。另纳入同期健康体检者48名作为对照组。61例CD患者中,男性39例,女性22例,平均年龄(34.5±11.2)岁,平均病程(6.5±3.2)年;回肠病变(L1)24例,结肠病变(L2)12例,回结肠病变(L3)22例,单纯累及上消化道(L4)3例。30例UC患者中,男性18例,女性12例,平均年龄(44.5±13.6)岁,平均病程(5.8±3.6)年,直肠炎(E1)2例,左半结肠炎(E2)13例,全结肠炎(E3)15例。排除标准:合并其他自身免疫性疾病;近1个月使用糖皮质激素,近3个月使用免疫抑制剂;近期明确感染性疾病史,严重心、肺、神经、精神疾病,糖尿病以及其他内分泌疾病,肝肾功能损害;服用避孕药的育龄女性;有创伤者。48例对照者中,男性27例,女性21例,平均年龄(41.6±11.9)岁,体检结果无异常。IBD组与对照组间性别构成和年龄差异无统计学意义(P>0.05)。
二、方法
1. 血清内脂素水平检测:常规采血,离心、分离血清,置于EP管中,-20 ℃保存待测。以ELISA法检测血清内脂素水平,人内脂素ELISA试剂盒购自上海酶联生物科技有限公司,具体操作步骤严格按照试剂盒说明书进行。于450 nm波长处测定各孔吸光度(A)值,绘制标准曲线,计算血清内脂素水平(pg/mL)。
2. C反应蛋白(CRP)和红细胞沉降率(ESR)检测:采用常规实验室方法检测临床常用炎性指标CRP和ESR。
3. 疾病活动性评估[4]:CD疾病活动性的评估采用Best CD活动指数(CDAI),UC疾病活动性的评估采用改良Mayo评分系统。
三、统计学分析
结 果
一、血清内脂素水平
ELISA检测显示,CD组和UC组血清内脂素水平均高于对照组,差异有统计学意义(P<0.05)(表1)。
二、血清内脂素水平与IBD患者临床特征的关系
1. 与疾病活动性的关系:CD组和UC组血清内脂素水平、CRP、ESR检测结果以及疾病活动性的Best CDAI或Mayo评分见表1。Pearson相关系数分析显示,CD组和UC组血清内脂素水平与炎性指标CRP、ESR均无相关性(CD组:内脂素与CRP,r=-0.063,P>0.05,内脂素与ESR,r=-0.005,P>0.05;UC组:内脂素与CRP,r=-0.092,P>0.05,内脂素与ESR,r=-0.037,P>0.05);UC组血清内脂素水平与Mayo评分呈显著正相关(r=0.398,P<0.05),CD组血清内脂素水平与Best CDAI无相关性(r=0.215,P>0.05)。
2. 与病变部位的关系:CD组和UC组各病变部位亚组间血清内脂素水平差异均无统计学意义(P>0.05)(表2),表明血清内脂素水平与IBD病变部位无相关性。
三、血清内脂素水平对IBD的诊断效能
ROC曲线分析显示,血清内脂素水平诊断CD的曲线下面积(AUC)为0.654,最佳临界值(cut-off值)为479.55 pg/mL,相应敏感性和特异性分别为31.1%和100%(图1)。血清内脂素水平诊断UC的AUC为0.622,cut-off值为443.21 pg/mL,相应敏感性和特异性分别为36.7%和91.7%(图2)。

表1 IBD患者血清内脂素水平和疾病活动性±s)


CD病变部位内脂素UC病变部位内脂素L1389.37±120.11E1437.99±169.06L2398.11±111.98E2389.69±109.14L3373.42±116.36E3361.69±126.28L4387.43±29.28--
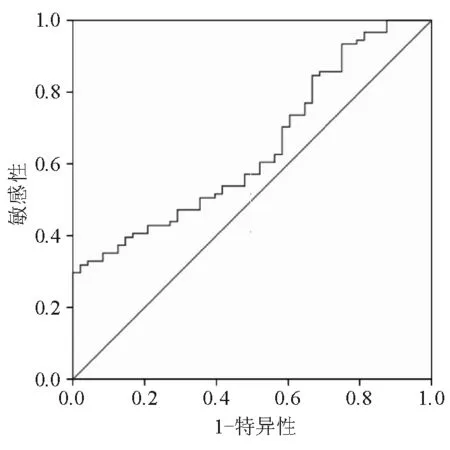
图1 血清内脂素水平诊断CD的ROC曲线

图2 血清内脂素水平诊断UC的ROC曲线
讨 论
内脂素是一种主要由脂肪细胞分泌的细胞因子,相对分子质量为52 kDa (1 Da=0.992 1 u),最早于2005年由Fukuhara等在内脏脂肪组织中发现并命名,其后有研究证明内脂素与1994年Samal等从骨髓基质活化淋巴细胞中发现的前B细胞集落增强因子(PBEF)是同一个蛋白分子[5]。该细胞因子具有多种迥然不同的生物学活性,除烟酰胺磷酸核糖转移酶(NAMPT)活性以及胰岛素抵抗作用外,作为一种分泌型细胞因子,内脂素还可诱导基质金属蛋白酶-9(MMP-9)以及多种炎性因子表达,如肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、IL-6、IL-8等[6-8],从而参与一些急慢性炎性疾病的发生、发展,如类风湿性关节炎、急性肺损伤等[9-10]。巨噬细胞、树突细胞、结肠上皮细胞亦为内脂素的可能来源[8]。除促进炎性因子表达、分泌外,内脂素还可诱导单核细胞表面的CD54、CD40、CD80等共刺激分子表达,从而促进T细胞活化,发挥免疫调节功能;体外实验证实,经内脂素预孵育的单核细胞,诱导淋巴细胞增殖的能力明显增强,MAPK信号途径参与了该作用的介导[8]。此外,内脂素还可明显增强人单核细胞由甘露糖受体介导的吞噬作用。研究[11]显示,内脂素竞争性抑制剂APO866可有效减轻免疫相关关节炎症,降低受累关节的促炎细胞因子分泌。
本研究以IBD患者为研究对象,通过分析血清内脂素水平与患者临床特征的关系,探讨其在IBD中的可能作用。研究严格限制处于感染、应激状态的患者入组,从而尽可能地排除了引起体内内脂素水平变化的其他因素,尤其是排除了2型糖尿病患者血清内脂素水平升高的干扰。研究结果显示活动期CD和UC患者的血清内脂素水平显著高于健康人,与既往研究发现一致[8,12-13],提示其水平升高与肠道炎症反应的发生、发展有一定关联。炎症部位免疫细胞功能的发挥在很大程度上需要趋化因子参与,而内脂素是CD14+单核细胞和CD19+B细胞的潜在趋化因素[8],此为内脂素除促进炎性因子分泌、参与免疫调节之外的另一个参与IBD发生、发展的可能途径。
此外,本研究还发现血清内脂素水平与UC患者的疾病活动性Mayo评分呈显著正相关,但与CD患者的Best CDAI无关,与CD和UC患者的临床常用炎性指标CRP、ESR以及病变部位亦无关。上述发现证实血清内脂素水平与IBD肠黏膜炎症之间有一定联系,但其参与调节CD和UC的作用可能存在差异,但亦可能与研究样本量的限制有关。本研究ROC曲线分析显示,血清内脂素水平诊断CD和UC的AUC分别为0.654和0.622,诊断准确性较低,诊断CD时cut-off值为479.55 pg/mL,敏感性和特异性分别为31.1%和100%,诊断UC时cut-off值为443.21 pg/mL,敏感性和特异性分别为 36.7%和91.7%。综上,血清内脂素对IBD的诊断作用有限,但有望成为明确活动期UC的潜在指标。
本研究的不足之处在于未能进一步收集IBD患者经治疗获得缓解后的外周血样本测定内脂素水平,故无法了解血清内脂素水平在缓解期IBD患者中是否下降并确定其区分缓解期与活动期IBD的界值。此外,既往研究[13]发现内脂素可能与IBD患者的骨密度降低有关,本研究因样本临床资料的限制而未作相关分析,后续有待完善。
综上所述,活动期IBD患者血清内脂素水平明显升高,提示其可能与IBD炎症活动有一定关联,并可能成为活动期UC的临床指标。内脂素可能通过诱导多种炎性因子表达、参与免疫调节而在IBD肠黏膜炎症免疫反应中发挥作用。然而,IBD发病机制复杂,而内脂素的病理生理功能又存在多样性,其在IBD中的确切作用机制仍有待进一步研究明确。
1 Peyrin-Biroulet L, Chamaillard M, Gonzalez F, et al. Mesenteric fat in Crohn’s disease: a pathogenetic hallmark or an innocent bystander?[J]. Gut, 2007, 56 (4): 577-583.
2 Yamamoto K, Kiyohara T, Murayama Y, et al.Production of adiponectin, an anti-inflammatory protein, in mesenteric adipose tissue in Crohn’s disease[J]. Gut, 2005, 54 (6): 789-796.
3 Paul G, Schäffler A, Neumeier M, et al. Profiling adipocytokine secretion from creeping fat in Crohn’s disease[J]. Inflamm Bowel Dis, 2006, 12 (6): 471-477.
4 中华医学会消化病学分会炎症性肠病学组. 炎症性肠病诊断与治疗的共识意见(2012年·广州)[J]. 胃肠病学, 2012, 17 (12): 763-781.
5 Fukuhara A, Matsuda M, Nishizawa M, et al. Retraction of Visfatin: a protein secreted by visceral fat that mimics the effects of insulin. [Science. 2005][J] Science, 2007, 318 (5850): 565.
6 Chang YC, Chang TJ, Lee WJ, et al.The relationship of visfatin/pre-B-cell colony-enhancing factor/nicotinamide phosphoribosyltransferase in adipose tissue with inflammation, insulin resistance, and plasma lipids[J]. Metabolism, 2010, 59 (1): 93-99.
7 Dahl TB, Yndestad A, Skjelland M, et al. Increased expression of visfatin in macrophages of human unstable carotid and coronary atherosclerosis: possible role in inflammation and plaque destabilization[J]. Circulation, 2007, 115 (8): 972-980.
8 Moschen AR, Kaser A, Enrich B, et al.Visfatin, an adipocytokine with proinflammatory and immunomodulating properties[J]. J Immunol, 2007, 178 (3): 1748-1758.
9 Otero M, Lago R, Gomez R, et al.Changes in plasma levels of fat-derived hormones adiponectin, leptin, resistin and visfatin in patients with rheumatoid arthritis[J]. Ann Rheum Dis, 2006, 65 (9): 1198-1201.
10 Ye SQ, Simon BA, Maloney JP, et al. Pre-B-cell colony-enhancing factor as a potential novel biomarker in acute lung injury[J]. Am J Respir Crit Care Med, 2005, 171 (4): 361-370.
11 Busso N, Karababa M, Nobile M, et al. Pharmacological inhibition of nicotinamide phosphoribosyltransferase/visfatin enzymatic activity identifies a new inflammatory pathway linked to NAD[J]. PLoS One, 2008, 3 (5): e2267.
12 Waluga M, Hartleb M, Boryczka G, et al.Serum adipokines in inflammatory bowel disease[J]. World J Gastroenterol, 2014, 20 (22): 6912-6917.
13 Moschen AR, Geiger S, Gerner R, et al.Pre-B cell colony enhancing factor/NAMPT/visfatin and its role in inflammation-related bone disease[J]. Mutat Res, 2010, 690 (1-2): 95-101.
(2016-05-23收稿;2016-06-29修回)
Serum Level and Clinical Significance of Visfatin in Patients with Active Inflammatory Bowel Disease
BAOWenxia1,LILing1,TAOLihua1,LIUYi1,ZHANGHailing1,PANGZhi2.
1DepartmentofGastroenterology,theFirstAffiliatedHospitalofSoochowUniversity,Suzhou,JiangsuProvince(215006);2DepartmentofGastroenterology,SuzhouMunicipalHospital(NorthBranch),Suzhou,JiangsuProvince
PANG Zhi, Email: pangzhi0273@sina.com
Visfatin; Adipokines; Crohn Disease; Colitis, Ulcerative; Diagnosis
10.3969/j.issn.1008-7125.2017.01.007
江苏省自然科学基金(BK20161232)
#Email: 20135232037@stu.suda.edu.cn
&本文通信作者,Email: pangzhi0273@sina.com
Background: The incidence of inflammatory bowel disease (IBD) is increasing in recent years, however, its pathogenic mechanism has not been fully clarified. Previous studies revealed that adipokines played crucial roles in regulating intestinal inflammation. Aims: To investigate the role of visfatin, an adipocytokine, and its clinical significance in active IBD. Methods: Ninety-one patients with active IBD including 61 Crohn’s disease (CD) and 30 ulcerative colitis (UC) at the First Affiliated Hospital of Soochow University and Suzhou Municipal Hospital from May 2015 to Dec. 2015 were enrolled in this study, and 48 healthy subjects were served as controls. Serum level of visfatin was determined by ELISA. Correlation of serum visfatin level with clinical features of IBD was analyzed, its diagnostic performance for IBD was assessed by ROC curve. Results: Serum level of visfatin was significantly higher in patients with active CD and UC than in healthy controls [(385.24±112.64) pg/mL and (378.91±118.57) pg/mLvs. (321.11±96.27) pg/mL,Pall <0.05]. Significant positive correlation was found between serum visfatin level and disease activity index (Mayo score) of UC (r=0.398,P<0.05), however, no correlations were found between serum visfatin level and disease activity index of CD, CRP and ESR, two common inflammatory indicators for IBD and location of IBD (Pall >0.05). The area under curve (AUC) of serum visfatin for diagnosis of CD and UC were 0.654 and 0.622, respectively; the diagnostic accuracy was relatively low. Conclusions: Serum visfatin might be associated with the active intestinal inflammation in IBD and has the potential to be served as a clinical index for active UC.

