间歇与持续有氧运动改善慢性心力衰竭大鼠骨骼肌糖原代谢研究
朱荣,马建设
ZHU Rong,MAJian-she
间歇与持续有氧运动改善慢性心力衰竭大鼠骨骼肌糖原代谢研究
朱荣,马建设
ZHU Rong,MAJian-she
心力衰竭(心衰)是一种全身性疾病,而非仅涉及心脏。心衰时骨骼肌功能异常,其机制与毛细血管稀疏、肌纤维由I型(氧化型)向II型(糖酵解型)转变、物质与能量代谢异常以及肌萎缩有关,最终导致运动耐力下降,是造成心衰患者呼吸困难、易于疲劳的主要原因[12]。流行病学研究证实,运动能力低下是心衰患者预后不良的独立预测变量[29]。
心衰时机体分解代谢加强,糖代谢供能比例增加使肌糖原含量减少。研究证实,骨骼肌糖原含量降低是心衰患者运动耐力下降的重要原因,减少骨骼肌糖原利用、增加肌糖原含量可显著提高心衰患者的运动能力并改善生活质量[21]。研究发现,运动疗法不仅能够改善心衰患者心功能,对骨骼肌系统也存在良性影响[10],但针对心衰患者的最佳运动处方仍未确定。已经明确的是,中等强度持续有氧运动是心衰患者的首选运动方式,可改善心功能和骨骼肌异常,其安全性和有效性也得到普遍认可。我们的前期研究也发现,长期中等强度有氧运动能够提高正常大鼠[3]以及心衰大鼠[4]骨骼肌糖原含量并改善运动能力。有研究显示,高强度间歇运动亦可作为心衰患者的康复治疗手段,不良反应的发生率并未明显增加,其对于运动能力和心功能的良性效应甚至优于传统的持续运动[22,31]。本团队曾采取正常大鼠高强度间歇运动方案,发现骨骼肌糖原含量上调[2],但对心衰大鼠的作用及机制未知。因此,本研究进一步以心衰大鼠为对象,对比高强度间歇运动和中等强度持续运动对其不同类型肌纤维糖原含量的影响及机制进行探讨,以期为制定特异性的运动康复处方以及制定新的治疗策略和干预靶点提供理论依据。
1 研究对象与方法
1.1 实验对象
健康雄性SD大鼠40只,体重250~300 g,由军事医学科学院实验动物中心提供。动物生产许可证批号:SCXK-(军)2007-004,动物批号:0006645,动物使用许可证批号:SYXK(京)2008-0009。动物饲养于标准实验室,自动温控(21± 2℃),湿度60%~65%,12 h昼夜交替光照,每笼5只,自由进食饮水。本实验在温州医科大学和中国农业科学院生物技术研究所作物功能基因与遗传改良研究室完成。
1.2 分组与造模
将大鼠随机分为心衰安静组(heart failure sedentary,HFS)、心衰间歇运动组(heart failure interval exercise,HF-IE)、心衰持续运动组(heart failure continuous exercise,HF-CE)和假手术组(sham-operated,SHAM),每组各10只。利用冠状动脉结扎术进行心衰造模,方法为:0.1 mg/kg戊巴比妥钠腹腔麻醉动物后仰卧固定,胸部备皮,连接小动物呼吸机,在心尖搏动处开胸暴露心脏,0号丝线结扎冠状动脉前降支。心电图显示心肌缺血改变(Ⅱ导出现ST段弓背抬高)持续超过30 min标志手术成功。迅速放回心脏缝合胸壁。术后连续3天给予青霉素1×105U/d肌注预防感染。SHAM组开胸后只穿针,但不结扎冠状动脉前降支,其余处理同上。
1.3 运动耐力测定与运动方案
所有大鼠在术后4周开始进行跑台适应性训练(10~15 m/min,30 min/d,共5天),而后利用递增负荷运动实验测定大鼠运动耐力[15]。将跑台坡度设置为0°,起始负荷为5 m/ min,每2 min递增1.5 m/min,直至力竭。力竭标准:大鼠拒绝继续运动,在电刺激下仍持续停留于电动跑台后部。记录最大位移、力竭时间和最大跑速(maximal velocity,Velmax)。
根据Borges等[8]、Hoydal等[17]的方法制定跑台运动方案。HF-IE组进行高强度间歇运动:先以40%Velmax运动5 min,再以80%Velmax运动4 min和40%Velmax运动4 min,之后依次交替进行,重复7次(运动时间为56 min),5天/周,共8周。HFCE组进行中等强度持续运动:热身运动5 min(40%Velmax),之后以60%Velmax持续运动56 min,5天/周,共8周。两种训练方式总的运动负荷相同(HF-IE组:[80%×4+40%×4]×7=33.6 Velmax·min;HF-CE组:60%×56=33.6 Velmax·min),可排除因运动负荷不同造成的结果差异。实验结束后第2天再次测定运动耐力。
1.4 心脏超声检测
实验结束后第3天进行心脏超声检测。首先称大鼠体重(body weight,BW),0.1 mg/kg戊巴比妥钠腹腔麻醉,仰卧固定,胸部备皮,用小动物超声影像诊断系统(Vevo 770,加拿大visualsonics公司)进行心脏超声检查。探头(频率为7.0 MHz)置于左胸获取M型超声心动图,获取以下参数:左心室收缩末期直径(left ventricular end-systolic diameter,LVESD)、左心室舒张末期直径(left ventricular end-diastolic diameter LVEDD)、缩短分数(fractional shortening,FS)、左心室射血分数(left ventricular ejection fraction,LVEF)和心率(heart rate,HR)。
1.5 取材
心脏超声检测结束后,尾静脉取血300 μL,4℃、3 000 rpm离心取血清。而后迅速取出心脏,称量心脏重量(heart weight,HW)后分离左心室并称量左室重量(left ventricular weight,LVW),分别计算与体重比值作为心脏质量指数(heart weight index,HWI)和左室心脏质量指数(left ventricular weight index,LVWI)。取左侧肺叶称湿重,置干燥箱24 h称干重,计算肺含水率(lung water ratio,LWR)=(肺湿重-肺干重)/肺湿重×100%。分离胫骨前肌(快肌为主)和比目鱼肌(慢肌为主),将组织分为3部分;第一部分新鲜组织做酶的活性和葡萄糖摄取率;第二部分连同心脏制作组织切片进行组织病理学观察;第三部分进行蛋白含量检测,用锡纸包裹投入液氮中并转移至-80℃低温冰箱冻存待测。
1.6 肌纤维类型测定
骨骼肌标本置于4%的多聚甲醛缓冲液中固定4~8 h后进行常规石蜡包埋、切片(5 μm)。ATP酶染色法鉴定I型和II型骨骼肌纤维:碱预孵(pH 10.6)后,I型肌纤维ATP酶活性被抑制,II型肌纤维ATP酶活性仍然保持,故II型纤维被染成深色,I型纤维则着色较浅。封固后,切片用显微照相图像采集系统进行照相,用Simple PCI图像分析软件分析肌纤维类型分布以及肌细胞横截面积(cross-sectional area,CSA)。
1.7 血糖和血胰岛素测定
利用半自动生化分析仪(MD-100型)以氧化酶法测定血糖浓度(试剂盒购自南京建成生物有限公司)。利用γ放免仪(FMQ-9013C型)以放免法测定血清胰岛素含量(试剂盒购自武汉博士德生物公司)。
1.8 肌糖原含量测定
蒽酮法测定,仪器为722型光栅分光光度计。取50 mg骨骼肌用400 μL浓度为30%的KOH消化(100℃,30 min),随后加入800 μL无水乙醇沸水浴10 min。冷却后4℃、3 000 g离心30 min,小心弃上清,将沉淀物悬浮于1 mL浓度5%的三氯乙酸中。取100 μL溶液与600 μL浓度0.2%的蒽酮溶液混匀,沸水浴5 min。冷却后以空白管调零,测定各样品和葡萄糖标准溶液在620 nm处的吸光度,计算糖原含量(单位:μg/ mg肌肉组织)。
1.9 葡萄糖摄取率测定
根据Turban等[30]方法稍作修改。取2块50 mg骨骼肌加入到5mL Krebs-Ringer碳酸盐缓冲液中(117 mmol/L NaCl,4.7 mmol/L KCl,2.5 mmol/L CaCl2,1.2 mmol/L KH2PO4,1.2 mmol/L MgSO4,24.6 mmol/L NaHCO3,pH 7.4),预孵育30 min。取出分别加入到2 mL不含胰岛素(-Ins)和含胰岛素(+ Ins,1.0μmol/L)的Krebs-Ringer碳酸盐缓冲液中,37℃、5% CO2、95%O2条件下震荡孵育1 h。再加入2 mL 1.5 nmol/L 2-脱氧葡萄糖(含0.5 μCi3H-2-脱氧葡萄糖),孵育30 min。冰生理盐水洗涤5次后,加入0.5 mL 4%(w/v)过氯酸,80℃消化30 min,室温冷却,14 000 g离心10 min。取250 uL至液闪瓶中,加1 mL乙二醇乙醚(助溶剂)和2 mL闪烁液(2.5-二苯基恶唑(PPO)0.5 g、1,4-双-(5-苯基,恶唑基)-苯(POPOP)0.2 g、甲苯1 000 mL混匀),Beckman LS 3801全自动液闪仪(美国)测定其放射性(单位:pmol/mg/min)。
1.10 糖原合酶活性测定
糖原合酶活性(glycogen synthase,GS)测定根据Franch等[16]的方法稍做修改。50 mg骨骼肌组织加入0.5 mL缓冲液(50 mmol/LTris-HCl,pH 7.0,1 mmol/LEDTA,0.1%β-mercaptoethanol,0.25 mol/L sucrose,5 μg/mL aprotinin,5 μg/mL leupeptin,0.1 mmol/L PMSF)匀浆后,4℃、3 000 g离心30 min。取上清液测蛋白浓度,另取50 μL上清液加等体积含10 mmol/L葡萄糖-6-磷酸(glucose 6-phosphate,G-6-P)(+G-6-P)和不含G-6-P(-G-6-P)的缓冲液(终浓度为25 mmol/L Tris/HCl,50 mmol/L NaF,5 mmol/L EDTA,2.5 mmol/L UDP-glucose,0.1 mCi/mmol[14C]-UDP-glucose),30℃孵育20 min。取75 mL溶液点在2 cm2Whatman滤纸上过滤,然后放进66%乙醇中清洗,晾干测试放射性活性(单位:pmol/mg/ min)。缓冲液不含G-6-P为活化型GS测定,缓冲液含G-6-P为GS总酶测定。GS活性用活化型酶活性与总酶活性的比值表示(-G-6-P/+G-6-P),即活性GS比,测试仪器同葡萄糖摄取率。
1.11 糖原磷酸化酶活性测定
糖原磷酸化酶活性(glycogen phosphorylase,GP)测试方法与仪器同糖原合酶活性测试。取50 mg骨骼肌匀浆后加入0.5 mL缓冲液混匀,4℃、3 000 g离心30 min。取50 μL上清液加等体积含2.5 mCi/mol[14C]-葡萄糖-1-磷酸(glucose 1-phosphate,G-1-P)缓冲液,活化型GP测定缓冲液不含AMP(-AMP),GP总酶测定缓冲液含2 mmol/L AMP(+AMP)。测定14C掺入糖原的放射活性(单位:nmol/mg/min)。GP活性用活化型酶活性与总酶活性的比值表示(-AMP/+AMP),即活性GP比。
1.12 Western Blotting测定蛋白表达量
取50 mg骨骼肌组织液氮研磨,匀浆裂解,4℃、15 000 g离心20 min,用考马斯亮蓝法测定总蛋白含量。取10 μg蛋白样品经15%SDS-PAGE分离后转移至PVDF膜。一抗(1: 1 000,购自美国Santa Cruz公司的兔抗鼠GP),磷酸化GP(p-GP)、GS和磷酸化GS(p-GS)4℃静置过夜。再以1:1000辣根过氧化物酶标记的羊抗兔IgG抗体(二抗)37℃孵育1 h,充分洗涤后,使用ECL发光成像,Image J软件读取各条带的灰度值,β-actin为内参蛋白。相对表达量=目的蛋白灰度值÷β-actin灰度值。
1.13 统计学处理
统计软件为SPSS 17.0 for windows。数据以“均数±标准差”表示,组间用One-Way ANOVA比较,多重比较使用Bonferroni检验,统计学差异为P<0.05。
2 结果
2.1 运动耐力结果
如图1所示,与SHAM组比较,HF-S组力竭时间降低(P<0.05);与HF-S组比较,HF-CE和HF-IE组力竭时间升高(P<0.05);与HF-CE组比较,HF-IE组力竭时间升高(P<0.05)。

图1 本研究各组大鼠运动至力竭的时间柱状图Figure 1.Exhaust Duration of Rats in Each Group
2.2 心脏结构与功能结果
如表1所示,与SHAM组比较,HF-S组LVESD和LVEDD升高(P<0.05),FS和LVEF降低(P<0.05);与HF-S组比较,HF-CE和HF-IE组LVESD和LVEDD降低(P<0.05),FS和LVEF升高(P<0.05)。

表1 各组大鼠的心脏结构与功能Table 1 Cardiac Structure and Function of Rats in Each Group
2.3 体重与心脏指数结果
如表2所示,与SHAM组比较,HF-S组HW、HWI、LVW、LVWI和LWR升高(P<0.05),HF-CE和HF-IE组 HWI、LVW和LVWI升高;与HF-S组比较,HF-CE和HF-IE组LWR降低(P<0.05)。

表2 各组大鼠体重与心脏指数Table 2 Body Weight and Heart Index of Rats in Each Group
2.4 骨骼肌纤维类型分布与CSA结果
ATP酶染色见图2、图3,I型肌纤维着色较深,II型肌纤维着色较浅。肌纤维分布和CSA见图4、图5。与SHAM组相较,HF-S组比目鱼肌和胫骨前肌I型肌纤维比例减少(P< 0.05),II型肌纤维比例增加(P<0.05),CSA下降(P<0.05)。与HF-S组相较,HF-CE和HF-IE组比目鱼肌和胫骨前肌I型肌纤维比例增加(P<0.05),II型肌纤维比例减少(P<0.05),CSA无显著性变化(P>0.05)。

图2 各组大鼠比目鱼肌ATP酶染色示意图Figure 2.ATP Anzyme Staining of Rat Musculus Soleus in Each Group
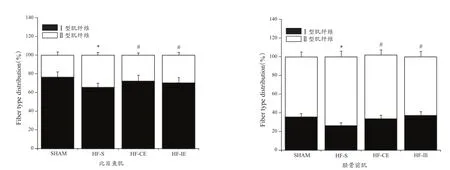
图4 各组大鼠比目鱼肌和胫骨前肌I型与II型肌纤维分布柱状图Figure 4.Distribution of Type I and Type II Muscle Fibers of Rat Musculus Soleus and Anterior Tibial Muscle in Each Group
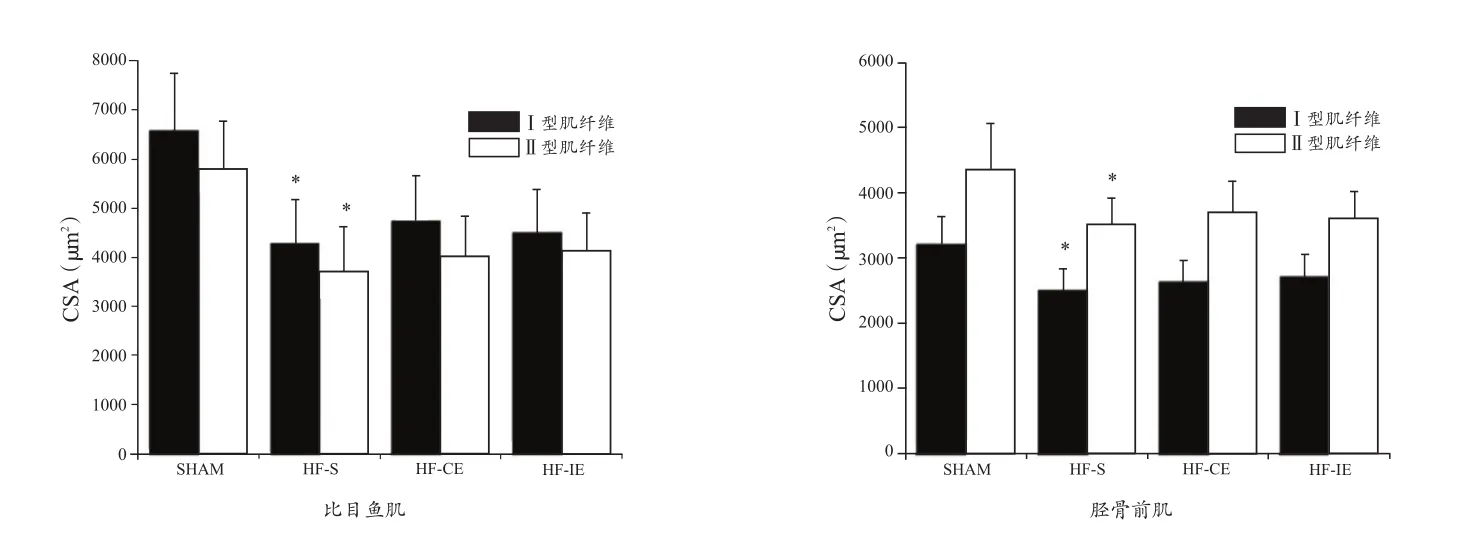
图5 各组大鼠比目鱼肌和胫骨前肌CSA柱状图Figure 5.CSA of Type I and Type II Muscle Fibers in Rat Musculus Soleus and Anterior Tibial Muscle in Each Group
2.5 血糖和胰岛素含量结果
如表3所示,与SHAM组比较,HF-S组血胰岛素升高(P<0.05);与HF-S组比较,HF-CE和HF-IE组血胰岛素降低(P<0.05)。
2.6 肌糖原含量结果
如图6所示,与SHAM组比较,HF-S组比目鱼肌和胫骨前肌糖原降低(P<0.05);与HF-S组比较,HF-CE和HF-IE组比目鱼肌和胫骨前肌糖原升高(P<0.05)。

表3 各组大鼠血糖和胰岛素含量Table 3 Concentration of Blood Glucose and Insulin of Rats in Each Group
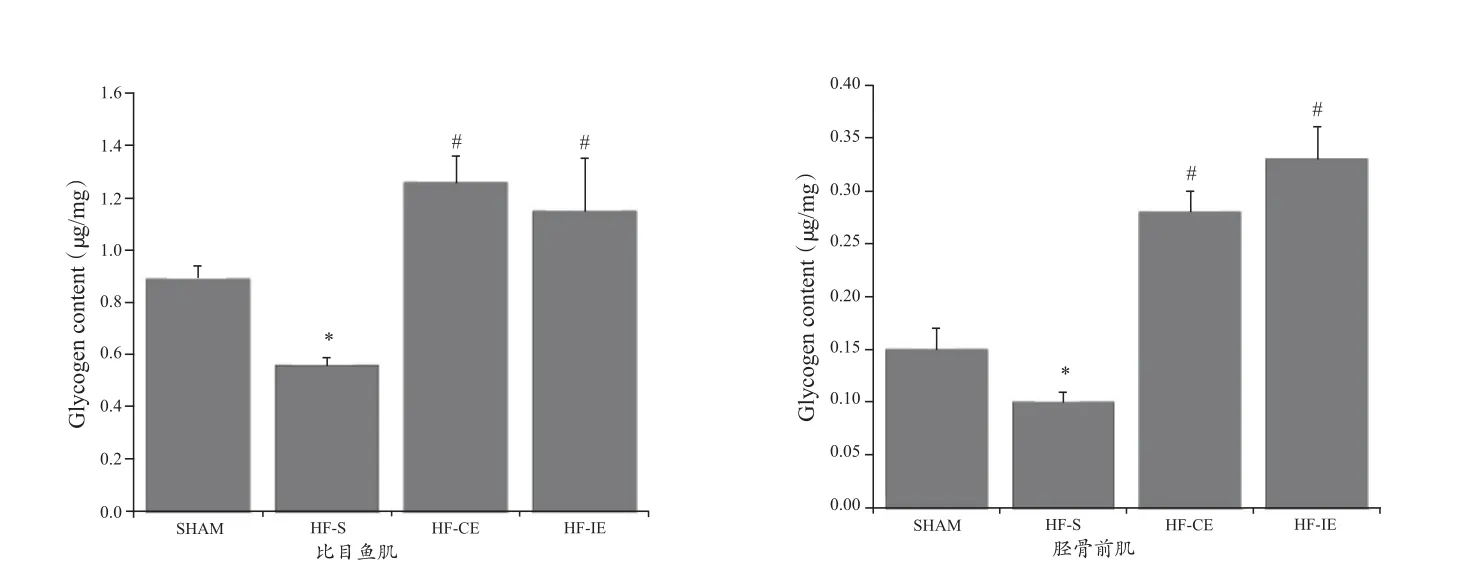
图6 各组大鼠比目鱼肌和胫骨前肌糖原含量柱状图Figure 6.Glycogen Concentration in Rat Musculus Soleus and Anterior Tibial Muscle in Each Group
2.7 葡萄糖摄取率结果
如图7所示,比目鱼肌和胫骨前肌基础葡萄糖摄取率(-Ins)在四组间无显著性差异(P>0.05),但胰岛素介导的葡萄糖摄取率(+Ins)HF-S组低于SHAM组(P<0.05),HF-CE和HF-IE组则高于HF-S组(P<0.05)。

图7 各组大鼠比目鱼肌和胫骨前肌葡萄糖摄取率柱状图Figure 7.Rates of Glucose Uptake of Rat Musculus Soleus and Anterior Tibial Muscle in Each Group
2.8 GS活性和蛋白表达结果
如图8~10所示,与SHAM组比较,HF-S组比目鱼肌和胫骨前肌活化型GS活性(-G-6-P)和活性GS比(-G-6-P/+G-6-P)降低,p-GS蛋白表达量升高(P<0.05);与HF-S组比较,HF-CE和HF-IE组活性GS比(-G-6-P/+G-6-P)升高,p-GS蛋白表达量降低(P<0.05)。GS总蛋白和GS总酶活性(+G-6-P)在4组间无显著性差异(P>0.05)。

图8 各组大鼠比目鱼肌和胫骨前肌GS活性柱状图Figure 8.GS Activity of Rat Musculus Soleus and Anterior Tibial Muscle in Each Group

图9 各组大鼠比目鱼肌和胫骨前肌活性GS比(-G-6-P/+G-6-P)柱状图Figure 9.Ratio of GS Activity(G-6-P/G-6-P)of Rat Musculus Soleus and Anterior Tibial Muscle in Each Group
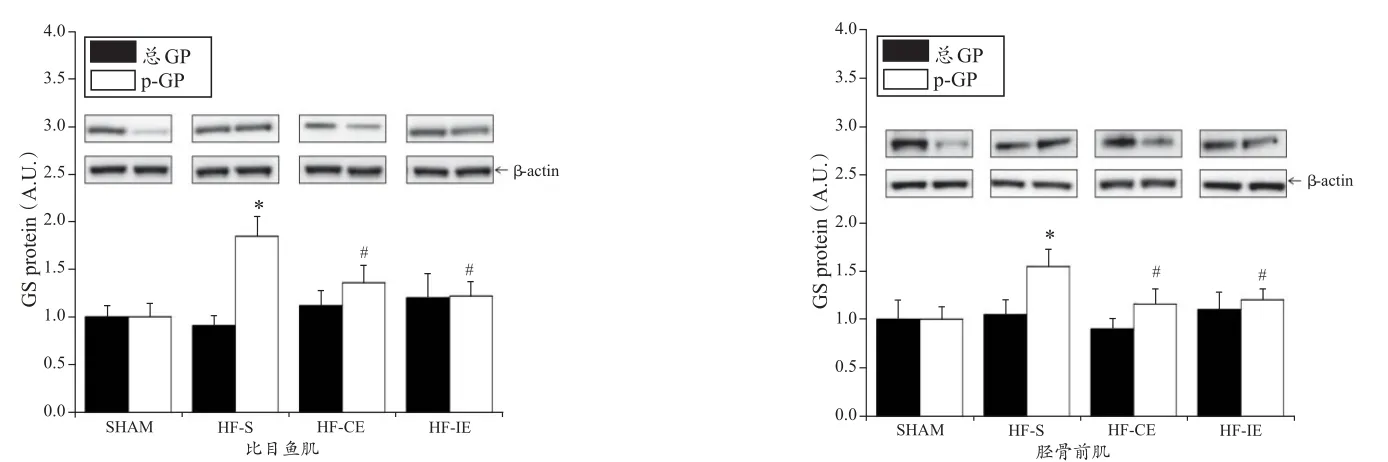
图10 各组大鼠比目鱼肌和胫骨前肌GS和p-GS蛋白含量变化示意图Figure 10.Changes of GS and p-GS Protein Level in Rat Musculus Soleus and Anterior Tibial Muscle in Each Group
2.9 GP活性和蛋白表达结果
如图11~13所示,与SHAM组比较,HF-S组比目鱼肌和胫骨前肌活化型GP活性(-AMP)、活性GP比(-AMP/+ AMP)和p-GP蛋白表达量升高;与HF-S组比较,HF-CE和 HF-IE组活化型GP活性(-AMP)、活性GP比(-AMP/+ AMP)和p-GP蛋白降低(P<0.05)。GP总蛋白和GP总酶活性(+AMP)在4组间无显著性差异(P>0.05)。
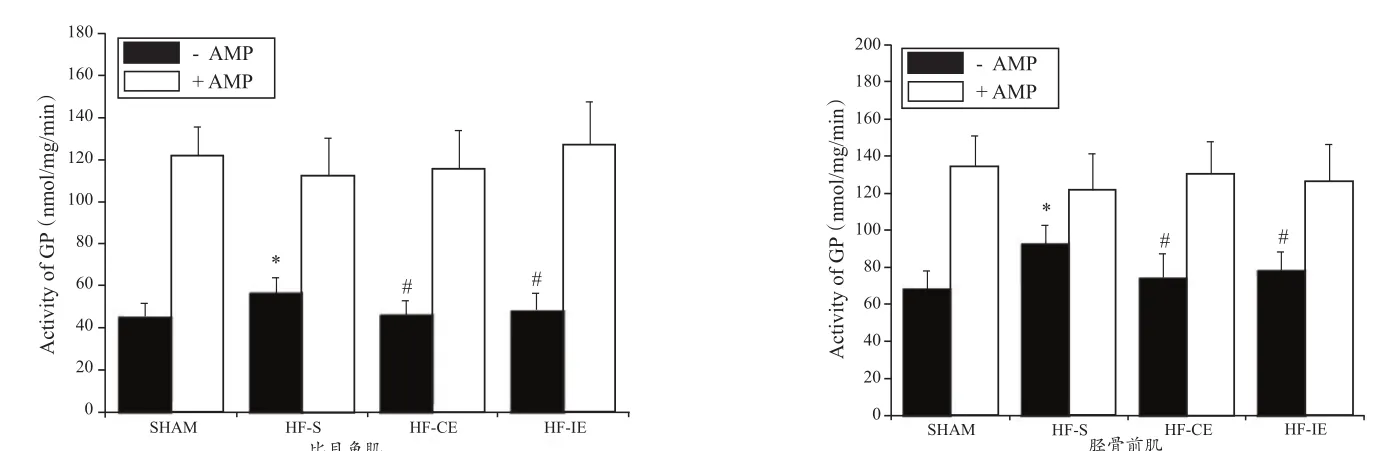
图11 各组大鼠比目鱼肌和胫骨前肌GP活性柱状图Figure 11.GP Activity of Rat Musculus Soleus and Anterior Tibial Muscle in Each Group

图13 比目鱼肌和胫骨前肌GP和p-GP蛋白的变化示意图Figure 13.Changes of GP and p-GP Protein Level in Rat Musculus Soleus and Anterior Tibial Muscle in Each Group
3 讨论
本研究发现,心肌梗塞后,心脏发生重塑,表现为左室肥厚,心腔代偿性扩张,肺水肿,最终导致心功能下降。研究报道,心衰常伴骨骼肌功能异常并造成运动能力下降,后者则是心衰患者预后不良的独立危险因子[29]。随着对心衰时骨骼肌细胞内分子机制的深入研究,学者们提出多个治疗心衰的潜在靶点,如代谢酶、钙调节相关蛋白、氧化应激以及炎症因子等。尽管治疗心衰的药物有多种,但没有一种药理学手段可阻止骨骼肌肌病的发生[12]。因此,心衰治疗方案中应强调在提高心功能的同时改善骨骼肌异常。
研究显示,中等强度持续有氧运动可显著改善心衰患者骨骼肌功能和运动耐力,减轻呼吸困难、易疲劳等症状,在一定程度上改善生活质量并降低住院率与死亡率[10],但针对心衰患者的最佳运动处方仍未确定。近年来,在传统有氧运动方式基础上,发展了一种新颖的运动模式,即间歇有氧运动(以下简称间歇运动)。由于既往研究认为,间歇运动对心血管患者可能存在安全隐患而在实践中很少应用,但最近的流行病学研究、实验研究和临床研究都证实,间歇运动能够产生比中低强度持续运动更有效的强心作用[20]。间歇运动是一种高效率的方式,即使在较低的负荷量时也可以产生与传统持续有氧运动相同的骨骼肌代谢方面的适应性变化[25]。本研究中,虽然HF-CE和HF-IE组心脏指数(HWI、LVW和LVWI)仍高于SHAM组,但力竭时间、FS和LVEF高于HF-S组,LVESD、LVEDD和LWR低于HF-S组,上述心脏结构与功能参数以及运动耐力参数的变化说明,两种运动方式均可抑制心脏重塑并提高心功能和运动能力。此外,HF-IE组运动耐力显著高于HF-CE组,提示,间歇运动对于提高运动能力的效果更佳。
肌肉萎缩是心衰患者运动能力下降的主要原因。在本研究中,组织病理学观察发现,HF-S组目鱼肌和胫骨前肌CSA均较SHAM组显著性下降,而两种运动方式对CSA并无显著影响,可能与本研究建立的心衰模型动物骨骼肌萎缩程度较轻以及运动时间有关。与SHAM组比较,HF-S组比目鱼肌和胫骨前肌I型肌纤维减少,II型肌纤维增多,提示,心衰时肌纤维由耐疲劳的I型(氧化型)向不耐疲劳的II型(糖酵解型)转变,这是心衰患者肌力减退和易于疲劳的首要原因[19]。运动后快、慢肌I型肌纤维比例均显著增加,但不同运动方式之间并无显著性差异,与Bartlett等[7]针对人体试验的结果一致,说明,运动改善骨骼肌有氧代谢能力的作用不依赖于运动方式。
肌糖原是葡萄糖在肌肉中的储存形式,是肌肉收缩的重要能源物质,其储备量与运动能力密切相关[24]。心衰时机体能源物质不足,骨骼肌灌注减少,缺血缺氧使骨骼肌的供能方式由利用自由脂肪酸转向糖酵解,细胞酸中毒,糖原利用增加[6],因此,肌糖原含量下降。在本研究中,HF-S组大鼠比目鱼肌和胫骨前肌糖原含量均低于SHAM组,同时运动耐力降低,提示,肌糖原含量下降是心衰骨骼肌功能异常、易疲劳和运动不耐受的重要原因。规律运动可改善心肌和骨骼肌代谢异常,本课题组前期的研究发现[1],8周跑台运动可促进心衰大鼠心肌脂肪酸氧化利用,减轻心肌脂质沉积并改善脂毒性心脏异常。研究证实,增加骨骼肌糖原含量可提高心衰患者运动耐力并促进心脏康复[21]。规律运动可提高正常骨骼肌糖原含量[2,3,26],因此推测,运动亦可增加心衰时骨骼肌糖原含量。在本研究中,间歇运动和持续运动均可提高比目鱼肌和胫骨前肌糖原含量,且两种运动方式的作用是等效的。有研究通过电镜观察发现[23],肌糖原在肌纤维亚细胞结构中的分布存在异质性,包括肌内(intramyofibrillar)糖原、肌间(intermyofibrillar)糖原和肌膜下(subsarcolemmal)糖原3种亚细胞定位,以肌间糖原为主。I型肌纤维中的比例为12%、77%和11%,II型肌纤维则为8%、84%和8%。心衰时糖原定位的改变以及运动的干预效果尚无研究报道。
糖原含量是由骨骼肌摄取葡萄糖、糖原合成以及糖原分解等因素共同决定的,由此,本研究对心衰和不同方式运动影响肌糖原含量的具体机制进行了深入探讨。糖原缺乏时骨骼肌可通过摄取血糖作为能量底物,因此,肌糖原的合成与肌细胞摄取葡萄糖的速率成正比,且这一过程受胰岛素调控[28]。本研究中,HF-S组血胰岛素明显升高而胰岛素刺激的葡萄糖摄取率(+Ins)降低,提示,心衰时存在胰岛素抵抗,其机制与肌膜葡萄糖转运体表达下调有关[14],造成骨骼肌对血糖的利用减少。HF-IE和HF-CE组血胰岛素降低,胰岛素介导的葡萄糖摄取率(+Ins)显著升高,提示,长期运动改善了胰岛素抵抗,骨骼肌摄取血糖的能力增强。GS和GP分别是糖原合成与分解的限速酶,GS磷酸化失活,去磷酸化激活,GP则相反。此外,GS还受G-6-P的别构调节[11]。本研究中,与SHAM组比较,HF-S组GS活性(-G-6-P/+G-6-P)降低,GP活性(-AMP/+AMP)、p-GP和p-GS蛋白表达上调,说明,心衰时糖原合成减少、分解增加。在不同方式运动后,GS活性(-G-6-P/+G-6-P)增加,GP活性(-AMP/+AMP)、p-GP和p-GS蛋白表达量下调,且不同肌纤维类型的变化规律基本一致,提示,长期运动可促进糖原合成并降低其利用。其机制可能与上游的信号分子——糖原合酶激酶3(glycogen synthase kinase 3,GSK-3,可使GS磷酸化而失活)活性下调[5]、交感激活得到抑制[18]、儿茶酚胺分泌减少[27]等因素有关。
需要指出的是,虽然间歇运动和持续运动在改善肌纤维类型、增强心功能、提高心衰大鼠骨骼肌糖原含量及相关机制等方面并无显著性差异,但间歇运动对于运动耐力的改善作用优于持续运动,提示,还存在影响运动能力的其他重要因素,如线粒体生物合成、有氧氧化关键酶的活性和表达量等[9]。Cochran等[13]发现,间歇运动后过氧化物酶体增殖物活化受体γ辅活化蛋白1(peroxisome proliferator-activated receptor-γcoactivator-1α,PGC-1α,调节线粒体生物合成的关键性信号分子)表达量显著高于持续运动。因此,还要进一步探讨不同有氧运动形式的作用机制。
4 结论
1.心衰时,心脏重塑、心功能下降,骨骼肌快肌和慢肌均发生I型肌纤维向II型肌纤维转换,肌纤维横截面积减少(肌萎缩);长期间歇有氧运动和持续有氧运动均能够抑制心衰大鼠心脏重塑、改善心功能,增加骨骼肌快肌和慢肌I型肌纤维含量。
2.心衰时,由于胰岛素抵抗、骨骼肌摄取葡萄糖减少、糖原合成减少、糖原分解增多,骨骼肌糖原含量下降、运动能力降低;长期间歇有氧运动和持续有氧运动均可提高心衰大鼠快肌和慢肌糖原含量,其机制可能与改善胰岛素抵抗、增加葡萄糖摄取、促进糖原合成、减少糖原分解有关,且两种运动方式对肌糖原代谢的作用与机制是等效的。
3.间歇运动对于心衰大鼠运动耐力的改善作用优于持续运动,其机制与心功能、肌糖原的变化以及肌纤维类型转换无关。
[1]赛庆彬,马延超,朱荣.有氧运动抑制心力衰竭大鼠心脏脂质沉积:AMPK-PPARa信号通路的作用[J].中国运动医学杂志,2012,31(12):1081-1086,1108.
[2]施曼莉,朱荣.高强度间歇运动对骨骼肌糖原含量的影响及机制研究[J].体育科学,2015,35(4):66-71.
[3]许绍哲,朱荣.长期运动训练诱导sd大鼠骨骼肌糖原含量上调的分子机制[J].中国运动医学杂志,2015,34(1):42-49.
[4]甄洁,朱荣.有氧运动对慢性心力衰竭大鼠骨骼肌糖原和运动耐力的影响[J].中国康复理论与实践,2015,(4):426-431.
[5]AHMAD F,LAL H,ZHOU J,et al.Cardiomyocyte-specific deletion of Gsk3alpha mitigates post-myocardial infarction remodeling,contractile dysfunction,and heart failure[J].JAm Coll Cardiol,2014,64(7):696-706.
[6]AZEVEDO P S,MINICUCCI M F,SANTOS P P,et al.Energy metabolism in cardiac remodeling and heart failure[J].Cardiol Rev,2013,21(3):135-140.
[7]BARTLETT J D,HWA J C,JEONG T S,et al.Matched work high-intensity interval and continuous running induce similar increases in PGC-1alpha mRNA,AMPK,p38,and p53 phosphorylation in human skeletal muscle[J].JAppl Physiol(1985),2012,112(7):1135-1143.
[8]BORGES J P,MASSON G S,TIBIRICAE,et al.Aerobic interval exercise training induces greater reduction in cardiac workload in the recovery period in rats[J].Arq Bras Cardiol,2014,102(1): 47-53.
[9]BROSKEY N T,GREGGIO C,BOSS A,et al.Skeletal muscle mitochondria in the elderly:Effects of physical fitness and exercise training[J].J Clin Endocrinol Metab,2014,99(5):1852-1861.
[10]BRUM PC,BACURAUAV,CUNHAT F,et al.Skeletal myopathy in heart failure:effects of aerobic exercise training[J].Exp Physiol,2014,99(4):616-620.
[11]CHANDRAMOULI C,VARMAU,STEVENS E M,et al.Myocardial glycogen dynamics:New perspectives on disease mechanisms[J].ClinExpPharmacolPhysiol,2015,42(4):415-425.
[12]CHAPLEAU M W.Contributions of skeletal muscle myopathy to heart failure:Novel mechanisms and therapies[J].Exp Physiol,2014,99(4):607-608.
[13]COCHRAN A J,PERCIVAL M E,TRICARICO S,et al.Intermittent and continuous high-intensity exercise training induce similar acute but different chronic muscle adaptations[J].Exp Physiol,2014,99(5):782-791.
[14]DOEHNER W,GATHERCOLE D,CICOIRAM,et al.Reduced glucose transporter GLUT4 in skeletal muscle predicts insulin resistance in non-diabetic chronic heart failure patients independentlyof bodycomposition[J].IntJ Cardiol,2010,138(1):19-24.
[15]FERREIRA J C,ROLIM N P,BARTHOLOMEU J B,et al. Maximal lactate steady state in running mice:Effect of exercise training[J].ClinExpPharmacolPhysiol,2007,34(8):760-765.
[16]FRANCH J,ASLESEN R,JENSEN J.Regulation of glycogen synthesis in rat skeletal muscle after glycogen-depleting contractile activity:Effects of adrenaline on glycogen synthesis and activation of glycogen synthase and glycogen phosphorylase[J].BiochemJ,1999,344(Pt 1):231-235.
[17]HOYDAL M A,WISLOFF U,KEMI O J,et al.Running speed and maximal oxygen uptake in rats and mice:Practical implications for exercise training[J].Eur J Cardiovasc Prev Rehabil,2007,14(6):753-760.
[18]IELLAMO F,MANZI V,CAMINITI G,et al.Validation of rate of perceived exertion-based exercise training in patients with heart failure:Insights from autonomic nervous system adaptations[J]. IntJ Cardiol,2014,176(2):394-398.
[19]KITZMAN D W,NICKLAS B,KRAUS W E,et al.Skeletal muscle abnormalities and exercise intolerance in older patients with heart failure and preserved ejection fraction[J].Am J Physiol HeartCircPhysiol,2014,306(9):H1364-1370.
[20]KOUFAKI P,MERCER T H,GEORGE K P,et al.Low-volume high-intensityintervaltrainingvs continuousaerobiccyclinginpatients with chronic heart failure:A pragmatic randomised clinical trial of feasibility and effectiveness[J].J Rehabil Med,2014,46(4):348-356.
[21]MANCINI D,BENAMINOVITZ A,CORDISCO M E,et al. Slowed glycogen utilization enhances exercise endurance in patients with heart failure[J].JAm Coll Cardiol,1999,34(6):1807-1812.
[22]MOHOLDTT,AAMOT I L,GRANOIEN I,et al.Aerobic interval training increases peak oxygen uptake more than usual care exercise training in myocardial infarction patients:A randomized controlledstudy[J].ClinRehabil,2012,26(1):33-44.
[23]NIELSEN J,ORTENBLAD N.Physiological aspects of the subcellular localization of glycogen in skeletal muscle[J].Appl PhysiolNutr Metab,2013,38(2):91-99.
[24]ORTENBLAD N,WESTERBLAD H,NIELSEN J.Muscle glycogen stores and fatigue[J].J Physiol,2013,591(Pt 18):4405-4413.
[25]PEAKE J M,TAN S J,MARKWORTH J F,et al.Metabolic and hormonal responses to isoenergetic high-intensity interval exercise and continuous moderate-intensity exercise[J].Am J Physiol EndocrinolMetab,2014,307(7):E539-552.
[26]PHILPA,HARGREAVES M,BAAR K.More than a store:Regulatory roles for glycogen in skeletal muscle adaptation to exercise[J].Am J Physiol Endocrinol Metab,2012,302(11):E1343-1351.
[27]RENGO G,PAGANO G,PARISI V,et al.Changes of plasma norepinephrine and serum N-terminal pro-brain natriuretic peptide after exercise training predict survival in patients with heart failure[J].IntJ Cardiol,2014,171(3):384-389.
[28]SYLOW L,KLEINERT M,PEHMOLLER C,et al.Akt and Rac1 signaling are jointly required for insulin-stimulated glucose uptake in skeletal muscle and downregulated in insulin resistance[J].CellSignal,2014,26(2):323-331.
[29]TABET J Y,MEURIN P,BENZIDI Y,et al.Greater prognostic value of peak VO2 after exercise training program completion in heartfailurepatients[J].IntJ Cardiol,2013,168(4):4139-4144.
[30]TURBAN S,BEARDMORE V A,CARR J M,et al.Insulinstimulated glucose uptake does not require p38 mitogen-activated protein kinase in adipose tissue or skeletal muscle[J].Diabetes,2005,54(11):3161-3168.
[31]WISLOFF U,STOYLEN A,LOENNECHEN J P,et al.Superior cardiovascular effect of aerobic interval training versus moderate continuous training in heart failure patients:A randomized study[J].Circulation,2007,115(24):3086-3094.
The Improvement of Interval and Continuous Aerobic Exercise on Skeletal Muscle Glycogen Metabolism in Rats with Chronic Heart Failure
目的:对比不同有氧运动方式(间歇有氧运动、持续有氧运动)对慢性心力衰竭(心衰)大鼠不同类型肌纤维糖原代谢的影响及机制探讨。方法:4400只SSDD大鼠随机分为心衰安静组(HHFF--SS)、心衰间歇运动组(HHFF--IIEE)、心衰持续运动组(HHFF--CCEE)和假手术组(SSHHAAMM),每组各1100只。心衰造模采用冠状动脉结扎术。HHFF--IIEE组进行 88周高强度间歇跑台训练,HHFF--CCEE进行 88周中等强度持续跑台训练。测试指标:利用递增负荷力竭运动实验测定运动耐力(力竭时间),超声心动图检测心脏结构与功能,分离胫骨前肌(快肌为主)和比目鱼肌(慢肌为主),利用AATTPP酶染色法鉴定肌纤维类型分布,蒽酮法测定骨骼肌糖原含量,放射性同位素法测定葡萄糖摄取率以及骨骼肌糖原合酶(GGSS)和糖原磷酸化酶(GGPP)活性,Western BBlloott法测定总GGSS、磷酸化GGSS( PP--GGSS)、总GGPP以及磷酸化GGPP( PP--GGPP)蛋白表达量。结果:与SSHHAAMM组比较,HHFF--SS组力竭时间、心功能下降( PP< 00..0055),血胰岛素升高( PP< 00..0055),比目鱼肌和胫骨前肌 II型肌纤维比例减少( PP< 00..0055), IIII型肌纤维比例增加( PP< 00..0055),肌糖原含量、胰岛素介导的葡萄糖摄取率和GGSS活性降低( PP< 00..0055),GGPP活性、pp--GGSS蛋白和 PP--GGPP蛋白表达量升高( PP< 00..0055)。与HHFF--SS组比较,HHFF--CCEE和HHFF--IIEE组力竭时间升高( PP< 00..0055),心功能增强( PP< 00..0055),血胰岛素降低( PP< 00..0055),比目鱼肌和胫骨前肌 II型肌纤维比例增加( PP< 00..0055), IIII型肌纤维比例减少( PP< 00..0055),肌糖原含量、胰岛素介导的葡萄糖摄取率、GGSS活性升高( PP< 00..0055),GGPP活性、 PP--GGSS蛋白和 PP--GGPP蛋白表达量降低( PP< 00..0055)。与HHFF--CCEE组比较,HHFF--IIEE组力竭时间升高( PP< 00..0055),其他指标在两组间均无显著性差异( PP> 00..0055)。结论: 11)长期间歇有氧运动和持续有氧运动均能够抑制心衰大鼠心脏重塑、改善心功能,并增加骨骼肌快肌和慢肌 II型肌纤维含量; 22)运动可提高快肌和慢肌糖原含量,其机制可能与改善胰岛素抵抗、增加葡萄糖摄取、促进糖原合成、减少糖原分解有关,且两种运动方式对肌糖原代谢的作用与机制是等效的; 33)间歇运动对于心衰大鼠运动耐力的改善作用优于持续运动,但心功能、肌糖原的变化以及肌纤维类型转换没有支持其机制。
有氧运动;间歇运动;慢性心力衰竭;骨骼肌;糖原代谢
Objective:To compare the effects of different exercise mode(interval aerobic exercise vs continuous aerobic exercise)on glycogen metabolism of distinct muscle fiber type in rats with heart failure and investigate the possible mechanism.Methods:Forty SD rats were divided into heart failure sedentary(HF-S)group,heart failure interval exercise(HF-IE)group,heart failure continuous(HF-CE)group or sham-operated(SHAM)group and heart failure model was established by coronary artery ligation.Animals in HF-IE group performed an eight weeks high-intensity interval treadmill running while those of HF-CE group conducted moderate-intensity continuous aerobic exercise. Exercise endurance(exhaust duration)was determined by graded exhausted exercise test;cardiac structure and function by echocardiogram;tibialis anterior(mainly fast muscle)as well as soleus muscle(mainly slow muscle)isolated for identification of muscle fiber type distribution by ATPase staining,muscle glycogen content was measured by anthracenone method,glucose uptake rate,activity of glycogen synthase(GS)and glycogen phosphorylase(GP)by radicisotope method,protein expression level of total GS,phospho-GS(p-GS),total GP and phospho-GP(p-GP)by Western Blot.Results:Compared with SHAM group,exhaust duration and cardiac function reduced(P<0.05),blood insulin raised(P<0.05),type I muscle fibers decreased while type II increased in tibialis anterior and soleus muscles(P<0.05),muscle glycogen content,insulin mediated glucose uptake rate and GS activity lowered(P<0.05),GPactivity,p-GS and p-GPprotein expression heightened(P<0.05)in HF-S group;compared with HF-S group,exhaust duration and cardiac function improved(P<0.05),blood insulin reduced(P<0.05),type I muscle fibers increased while type II decreased in tibialis anterior and soleus muscles(P<0.05),muscle glycogen content,insulin mediated glucose uptake rate and GS activity heightened(P<0.05),GPactivity,p-GS and p-GPprotein expression lowered(P<0.05)in HF-CE and HF-IE group;compared with HF-CE group,exhaust duration increased in HF-IE group(P<0.05),there was no difference of other indications between groups.Conclusion:1)Both long-term aerobic interval exercise and aerobic continuous exercise inhibited cardiac remodelling,improved cardiac function and promoted switch from II fiber type to I type of fast and slow muscle in rats with heart failure.2)Exercise enhanced glycogen content of fast and slow muscle and the possible mechanism was related to improvement of insulin resistance,augmentation in muscle glucose uptake,increase of glycogen synthesis and decrease of glycogen breakdown,which was equipotent of the two exercise mode on glycogen metabolism and related mechanism.3)Aerobic interval exercise promoted superior improvements in exercise capacity than continuous exercise,which was independence of cardiac function,muscle fiber type switch and muscle glycogenvariation.
aerobic exercise;interval training;chronic heart failure;skeletal muscle;glycogen metabolism
1002-9826(2017)01-0063-10
10.16470/j.csst.201701008
G804.2
:A
2016-04-11;
:2016-11-13
浙江省公益性技术应用研究计划项目(2014C33262)。
朱荣,女,教授,博士,主要研究方向为运动与骨骼肌代谢,E-mail:zhurong@wmu.edu.cn。
温州医科大学,浙江 温州 325035
Wenzhou Medical University,Wenzhou 325035,China.

