香烟烟雾提取物诱导呼吸道上皮细胞间质性转化的实验研究*
刘振峰,刘建英△,刘代顺,周国旗,陈 乾,王海霞
(1.贵州省遵义市第一人民医院呼吸科 563003;2.贵州省遵义市第一人民医院神经内科 563003;3.江苏省苏州市科技城医院呼吸科 215000)
论著·基础研究
香烟烟雾提取物诱导呼吸道上皮细胞间质性转化的实验研究*
刘振峰1,刘建英1△,刘代顺1,周国旗1,陈 乾2,王海霞3
(1.贵州省遵义市第一人民医院呼吸科 563003;2.贵州省遵义市第一人民医院神经内科 563003;3.江苏省苏州市科技城医院呼吸科 215000)
目的 探讨香烟烟雾提取物(CSE)在呼吸道上皮细胞间质性转化(EMT)中的作用,为进一步研究香烟烟雾提取物在慢性阻塞性肺疾病(COPD)气道重构发生机制提供新的线索。方法 用不同浓度(0%、0.5%、1.0%、2.5%、5.0%,其中浓度0作为对照组)的CSE刺激呼吸道上皮细胞BEAS-2B 72 h,逆转录PCR检测E钙粘蛋白(E-cad)、N钙粘蛋白(N-cad)mRNA表达情况,酶联免疫吸附试验(ELISA)检测细胞培养上清液中TGF-β1浓度;用2.5%CSE刺激BEAS-2B细胞不同时长(0、12、24、48 h,其中时间0 h作为对照),倒置显微镜下观察细胞形态变化,逆转录PCR检测E-cad、N-cad、补体C3 mRNA表达情况,ELISA法检测细胞培养上清液中TGF-β1、过敏毒素C3a浓度。结果 在不同浓度的CSE刺激BEAS-2B细胞72 h后,CSE各浓度刺激组较对照组E-cad mRNA表达下调,N-cad mRNA表达增加,且呈浓度依赖性(P<0.05);ELISA法检测细胞培养上清液中TGF-β1水平,CSE各浓度刺激组较对照组增加(P<0.05);2.5%CSE在不同时间点作用BEAS-2B细胞,刺激组细胞呈梭形改变,CSE各时间段刺激组较对照组 E-cad mRNA表达减少,补体C3、N-cad mRNA表达增加,且呈时间依赖性(P<0.05),CSE各时间段刺激组细胞培养上清液中TGF-β1、C3a水平较对照组增加(P<0.05)。结论 CSE可诱导正常的呼吸道上皮细胞BEAS-2B发生EMT,补体C3激活可能参与此过程。
肺疾病,慢性阻塞性;香烟烟雾提取物;呼吸道上皮细胞;上皮间质转化;过敏毒素C3a
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种常见的气道慢性炎症性疾病,其特征是持续的气流受限,这种气流受限通常进行性加重。COPD病理学改变主要表现为气道上皮细胞变性、坏死,上皮纤维化,基底膜增厚,黏液分泌腺肥大和杯状细胞增多,黏液分泌增加。目前,COPD的病因和发病机制不清楚,普遍认为与气道和肺组织对香烟烟雾等有害气体或有毒颗粒的异常反应有关。
气道重塑是COPD患者气流受限的病理生理学改变的基础。气道重塑可发生于多种气道疾病,是气道慢性炎症所致气道上皮下纤维化的结果。肌成纤维细胞在纤维化发生过程中起着重要作用,目前推测其主要来源有:循环中来源于骨髓的成纤维细胞的迁入、上皮细胞间质性转化(epithelial-mesenchymal transition,EMT)、病灶局部成纤维细胞的活化,30%~40%的肌成纤维细胞来源于EMT[1]。EMT与损伤修复、组织再生和器官纤维化密切相关。普遍认为香烟烟雾主要引起组织细胞产生过多的活性氧造成组织损伤,但是香烟烟雾在COPD患者气道重塑过程中的作用并不清楚。香烟烟雾作为一种损伤性刺激,可以造成细胞功能和结构损伤。最近研究显示,免疫机制可能参与组织损伤修复过程。气道上皮细胞修复与再生是一个动态过程,反复损伤导致上皮细胞修复信号通路持续激活,这种上皮细胞的修复过程与细胞或体液中产生的炎性介质密切相关。过敏毒素C3a是其中的一种炎性介质,它是补体系统活化过程中产生的具有炎性介质作用的活性片段。研究发现,除了它的促炎作用外,过敏毒素C3a可能参与了组织损伤后的修复过程[2-4]。
本实验旨在通过体外利用香烟烟雾提取物(cigarette smore extrac,CSE)刺激呼吸道上皮细胞,分别检测上皮性细胞分子标记和间叶性细胞分子标记表达变化,验证香烟烟雾是否在气道EMT过程中起促进作用及是否伴有补体C3的激活。
1 材料与方法
1.1 材料 BEAS-2B细胞购买于上海拜力生物科技有限公司,是SV40病毒转染的人支气管上皮细胞,核型接近于二倍体,在体外易于人工培养和传代,能够无限生长,无自发转化能力,尚未获得恶性转化特性,符合研究细胞转化实验的细胞选用原则。
1.2 方法
1.2.1 100%CSE制备[5]使红金龙牌香烟燃烧的烟雾通过液体后溶入PBS中,即为原液,含香烟烟雾的PBS在超净工作台内经0.22 μm针式过滤器过滤,然后调节吸光值A320=3.0±0.1,此时的溶液即为100%CSE,30 min内用于实验。用不同浓度(0%、0.5%、1.0%、2.5%、5.0%,其中浓度0作为对照组)的CSE刺激呼吸道上皮细胞BEAS-2B 72 h,用逆转录PCR检测E钙黏蛋白(E-cadherin,E-cad)、N钙黏蛋白(N-cadherin,N-cad)mRNA表达情况,酶联免疫吸附试验(ELISA)检测细胞培养上清液中TGF-β1浓度;用2.5% CSE在不同时间(0、12、24、48 h,其中0 h为对照组)刺激BEAS-2B细胞,0 h为对照组,倒置显微镜下观察细胞形态变化,逆转录PCR检测E-cad、N-cad、C3 mRNA表达情况,ELISA法检测细胞培养上清液中TGF-β1、C3a浓度。
1.2.2 细胞培养 BEAS-2B细胞接种于培养皿,用RPMI-1640 (含25 ng/mL rhEGF、10 μg/mL INS、0.4 μg/mL HC、5%FBS、100 U/mL青霉素、100 μg/mL链霉素)培养基,置于5%CO2、饱和湿度、37 ℃培养箱培养,每2~3天传代1次,实验时取对数生长期细胞。参照文献CSE细胞毒性实验结果[5],CSE刺激浓度分别为0%、0.5%、1.0%、2.5%、5.0%。
1.2.3 总RNA提取及PCR 用Trizol试剂参照说明书提取总RNA,测定A260/A280吸光度判断纯度和浓度后取2 μL总RNA使用cDNA反转录试剂盒进行反转录DNA。实验中所用引物由上海生工生物工程有限公司设计并合成,引物信息见表1。PCR反应过程:反应体系25 μL,94 ℃预变性3 min;94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸1 min,共30个PCR循环;最后72 ℃总延伸10 min。
1.2.4 琼脂糖凝胶电泳及灰度定量 洗净制胶板,并安插好梳子,晾干备用;称取0.4 g琼脂粉,放入烧杯中,取20 mL 0.5×TBE加入烧杯中;将烧杯放入微波炉中,中低火2 min,取出;冷却至大约60 ℃后,加入3 μL Ⅰ型Glod view,充分混匀;将胶快速倒入制胶板中,避免气泡形成,冷却30 min;用6×Loading buffer与PCR产物按1∶5比例于一次性薄膜手套上混匀后加入上样孔中;110 V,2 min出孔,80 V,45 min电泳,待溴酚蓝距离边沿还有1 cm时即可停止电泳;通过凝胶成像仪拍照,利用Quantity-One Ver 4.52凝胶定量分析软件对所形成的电流条带图进行定量分析。

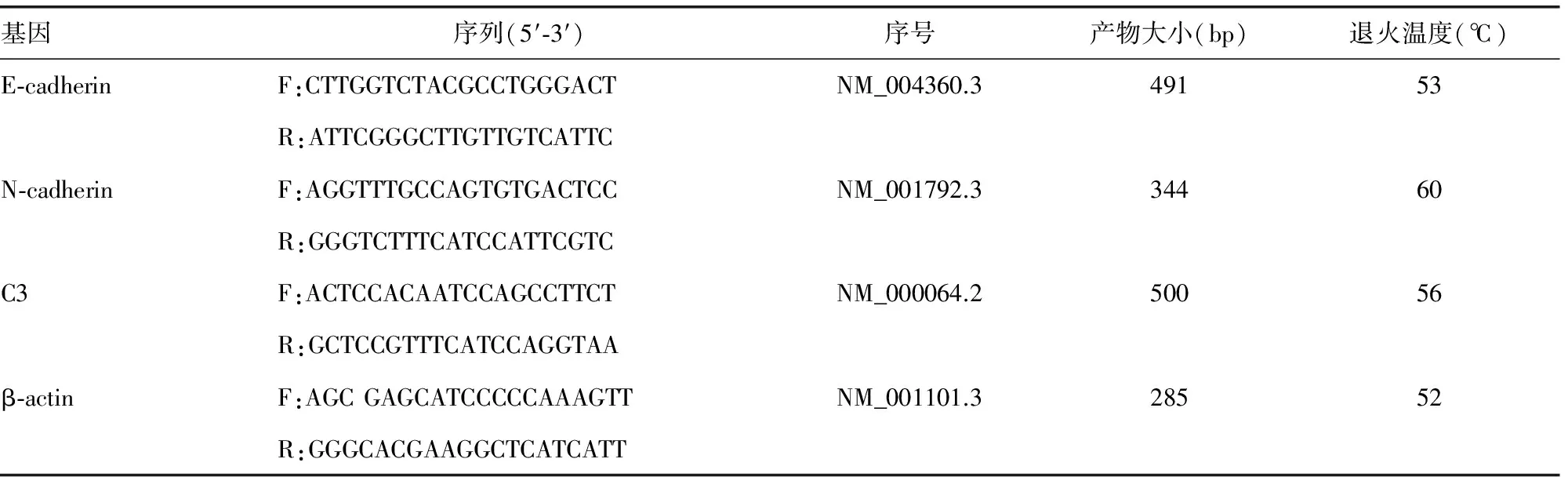
表1 PCR基因引物序列信息
2 结 果
2.1 不同浓度的CSE作用呼吸道上皮细胞,对E-cad、N-cad mRNA表达的影响 不同浓度(0.5%、1.0%、2.5%、5.0%)的CSE作用于呼吸道上皮细胞BEAS-2B 72 h后,与对照组比较,随着CSE浓度的增加,上皮性细胞的分子标记E-cad mRNA的表达逐渐减少,间质性细胞分子标记N-cad mRNA的表达逐渐增加,并且成浓度依赖性变化。本实验对3次独立实验PCR扩增产物的电泳条带进行灰度变化的定量分析,得到同样的结果(P<0.05),见图1;当CSE的浓度为2.5%时,E-cad、N-cad mRNA的表达出现明显变化,因此采用2.5%CSE进行后续实验。

*:P<0.05,与对照组比较。M:DNA分子标记物;1:对照组;2:0.5%CSE组;3:1.0%CSE组;4:2.5%CSE组;5:5.0%CSE组。
图1 CSE对E-cad、N-cad mRNA表达的影响
2.2 2.5%CSE作用不用时间后细胞形态变化 本实验分别观察了不同时间点(0 h、12 h、24 h、48 h),正常呼吸道上皮细胞均成椭圆形生长,当受到CSE刺激后,细胞形态呈梭形改变,同时实验中观察到,CSE刺激组细胞的生长较对照组增殖缓慢,见图2。

图2 观察呼吸道上皮细胞BEAS-2B 形态改变(×100)
2.3 2.5%CSE不同时间对E-cad,N-cad mRNA表达的影响 用2.5%CSE刺激呼吸道上皮细胞BEAS-2B,在不同的时间点(0、12、24、48 h),RT-PCR法检测2.5%CSE对E-cad、N-cad mRNA表达的影响,与对照组比较,E-cad mRNA表达减少,N-cad mRNA表达增加,呈时间依赖性。本实验对3次独立实验PCR扩增产物的电泳条带进行灰度变化的定量分析,得到同样的结果(P<0.05),见图3。进一步确定了CSE可诱导BEAS-2B细胞发生EMT过程。

*:P<0.05,与对照组比较。
图3 2.5%CSE对E-cad、N-cad mRNA表达的影响
2.4 CSE诱导转化生长因子TGF-β1表达增加 不同浓度的CSE(0%、0.5%、1.0%、2.5%、5.0%)刺激BEAS-2B细胞72 h后,与对照组比较,随着CSE浓度增加,TGF-β1表达增加,呈浓度依赖性变化(P<0.05);2.5%的CSE刺激BEAS-2B细胞,在不同的时间点(0、12、24、48 h),与对照组比较,TGF-β1表达呈时间依赖性增加(P<0.05),见图4。

*:P<0.05,与对照组比较。
图4 CSE对TGF-β1表达的影响
2.5 2.5%CSE激活补体C3系统 2.5%CSE刺激呼吸道上皮细胞BEAS-2B,在不同的时间点检测补体C3 mRNA表达,与对照组比较,CSE各浓度刺激组C3 mRNA的表达逐步增加,呈时间依赖性变化(P<0.05)。2.5%CSE刺激呼吸道上皮细胞BEAS-2B,在不同的时间点检测上清液中过敏毒素C3a水平,与对照组比较,CSE各浓度刺激组上清液中过敏毒素C3a的浓度逐步表达增加(P<0.05),见图5。

*:P<0.05,与对照组比较。
图5 C3a mRNA在不同时间点的表达水平
3 讨 论
吸烟是COPD发病的主要危险因素,本实验通过体外CSE刺激呼吸道上皮细胞模拟COPD患者香烟烟雾暴露,寻求吸烟与COPD发病(或气道重构)的相关性。目前已经有研究发现,COPD患者的支气管上皮细胞波形蛋白的表达增加,E-cad的表达减少[6],表明EMT过程确实存在于COPD患者肺组织,这与体外细胞实验结果相符。CSE可诱导正常的呼吸道上皮细胞发生EMT,这一过程可能参与了气道损伤的组织修复,但是反复损伤所致的EMT表现为气道上皮纤维化发生。各浓度CSE仅仅是作为其中的一种危险因子,香烟烟雾可能只是一种损伤性的刺激,可以引起呼吸道上皮细胞结构和功能的损伤,EMT参与的修复过程可能是普遍存在的。
实验过程中观察到CSE刺激组的呼吸道上皮细胞较对照组细胞增殖缓慢,推测其原因可能是受刺激的细胞存在损伤,氧化应激可能是在细胞损伤过程中起作用。另外,细胞衰老表现为细胞的增殖能力衰退,新陈代谢过程中产生的氧自由基对细胞的损伤是其发生的一个主要机制。最近研究表明COPD的发病与肺泡上皮细胞和气道上皮细胞衰老增加相关,这些细胞表现为细胞增殖能力下降和衰老相关的细胞因子的异常分泌[7-9]。香烟烟雾可引起细胞氧自由基产生增加,本实验过程中,观察到CSE刺激组,BEAS-2B细胞较对照的增殖缓慢,可能这些受刺激的细胞就存在衰老。
COPD是一种多因素相关的呼吸道疾病,目前,针对COPD气道炎症和气道重塑的治疗仍然是世界性的难题。香烟烟雾可刺激呼吸道上皮细胞,诱导其向间质性细胞转化,如肌成纤维细胞,有助于气道纤维或气道重塑发生,因此戒烟仍不失为一种有效的预防措施。激素和抗炎剂的应用,虽可以减轻呼吸系统症状和延缓疾病的进展,但是COPD患者肺部已经形成的结构改变,目前治疗水平尚且无法逆转。干细胞在COPD发病及损伤修复过程中的作用也成了当今世界研究的热点。研究发现骨髓间充质干细胞MSCs可以减轻香烟烟雾诱发的小鼠肺部炎性反应和肺气肿,这可能是通过抑制肺巨噬细胞环氧化酶COX-2和COX-2介导的PGE2产生起作用的[10]。因此,在今后笔者对干细胞的研究,包括基底细胞,有望在COPD治疗中会有重大突破。
[1]Nho RS.Current concept for the pathogenesis of idiopathic pulmonary fibrosis[J].Clin Res Pulmonol,2013,1(1):1008.
[2]Markiewski MM,Mastellos D,Tudoran R,et al.C3a And C3b activation products of the third component of complement (C3) are critical for normal liver recovery after toxic injury[J].J Immunol,2004,173(2):747-754.
[3]Markiewski MM,Deangelis RA,Strey CW,et al.The regulation of liver cell survival by complement[J].J Immunol,2009,182(9):5412-5418.
[4]Lara-Astiaso D,Izarra A,Estrada JC,et al.Complement anaphylatoxins C3a and C5a induce a failing regenerative program in cardiac resident cells.Evidence of a role for cardiac resident stem cells other than cardiomyocyte renewal[J].Springerplus,2012(1):63.
[5]Cortijo J,Mata M,Milara J,et al.Aclidinium inhibits cholinergic and tobacco smoke-induced MUC5AC in human airways[J].Eur Respir J,2015,17(4):385-395.
[6]Gohy ST,Hupin C,Fregimilicka C,et al.Imprinting of the COPD airway epithelium for dedifferentiation and mesenchymal transition[J].Eur Respir,2015,17(4):385-395.
[7]Chilosi M,Carloni A,Rossi A,et al.Premature lung aging and cellular senescence in the pathogenesis of idiopathic pulmonary fibrosis and COPD/emphysema[J].Transl Res,2013,162(3):156-173.
[8]Campisi J.Cellular senescence:putting the paradoxes in perspective[J].Curr Opin Genet Dev,2011,21(1):107-112.
[9]Aoshiba K,Nagai A.Senescence hypothesis for the pathogenetic mechanism of chronic obstructive pulmonary disease[J].Proc Am Thorac Soc,2009,6(7):596-601.
[10]Gu W,Song L,Li XM,et al.Mesenchymal stem cells alleviate airway inflammation and emphysema in COPD through down-regulation of cyclooxygenase-2 via p38 and ERK MAPK pathways[J].Sci Rep,2015(5):8733.
Cigarette smoke extrac induced epithelial-mesenchymal transition in respiratory epithelial cells*
LiuZhengfeng1,LiuJiangying1△,LiuDaishun1,ZhouGuoqi1,ChenQian2,WangHaixia3
(1.DepartmentofRespiration,theFirstHospitalofZunyiCity,Zunyi,Guizhou563003,China;2.DepartmentofNeurology,theFirstHospitalofZunyiCity,Zunyi,Guizhou563003,China;3.DepartmentofRespiration,ScienceandTechnologyCityHospitalofSuzhouCity,Suzhou,Jiangsu215000,China)
Objective To investigate the epithelial-mesenchymal transition in respiratory epithelial cells stimulated by cigarette smoke extract in vitro for the new clue of the airway remodeling of COPD due to cigarette smoke.Methods The messenger ribonucleic acid levels of E-cadherin,N-cadherin were measured by RT-PCR combined with agarose gel electrophoresis after the treatment of different concentrations cigarette smoking extract (0%,0.5%,1.0%,2.5%,5.0%) for 72 hours in respiratory epithelial cells.The concentration of TGF-β1 was quantified by enzyme linked immunosorbent assay in the supermatant.After the treatment of 2.5% cigarette smoking extract in respiratory epithelial cells,the morphological changes measured by inversion microscope,the messenger ribonucleic acid levels of E-cadherin,N-cadherin and complement component C3 by RT-PCR combined with agarose gel electrophoresis and the protein concentration of TGF-β1 and complement component C3a in the supermatant by enzyme linked immunosorbent assay were conducted at different times(0,12,24,48 h).Results The stimulation of different concentrations CSE for 72 hours in BEAS-2B cells decreased the level of E-cadherin mRNA expression accompanied by rising expression of the messenger ribonucleic acid level of N-cadherin compared with the control group in a concentration dependent manner,Simultaneously,after different stimulations there was a significant increase in TGF-β1 protein level in the supermatant (P<0.05).After the treatment of 2.5% cigarette smoking extract in respiratory epithelial cells at different times,BEAS-2B cells acquired an elongated,shuttle-like shape in morphology,besides which there was an inverse change that the mRNA expression of E-cadherin was reduced compared with the control group as a significant increase in a time dependent manner in the mRNA expression of N-cadherin and complement component C3 (P<0.05),as well as the protein level of TGF-β1 and complement component C3a in the supermatant were elevated after BEAS-2B cells treated with 2.5% CSE exposure at different times (P<0.05).Conclusion Cigarette smoke extract may be induced epithelial to mesenchymal transition,in which the activation of complement C3 may play a role.
pulmonary disease,chronic obstructive;cigarette smoke extract;respiratory epithelial cells;epithelial mesenchymal transition;anaphylatoxin C3a
10.3969/j.issn.1671-8348.2017.03.010
贵州省科学技术基金项目(黔科合J字[2013]2301)。 作者简介:(1978-),副主任医师,博士,主要从事慢性阻塞性肺疾病方面研究。△
R714.253
A
1671-8348(2017)03-0318-04
2016-07-18
2016-10-15)

