长春西汀对大鼠颅脑损伤的保护机制研究
吴 昊 张华暹 郑卜毅 谭龙威
颅脑损伤(traumatic brain injury,TBI)在所有年龄阶段都具有高度的致残率,脑外伤可对神经组织造成原发性和继发性的损伤,原发性损伤是由最初的机械损伤引起的血管,神经元和轴突的物理性破坏,紧随原发性损伤,存在不同通路来诱发继发性损伤,导致初始损伤周围区域的额外组织死亡[1]。长春西汀在临床上可以改善脑供血不足、血管性认知功能障碍和老年痴呆症。本研究采用大鼠TBI模型,探讨长春西汀对于TBI的保护作用以及对抗氧化和凋亡通路的影响。
1 材料与方法
1.1 实验试剂 长春西汀购自百灵威公司,吐温80购自Sigma-Aldrich公司,protein assay kit、RIPA 裂解液和Super Signal West Dura chemiluminescence购自 Thermo Scientific公 司,Bcl-2、Bax、Caspase 3和GAPDH抗体购自Cell Signaling Technology公司,标记有辣根过氧化物酶的二级抗体IgG购自公司Jackson-Immuno Research,醋酸纤维素酶购自Whatman公司。丙二醛(MDA)的含量检测试剂盒、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPx)、过氧化氢酶(CAT)活性检测试剂盒购自碧云天公司。
1.2 实验仪器 垂直电泳仪及转膜仪购自Applied Biosystems公司,离心机购自Eppendorf公司,Image Quant LAS 4000 mini 购自GE healthcare公司,立体定位仪购自上海拜力生物科技有限公司,颅脑撞击器购自hatteras公司。
1.3 实验动物与分组 250只7周龄的Wistar雄性大鼠购自上海实验动物中心,饲养于独立通风笼盒(IVC)环境中,适应2d。在IVC环境中每天光照和黑暗各12h,22°C,60%湿度。大鼠自由取食和饮水。大鼠随机分为5组,分别为假手术组、模型组和长春西汀组(低、中、高3个剂量),每组各50只。
1.4 TBI模型制作 对大鼠称重,根据体重腹腔注射10%的水合氯醛,按照0.4 ml/100g进行麻醉,并固定于立体定位仪上,固定头部,清除毛发。假手术组大鼠只进行颅部皮肤切口,然后清洁伤口缝合。模型组和长春西汀组参考Feeney法[2]制作TBI模型:常规手术开颅骨窗,要求硬膜保持完整,使用重量为20g的砝码于30cm高度连接金属导杆坠落,撞击硬膜上的圆锥,造成TBI。撞击后1h参照Wayne Clark评估方法,进行大鼠的神经行为学观察和评分,TBI分为轻度、中度和重度,神经行为学评分分别为≤6分、≤12分和≤18分,选用其中的重度损伤作为研究模型。长春西汀组分为3个剂量组,分别腹腔注射长春西汀10mg/kg、20mg/kg和40mg/kg,模型组腹腔注射等量生理盐水,给药14d。
1.5 脑组织含水量检测 在给药第14天,腹腔注射10%的水合氯醛(0.4 ml/100g)麻醉10只大鼠后迅速断头、开颅、取出完整的脑组织,电子天平测量脑组织湿重,将脑组织在电热恒温鼓风干燥箱中、95℃、干燥24h至恒重,然后干燥冷却15min,用电子天平称重。脑含水量(%)=(湿重-干重)/ 湿重×100%。
1.6 酶活性检测 在给药第3、7和14天,分别取10只大鼠,对血浆中SOD、GPx、CAT的活性使用相应的试剂盒进行检测,活性单位为U/mg。
1.7 免疫印迹实验 在给药第14天,10只大鼠脑组织用裂解液(25mmol/L Tris-HCl,pH=7.5,150mmol/L NaCl,1mmol/L Na3VO4,1% Triton X-100 和 protease inhibitor cocktail)裂解。裂解后,12000r/min,4℃离心90min,取上清液,测定蛋白浓度。将蛋白用裂解液稀释为相同的浓度,再加入相同体积的2×loading buffer。样品加热震荡15min。各取10μl的样品,用10%的SDS-聚丙烯酰胺凝胶分离蛋白。将蛋白转移至硝酸纤维膜上,剪下目的蛋白,室温,在含有5%的脱脂牛奶中封闭1h。将蛋白与对应的抗体在4℃孵育过夜。次日,将膜用洗膜液洗3次,15min/次。与相应的标记有辣根过氧化物酶的二抗室温孵2h。用洗膜液洗膜3次,15min/次。最后用辣根过氧化物酶的底物与膜作用5min。用Image Quant LAS 4000 mini曝光蛋白条带。
1.8 统计学方法 采用Graphpad Prism Software 7统计软件。计量资料以(s)表示,两组以上的数据差异用one way ANOVA进行分析,两组数据之间的差异应用student's t test分析。当P<0.05为差异有统计学意义。
2 结果
2.1 长春西汀对大鼠的氧化应激影响 见表1~4。
表1 长春西汀对大鼠SOD的影响[U/mg,]

表1 长春西汀对大鼠SOD的影响[U/mg,]
注:与假手术组比较,*P<0.01;与模型组比较,#P<0.05,▲P<0.01
?
表2 长春西汀对大鼠GPx的影响[U/mg,(]

表2 长春西汀对大鼠GPx的影响[U/mg,(]
注:与假手术组比较,*P<0.01;与模型组比较,#P<0.05,▲P<0.01
?
表3 长春西汀对大鼠CAT的影响[U/mg,]

表3 长春西汀对大鼠CAT的影响[U/mg,]
注:与假手术组比较,*P<0.01;与模型组比较,#P<0.05,▲P<0.01
?
表4 长春西汀对大鼠MDA的影响[nmol/mg,]

表4 长春西汀对大鼠MDA的影响[nmol/mg,]
注:与假手术组比较,*P<0.01;与模型组比较,#P<0.05,▲P<0.01
?
2.2 长春西汀对大鼠脑细胞凋亡通路影响 Western Blot检测结果,与模型组大鼠比较,长春西汀20mg/kg和40mg/kg组大鼠脑组织中Bax和Caspase 3的表达均显著下降(P<0.05,P<0.01),Bcl-2的表达显著增加(P<0.05,P<0.01)。
2.3 长春西汀对大鼠脑水肿影响 脑称重结果分析,与模型组大鼠比较,长春西汀20mg/kg和40mg/kg组大鼠脑组织含水量均显著下降(P<0.05),见表5。
表5 长春西汀对大鼠脑水肿影响[%,]
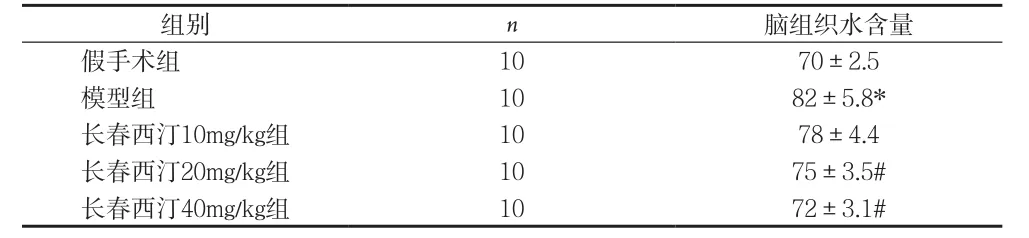
表5 长春西汀对大鼠脑水肿影响[%,]
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05
?
3 讨论
TBI后,继发性损伤对组织的破坏性常较原发性损伤更为广泛和严重,由自由基及脂质过氧化引起的氧化应激损伤是继发性损伤中已被广泛认同的病理生理机制之一,TBI后短时间内即可迅速产生大量的自由基,主要表现为对各种生物大分子的攻击,造成了机体严重的损害[3]。脑组织含有丰富的脂肪酸,易被氧化,MDA是脂质过氧化最重要的产物之一,消耗了相当大比例的氧,并限制了抗氧化防御系统。由于其较高的代谢率和脂肪含量,脑组织对TBI损伤特别敏感,因此在继发性TBI中会出现迟发性神经功能障碍和死亡。继发性的TBI常涉及创伤部位的细胞凋亡。Bcl-2(bcl-2原癌基因的编码产物)抑制细胞凋亡,Bax(Bcl2-Associated X的蛋白质)促进细胞凋亡,TBI动物模型中Bcl-2水平下降,Bax水平升高[4]。Caspase 3是一种白细胞介素转换酶,并被认为是哺乳动物细胞凋亡和炎症通路的主要效应因子,是细胞凋亡活性的标记物。
线粒体在正常生理条件下产生超氧阴离子自由基和过氧化氢(H2O2),这些不断产生的活性氧(ROS)是由SOD、GSH-Px、CAT来负责清除的。SOD,催化超氧阴离子生成过氧化氢,然后被CAT或GSH-Px分解为水和氧气。羟基自由基(-OH)可以通过芬顿反应产生H2O2(H2O2+Fe2+的→-HO+Fe3++-OH)。其他小分子抗氧化剂,如谷胱甘肽(GSH),抗坏血酸,和α-生育酚,也参与清除自由基的清除。
大量动物实验表明,TBI后机体的氧自由基反应增强,创伤后过氧化脂质的含量明显增加,羰基蛋白水平亦明显提高[5]。TBI动物模型研究也证实使用抗氧化剂能 够减轻创伤后继发 TBI[6]。
本实验研究了长春西汀对于重度TBI大鼠的保护机制。结果显示,长春西汀能够剂量依赖性的提高重度TBI大鼠的抗氧化能力,改善大鼠脑水肿程度,中剂量组(20mg/kg)和高剂量组(40mg/kg)与模型组比较具有显著的治疗效果。在脑细胞保护机制方面,长春西汀同样剂量依赖性的改善了重度TBI大鼠脑组织中Bcl-2、Bax和Caspase的水平,中剂量组(20mg/kg)和高剂量组(40mg/kg)与模型组比较分别显著增加脑组织中Bcl-2的水平,减少Bax和Caspase 3水平。基于本实验数据,长春西汀的剂量为20mg/kg~40mg/kg时,对于重度TBI大鼠具有明显的治疗效果。
[1] Kertmen H, Gürer B, Yilmaz ER, et al. Antioxidant and antiapoptotic effects of darbepoetin-α against traumatic brain injury in rats. Arch Med Sci,2015,11(5):1119-1128.
[2] Wong DY,Krebsbach PH,Hollister SJ.Brain cortex regeneration affected by scaffold architectures.J Neurosurg,2008,109(4):715-22.[3] Awasthi D,Church DF,Torbati D,et al.Oxidative stress following traumatic brain injury in rats.Surg Neurol,1997,47(6):575-581.
[4] Wang Q,Zhang L,Yuan X,et al.The Relationship between the Bcl-2/Bax Proteins and the Mitochondria-Mediated Apoptosis Pathway in the Differentiation of Adipose-Derived Stromal Cells into Neurons.PLoS One,2016,11(10):e0163327.
[5] Reed TT,Owen J,Pierce WM,et al.Proteomic identification of nitrated brain proteins in traumatic brain-injured rats treated postinjury with gamma-glutamylcysteine ethyl ester:insights into the role of elevation of glutathione as a potential therapeutic strategy for traumatic brain injury.J Neurosci Res,2009,87(2):408-417.
[6] Hall ED,Vaishnav RA,Mustafa AG.Antioxidant therapies for traumatic brain injury. Neurotherapeutics,2010,7(1):51-61.

