原发性输卵管绒癌一例报道
陈 骋 段 萍 潘镏镏 虞楼超 祁旦巳 王乐丹*
绒癌是一种高度恶性的由细胞滋养细胞和合体滋养细胞不典型增生和不规则增殖导致坏死的肿瘤[1]。输卵管绒癌非常罕见,其临床表现和输卵管异位妊娠非常相似,常易被误诊为输卵管异位妊娠而行急诊手术。本文报道1例原发性输卵管绒毛膜癌误诊病例,旨在对该病的临床表现提高认识,减少或者避免误诊,并及早给予合理的治疗。
1 临床资料
患者,女,48岁,贵州人,生育史4-0-0-3,一子意外夭折,20+年前行绝育术。平素月经规则,2015年10月9日因“停经1+月,腹痛10h”入院,入院后查血人绒毛膜促性腺激素(β-HCG)58592mIU/ml,阴道B超示“右侧附件区混合回声团(异位妊娠可能,大小98mm×47mm,内可见一偏高回声团,大小约28mm×27mm,其内可见液暗区,大小10mm×9mm,未见明显胚芽及卵黄囊,CDFI示血流信号可见),盆腔积液(21mm)”。体格检查:一般情况可,生命体征尚可,腹软,全腹压痛、反跳痛。妇检:外阴阴性,阴道光畅,宫颈轻度糜料,举痛阳性,子宫后位,常大,压痛明显,双附件区增厚,压痛明显。阴道后穹窿穿刺抽出2ml暗红色不凝血。急诊行剖腹探查术,术中见:腹腔内游离血性液及血凝块共约1200ml,子宫正常大小,表面光整,右侧输卵管增粗呈腊肠型,约5cm×4cm,近峡部处见一约1cm大小破口,附着大量血凝块。左侧输卵管见结扎痕迹,双侧卵巢外观未见异常。术中行“右侧输卵管切除术”,术毕剖视右侧输卵管管腔内未见绒毛组织。术后第5天血HCG降至2341mIU/ml出院。常规病理回报示“(右侧)输卵管绒毛膜上皮(绒瘤)癌”(见图1、2)。免疫组化示:Ki-67(滋养细胞+约60%~70%;合体样细胞+约10%),HCG(+++),CK(+),PLAP(小灶 +)(见图 3~6),符合绒癌。术后辅以化学治疗。化疗前血HCG 16103mIU/ml,胸部CT示右肺中叶钙化灶,但化疗前后无明显变化(见图7、8)。按照FIGO预后评分该例输卵管绒癌为:I期,9分。患者系高危绒癌,予EMA-EP方案化疗。现患者已在本院化疗7次,每次化疗前评估情况见表1,化疗期间三系改变(见图9)。第4次化疗期间出现IV度骨髓抑制、口腔溃疡严重,导致不能进食,无法上EP,故为EMA方案,第5~7次化疗为巩固化疗,均为EMA方案,且化疗剂量相对减少。现患者一般情况良好,第7次化疗结束后当地每周复查血HCG波动于2~3.5mIU/ml,目前仍在随访中。

图1 合体/细胞滋养细胞核异型,核分裂,伴出血﹑坏死(HE染色,40倍)

图2 合体/细胞滋养细胞核深染,异型明显,核分裂像易见(HE染色,200倍)

图3 Ki67(滋养细胞+约60%~70%;合体样细胞+约10%,200倍)

图4 HCG肿瘤细胞孢浆深染(+++)(200倍)
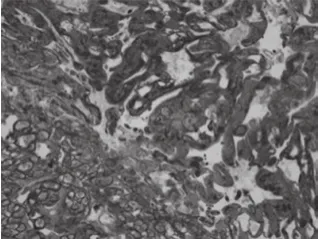
图5 CK(+)(400倍)

图6 PLAP灶(+)(100倍)

图7 第1次化疗前胸部CT

图8 第7次化疗后胸部CT

表1 每次化疗前评估

图9 七次化疗期间三系水平变化
2 讨论
原发性输卵管绒癌包括妊娠性和非妊娠性。输卵管妊娠性绒癌是由输卵管妊娠滋养细胞演变而来。输卵管非妊娠性绒癌的组织发生来自胚胎残余组织或畸胎瘤潜能未分化胚细胞,大约占女性恶性生殖肿瘤的0.14%~1.8%[2]。其诊断标准:(1)宫腔无病灶。(2)病理证实为绒癌。(3)排除葡萄胎妊娠发展而来。(4)排除同时存在的宫内正常妊娠。该患者否认既往异位妊娠及葡萄胎病史,B超提示宫腔内无妊娠征象,病理证实为绒癌,符合原发性输卵管非妊娠性绒癌。
绝大多数报道输卵管绒癌病例的临床表现与输卵管妊娠相似,易误诊行急诊手术治疗,术后病理检查方可确诊,故其临床诊断率较低。当临床诊断输卵管妊娠,而血β-HCG异常升高,尤其术中剖视标本发现病灶内充满烂肉样组织,且未见绒毛及胚胎组织时,应高度怀疑输卵管绒癌。两者鉴别的金标准为病理检查。输卵管妊娠时管腔内可见绒毛、出血,滋养叶细胞无异常增生,而输卵管绒毛膜癌的管腔内可见大片分化不良的细胞滋养细胞和合体滋养细胞浸润肌层,伴出血、坏死,且未见绒毛及胚胎组织[3]。
不仅因为输卵管绒癌罕见,症状类似输卵管异位妊娠,而且如果手术时取得组织较少,而又缺乏免疫组织化学诊断,也会导致错误的诊断[4]。Ki-67是判断肿瘤细胞增殖情况的一个指标,越高表示肿瘤细胞增殖多,恶性程度越高,但是对化疗的敏感性越高。HCG即人绒毛膜促性腺激素,主要用于标记绒癌及检测分泌异位激素的肿瘤。CK是角蛋白,一般在上皮组织中存在,阳性代表上皮来源的恶性病变。PLAP即胎盘碱性磷酸酶,结合HCG是为了鉴别绒癌与PSTT。绒毛膜癌常见到3种不同类型滋养细胞,侵蚀血管和破坏平滑肌,并摧毁正常细胞,伴大片出血坏死,瘤细胞异型性明显,核分裂像易见,PLAP呈灶性弱阳性,HCG呈强阳性。本例患者术后免疫组化示:Ki-67(滋养细胞+约60~70%;合体样细胞+约10%),HCG(+++),CK(+),PLAP(小灶+),符合绒癌。
输卵管绒癌的治疗目前尚无统一标准,Izabella Petre[5]主张治疗方法类似卵巢癌,先行全子宫及双侧输卵管卵巢切除术,再分次化疗。年轻未生育者,可保留生育功能,可行病灶侧附件或病灶侧输卵管切除术,保留子宫和对侧附件。苏桂栋等[6]报道因盆底部位血管丰富,一旦转移手术操作困难,易致致命性出血,故术前给予1个疗程化疗使病灶局限再行手术,术后继续化疗,效果较好。但输卵管绒癌早期诊断较困难,术前化疗较难实现,故术后补充化疗是惯用、并且也符合临床实际的治疗途径[7]。目前国内仍采用化疗为主,手术为辅的治疗方案[8]。化疗方案主要以5-氟尿嘧啶及更生霉素联合治疗的方案,复发或高危患者也可采用EMA-CO或EMA-EP、BEP等联合化疗方案,化疗时间应根据患者病程的不同而决定。Muto等[9]报道输卵管绒癌对化疗的敏感性和宫内绒癌相似,预后较好。输卵管绒癌对化疗也很敏感,但是需警惕化疗药物对患者造成的副反应,及早预防。有研究表明,手术后辅以化疗可以减少化疗的疗程,减少化疗的副反应。该例患者化疗4次后血HCG降至正常,化疗期间出现胃肠道反应、脱发、口腔溃疡、骨髓抑制、肝功能损害等副反应。尤其第4次化疗期间骨髓IV度抑制,严重口腔溃疡,口腔疼痛剧烈无法进食,导致无法上EP。口泰漱口、锡类散、贝复济喷口腔患处,复合维生素B片口服等治疗后口腔溃疡仍无明显改善,最后予巨和粒针1.5mg+生理盐水100ml及亚叶酸钙针10ml+生理盐水100ml交替漱口后好转。
虽然输卵管绒癌在临床相对罕见,但术前详细复习患者病史、症状及辅助检查,尤其血HCG值异常增高时,应高度考虑是否有输卵管绒癌,以减少其漏诊率。术中应剖视大体标本,尽可能地将手术所切除的组织全部送检,并加行免疫组化诊断,以显著提高输卵管绒癌的早期诊断率,使患者能够得到早期及时合理地治疗。如明确诊断输卵管绒癌,则应根据患者年龄、子宫是否有病灶、是否有保留生育功能的要求等因素综合考虑决定手术方式及治疗方案。术后亦应随访血HCG水平至正常,尤其是未生育女性保守治疗或行保守手术的患者,若术后血HCG水平下降缓慢或下降后反升,尤其是再次出现附件包块或胸片见阴影时,可再次行开腹探查术,以防止输卵管绒癌漏诊[7]。
[1] Skubisz MM,Tong S.The evolution of methotrexate as a treatment for ectopic pregnancy and gestational trophoblastic neoplasia:a review.ISRN Obstet Gynecol,2012,2012(1):637094.
[2] Velişcu A,Marinescu B,Costoiu L,et al.Bilateral primary Fallopian tube carcinoma: a case report.Rom J Morphol Embryol, 2013,54(4): 1183-1187.
[3] 黄建珍,钱小泉.原发性输卵管绒毛膜癌1例.现代医药卫生,2013,7(29):1118.
[4] Butler R,Chadha Y,Davies J,et al.A case of primary tubal gestational choriocarcinoma.Aust N Z J Obstet Gynaeco,2010,50:200-201.
[5] Petre I, Bernad E, Mureşan A,et al.Choriocarcinoma developed in a tubal pregnancy - a case report.Rom J Morphol Embryol,2015,56(2 Suppl):871-874.
[6] 苏桂栋,宋天蓉,徐艳红,等.输卵管绒毛膜癌1例报告.南方医科大学学报,2007,27(10):1614.
[7] 王海芳,张爱华,李强.原发输卵管绒癌二例误诊分析.天津医药,2012,11(40):1183-1184.
[8] 王泽华.妇产科治疗学.北京:人民卫生出版社,2009:598-601.
[9] Muto MG,Lage JM,Berkowitz RS,et al.Gestational trophoblastic disease of the fallopian tube.J Reprod Med,1991,36(1):57-60.

