干扰TRPM7对人肺成纤维细胞向肌成纤维细胞转化的影响
李利华,卢滨,吴红科,张浩,姚菲菲
(河南省郑州人民医院呼吸科,河南郑州450003)
论著
干扰TRPM7对人肺成纤维细胞向肌成纤维细胞转化的影响
李利华,卢滨,吴红科,张浩,姚菲菲
(河南省郑州人民医院呼吸科,河南郑州450003)
目的研究干扰瞬时受体电位通道7(TRPM7)对人肺成纤维细胞向肌成纤维细胞转化的影响。方法用转化生长因子-β1(TGF-β1)刺激人胚肺成纤维细胞WI-38和MRC-5,Western blot检测细胞平滑肌肌动蛋白(α-SMA)和胶原Ⅰ的表达,来评价细胞的转化。用实时聚合酶链反应(Real-time PCR)和Western blot检测细胞中TRPM7的表达。将特异性的TRPM7 siRNA转染到细胞中,并将细胞分为对照组、模型组、TRPM7 siRNA组、转染非特异性siRNA组(Scramble组)。检测转化过程中相关蛋白α-SMA、胶原Ⅰ、Smad3、p-Smad3及Smad7的表达。结果TGF-β1(15μg/L)作用24h后,成功诱导肺成纤维细胞转化为肌成纤维细胞。与对照组比较,模型组细胞中TRPM7 mRNA和蛋白高表达,且细胞中α-SMA、胶原Ⅰ、Smad3及p-Smad3的蛋白表达增多,Smad7表达降低,差异有统计学意义(P<0.05)。与模型组比较,TRPM7 siRNA转染组细胞TRPM7 mRNA和蛋白低表达,且α-SMA、胶原Ⅰ、Smad3及p-Smad3的表达下降,Smad7的表达升高,差异有统计学意义(P<0.05)。结论下调TRPM7可在一定程度上干预肺成纤维细胞向肌成纤维细胞转化,该作用可能与TGF-β1/Smads信号通路有关。
瞬时受体电位通道7;肺纤维化;肺成纤维细胞;TGF-β1/Smads信号通路
特发性肺间质纤维化(idiopathic pulmonary fibrosis,IPF)是一种严重的弥漫性肺间质疾病,病因不明、发病机制不清[1],且全球发病率、死亡率不断上升[2]。IPF是特发性间质性肺炎最常见最致命的形式[3],最终可导致呼吸衰竭,且预后极差[4]。尽管目前对于该病有诸多治疗方法,但是疗效仍不理想。因此,研究并阐明其发病机制,寻找新的治疗靶点,对攻克该病至关重要。
瞬时受体电位通道7(transient receptor potential channel 7,TRPM7)是细胞膜上的一类重要的阳离子瞬时受体电位通道(transient receptor potential channels,TRP)家族成员之一,TRPM7包含TRP离子通道与蛋白激酶域融合区域的双功能膜蛋白[5],可使自身或底物磷酸化,也被称为通道酶[6]。TRPM7广泛存在于机体中,参与细胞的生长、增殖、迁移、凋亡等多种生理过程[7]。TRPM7在纤维化疾病的发病过程中扮演着重要角色[8-9],但其在肺纤维化中的作用至今鲜见报道。本实验用人胚肺成纤维细胞系MRC-5和WI-38为研究对象,探讨干扰TRPM7对转化生长因子-β1(transforming growth factor-β,TGF-β1)诱导的肺成纤维细胞向肌成纤维细胞转化的影响。
1 材料与方法
1.1 主要试剂
人胚肺成纤维细胞系WI-38和MRC-5购自中国科学院上海细胞库,达尔伯克必需基本培养基(dulbecco's minimum essential medium,DMEM)培养基购自美国Hyclone公司,胎牛血清(fetal bovine serum,FBS)购自美国Gibco公司,重组人的TGF-β1购自以色列Pro Spec公司(批号:810TGFB131),兔抗人平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)抗体(货号:ab5694)、兔抗人TRPM7抗体(货号:ab109438)、小鼠抗人胶原Ⅰ抗体(货号:ab6308)、兔抗人Smad3抗体(货号:ab40854)、兔抗人p-Smad3抗体(货号:ab52903)购自美国Abcam公司,小鼠抗人Smad7抗体(货号:sc-365846)和小鼠抗人甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(货号:sc-47778)购自美国Santa Cruz公司,辣根过氧化物酶(horseradish peroxidase,HRP)标记的兔抗小鼠IgG(货号:SN133)和HRP标记的山羊抗兔IgG(货号:SN134)购自南京生兴生物技术有限公司,LipofetamineTM2000、TRIzol试剂盒与逆转录试剂盒购自美国Invitrogen公司,无线电免疫沉淀(radio-immunoprecipitation assay,RIPA)蛋白裂解液来自美国Sigma-Aldrich公司,TRPM7 siRNA片段由上海生工生物工程股份有限公司合成。
1.2 细胞培养
分别将MRC-5细胞和WI-38细胞置于10% FBS的DMEM培养基、37℃、5%二氧化碳CO2培养箱中培养,至80%融合后,更换无血清培养基,待用。
1.3 肺成纤维细胞向肌成纤维细胞转化模型的复制
分别用0、5、10、15和20μg/L TGF-β1诱导MRC-5和WI-38细胞24 h。用Western blot检测相关蛋白的表达,筛选细胞模型。
1.4 TRPM7 siRNA序列的设计及转染
将人胚肺成纤维细胞WI-38和MRC-5接种于6孔板(2.0×105个/孔),待细胞生长至70%~80%时,更换无血清培养基,按照LipofetamineTM2000说明书进行操作,分别将TRPM7 siRNA或非特异性siRNA(Scramble)转染细胞48 h。
HPLC法需要的试剂较多,需要接触OTA的标准品,使用的免疫亲和柱也需要冷藏保存,需要避免移动色谱仪,便携性不强,实验耗时较长。但是该方法的重复性好、准确度高,因此国家标准中推荐使用此方法[16-20]。
1.5 实验分组
将细胞分为对照组、模型组、Scramble组和TRPM7 siRNA组。对照组细胞正常培养,模型组细胞用筛选出浓度的TGF-β1刺激24 h,Scramble组和TRPM7 siRNA组细胞分别转染非特异性siRNA或TRPM7 siRNA后同模型组进行相同处理。
1.6 实时聚合酶链反应检测TRPM7 mRNA的表达
分别提取MRC-5和WI-38细胞总RNA,测定RNA浓度和纯度后逆转录合成cDNA,并转录为DNA,聚合酶链反应(polymerase chain reaction,PCR)产物用1%琼脂糖凝胶电泳。TRPM7正向引物:5'-GCAA ATGACTCCACTCTC-3',反向引物:5'-GATTCTCTCT TCACTCCCAG-3';内参GAPDH正向引物:5'-ACAG CAACAGGGTGGTGGAC-3',反向引物:5'-TTTGAGG GTGCAGCGAACTT-3'。根据2-ΔΔCt法计算目的基因的相对表达量,实验重复3次。PCR引物由上海生工生物工程股份有限公司合成。
1.7 Western blot检测α-SMA、胶原Ⅰ、TRPM7、Smad3、p-Smad3及Smad7蛋白的表达
用0.05%胰蛋白酶消化细胞,磷酸盐缓冲溶液(phosphate buffer saline,PBS)洗涤3次,加入细胞裂解液裂解细胞,提取蛋白并测定其浓度,经十二烷基硫酸钠-聚丙烯酰胺(sodium dodecyl sulfatepolyacrylamide gelelectrophoresis,SDS-PAGE)电泳分离后,将蛋白转移到聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,用含5%脱脂奶粉、2%牛血清蛋白(bovine serum albumin,BSA)、0.2%Tween-20的PBS液的封闭液室温下封闭2 h,4℃下过夜孵育一抗,包括小鼠抗人TRPM7抗体(1∶1 000)、兔抗人α-SMA抗体(1∶100)、小鼠抗人胶原Ⅰ抗体(1∶500)、小鼠抗人Smad3抗体(1∶1 000)、兔抗人p-Smad3抗体(1∶2 000)、兔抗人Smad7抗体(1∶500)和兔抗人GADPH抗体(1∶1 000),洗膜后,加入二抗(1∶4 000),用化学发光法进行显色反应。
1.8 统计学方法
数据分析采用SPSS 20.0统计软件,计量资料以均数±标准差(x±s)表示,多组比较用单因素方差分析,两两比较用LSD-t检验,P<0.05为差异有统计学意义。

图1 Western blot检测不同浓度TGF-β1对WI-38和MRC-5细胞中α-SMA和胶原Ⅰ表达的影响
2 结果
分别用0、5、10、15和20μg/L TGF-β1刺激WI-38和MRC-5细胞24 h,各组α-SMA和胶原Ⅰ的相对表达量比较,经方差分析,差异有统计学意义(WI-38细胞:F=51.126和59.181,P=0.000;MRC-5细胞:F=59.690和49.163,P=0.000),均呈递增趋势(见图1)。5μg/L TGF-β1组α-SMA和胶原Ⅰ的表达量与对照组比较,经LSD-t检验,差异无统计学意义(WI-38细胞:t=1.802和3.339,P=0.165和0.198;MRC-5细胞:t=2.328和3.157,P=0.091和0.172)。10、15和20μg/L TGF-β1组α-SMA和胶原Ⅰ的表达量与对照组比较,经LSD-t检验,差异有统计学意义(WI-38细胞10μg/L TGF-β1组:t=4.189和2.681,P=0.019和0.024;WI-38细胞15μg/L TGF-β1组:t=9.675和10.653,P=0.000;WI-38细胞20μg/L TGF-β1组:t=14.516和15.482,P=0.000;MRC-5细胞10μg/LTGF-β1组:t=2.816和3.462,P=0.039和0.015;MRC-5细胞15μg/L TGF-β1组:t=10.817和7.522,P=0.000;MRC-5细胞20μg/L TGF-β1组:t=16.295和19.745,P=0.000),15和20μg/L TGF-β1组α-SMA和胶原Ⅰ的表达>0μg/L,表明15μg/L TGF-β1作用24 h后,肺成纤维细胞成功转化为肌成纤维细胞。
2.2 TRPM7在TGF-β1诱导的肺成纤维细胞转化模型中高表达
用15μg/LTGF-β1分别刺激WI-38和MRC-5细胞24h,诱导肺成纤维细胞转化为肌成纤维细胞,实时聚合酶链反应(real-time polymerase chain reaction,Real-time PCR)和Western blot检测结果表明,WI-38和MRC-5细胞的模型组与对照组比较,差异有统计学意义(WI-38细胞TRPM7 mRNA:t=13.825,P=0.000;WI-38细胞TRPM7蛋白:t=27.500,P= 0.000;MRC-5细胞TRPM7 mRNA:t=24.316,P= 0.000;MRC-5细胞TRPM7蛋白:t=24.084,P=0.000),模型组中TRPM7 mRNA和蛋白表达量高于对照组(见图2)。
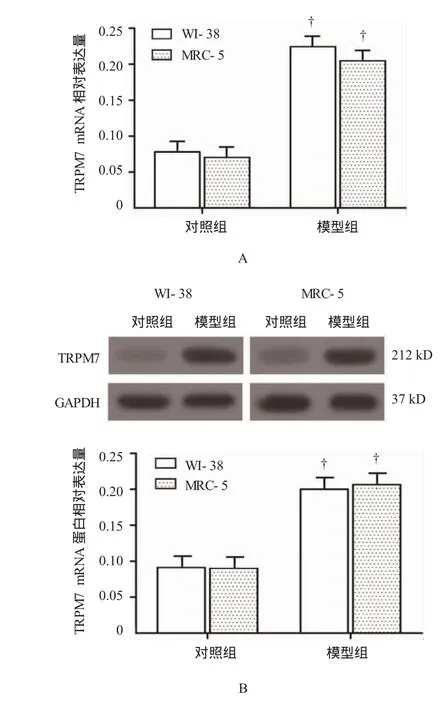
图2 Real-time PCR和Western blot检测TRPM7在WI-38和MRC-5细胞中的表达
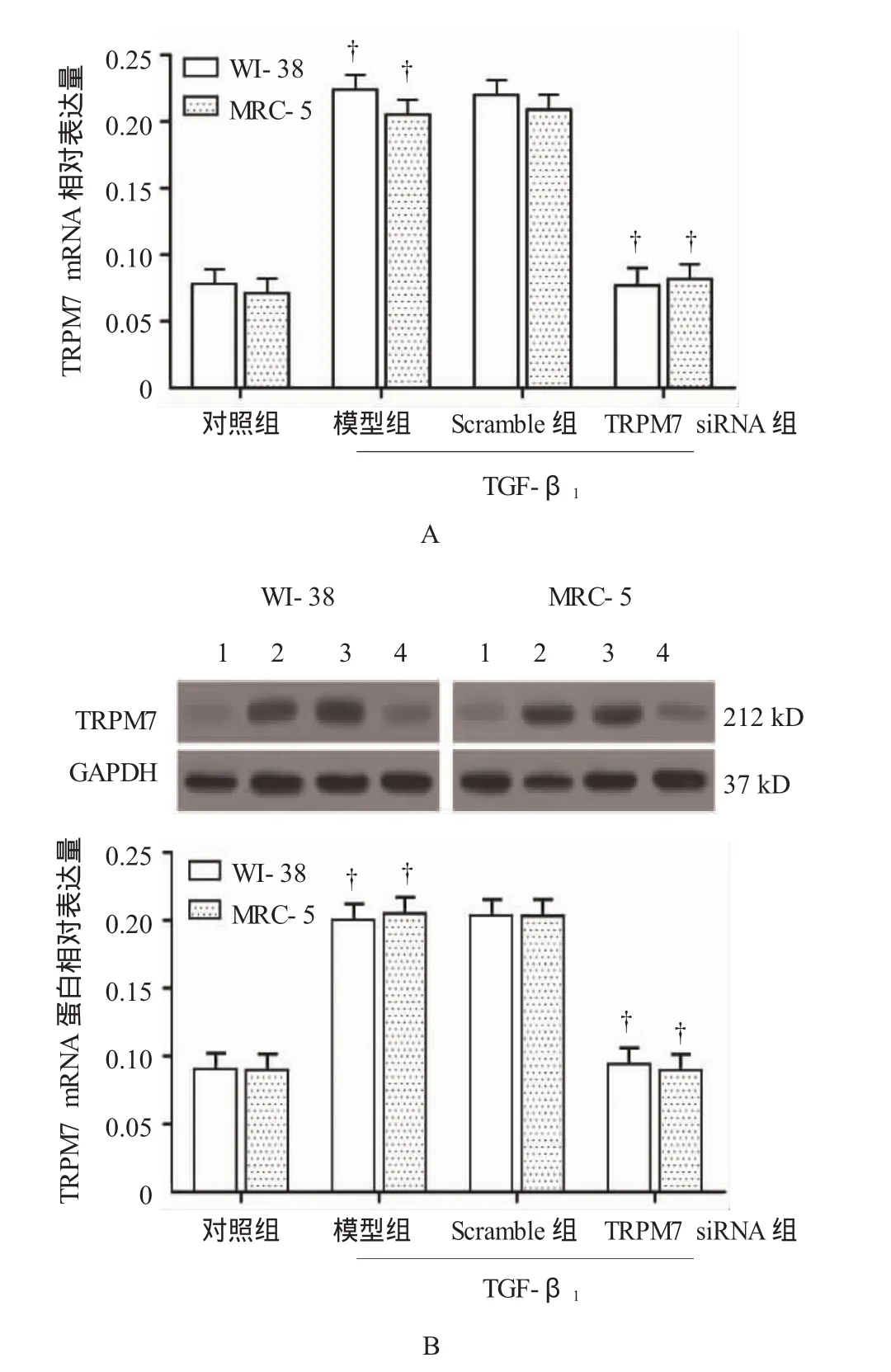
图3 qPCR和Western blot检测TRPM7 siRNA对WI-38和MRC-5细胞TRPM7表达的影响
2.3 TRPM7 siRNA抑制WI-38和MRC-5细胞中TRPM7的表达
转染TRPM7 siRNA 48h后,用15μg/L TGF-β1刺激WI-38和MRC-5细胞24 h,TRPM7 mRNA和蛋白表达见图3。模型组和对照组TRPM7 mRNA和蛋白表达量,差异有统计学意义(WI-38细胞TRPM7 mRNA:t=33.918,P=0.000;WI-38细胞TRPM7蛋白:t=26.774,P=0.000;MRC-5细胞TRPM7 mRNA:t=23.729,P=0.000;MRC-5细胞TRPM7蛋白:t= 26.855,P=0.001),模型组TRPM7表达高于对照组。模型组、Scramble组及TRPM7 siRNA组的TRPM7 mRNA和蛋白表达量,经方差分析,差异有统计学意义(WI-38细胞TRPM7 mRNA:F=264.277,P=0.000;WI-38细胞TRPM7蛋白:F=205.178,P=0.000;MRC-5细胞TRPM7 mRNA:F=184.192,P=0.000;MRC-5细胞TRPM7蛋白:F=248.786,P=0.000),其中siRNA转染组TRPM7 mRNA和蛋白表达量与模型组比较,经LSD-t检验,差异有统计学意义(WI-38细胞:t= 17.870和19.314,P=0.000;MRC-5细胞:t=17.275和23.016,P=0.000),siRNA转染组TRPM7 mRNA和蛋白表达量低于模型组。
2.4 TRPM7 siRNA对TGF-β1/Smad信号通路相关基因表达的影响
WI-38和MRC-5细胞模型组与对照组比较,差异有统计学意义(WI-38细胞Smad3:t=6.604,P=0.003;WI-38细胞p-Smad3:t=8.486,P=0.001;WI-38细胞Smad7:t=7.977,P=0.001;MRC-5细胞Smad3:t= 6.154,P=0.004;MRC-5细胞p-Smad3:t=5.317,P= 0.006;MRC-5细胞Smad7:t=8.341,P=0.001),模型组Smad3和p-Smad3的蛋白表达高于对照组,Smad7蛋白表达低于对照组。模型组、Srcamble组及TRPM7 siRNA组的Smad3、p-Smad3和Smad7蛋白表达量比较,经方差分析,差异有统计学意义(WI-38细胞Smad3:F=42.020,P=0.000;WI-38细胞p-Smad3:F=31.000,P=0.000;WI-38细胞Smad7:F=40.327,P= 0.000;MRC-5细胞Smad3:F=22.373,P=0.002;MRC-5细胞p-Smad3:F=60.928,P=0.000;MRC-5细胞Smad7:F=50.683,P=0.000)。TRPM7 siRNA可下调肺成纤维细胞中Smad3和p-Smad3的蛋白表达,上调Smad7蛋白表达(WI-38细胞:t=7.949、8.141和8.283,P=0.000;MRC-5细胞:t=8.283、9.354和9.125,P=0.000)。见图4。

图4 Western blot检测TRPM7 siRNA对Smad3、p-Smad3及Smad7表达的影响
2.5 TRPM7 siRNA降低α-SMA和胶原Ⅰ的表达
Western blot检测结果显示,WI-38和MRC-5细胞模型组与对照组比较,差异有统计学意义(WI-38细胞α-SMA:t=13.152,P=0.000;WI-38细胞胶原Ⅰ:t=11.631,P=0.000;MRC-5细胞α-SMA:t=11.913,P=0.000;MRC-5细胞胶原Ⅰ:t=12.129,P=0.000),模型组α-SMA和胶原Ⅰ蛋白表达量高于对照组;模型组、Srcamble组及TRPM7 siRNA组α-SMA和胶原Ⅰ蛋白表达量比较,经方差分析,差异有统计学意义(WI-38细胞α-SMA:F=106.364,P=0.000;WI-38细胞胶原Ⅰ:F=107.823,P=0.000;MRC-5细胞α-SMA:F=135.850,P=0.000,MRC-5细胞F胶原Ⅰ:F=118.595,P=0.000);其中模型组和Srcamble组比较,经LSD-t检验,差异无统计学意义(WI-38细胞α-SMA:t=0.868,P=0.257;WI-38细胞胶原Ⅰ:t=1.348,P=0.708;MRC-5细胞α-SMA:t=0.926,P= 0.327;MRC-5细胞胶原Ⅰ蛋白:t=0.158,P=0.847)。TRPM7 siRNA组WI-38和MRC-5细胞中α-SMA和胶原Ⅰ蛋白表达量与模型组比较,经LSD-t检验,差异有统计学意义(WI-38细胞:t=14.185和 12.396,P=0.000;MRC-5细胞:t=10.339和8.969,P=0.000),表明TRPM7 siRNA组WI-38和MRC-5细胞中α-SMA和胶原Ⅰ蛋白表达量低于模型组。见图5。
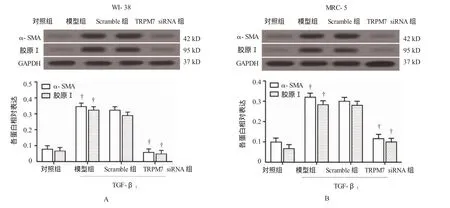
图5 Western blot检测TRPM7 siRNA对α-SMA表达和胶原Ⅰ表达的影响
3 讨论
IPF病理表现为细胞外基质蛋白大量沉积及肺成纤维细胞聚集与活化,其发病机制迄今不明。通常被认为是肺成纤维细胞转化为肌纤维细胞并聚集在肺间质,细胞外基质合成增多降解减少,致纤维化的细胞因子表达上调等多因素作用的结果。成纤维细胞在肺纤维化形成过程中扮演着极为重要的角色,其活化是肺纤维化形成的关键步骤和核心环节[10]。在肺纤维化发展过程中,活化的肺泡巨噬细胞或其他细胞分泌的TGF-β1使肺成纤维细胞表型发生转化,为可表达α-SMA、合成大量胶原的肌成纤维细胞[11-12],而肺间质中的胶原纤维主要由肌成纤维细胞产生。肌成纤维细胞还可造成细胞外基质异常沉积,诱导肺泡上皮细胞凋亡,在肺纤维化疾病发生、发展中发挥至关重要的作用[13]。本实验中,经15μg/L TGF-β1诱导24 h,α-SMA和胶原Ⅰ蛋白合成显著增高,表明肺成纤维细胞成功向肌成纤维细胞转化。
TGF-β1/Smad信号通路在肺纤维化过程中起重要作用[14-16]。TGF-β1是TGF-β1/Smad信号通路中一个重要的调控因子,也是促肺纤维化的关键因子[11],可促进成纤维细胞过度增殖、分化,向成肌纤维细胞表型转化[17],继而导致肺间质和肺泡间α-SMA与胶原蛋白等细胞外基质蛋白的过度沉积,最终导致肺纤维化的发生、发展。本实验结果显示,与模型组相比,TRPM7 siRNA可降低肺成纤维细胞中α-SMA和胶原Ⅰ蛋白的表达,表明TRPM7 siRNA通过抑制TGF-β1发挥抗纤维化作用。TGF-β1主要通过Smads信号通路转导,诱导其下游因子表达而发挥致纤维化作用[18]。Smad蛋白既可促进又可抑制TGF-β1信号转导,其中Smad3为TGF-β1/Smads信号通路中主要的活化蛋白,其正常表达是肺纤维化形成所必须的[19],抑制Smad3或p-Smad3可抵抗TGF-β1诱导的纤维化[20]。而Smad7是TGF-β1/ Smad信号通路中的负调节蛋白,可阻滞Smad3磷酸化。此外Smad7活化可抑制TGF-β1的活性,从而抑制肺纤维化[21-22]。本实验发现,TRPM7 siRNA可通过抑制TGF-β1/Smad信号途径,下调Smad3及p-Smad3表达,上调Smad7表达,而减少肺成纤维细胞向肌成纤维细胞转化,表现为α-SMA表达和胶原Ⅰ蛋白合成减少。
TRPM7有阳离子通道和蛋白激酶双重结构,其通过影响细胞内信号转导参与细胞多种生理过程[23],在调节细胞内离子平衡、促进细胞生长、调节神经递质释放及维持细胞功能等方面具有重要作用[24-25]。TRPM7被认为是纤维化疾病的一个潜在的治疗靶点[26]。本研究发现,TRPM7在TGF-β1诱导的WI-38和MRC-5细胞中高表达。为进一步确定TRPM7在肺纤维化中的作用,用TRPM7 siRNA抑制TRPM7的表达,发现TGF-β1/Smad信号通路受到抑制,WI-38和MRC-5细胞α-SMA和胶原Ⅰ蛋白表达均降低,表明TRPM7 siRNA在抑制肺成纤维细胞向肌成纤维细胞转化过程中发挥关键作用。
综上,本研究证实,TRPM7 siRNA可在一定程度上抑制TGF-β1诱导的肺成纤维细胞向肌成纤维细胞转化,且该作用与TGF-β1/Smads信号通路有关。干扰TRPM7有望成为防治肺纤维化新的靶点。
[1]MAHER TM,WELLS AU,LAURENT GJ.Idiopathic pulmonary fibrosis:multiple causes and multiple mechanisms[J].Eur Respir J,2007,30(5):835-839.
[2]HUTCHINSON J P,MCKEEVER T M,FOGARTY A W,et al. Increasing global mortality from idiopathic pulmonary fibrosis in the twenty-first century[J].Ann Am Thorac Soc,2014,11(8): 1176-1185.
[3]SPAGNOLO P,SVERZELLATI N,ROSSI G,et al.Idiopathic pulmonary fibrosis:an update[J].Ann Med,2015,47(1):15-27.
[4]HIRAI M,HIRONO M,OOSAKI T,et al.Adjuvant chemotherapy in stage I uterine endometrial carcinoma[J].Int J Gynaecol Obstet,2002,78(1):37-44.
[5]RUNNELS L W.TRPM6 and TRPM7:a Mul-TRP-PLIK-cation of channel functions[J].Curr Pharm Biotechnol,2011,12(1):42-53. [6]OANCEA E,WOLFE J T,CLAPHAM D E.Functional TRPM7 channels accumulate at the plasma membrane in response to fluid flow[J].Circ Res,2006,98(2):245-253.
[7]ABED E,MOREAU R.Importance of melastatin-like transient receptor potential 7 and magnesium in the stimulation of osteoblast proliferation and migration by platelet-derived growth factor[J].Am J Physiol Cell Physiol,2009,297(2):C360-368.
[8]LIU H,LI J,HUANG Y,et al.Inhibition of transient receptor potential melastain 7 channel increases HSCs apoptosis induced by TRAIL[J].Life Sci,2012,90(15/16):612-618.
[9]DU J,XIE J,ZHANG Z,et al.TRPM7-mediated Ca2+signals confer fibrogenesis in human atrial fibrillation[J].Circ Res,2010, 106(5):992-1003.
[10]HINZ B,PITTET P,SMITH-CLERC J,et al.Myofibroblast development is characterized by specific cell-cell adherens junctions[J].Mol Biol Cell,2004,15(9):4310-4320.
[11]HILLS C E,SQUIRES P E.The role of TGF-beta and epithelial-to mesenchymal transition in diabetic nephropathy[J].Cytokine Growth Factor Rev,2011,22(3):131-139.
[12]WILSON S E.Corneal myofibroblast biology and pathobiology: generation,persistence,and transparency[J].Exp Eye Res,2012, 99:78-88.
[13]MALOUF M A,HOPKINS P,SNELL G,et al.An investigator-driven study of everolimus in surgical lung biopsy confirmed idiopathic pulmonary fibrosis[J].Respirology,2011,16(5):776-783.
[14]LEASK A,ABRAHAM D J.All in the CCN family:essential matricellular signaling modulators emerge from the bunker[J].J Cell Sci,2006,119(23):4803-4810.
[15]CHEN Z,TAN W,ZHANG L,et al.Beneficial impact of bFGF antisense therapy in a rat model of pulmonary fibrosis[J].Sarcoidosis Vasc Diffuse Lung Dis,2015,32(1):22-31.
[16]LI LC,LI DL,XU L,et al.High-mobility group box 1 mediates epithelial-to-mesenchymal transition in pulmonary fibrosis involving transforming growth factor-beta 1/Smad 2/3 Signaling[J]. J Pharmacol Exp Ther,2015,354(3):302-309.
[17]NAKAMUTA M,KOTOH K,ENJOJI M,et al.Effects of fibrilor fixed-collagen on matrix metalloproteinase-1 and tissue inhibitor of matrix metalloproteinase-1 production in the human hepatocyte cell line HLE[J].World J Gastroenterol,2005,11(15): 2264-2268.
[18]LEASK A,ABRAHAM DJ.TGF-beta signaling and the fibrotic response[J].Faseb J,2004,18(7):816-827.
[19]FLANDERS KC.Smad 3 as a mediator of the fibrotic response[J]. Int J Exp Pathol,2004,85(2):47-64.
[20]WANG C,SONG X,LI Y,et al.Low-dose paclitaxel ameliorates pulmonary fibrosis by suppressing TGF-beta 1/Smad 3 pathway via miR-140 upregulation[J].PLoS One,2013,8(8): e70725.
[21]YAN X,LIAO H,CHENG M,et al.Smad7 protein interacts with receptor-regulated smads(R-Smads)to inhibit transforming growth factor-beta(TGF-beta)/smad signaling[J].J Biol Chem, 2016,291(1):382-392.
[22]LI H X,LIU H,WANG C M,et al.Artesunate restraining MAPK passage by smad7 to resist pulmonary fibrosis[J].Eur Rev Med Pharmacol Sci,2014,18(21):3199-3204.
[23]SCHMITZ C,DEASON F,PERRAUD A L.Molecular components of vertebrate Mg2+-homeostasis regulation[J].Magnes Res, 2007,20(1):6-18.
[24]SAHNI J,SCHARENBERG A M.TRPM7 ion channels are required for sustained phosphoinositide 3-kinase signaling in lymphocytes[J].Cell Metab,2008,8(1):84-93.
[25]GUILBERT A,GAUTIER M,DHENNIN-DUTHILLE I,et al. Evidence that TRPM7 is required for breast cancer cell proliferation[J].Am J Physiol Cell Physiol,2009,297(3):C493-502.
[26]XU T,WU B M,YAO H W,et al.Novel insights into TRPM7 function in fibrotic diseases:a potential therapeutic target[J].J Cell Physiol,2015,230(6):1163-1169.
(童颖丹 编辑)
Inhibitive effect of TRPM7 on transformation of human lung fibroblasts to myofibroblasts
Li-hua Li,Bin Lu,Hong-ke Wu,Hao Zhang,Fei-fei Yao
(Department of Respirology,the People's Hospital of Zhengzhou, Zhengzhou,Henan 450003,China)
ObjectiveTo investigate the effects of siRNA-induced transient receptor potential channel 7 (TRPM7)on differentiation of human fetal lung fibroblasts to myofibroblasts induced by TGF-β1,providing a new target for the prevention and treatment of pulmonary fibrosis.MethodsWI-38 and MRC-5 cells were cultured and stimulated with TGF-β1.The expressions of smooth muscle actin(α-SMA)and collagenⅠwere detected by Western blot for evaluation of differentiation of fetal lung fibroblasts to myofibroblasts.The mRNA and protein expressions of TRPM7 in the cells were detected by real-time PCR and Western blot.The cells were divided into control group,model group,nonspecific transfected group and TRPM7 siRNA group. Western blot was performed to detect the expressions of α-SMA,collagenⅠ,Smad3,p-Smad3 and Smad7, respectively.ResultsWI-38 and MRC-5 cells were successfully transformed into muscle fibroblasts in the presence of TGF-β1(15 μg/L)for 24 h.Compared with the control group,the up-regulation of TRPM7,α-SMA,collagenⅠ,Smad3 and p-Smad3,and the down-regulation of Smad7 were observed in the model group(P<0.05).Furthermore,the expressions of TRPM7,α-SMA,collagenⅠ,Smad3 and p-Smad3 were remarkably down-regulated in the TRPM7 siRNA group compared with the model group(P<0.05),while TRPM7 siRNA significantly increased Smad7 level compared with the model group(P<0.05).ConclusionsTRPM7 siRNA could restrain differentiation of fetal lung fibroblasts to myofibroblasts to some extent,which may be related to the activation of TGF-β1/Smads signal pathway.
transient receptor potential channel 7;pulmonary fibrosis;lung fibroblast;TGF-β1/Smads signaling
R563
A
10.3969/j.issn.1005-8982.2017.01.007
1005-8982(2017)01-0035-07
2016-01-14

