新型自组装肽纳米纤维支架材料的生物安全性评价*
陈硕,蒋电明,何彬,周敖
(重庆医科大学附属第一医院骨科,重庆400016)
论著
新型自组装肽纳米纤维支架材料的生物安全性评价*
陈硕,蒋电明,何彬,周敖
(重庆医科大学附属第一医院骨科,重庆400016)
目的评价新型自组装肽纳米纤维水凝胶支架材料D-RADA16的生物相容性及安全性,为该材料的临床推广应用提供试验依据。方法根据GB/T 16886.1-2011/ISO 10993-1∶2009《医疗器械生物学评价标准》,选取体外细胞毒性试验、全身急性毒性试验、皮内刺激试验、溶血试验、热源试验、微核试验评价D-RADA16的生物相容性。结果细胞毒性试验中,材料共培养组相对增殖率均>90%,细胞毒性为1级,材料无细胞毒性。溶血试验结果显示,生物材料D-RADA16的溶血率为0.96%,符合<5%的国家标准。各组小鼠活动正常,7d内无小鼠死亡,各组动物未见中毒症状或不良反应,7 d后各组小鼠体质量比较,差异无统计学意义(P>0.05)。7 d后处死动物,肝、脾、肾大体观察和苏木精-伊红染色法染色未见异常。热原试验显示,3只动物体温升高,最高0.5℃,升高总数为1.2℃,符合<1.4℃的国家标准。皮内刺激试验显示,兔各时间点注射肽溶液后原发性刺激指数均为0分。遗传毒性试验显示,各实验组与阴性对照组微核数比较,差异无统计学意义(P>0.05),各实验组与阳性对照组微核数比较,差异有统计学意义(P<0.05),材料未见明显致突变性。结论新型纳米生物支架材料D-RADA16无细胞毒性、溶血作用、急性毒性、致热原性、皮肤刺激性、遗传毒性,具有良好的生物安全性和生物相容性,为材料进一步的细胞生物学研究及临床应用提供理论依据。
自组装肽;右旋氨基酸;细胞毒性;生物安全性
自组装肽(self-assembling peptide,SAP)是一种新型的生物支架材料。1995年ZHANG等[1]首次报道,SAP EAK16-Ⅱ(AEAEAKAKAEAEAKAK),此后各种新型SAP被陆续开发出来并广泛应用于组织工程。目前应用较为广泛的SAP大部分是由L型氨基酸构成,很容易被体内的蛋白酶降解,不能持续稳定地发挥生物学活性作用,限制其应用范围[2]。为提高SAP在体内的稳定性,研究人员开展大量的工作,而采用D型氨基酸来构建SAP是一种很好的解决方案[3]。为此,笔者设计并合成一种新型SAP:D-RADA 16(其氨基酸序列为:AcN-RADARADARADARADA -CONH2),仅由D型氨基酸构成。笔者推测D-RA DA16具有更好地生物学稳定性,特别适用于在体内需要长时间发挥生物学效应的领域,如药物的控制释放、神经修复及诱导成骨等。
然而,生物材料在与人体直接接触或植入人体内时都可能存在一定的风险性;其次,生物材料可能被机体吸收,长期植入活体内可能发生明显的生物降解;再次,生物材料与人体长时间接触,在其缓慢的降解过程中也有可能释放毒性物质。因此,一种生物材料应用于临床前必须经过一系列的生物安全性评价。
本试验根据GB/T 16886.1-2011/ISO 10993-1∶2009《医疗器械生物学评价标准》[4]的生物相容性评价标准选取6个试验,采用体外实验与动物体内实验相结合的方法,评价D-RADA16的生物相容性及安全性,为该材料的临床推广应用提供试验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物7~8周龄健康昆明小鼠50只,雌雄各半,体质量19~25 g;4周龄SD大鼠1只,体质量约160 g,雄性;6周龄新西兰大白兔6只,体质量2.1~2.5 kg,雌性;上述动物均由重庆医科大学试验动物中心提供,实验动物使用合格证:SCXK(渝)2016-0210。
1.1.2 主要材料与仪器自组装肽D-RADA16(上海波泰生物科技有限公司合成),SB-3200D超声震荡清洗仪(宁波新艺超声设备有限公司),草酸钾(四川成都科隆化工试剂厂),苯酚(北京化工厂),环磷酰胺(江苏恒瑞医药股份有限公司),磷酸盐缓冲液(phosphate buffered saline,PBS)(上海碧云天生物技术有限公司),四唑盐(美国Sigma公司),二甲基亚砜(dimethyl sulfoxide,DMSO)(美国Sigma公司),DMEM/F12培养液(美国Hyclone公司),胎牛血清(美国Hyclone公司),0.25%胰蛋白酶(美国Hyclone公司),TE-2000U倒置相差显微镜(日本Olympus公司),超净工作台(苏州安泰空气技术有限公司),隔水式电热恒温培养箱(上海跃进医疗器械厂),Z52型医用低速离心机(河北省保定市安新县白洋离心机厂),高压灭菌锅(日本SANYO公司),600型恒温水箱(金坛市中大仪器厂),移液器(德国Eppendorf公司),全波长酶标仪(芬兰赛默飞世尔公司),万分之一天平(日本岛津公司),超纯水仪(美国Milliore公司)。
1.2 实验方法
1.2.1 肽母液的制备将肽130 mg溶于52 ml超纯水中,配制母液浓度0.25%w/v(2.5 mg/ml),超声震荡30 s,4℃冰箱冷冻保存备用。
1.2.2 材料浸提液制备使用0.9%无菌氯化钠注射液作为浸提介质,浸提比例为每1 ml 0.9%氯化钠注射液中加入0.2 g D-RADA16材料。先取16 ml D-RADA16材料母液,加入少量PBS待其充分形成水凝胶,再加入80 ml 0.9%无菌氯化钠注射液,使水凝胶材料全部没入0.9%无菌氯化钠注射液中,将之放置于有盖的玻璃瓶中,并转移到37℃、5%二氧化碳CO2培养箱中静置,持续浸提72 h后,置于4℃冰箱保存备用。
1.2.3 细胞毒性试验采用GB/T 16886.5-2011体外细胞毒性试验标准进行细胞形态学观察及四甲基偶氮唑盐比色法[3-(4,5-dimethyl-2-thiazolyl)-2, 5-diphenyl-2-h-tetrazolium bromide,MTT]检测肽溶液对大鼠骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)的毒性。取鼠龄4周,体质量约160 g的SD大鼠1只,采用全骨髓培养法体外分离培养BMSCs,传3代后消化细胞,得到终浓度为1×104个/ml的细胞悬液。在96孔培养板中,加入100 μl/孔细胞悬液,置入37℃、5%CO2培养箱中培养24 h。在显微镜下观察细胞贴壁后,弃培养板内原培养液,分材料共培养组(A组),阴性对照组(B组),阳性对照组(C组)3组,每组设12孔。A组加入50 μl/孔肽溶液和50 μl DMEM/F12培养液,B组每孔加入100 μl DMEM/F12培养液,C组每孔加入50μl 64g/L的苯酚溶液和50 μl DMEM/F12培养液。将A、B、C组全部放入37℃、5%CO2培养箱中培养。分别于培养2和4 d时取A、B、C组各6孔,加入MTT溶液20 μl/孔,放入37℃、5%CO2培养中孵育4 h。4 h后吸去孔内液体,加入DMSO 150 μl,低速摇床反应10 min,用酶标仪于波长490 nm测其光密度(optical density,OD)值,并根据以下公式计算细胞的相对增殖率(the relative growth rate,RGR)。
PGR(%)=(实验组平均OD值÷阴性对照组OD值)×100%
细胞毒性标准[5]:分6级评定材料的毒性程度,RGR≥100%为0级;75%~9%为1级;50%~74%为2级;25%~49%为3级;1%~24%为4级;0为5级。
1.2.4 溶血试验采用GB/T 16886.4-2011推荐溶血试验法。取1只健康新西兰大白兔,麻醉后采用含3.2%枸橼酸钠抗凝剂的负压采血管,采用心脏穿刺法获取兔血5 ml。反复颠倒混匀后,立即取抗凝血4 ml加入0.9%无菌氯化钠注射液5 ml稀释,置于37℃、5%CO2、湿度为100%的培养箱中备用。实验分为实验组、阴性对照组、阳性对照组3组。实验组加入浸提液5 ml,阴性对照组加入0.9%无菌氯化钠注射液5 ml,阳性对照组加入蒸馏水5 ml。全部组别置于37℃恒温水浴箱中,30 min后加入稀释兔血0.1 ml。轻摇混匀后继续置于37℃水浴箱中,60 min后2 500 r/min离心5 min,吸取上清液移入96孔板中,用酶标仪测定上清液在波长545 nm处的OD值,每组设6个复孔,取平均值计算溶血率。
溶血率(%)=[(实验组OD值-阴性对照组OD值)÷(阳性对照组OD值-阴性对照组OD值)]× 100%
1.2.5 急性毒性试验采用GB/T16886.11-2011推荐系统毒性试验。取20只7~8周龄的昆明小鼠,将其随机分为实验组、对照组,每组10只,记录每只小鼠的初始体质量。实验组小鼠腹腔注射肽溶液(浓度50 ml/kg),对照组小鼠腹腔注射0.9%无菌氯化钠注射液(浓度50 ml/kg)。在注射后连续观察7 d,每天观察小鼠的进食、活动等一般情况及毒性表现和死亡动物数量,并记录注射后1、2和3 d后小鼠的体质量变化。注射后7 d采用10%水合氯醛以10 ml/kg的剂量处死所有小鼠,切开腹腔,观察各小鼠腹腔内脏器有无腹水、腹腔脏器水肿、脏器粘连或坏死。每组随机选2只小鼠的肝、脾、肾,切片后分别行苏木精-伊红染色法(hematoxylin-eosin staining,HE)染色。
1.2.6 热原试验采用GB/T 16886.10-2011推荐热原试验法。取3只健康新西兰大白兔,体质量2.1~2.5 kg,雌雄不限。开始正式实验前7 d预测兔肛温,1次/h,共4次,体温38.6~39.4℃,最大温差≤0.4℃。根据标准符合实验要求[6]。在相同环境下采用相同饲料饲养。7 d后于相同室温和湿度下开始正式实验。实验前禁食2 h,将肛门体温计插入兔肛门,深度约6 cm,时间约3 min,间隔30 min分别测3次体温,取其平均值为正常体温值。经耳缘静脉按10 ml/kg剂量缓慢注入已预热至37℃的材料浸提液,注射后1、2和3 h测量动物肛温,以3次肛温最高值减去正常体温即为体温升高度数。
1.2.7 皮内刺激试验采用GB/T 16886.10-2011推荐最大剂量耐受法进行皮内刺激试验。取3只健康新西兰大白兔,体质量2.1~2.5 kg,雌雄不限。试验前24h,采用电动剃毛器小心剔除受试兔脊柱两侧各5 cm×30 cm的兔毛,避免造成皮肤损伤。75%乙醇消毒剔除兔毛后的局部皮肤。在受试兔脊柱两侧各选择5个点,每点间隔2.5 cm,在右侧各选取点处皮下注射0.2 ml肽溶液,左侧各选取点处皮下注射0.2 ml 0.9%无菌氯化钠溶液。注射后24、48和72 h注意观察注射点局部及周围皮肤有无红斑和水肿等炎症反应。根据皮内刺激评分系统[7],记录每只受试兔在所有3个试验时间点注射肽溶液后出现红斑和水肿的分数(皮内刺激反应评分见表1)再将所有得到的原发性刺激计分相加,用结果除以3,则为SAP水凝胶支架材料的原发性刺激指数(primarily stimulation index,PII)。其中0.0~0.4分为无刺激,0.5~1.9分为轻度刺激,2.0~4.9分为中度刺激,5.0~8.0分为强刺激。

表1 皮内刺激评分表
1.2.8 遗传毒性试验采用GB/T 16886.3-2011推荐遗传毒性试验法(骨髓微核试验)。取50只健康昆明小鼠,体质量20~25 g,随机分5组:A、B、C 3个试验组,D(阳性对照组)和E组(阴性对照组),每组10只,雌雄各半。A、B、C组腹腔注射肽溶液(浓度分别为12.5、25和50 ml/kg),D组腹腔注射环磷酰胺(浓度60 mg/kg),E组腹腔注射0.9%无菌氯化钠溶液。采用2次给药法,2次给药的时间间隔24 h,于第2次给药后6h采用10%水合氯醛10ml/kg的剂量处死所有小鼠,取胸骨骨髓涂片,吉姆萨(Giemsa)染色。显微镜下观察每只动物1 000个嗜多染红细胞(polychromatic erythrocytes,PCE),计数含有微核的细胞数。
1.3 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料以均数±标准差(x±s)表示,两组比较用t检验,多组比较用单因素方差分析(one-way analysis of variance,ANOVA),若方差齐,则组间两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 细胞毒性试验结果
培养2 d后,实验组A组和阴性对照组B组细胞几乎全部贴壁,折光性强,多为梭形和多角形,并见圆形分裂细胞;阳性对照组C组部分细胞未贴壁,成悬浮的死细胞,已贴壁的部分细胞圆缩化(见图1A~C)。培养4 d,实验组和阴性对照组细胞形态正常,生长旺盛,细胞膜完整,胞体呈长梭形,贴壁良好,整体呈漩涡状改变;阳性对照组细胞数量减少,大部分残存细胞胞体变小成圆形,核固缩,贴壁细胞聚集成团,为中毒形态(见图1D~F)。各组细胞RGR及细胞毒性分级结果见表2。MTT试验证实,D-RADA16与大鼠BMSCs共培养2和4d后,细胞RGR均>90%。依据医疗器械生物学评价标准实施指南[8]规定的标准,D-RADA16的细胞毒性为1级,无细胞毒性。培养2和4 d后,各组OD值比较,经方差分析,差异有统计学意义(F=1 069.745和2 149.382,P= 0.211和0.194)。进一步两两比较,培养2和4 d后,试验组与阴性对照组OD值比较,差异无统计学意义(t=-1.161和-1.215,P=0.273和0.252);试验组与阳性对照组OD值比较,差异有统计学意义(t=41.187和85.792,P=0.000)。各组细胞增殖趋势见图1G。
2.2 溶血试验结果

离心后,实验组与阴性对照组类似,上层液体无色透明,下层为离心得到的红细胞沉淀(见图2);阳性对照组离心后上层液体呈淡红色,下层有较少的红细胞沉淀。试验组、阴性对照组、阳性对照组OD值分别为(0.053±0.003)、(0.052±0.003)和(0.220± 0.005),经方差分析,差异有统计学意义(F=3376.860,P=0.000)。进一步两两比较,试验组与阴性对照组OD值比较,差异无统计学意义(t=0.787,P=0.449);试验组与阳性对照组OD值比较,差异有统计学意义(t= -67.592,P=0.000)。根据医疗器械生物学评价标准实施指南[8]规定的标准,溶血率<5%说明受检材料符合医用材料溶血要求,溶血率≥5%提示受检材料有溶血作用。测得生物材料D-RADA16的溶血率为0.96%,符合<5%的国家标准。
2.3 急性毒性试验结果
各组小鼠观察期内一般情况及进食、进水均正常,未见明显呼吸困难、惊厥、瘫痪及死亡发生。实验组和对照组小鼠体重呈上升趋势。两组小鼠24、48和72 h体质量比较,差异无统计学意义(t=0.003、0.000和0.177,P=0.957、0.997和0.679)(见表3)。7d后处死动物,切开腹腔发现无腹水,腹腔脏器无肉眼可见的粘连及坏死征象,主要腹腔脏器(肝、脾、肾)大体观察和组织切片HE染色未见异常(见图3)。

图1 细胞毒性试验结果

图2 试验组、阴性对照组、阳性对照组离心后大体观察
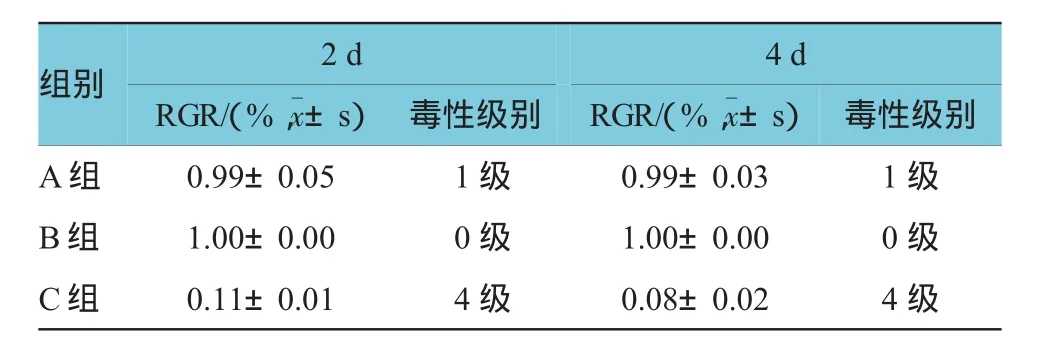
表2 各组BMSCs增殖活力比较(n=6)

图3 急性毒性试验结果
2.4 热原试验结果
3只动物注射材料浸提液前,体温分别是(39.13± 0.17)、(39.30±0.08)和(39.27±0.09)℃,注射材料浸提液后,3个时间点所测最高体温分别为39.6、39.6和39.7℃,3只动物体温分别升高为0.5、0.3和0.4℃,均<0.6℃,升高的总数为1.2℃,符合<1.4℃的国家标准。
2.5 皮内刺激试验结果
3只新西兰大白兔在注射肽溶液后24、48和72 h,右侧注射点出现的炎症反应情况与左侧各注射点注射0.9%无菌氯化钠溶液的情况类似,未见明显刺激反应(见图4),无明显红斑、局部水肿或皮肤异常坏死等情况发生,24、48和72 h原发性刺激指数均为0分。
2.6 遗传毒性试验结果
各组小鼠胸骨髓嗜多染红细胞的微核数见表4。雌性及雄性组分别行方差分析,雌性各组微核数比较,差异有统计学意义(F=95.750,P=0.000)。进一步用两两比较经LSD-t检验,各实验组(A、B、C组)微核数分别与阴性对照组(E组)比较,差异无统计学意义(t=0.535、0.535和0.001,P=0.713、0.713和1.000);A、B、C组微核数分别与阳性对照组(D组)比较,差异有统计学意义(t=-11.159、-11.159和-12.124,P= 0.000)。
雄性各组微核数比较,差异有统计学意义(F= 111.667,P=0.000)。进一步用两两比较LSD-t检验,A、B、C组微核数分别与E组比较,差异无统计学意义(t=0.447、1.897和0.632,P=0.672、0.211和0.672);A、B、C组微核数分别与D组比较,差异有统计学意义(t=-12.333、-13.510和-14.241,P=0.000)。

表3 两组不同时间点材料对动物体质量的影响(n=10,g,x±s)
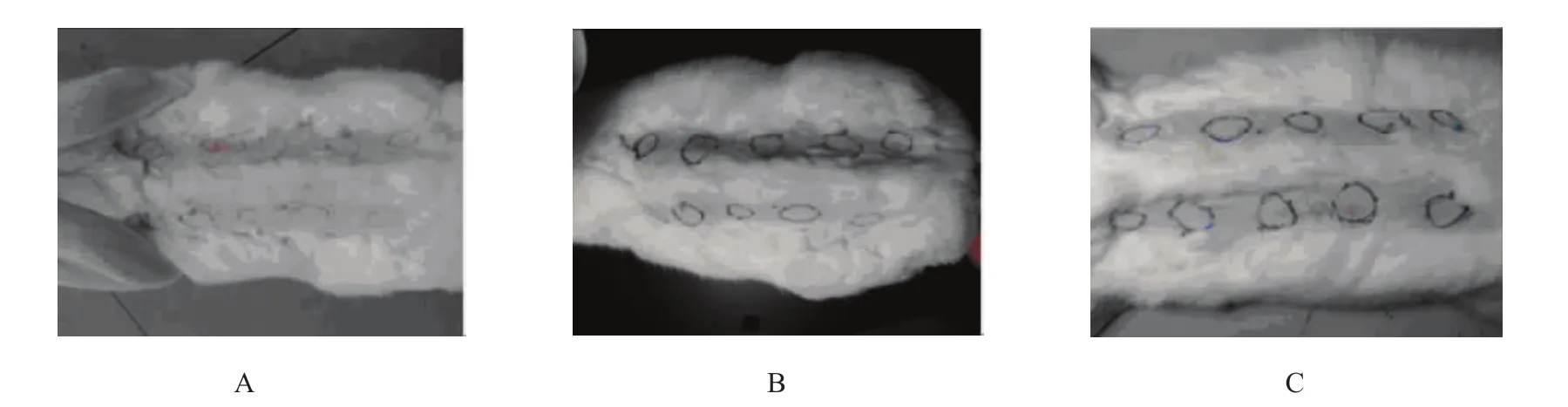
图4 不同时间新西兰大白兔注射局部及周围皮肤组织反应
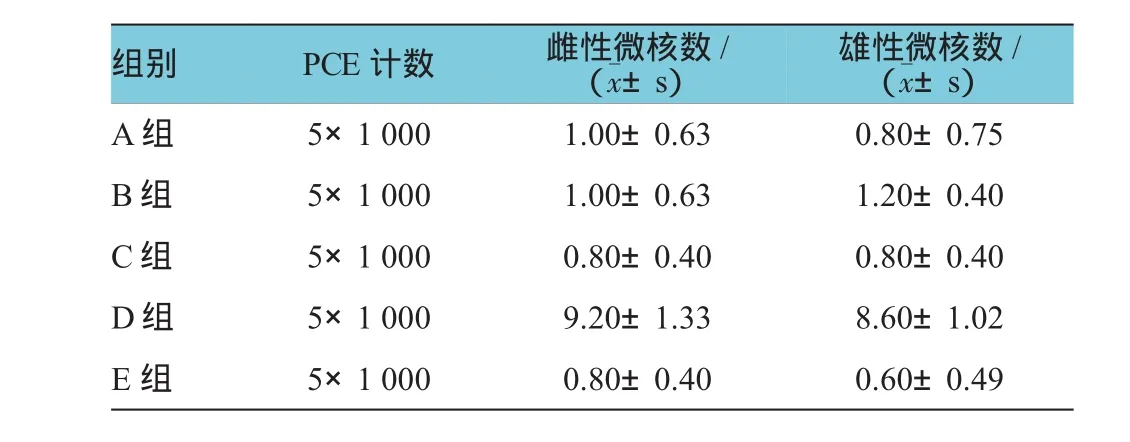
表4 小鼠骨髓嗜多染红细胞微核试验结果(n=5,个,x±s)
3 讨论
作为一种新型纳米生物支架材料,SAP可在阳离子存在的水溶液中形成宏观的水凝胶,以及微观的纳米纤维结构,纳米纤维进一步形成三维网状支架结构[1]。原子力显微镜和扫描电镜显示,其孔径约为5~200 nm,其纤维直径约为10 nm,作为细胞培养的支架,可实现真正意义上的三维培养要求[3]。此后,SAP作为一种具有极佳应用前景的纳米纤维支架材料,逐步被应用于再生医学和组织工程的各个领域,如骨修复、软骨修复、神经修复、心脏修复、创伤愈合、成血管、快速止血等等[9-13]。但一直以来,研究人员更倾向于使用L型即左旋氨基酸设计左旋自组装肽构建纳米纤维支架,用于组织工程的三维微环境构建[14]。然而,D型即右旋氨基酸构成的肽链及蛋白质更加稳定,因为蛋白酶可以降解L型肽链,但不能降解D型肽链[14-15]。
SAP在水溶液中可吸收大量水分凝胶化,从而使水分充斥于纳米纤维的三维网状结构中,较大程度地伸展被交联的大分子肽链,使整个材料形成含水量极高(>99%)的水凝胶结构,这与充盈大量液体的机体组织及其相似。水凝胶材料柔软、湿润的表面,以及与组织的亲和性大大减少材料对于机体的刺激性。因此,一般认为SAP材料具有良好的生物相容性。
然而,任何一种生物材料在获准临床应用之前,首先应该具备使用的安全性和良好的生物相容性,而体内外实验是目前评价材料生物安全性的主要手段[16]。作为一种新型材料,D-RADA16的安全性尚不明确。显而易见,D-RADA16的降解产物是D型氨基酸。目前已知一些D型氨基酸对细胞的生长有毒性和抑制作用,如D-丙氨酸和D-天冬氨酸[17]。为确保新型生物材料D-RADA16在临床应用时的安全性,必须进行生物学评价试验,以便提供进一步有关安全性的数据和资料。
医疗器械生物学评价系列标准(即GB/T16886/ IS010993)是医疗器械安全性评价两大基础标准之一,对于保证医疗器械安全性发挥重要作用。为保证本研究的规范性、时效性及结果的准确性,笔者依据最新版本GB/T 16886.1-2011/ISO 10993-1∶2009《医疗器械生物学评价标准》规定和推荐的评价生物材料生物安全性的主要体内外实验方法,选择细胞毒性试验、溶血试验、急性毒性试验、热原试验、皮内刺激试验、微核试验对D-RADA16的生物安全性和生物相容性进行全面评价。
细胞毒性试验采用体外细胞培养技术,测定由材料导致的细胞溶解或死亡,以及对细胞生长的抑制和其他影响。该试验属体外试验,能在短期内检出材料对细胞新陈代谢的影响,对毒性物质具有较高的敏感性,同时可直接观察到细胞在材料表面的粘附情况及界面反应,可为材料的细胞相容性提供最直观的证据[18],从而能快速筛选材料,是所有生物学试验中首选的项目。本研究通过倒置相差显微镜观察到D-RADA16水凝胶支架材料与BMSCs共培养2和4 d后,细胞生长旺盛,形态正常,整体呈漩涡状改变。MTT试验进一步证实其细胞RGR均>90%,根据《医疗器械生物学评价标准》,生物材料D-RADA16对大鼠BMSCs的细胞毒性为1级,说明该材料无细胞毒性。
溶血试验评价血液接触材料后的相互作用,被认为是细胞毒性评价的一个补充实验,同时也是医疗器械生物学安全性测评中最为常用的实验。本研究中实验组及阴性对照组涂片镜检均未见红细胞破裂或凝聚。酶标仪检测OD值后计算出D-RADA16的溶血率为0.96%,符合溶血率<5%的国家标准,说明D-RADA16材料溶血性符合安全标准,无溶血作用。
急性全身毒性试验是体内试验之一,根据材料与人体的接触途径,将材料在24 h以内通过静脉注射、口服、腹腔注射或吸入、皮肤接触等途径作用于受试动物体内,观察动物的全身反应,从而评价医疗器械是否释放毒性物质。其优点包括程序简单,成本低,用时省,广泛适用于短期或长期应用于体内的器械。本研究中结果显示实验组与对照组比较,小鼠一般状况良好,体质量正常增加。7 d后处死动物,大体观察和组织切片HE染色均未见异常。另外该部分实验还包括热原试验,检测材料的致热反应。其方法是将一定量的材料浸提液经静脉途径注入动物体内,在规定时间点监测动物体温变化,以确定浸提液中的热原量是否符合要求。本试验中各观察时间点兔体温升高均<0.6℃,升高的总数为1.2℃,符合<1.4℃的国家标准,说明材料D-RADA16对受试动物无致热作用。
皮内刺激试验属体内试验,方法相对比较成熟,敏感性较高,因此为各类医用材料及器械必须评价的项目之一。试验结果显示实验组与对照组各时相点注射后反应情况相似,未见皮肤刺激反应,说明材料D-RADA16无刺激性。
本课题组选用GB/T 16886.5-2011/ISO 10993-5:2009标准中推荐的短期遗传毒性试验做初步筛选,如果短期试验阴性可暂不进行致癌试验。小鼠骨髓嗜多染红细胞核试验是目前应用最为广泛的微核试验。在众多的致突变初筛试验中,该试验经济、简单、快速,尤适用于检验材料可浸出成分的潜在致突变性[19]。实验结果显示,各实验组小鼠骨髓微核试验阴性,表明材料D-RADA16不具有致染色体畸变作用。
综上所述,依据GB/T 16886.1-2011/ISO 10993-1:2009《医疗器械生物学评价标准》最新版本所规定和推荐的体内外实验方法,选择细胞毒性试验、溶血试验、急性毒性试验、热原试验、皮内刺激试验、遗传毒性试验对D-RADA16的生物安全性和生物相容性进行全面评价,得到如下结论:新型SAP纳米纤维水凝胶支架材料D-RADA16无细胞毒性、溶血作用、急性毒性、致热原性、皮肤刺激性、遗传毒性,具有良好的生物安全性和生物相容性,具有广阔的临床应用前景。本研究为材料D-RADA16下一步的细胞生物学研究及临床应用提供理论依据。
[1]ZHANG S,HOLMES T C,DIPERSIO C M,et al.Self-complementary oligopeptide matrices support mammalian cell attachment[J]. Biomaterials,1995,16:1385-1393.
[2]TAVAKOL S,SABER R,HOVEIZI E,et al.Chimeric self-assembling nanofiber containing bone marrow homing peptide's motif induces motor neuron recovery in animal model of chronic spinalcordinjury,aninvitro andinvivo investigation[J]. Molecular Neurobiology,2016,53(5):1-11.
[3]LUO Z,YUE Y,ZHANG Y,et al.Designer D-form self-assembling peptide nanofiber scaffolds for 3-dimensional cell cultures[J]. Biomaterials,2013,34:4902-4913.
[4]奚廷斐.医疗器械生物学评价标准[M].北京:中国标准出版社, 2012:90-92.
[5]全仁夫,杨迪生,苗旭东,等.二氧化锆梯度复合羟基磷灰石的生物相容性研究[J].中国修复重建外科杂志,2006,20:569-573.
[6]国家药典委员会.中华人民共和国药典2005版[M].北京:化学工业出版社,2005:66.
[7]RUDRA J S,SUN T,BIRD K C,et al.Modulating adaptive im-mune responses to peptide self-assemblies[J].ACS Nano,2012,6: 1557-1564.
[8]郝和平.医疗器械生物学评价标准实施指南[M].北京:中国标准出版社,2000:81-110.
[9]WANG B,WU Y,SHAO Z,et al.Functionalized self-assembling peptide nanofiber hydrogel as a scaffold for rabbit nucleus pulposus cells[J].Journal of Biomedical Materials Research Part A, 2012,100A:646-653.
[10]LIU X,WANG X,HORII A,et al.In vivo studies on angiogenic activity of two designer self-assembling peptide scaffold hydrogels in the chicken embryo chorioallantoic membrane[J]. Nanoscale,2012,4:2720-2727.
[11]SOLER-BOTIJA C,BAGO J R,LLUCIA-VALLDEPERAS A,et al.Engineered 3D bioimplants using elastomeric scaffold,self assembling peptide hydrogel,and adipose tissue-derived progenitor cells for cardiac regeneration[J].American Journal of Translational Research,2014,6:291-301.
[12]WU M,YE Z,ZHU H,et al.Self-assembling peptide nanofibrous hydrogel on immediate hemostasis and accelerative osteosis[J]. Biomacromolecules,2015,16:3112-3118.
[13]BRADSHAW M,HO D,FEAR M W,et al.Designer self-assembling hydrogel scaffolds can impact skin cell proliferation and migration[J].Scientific reports,2014,4:6903.
[14]HE B,YUAN X,JIANG D.Molecular self-assembly guides the fabrication of peptide nanofiber scaffolds for nerve repair[J]. RSC Advances,2014,4:23610-23621.
[15]NAGY K J,GIANO M C,JIN A,et al.Enhanced mechanical rigidity of hydrogels formed from enantiomeric peptide assemblies[J].Journal of the American Chemical Society,2011,133: 14975-14977.
[16]MOUTOS F T,FREED L E,GUILAK F.A biomimetic three dimensional woven composite scaffold for functional tissue engineering of cartilage[J].Nat Mater,2007,6:162-167.
[17]FISHER G H,D'ANIELLO A,VETERE A,et al.Free D-aspartate and D-alanine in normal and Alzheimer brain[J].Brain Research Bulletin,1991,26:983-985.
[18]PIOLETTI D P,TAKEI H,LIN T,et al.The effects of calcium phosphate cement particles on osteoblast functions[J].Biomaterials,2000,21:1103-1114.
[19]苏保,蒋电明,严永刚,等.氨基酸聚合物/硫酸钙生物工程骨的生物相容性研究[J].第三军医大学学报,2011,33:40-44.
(童颖丹 编辑)
Biological safety of designer self-assembling peptide nanofiber hydrogel scaffolds*
Shuo Chen,Dian-ming Jiang,Bin He,Ao Zhou (Department of Orthopedics,the First Affiliated Hospital of Chongqing Medical University,Chongqing 400016,China)
ObjectiveTo evaluate the biological safety of designer self-assembling peptide(SAP)nanofiber hydrogel scaffolds D-RADA16,so as to provide experimental evidence for the clinical application of the material.MethodsAccording to Biological Evaluation of Medical Devices(GB/T 16886.1-2011/ISO 10993-1: 2009),physiological saline lixivium of the biomaterial or the hydrogel biomaterial was used for in vitro cytotoxicity test,hemolysis test,acute toxicity test,pyrogen test,intradermal irritation test,and micronucleus test to evaluate the biocompatibility of the material.ResultsIn the cytotoxicity test,the relative growth rate of the experimental group was above 90%,and the toxicity of D-RADA16 was graded 1,indicating no cytotoxicity. The hemolysis rate of the lixivium was 0.96%,which was lower than the national standard(<5%).The activity of mice was normal in the acute toxicity test.No animal died and no toxicity symptom or adverse effect was shown within 7 d.The increase of average daily weight showed no statistically significant difference between the experimental group and the control group after 7 d(P>0.05).The mice were sacrificed after 7 d,and no abnormal changes were observed in general observation and HE staining of the liver,spleen or kidneys.Themaximum increase of the body temperature in the experimental group was 0.5℃,and the total increase of body temperature of the three experimental animals was 1.2℃,which met the national standard in the pyrogen test(<1.4℃).Intradermal irritation test showed that the primary irritation index was 0 at every defined time point.In the micronucleus test,the results showed that there was no statistically significant difference at micronucleus number between the experimental groups and the negative control group(P>0.05),and there were statistically significant differences between the experimental groups and the positive control group(P<0.01). Therefore,potential mutagenicity was not observed in the micronucleus test.ConclusionsDesigner SAP hydrogel scaffolds D-RADA16 does not have cytotoxicity,hemolytic effect,acute toxicity,pyrogenicity,skin irritation or genetic toxicity.It has good biological safety and biocompatibility,therefore exhibits a promising clinical application prospect and provides theoretical basis for further research of cell biology study and clinical application.
self-assembling peptide;D-amino acid;cytotoxicity;biological safety
R318.08
A
10.3969/j.issn.1005-8982.2017.01.004
1005-8982(2017)01-0016-08
2016-04-12
国家自然科学基金(No:81472057)
蒋电明,E-mail:jdm571026@vip.163.com
陈硕,现工作单位为四川省都江堰市人民医院骨科

