血必净对爆炸致家兔急性肺损伤的保护作用及其机制研究*
黄鑫,郝建,李树雯,马宏昊,李鲁欢,贺慧博,李成恩
(1.安徽医科大学解放军杭州临床学院,浙江杭州310007;2.浙江省杭州一二八医院心肺康复科,浙江杭州310007;3.中国科学技术大学近代力学系,安徽合肥230027)
论著
血必净对爆炸致家兔急性肺损伤的保护作用及其机制研究*
黄鑫1,郝建2,李树雯2,马宏昊3,李鲁欢2,贺慧博1,李成恩1
(1.安徽医科大学解放军杭州临床学院,浙江杭州310007;2.浙江省杭州一二八医院心肺康复科,浙江杭州310007;3.中国科学技术大学近代力学系,安徽合肥230027)
目的探讨血必净对爆炸致家兔急性肺损伤(ALI)时肺组织核转录因子-κB(NF-κB)活性的影响及其对ALI的作用机制。方法将32只清洁家兔随机分为4组,每组8只。对照组(NS)、ALI组、低剂量血必净干预组(L-XBJ)和高剂量血必净干预组(H-XBJ)。爆炸致伤家兔,复制ALI动物模型后,L-XBJ、H-XBJ组分别注射10和20 ml/kg血必净溶液,NS、ALI两组注射等量生理盐水。24 h时采集静脉血及部分肺组织,测定肺湿干重比(W/D),酶联免疫吸附法检测血清中肿瘤坏死因子-α(TNF-α)、白细胞介素6(IL-6)、白细胞介素10(IL-10)水平,Western blot检测肺组织NF-κB蛋白表达量,逆转录聚合酶链反应检测肺组织NF-κB mRNA表达水平,光镜下观察肺组织病理学改变。结果L-XBJ、H-XBJ组W/D小于ALI组并呈浓度依赖性。与ALI组比较,血必净可以降低血清中TNF-α、IL-6含量,降低NF-κB mRNA和蛋白表达,提高IL-10含量。肺病理切片显示,ALI组肺组织严重出血、水肿及大量炎症细胞浸润,L-XBJ、H-XBJ组肺损伤程度明显减轻。结论血必净干预能显著下调促炎因子TNF-α、IL-6水平及上调抗炎因子IL-10水平,并抑制NF-κB活化,阻断其介导的炎症反应通路,减轻ALI,保护肺组织。
血必净;急性肺损伤;爆炸伤;核转录因子-κB
急性肺损伤(acute lung injury,ALI)是指心源性以外的各种肺内外致病因素导致的急性低氧性呼吸功能不全或衰竭,肺毛细血管内皮细胞和肺泡上皮细胞的损伤而导致的肺部炎症和肺通透性增加是其常见的病理特征。爆炸伤是ALI的常见致病因素之一,无论是战争引起的爆炸伤,还是和平环境中火灾、金属粉尘等爆炸伤均可导致肺微血管和肺泡上皮的大范围损伤,各种炎症细胞、炎症介质、肺泡内蛋白的渗出增多,肺间质及肺泡水肿,进而导致严重的通气血流比例失调、进行性呼吸窘迫,甚至造成器官组织严重损毁而死亡[1]。作为常见危重病,ALI死亡率高达40%[2],且缺乏有效的治疗经验和方法,严重威胁重症患者的生命安全。研究证实,炎症反应的失控、促炎因子与抗炎因子的失衡是ALI发病的重要机制,其中核转录因子-κB(nuclear transcription factor-κB,NF-κB)作为调控、转录核内众多炎症因子的开关[3],在介导ALI的发生、发展中起着重要作用[4]。盛洁莹[5]和刘佳等[6]针对严重创伤患者的研究表明,血必净在ALI治疗中能够有效地拮抗内毒素,抑制肿瘤坏死因子的失控性释放,清除体内炎症介质,使急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)发生率明显下降,疗效显著。本研究主要通过复制爆炸致家兔ALI模型,观察ALI NF-κB在血必净干预后的活性变化情况,然后对其下游细胞因子水平的变化规律、血必净用于应急救治的临床价值进行分析,并探讨其作用机制。
1 材料与方法
1.1 实验试剂
血必净注射液(天津红日药业股份有限公司),酶联免疫吸附法(enzyme-linked immunosorben assays,ELISA)试剂盒(上海源叶生物科技有限公司),NF-κB、Western blot试剂盒(美国Sigma公司,批号:148G3026),NF-κB逆转录试剂盒(美国Thermo公司,批号:00145205),一种新型总RNA抽提试剂(Trizol)设备(美国Invitrogen公司,批号:14105),引物合成设备(美国Invitrogen公司),山羊抗兔免疫球蛋白G(IgG)(北京中杉金桥生物技术有限公司,批号:109525),山羊抗小鼠IgG(北京中杉金桥生物技术有限公司,批号:109145),荧光定量聚合酶链反应仪(美国Thermo公司,PIKOREAL96)。
1.2 动物分组和ALI模型复制
普通级家兔32只,雌雄各半,重量(2.25±0.25)kg,购于安徽长临河医药科技有限公司,合格证号:SCXK(皖)2006-002,自由喂养。将家兔按随机数字表法分为对照组(NS)、ALI组、低剂量血必净干预组(L-XBJ)和高剂量血必净干预组(H-XBJ),每组8只。实验前所有家兔禁食12 h、禁水4 h,双耳部备皮,耳中塞入脱脂棉球,胸部脱毛以避免兔毛对爆炸冲击波强度产生影响。家兔固定于自制钢质保护箱中,胸部前方箱体处开一窗口,窗口大小与家兔胸部范围一致。头颈部、腹部及四肢等其余部位均保护在箱体内,将保护箱置于空中爆炸容器内并固定。爆炸源采用工业炸药,并将其制成重为35 g的球形药包,爆心距为35 cm,采用标准8号雷管进行引爆,同时保持药包中心、家兔胸部中心和空中压力传感器位于同一水平线。传感器置于距药包35cm处,记录测点处压力时程曲线,爆炸实施过程由专业人员操作和控制[7]。爆炸后,爆炸容器内立即排风换气,迅速取出实验家兔至通风环境下,并实施简单的急救措施,立即检查并缝合胸壁破口,清理呼吸道以保持呼吸道通畅,胸腔穿刺排气减压,静脉注射平衡盐溶液以改善循环,侧卧位观察家兔的精神状态、应激反应等,并记录家兔体温、呼吸、心率、死亡率等情况。模型复制成功后,对实验家兔进行药物干预。治疗药物血必净的剂量参照曹文伟[8]在脓毒症的研究中使用的剂量改良而成。L-XBJ、H-XBJ组分别注射10和20 ml/kg血必净溶液,NS、ALI两组注射等量生理盐水。爆炸后存活<1 h的样本,定为现场死亡。本研究中实验家兔处置方法经安徽医科大学动物伦理学审查通过。
1.3 检测指标及方法
1.3.1 肺湿干重比(W/D)测定分离右肺中叶,生理盐水冲洗,滤纸吸干后称湿重(wet weight,W),湿肺置入80℃烤箱内72 h完全脱水后,再称干重(dry weight,D)。以肺W/D表示肺组织含水量,计算公式为:W/D=湿肺重/干肺重。
1.3.2 血清TNF-α、IL-6、IL-10的测定采集24h静脉血,室温下3 000 r/min匀速离心10 min,收集上清液置于-80℃冰箱冷冻保存。用ELISA检测,操作步骤严格按照试剂盒说明书进行[9]。
1.3.3 肺组织NF-κB蛋白表达检测按照试剂盒说明书,剪取右肺组织,称重,加入从动物组织和动物细胞中抽取的可溶性蛋白细胞裂解液1 ml进行裂解,室温下12 000 r/min匀速离心10 min,收集上清液,即含有组织总蛋白。经电泳、转膜、封闭、一抗孵育、二抗孵育等步骤后,得到蛋白电泳条带。
1.3.4 肺组织NF-κB mRNA表达检测按照试剂盒说明书,采用Trizol法抽提肺组织总RNA,逆转录成cDNA并进行荧光定量PCR反应。反应条件如下:95℃预变性5 min,95℃变性10 s,60℃退火30 s,60℃延伸30 s,共40个循环。选取GAPDH作为内参基因,根据扩增曲线确定Ct值,采用2-△△ct法计算目的基因表达相对值。NF-κB P65引物序列如下,正向引物:5'-TGGTCAGCTCCCTTCTCTGT-3',反向引物:5'-TACCTCCAGCCTGCTTCTGT-3'。
1.3.5 肺组织病理学观察取右下肺中部组织置于10%中性福尔马林中固定,石蜡包埋,苏木精-伊红染色法(hematoxylin-eosin staining,HE)染色,光镜下观察肺组织病理学改变。
1.4 统计学方法
数据分析采用SPSS 17.0统计软件,计量资料以均数±标准差(x±s)表示,采用单因素方差分析(One way ANOVA),组间两两比较用SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组肺W/D,血清TNF-α、IL-6及IL-10比较
爆炸后24 h,各组家兔肺组织W/D,血清TNF-α、IL-6及IL-10比较,经单因素方差分析,差异有统计学意义(P=0.000)。W/D及TNF-α、IL-6经SNK-q检验,ALI组较NS组升高(q=18.286、60.213和25.419,P=0.000),L-XBJ组较ALI组降低(q=8.819、44.763和14.169,P=0.000),H-XBJ组较ALI组降低(q=13.492、53.597和20.631,P=0.000),以H-XBJ组降低最明显(q=4.673、8.834和6.461,P=0.000)。IL-10经SNK-q检验,ALI组较NS组升高(q=6.125,P=0.000),L-XBJ、H-XBJ组均较ALI组升高(q= 3.851和19.860,P=0.000),以H-XBJ组升高最明显(q=16.009,P=0.000)。见表1。
2.2 各组家兔肺组织NF-κB蛋白表达比较
肺组织中NF-κB蛋白表达量ALI组最明显,且随血必净剂量增加,L-XBJ、H-XBJ组的蛋白表达水平逐渐降低。见图1、2。
2.3 各组家兔肺组织NF-κB mRNA表达比较

表1 各组家兔肺W/D,血清TNF-α、IL-6及IL-10含量比较(n=8,x±s)
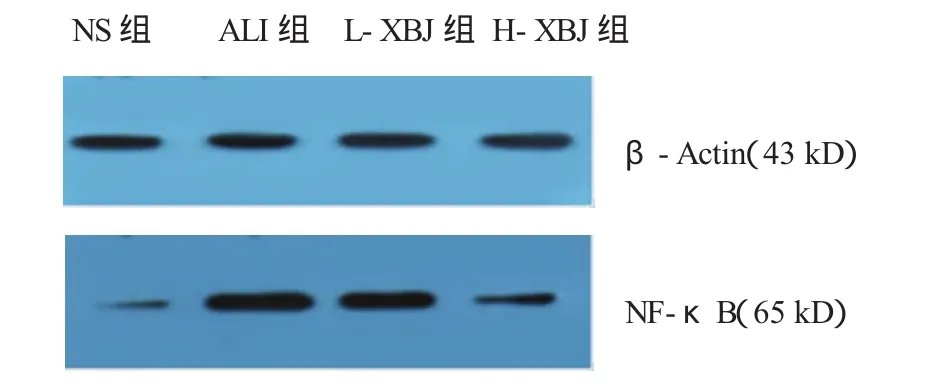
图1 Western blot检测各组NF-κB蛋白表达水平
各组家兔肺组织NF-κB mRNA表达量比较,经单因素方差分析,差异有统计学意义(P<0.05)。经SNK-q检验,ALI组较NS组升高(q=25.756,P= 0.000),L-XBJ、H-XBJ组较ALI组降低(q=11.009和 17.799,P=0.000),且以H-XBJ组降低最明显(q= 6.790,P=0.000)。见表2和图3。

图2 Western blot检测各组NF-κB蛋白表达水平(n=8,x±s)
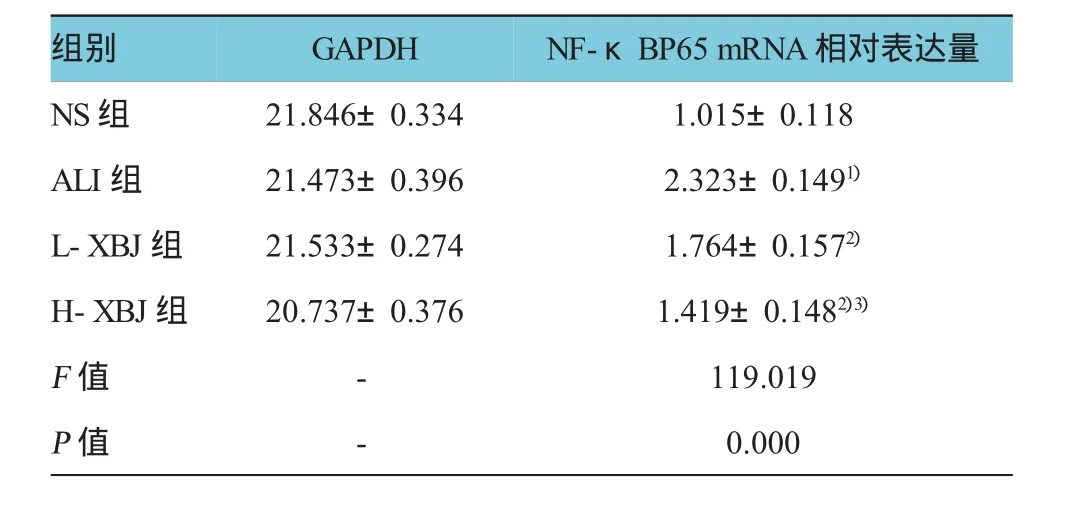
表2 各组NF-κB mRNA表达水平比较(n=8,x±s)

图3 NF-κB mRNA的表达
2.4 各组家兔肺组织病理学改变
光镜下观察:NS组肺组织结构清晰可见,肺泡壁完整,肺泡腔内无出血、水肿液,无炎症细胞浸润,间质无渗出。ALI组肺微血管及肺泡隔毛细血管扩张充血,肺泡壁破裂,肺泡腔和肺泡隔内大量红细胞和液体渗出,可见炎症细胞浸润,肺间质水肿,偶有透明膜形成,肺泡大小不一,可见肺不张及代偿性肺气肿,肺泡间隔明显增厚。L-XBJ、H-XBJ组肺毛细血管扩张充血,肺泡腔出血、渗出,炎症细胞浸润较ALI组明显减轻,以H-XBJ组最为明显,肺间质水肿明显吸收。见图4。

图4 各组家兔肺组织病理学变化(HE×400)
3 讨论
实验前,各组家兔均呼吸平稳,正常饮食、饮水。爆炸致伤后,ALI组家兔呼吸急促,心率加快,口唇、耳部等皮肤黏膜相继呈发绀表现,部分家兔口鼻腔黏膜充血伴泡沫状分泌物,烦躁不安,双肺部干、湿啰音明显,少数家兔出现短暂昏迷,提示爆炸致家兔呼吸功能不全。L-XBJ、H-XBJ组亦存在上述症状,且损伤程度较ALI组减轻,以H-XBJ组最明显。家兔肺组织肉眼观:NS组家兔肺表面呈均匀粉红色,均质,包膜光滑、完整,无破损病灶,切面无液体溢出。ALI组肺表面呈暗红色,体积显著增大,可见广泛出血灶,切面富含蛋白质的粉红色泡沫状液体溢出。L-XBJ、H-XBJ组肺表面呈暗红色,切面充血水肿轻,肺体积较ALI组减小。爆炸后,肺血管内皮细胞和肺泡上皮细胞受损,大量炎症细胞激活、增殖,释放大量蛋白酶、细胞因子等,诱发全身失控性炎症反应,同时导致血管通透性增加,组织液生成和回流失衡,肺水肿及透明膜形成,以及诱发代偿性肺气肿、肺不张等病变,使肺顺应性下降,进而引起肺通气血流比例失调,呼吸困难。本实验中,各组家兔爆炸后呼吸加快、心悸、口唇紫绀、烦躁不安,随后出现肺部啰音、口鼻分泌物、昏迷等症状,伴有呼吸困难、窘迫,肺病理学改变符合ALI病理变化标准[10],提示爆炸致家兔ALI的造模成功。
相关研究表明,炎症介质的激活、释放,炎症反应的失控是ALI疾病发病的本质[11]。而NF-κB作为调控、转录核内众多炎症因子的开关,当机体遭受各种致病因素后,活化的NF-κB促发一系列炎症细胞因子的基因表达,并可诱发全身炎症反应综合征,因此炎症反应的早期干预已成为治疗ALI,保护肺组织的关键。静息状态下,NF-κB多以p50/p65二聚体的形式与其抑制蛋白IκB相结合,以无活性状态存在于胞浆中。当细胞受到脂多糖、TNF-α等信号刺激后,IκB磷酸化后,逐渐与NF-κB分离,NF-κB被激活,活化的NF-κB迅速移位入细胞核与靶基因的特异序列结合,从而启动信号通路和基因转录,诱导相关基因表达。NF-κB通过促发TNF-α、IL-6及继发性炎症因子的转录,启动肺部炎症;反之,TNF-α进一步激活NF-κB,形成正反馈,增加炎症持续应答时间,放大炎症反应。TNF-α由活化的单核/巨噬细胞分泌产生,可诱导中性粒细胞向炎症部位聚集,并释放大量趋化因子,同时激活内皮细胞释放IL-6、IL-8等炎症因子,使炎症反应进一步失控,引起肺组织损伤。IL-6促进巨噬细胞分化,直接损伤血管内皮细胞,QI等[12]认为,IL-6含量增高与肺炎症反应呈正相关。另外,ALI过程中还启动抗炎反应,NF-κB活化后,IκB的含量被上调,核内NF-κB的活性逐渐下降。IL-10是其中最重要的抗炎因子之一,直接抑制炎症免疫应答,同时显著抑制单核巨噬细胞、中性粒细胞表达IL-6、TNF-α等。IL-10可抑制多种炎症细胞活化,维持促炎因子和抗炎因子的平衡状态,减轻肺损伤[13]。本实验显示,ALI组模型复制成功后,W/D,血清NF-κB、TNF-α、IL-6及IL-10水平均明显提高,表明NF-κB参与炎症反应过程,通过调控TNF-α等细胞因子的转录,在ALI的发生、发展中起着重要作用,与文献报道一致。
血必净是由红花、赤芍、当归、丹参等组成的中药复方制剂,WANG[14]和高洁等[15]研究表明,血必净治疗ALI是通过对各种炎症介质的免疫调理作用,调节促炎因子与抗炎因子的平衡,并通过抑制中性粒细胞在肺组织中的渗出和炎症介质的过度表达,从而保护肺组织。肺湿干重比是反应肺组织水肿程度的指标。本实验中,血必净干预组的湿干重比小于ALI组,且高、低剂量组比较,差异有统计学意义,表明高剂量血必净可以减轻爆炸致ALI的病变严重程度,降低血管通透性,减少蛋白和液体的渗出。另外,从数值上看,血必净干预组肺部炎症反应较ALI组明显减轻,表明血必净在ALI早期就能有效下调促炎因子TNF-α、IL-6水平及抑制NF-κB活化,并上调抗炎因子IL-10水平,促进炎症的吸收,修复肺损伤。不同剂量的血必净均能抑制炎症因子的活性,以高剂量的血必净干预效果最为明显。
综上所述,血必净通过抑制NF-κB的活性,阻断其介导的炎症反应通路,减少炎症细胞的迁移与聚集,进而减轻肺部炎症反应及肺水肿,有效阻滞ALI病理进程,保护肺组织。
[1]HAN S H,MALLAMPALLI R K.The acute respiratory distress syndrome:from mechanism to translation[J].The Journal of Immunology,2015,194(3):855-860.
[2]RAN X,CHAO S,JUN-GANG Z,et al.Protective effect of veratric acid on lipopolysaccharide-induced acute lung injury in mice[J].European Journal of Pharmacology,2014,740:227-232.
[3]王金平,李雯,陈佳怡,等.血必净注射液对脓毒症大鼠肝组织NF-κB基因表达的影响[J].中国临床药理学与治疗学,2014,4: 385-388.
[4]CHENG Z,LI L.Ginsenoside Rg3 ameliorates lipopolysaccha ride-induced acute lung injury in mice through inactivating the nuclear factor-κB(NF-κB)signaling pathway[J].International Immunopharmacology,2016,34:53-59.
[5]盛洁莹.血必净注射液治疗创伤后急性肺损伤的疗效分析[J].中外医疗,2015,18:140-141.
[6]刘佳,朱余兵.血必净对脓毒症急性肺损伤大鼠氧化应激及炎性因子表达的影响[J].现代中药研究与实践,2016,1:33-35.
[7]范崇熙,张志培,程庆书,等.胸部爆震伤致兔急性呼吸窘迫综合征模型的建立及相关因素分析[J].中国危重病急救医学,2011,23(4): 243-246.
[8]曹文伟.不同剂量血必净急诊治疗脓毒症的疗效分析[J].当代医学, 2013,20:141-142.
[9]王丽君,郝建,赵建,等.抑肽酶对全氟异丁烯致大鼠急性肺损伤的作用[J].中国急救医学,2014,34(6):533-537.
[10]中华医学会重症医学分会.急性肺损伤/急性呼吸窘迫综合征诊断和治疗指南(2006)[J].中华急诊医学杂志,2007,16(4):343-349.
[11]罗晓红,牛小娟,许瑞元,等.血必净治疗高原多器官功能障碍综合征猪模型的疗效及治疗前后肺组织中NF-κB mRNA的表达变化[J].中国急救医学,2015,35(8):730-734.
[12]QI F,LIANG Z X,SHE D,et al.A clinical study on the effects and mechanism of xuebijing in severe pneumonia patients[J]. J Tradit Chin Med,2011,31(1):46-49.
[13]NIE L,WU W,LU Z,et al.CXCR3 may help regulate the inflammatory response in acute lung injury via a pathway modulated by IL-10 secreted by CD8+CD122+regulatory T cells[J]. Inflammation,2016,39(2):1-8.
[14]WANG P,SONG Y L,LIU Z,et al.Xuebijing injection in the treatment of severe pneumonia:study protocol for a randomized controlled trial[J].Trials,2016,17(1):1-11.
[15]高洁,孔令博,刘斯,等.血必净注射液治疗脓毒症及多器官功能障碍综合征的前瞻性多中心临床研究[J].中华危重病急救医学, 2015,27(6):465-470.
(童颖丹 编辑)
Protective effect of Xuebijing on blast-induced acute lung injury in rabbits and its mechanism*
Xin Huang1,Jian Hao2,Shu-wen Li2,Hong-hao Ma3,Lu-huan Li2,Hui-bo He1,Cheng-en Li1
(1.Hangzhou Clinical College of Chinese People's Liberation Army,Anhui Medical University, Hangzhou,Zhejiang 310007,China;2.Department of Cardiopulmonary Rehabilitation, Hangzhou 128 Hospital,Hangzhou,Zhejiang 310007,China;3.Department of Modern Mechanics,University of Science and Technology of China,Hefei,Anhui 230027,China)
ObjectiveTo investigate the effect of Xuebijing on activity of nuclear transcription factor-kB in the lung tissues of rabbits with blast-induced acute lung injury(ALI),and its mechanism.MethodsA total of 32 rabbits were randomly divided into 4 groups:normal control group(NS),ALI group,Xuebijing intervention groups of different doses(L-XBJ and H-XBJ groups).Each group had 8 rabbits.After the establishment of blast-induced ALI model of rabbits,the rabbits in the L-XBJ and H-XBJ groups were intravenously injected with different doses of Xuebijing(10 and 20 ml/kg respectively),while the rabbits in the NS group and the ALI group were injected with normal saline of the same volume.Part of the lung tissues and venous blood were collected at the 24th hour.The wet to dry weight ratio(W/D)was determined.The serum levels of tumor necrosis factor-α(TNF-α)and interleukins(IL-6 and IL-10)were measured by enzyme-linked im-munosorbent assay(ELISA).The expression of NF-κB protein in the lung tissues was evaluated by Western blot.The expression level of NF-κB mRNA in the lung tissues was detected by reverse transcription-polymerase chain reaction(RT-PCR).The pathological changes of the lung tissues were observed under light microscope.ResultsThe dry to weight ratio in the L-XBJ and H-XBJ groups was lower than that of the ALI group in a concentration-dependent manner.Compared to the ALI group,Xuebijing in the treatment groups greatly inhibited the serum levels of TNF-α and IL-6 and decreased the expression of NF-kB mRNA and protein,but increased the content of IL-10.Pathological examination of the pulmonary tissues indicated severe hemorrhage,edema and abundance of inflammatory cell infiltration in the ALI group;the degree of lung damage was obviously reduced in the L-XBJ and H-XBJ groups.ConclusionsThe interference of Xuebijing could significantly down-regulate the levels of proinflammatory cytokines TNF-α and IL-6,up-regulate antiinflammatory cytokine IL-10,inhibit the activation of NF-κB;thus block the inflammatory response pathway, alleviate acute lung injury and protect lung tissues.
Xuebijing;acute lung injury;blast injury;nuclear factor-kB
R563
A
10.3969/j.issn.1005-8982.2017.01.006
1005-8982(2017)01-0029-06
2016-02-29
南京军区医药卫生科研基金(No:14ZD41)
郝建,E-mail:jianhao105@163.com

