一个猪场高致病性PRRSV的分离鉴定
任素芳+郭立辉+李为栋+张召坤+李兴光+崔宝玉+吴家强+张玉玉

摘 要:本研究对一个猪场高致病性PRRSV疑似病例进行了病理剖检、PRRSV N蛋白基因RT-PCR扩增以及序列测定和分析。结果表明,N2号分离株N蛋白核苷酸序列与高致病性毒株(JXA1株、HuN4株、SX-1株、TJM株)的一致性均为99.1%,N3/N4号与高致病性毒株的一致性均为98.9%,由此判定该猪场病猪感染毒株为高致病性PRRSV。该研究结果可为养猪生产中高致病性PRRSV感染的判断提供借鉴。
关键词:病理解剖;PRRS;高致病性PRRSV;RT-PCR;序列测定
中图分类号:S858.285.3文献标识号:A文章编号:1001-4942(2016)12-0129-04
Abstract The suspected cases of highly pathogenic PRRSV from a pig farm were conducted autopsy, the gene sequence of N-protein of PRRSV was amplified by RT-PCR, and then its sequence was determined and analyzed. The identity of the nucleotide sequence of N-protein was 99.1% between the isolate N2 and the highly pathogenic strains (JXA1, HuN4, SX-1 and TJM), and that of isolate N3/N4 was 98.9% with the highly pathogenic strains. The results showed that the infected virus was highly pathogenic PRRSV in the pig farm. This research provided a reference for the diagnosis of highly pathogenic PRRSV infection in swine production.
Keywords Pathological anatomy; PRRS; Highly pathogenic PRRSV; RT-PCR; Sequencing
猪繁殖与呼吸障碍综合征(PRRS)俗称猪蓝耳病,由动脉炎病毒科猪繁殖与呼吸障碍综合征病毒(PRRSV)引起,是一种急性病毒性传染病[1,2]。高致病性PRRSV是我国现阶段猪蓝耳病流行的主导毒株,对猪呼吸系统、繁殖系统、神经系统、免疫系统、消化系统均有强的致病力,有很多猪场因为感染该病遭到毁灭性打击[3-8]。2016年6月份,某自繁自养的猪场发生疫情,该猪场的哺乳仔猪陆续发病,出现眼睑水肿、发热、食欲减退、皮肤发红、呼吸急促等现象,有的可见咳嗽、腹泻、震颤等症状,发病率达到80%,死亡率达到50%以上,使用黄芪多糖、抗生素等治疗效果均不明显。
为了对该猪场病情进行确诊,以便对症治疗,本研究对疑似病例进行病理解剖、RT-PCR扩增及序列测定和分析,以期对PRRSV毒株做出准确判断, 为及时采取有效的控制措施、提高猪的成活率提供依据。
1 材料与方法
1.1 样品采集
对4例病死猪进行解剖,观察病理变化。分别采集各病猪的肾、脾、肺、淋巴结组织各少许,-20℃低温保存备用。
1.2 材料和试剂
PRRSV阳性对照由本实验室保存;RT-PCR一步法试剂盒、DL2000 DNA Marker、凝胶回收试剂盒等购自大连宝生物工程有限公司;PTC-2000型PCR仪购自美国MJ Research公司。
1.3 引物设计与合成
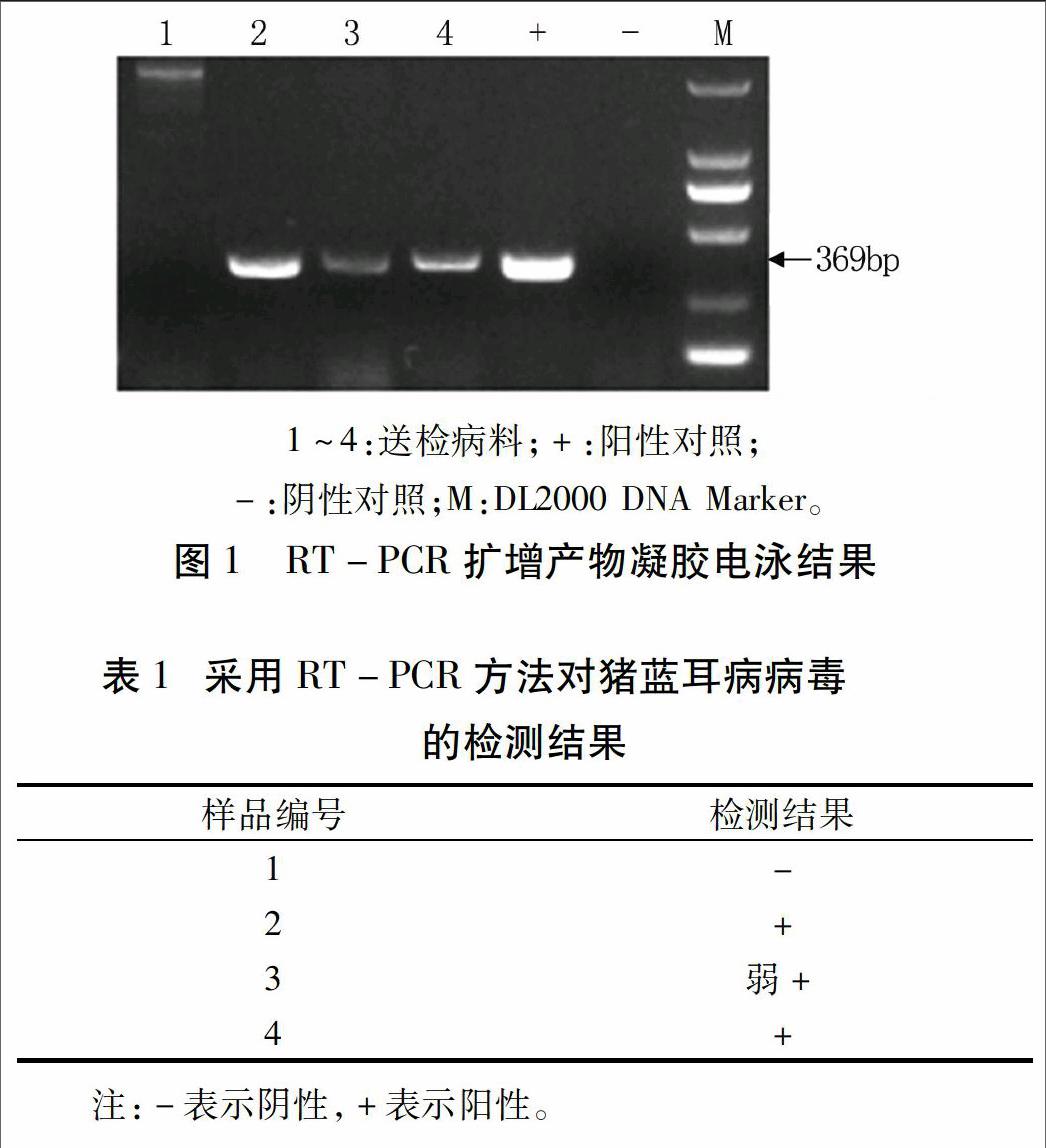
根据PRRSV N蛋白基因序列设计引物,由上海生工生物工程技术服务有限公司合成。引物序列为正向引物F:5′-ATGCCAAATAACAACGG-3′;反向引物R:5′-TGCTGAGGGTGATGCTGT-3′。引物的扩增片段大小为369 bp。
1.4 样品处理与RNA提取
样品RNA的提取参照文献[9],试验操作均在冰盒上完成,所用枪头、离心管均为RNase-free。取约2 g病料加入适量灭菌的PBS溶液(0.01 mol/L,pH 7.4)进行研磨,研磨后反复冻融3次,4℃、5 000 r/min离心2 min;取250 μL上清加入750 μL Trizol和200 μL氯仿,振荡混匀,-20℃静置5 min,4℃、12 000 r/min离心15 min;取500 μL上清加入等量的异丙醇,颠倒数次,-20℃静置20 min,4℃、12 000 r/min离心15 min收集沉淀;75%酒精洗涤沉淀后,20 μL灭菌水溶解沉淀即为样品RNA,-80℃保存备用。
1.5 RT-PCR扩增
RT-PCR扩增采用一步法。反应体系为25 μL,其中:2× 1 Step Buffer 12.5 μL,PrimeScript 1 Step Enzyme Mix 1 μL,上游引物F 1 μL,下游引物R 1 μL,RNA模板3 μL,RNase-free ddH2O 6.5 μL。反应程序为:50℃反转录30 min,95℃预变性1 min;94℃变性1 min,52℃退火1 min,72℃延伸1 min,重复30个循环; 72℃延伸10 min;4℃保存。扩增产物用1%琼脂糖凝胶电泳检测。
1.6 目的基因序列测定与分析
RT-PCR扩增产物送至上海生工生物工程技术服务有限公司进行序列测定。测序结果与GenBank发表的JXA1株、HuN4株、SX-1株、TJM株、NADC30株、SD1株、VR2332株的N蛋白基因序列进行比对,使用DNASTAR软件绘制进化树。
2 结果与分析
2.1 病理变化
剖检该猪场4例病死猪,发现有如下病理变化:淋巴结褐色肿大、有的出血,脾脏有梗死点,肺脏呈红褐花斑状且间质增宽,肾脏紫红色且表面有零星的出血点,喉头及气管充血且含有少量液体泡沫。初步诊断该猪场感染了猪蓝耳病病毒。
2.2 RT-PCR检测结果
采集的4例病料提取RNA后,进行RT-PCR扩增,1%琼脂糖凝胶电泳结果显示,3例病料均有一条369 bp的特异DNA片段,与目的片段大小一致(图1),说明所检病料有3例为PRRSV阳性(表1),且2号和4号病料为强阳性。
2.3 序列测定及分析
2.3.1 序列同源性比对 RT-PCR扩增产物送上海生工生物工程技术服务有限公司进行序列测定,序列命名为20160805_D17_N2_.seq、 20160805_D18-N3N4-.seq。将测定结果与GenBank发表的JXA1株、HuN4株、SX-1株、TJM株、NADC30株、SD1株、VR2332株的N蛋白基因序列进行比对,如图2所示。
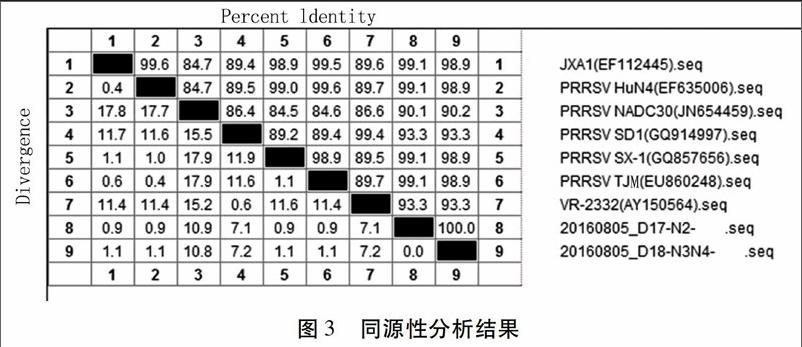
同源性分析结果如图3所示,N2号分离株N蛋白核苷酸序列与高致病性毒株(JXA1株、HuN4株、SX-1株、TJM株)的一致性均为99.1%;与经典毒株(VR2332株、SD1株)的一致性均为 93.3%;与北美强毒株NADC30株的一致性为90.1%。N3/N4(N3、N4号混合)号与高致病性毒株(JXA1株、HuN4株、SX-1株、TJM株)的一致性均为98.9%;与经典毒株(VR2332株、SD1株)的一致性均为93.3%;与北美强毒株NADC30株的一致性为90.2%。
2.3.2 进化树分析 结果如图4所示,20160805_D17-N2- .seq、 20160805_D18-N3N4- .seq与高致病性毒株N蛋白基因序列JXA1(EF112445).seq等处于同一分支,与其余毒株的N蛋白基因序列关系较远。说明所检病料为高致病性PRRSV阳性。
3 讨论与结论
传统的病毒分离鉴定方法是无菌采取病猪的血清或腹水或取肺、扁桃体和脾等组织数小块, 应用猪原代肺泡巨噬细胞培养物或MARC-145或HS2H细胞进行培养,然后再进行鉴定,这种方法费时费力,不适于疾病的快速诊断[10]。本研究通过病理剖检、PRRSV N蛋白基因RT-PCR扩增以及序列测定和分析,证明某猪场PRRSV分离株与高致病性毒株(JXA1株、HuN4株、SX-1株、TJM株)遗传距离比较近,确定该猪场病死猪为高致病性PRRSV感染。
采用临床剖检和实验室检测相结合的手段快速鉴别诊断猪的蓝耳病毒株,为指导养殖场采取相应的紧急防治措施提供了依据,从而减少猪场的经济损失。
参 考 文 献:
[1] Bilodeau R, Dea S, Sauvageau R A, et al. Porcine reproductive and respiratory syndrome in Quebec[J]. Vet. Rec., 1991, 129: 102-103.
[2] Halbur P, Paul P, Meng X, et al. Comparative pathogenicity of nine US porcine reproductive and respiratory syndrome virus (PRRSV) isolates in a five-week-old cesarean-derived, colostrum-deprived pig model[J]. J. Vet. Diagn. Invest., 1996, 8: 11-20.
[3] Li Y, Wang X, Bo K, et al. Emergence of a highly pathogenic porcine reproductive and respiratory syndrome virus in the Mid-Eastern region of China[J]. Vet. J., 2007, 174(3): 577-584.
[4] Tong G, Zhou Y, Hao X, et al. Highly pathogenic porcine reproductive and respiratory syndrome, China[J]. Emerg. Infect. Dis., 2007, 13(9): 1434-1436.
[5] Zhou L, Zhang J, Zeng J, et al. The 30-amino-acid deletion in the Nsp2 of highly pathogenic porcine reproductive and respiratory syndrome virus emerging in China is not related to its virulence[J]. J. Virol., 2009, 83 (10): 5156-5167.
[6] Wu J, Li J, Tian F, et al. Genetic variation and pathogenicity of highly virulent porcine reproductive and respiratory syndrome virus emerging in China[J]. Arch. Virol., 2009, 154(10): 1589-1597.
[7] 安同庆,田志军,李冉,等. 我国高致病性猪蓝耳病病毒的演化分析[J]. 中国兽医杂志,2011,47(4):3-6.
[8] 贾锐,叶佳欣,俞向前,等. 华东地区部分猪场猪繁殖与呼吸综合征病毒检测及其ORF5遗传变异分析[J]. 畜牧与兽医,2014,46(11):68-73.
[9] 张金强,吴家强,孟斌,等. 多重RT-PCR检测PRRSV和CSFV及PRRSV ORF5基因遗传变异分析[J]. 中国兽医学报,2011,31(5):633-637.
[10]吴高锋,李文刚,高卫科,等. 猪繁殖与呼吸综合征诊断及防制研究进展[C]//中国畜牧兽医学会动物传染病学分会猪病防控学术研讨会.2008:20-22.

