人脂肪源性干细胞体外培养和鉴定研究
王 娜
(湖北科技学院五官医学院,湖北 咸宁 437100)
人脂肪源性干细胞体外培养和鉴定研究
王 娜
(湖北科技学院五官医学院,湖北 咸宁 437100)
目的 建立人脂肪源性干细胞分离、体外培养及鉴定方法,以期为组织研究和临床应用提供细胞来源。方法 通过脂肪抽吸术获取人腹壁下脂肪组织,经过PBS液反复冲洗,I型胶原酶消化,采用直接贴壁筛选培养法进行体外培养,从脂肪组织中分离、培养、扩增细胞。相差显微镜观察细胞一般形态学特征,应用MTT法绘制细胞生长曲线,采用流式细胞仪检测细胞表面抗原,检测 CD34、CD45、CD44、CD90表达。结果 流式细胞仪检测表面标志物CD34、CD45表达阴性,CD44、CD90表达阳性。结论 采用直接贴壁培养法进行体外培养可获得生长稳定、增殖能力强的脂肪干细胞。
脂肪源性干细胞;原代培养;流式细胞检测
脂肪干细胞存在于脂肪组织中,具有多方向分化潜能,是一种理想的脂肪组织修复种子细胞[1-3]。有研究报道它们为脂肪细胞和血管的生长提供相关信号,同时也可能参与损伤修复[4]。临床上创伤和肿瘤常常导致软组织的缺损,严重者甚至影响患者器官的外形和功能[5]。脂肪源性干细胞(ADSCs)供给脂肪,移植入体内后排斥反应也较少。本文通过对脂肪干细胞的体外培养与鉴定,以期为组织研究和临床应用提供细胞来源。
1 材料与方法
1.1 实验材料 取自咸宁中心医院院整形外科患者腹部皮下脂肪,采取脂肪抽吸术。志愿者未患肿瘤及全身感染性疾病,共40例,年龄18~35岁,男女比例为4∶1,自愿接受整形外科脂肪抽吸手术,术前未接受放疗、化疗等危害人体细胞的任何治疗,并签知情同意书。
1.2 实验试剂 实验预先准备:0.1%I型胶原酶(碧云天,中国),0.01M磷酸盐缓冲液(PBS液),LG-DMEM培养基(GIBCO,美国),优质胎牛血清(Hyclone,美国),0.25%胰酶-0.02%EDTA(碧云天,中国),小鼠抗人单克隆抗体CD34抗体、CD44抗体及CD45抗体、 CD90抗体(北京四正柏生物科技有限公司),FITC标记羊抗鼠单克隆抗体(invitrogen,美国),双抗(100 U/mL 青霉素、100ng/mL链霉素),MTT(Sigma,美国)。
1.3 实验方法 将获取的脂肪组织立即送至实验室,用无菌PBS液反复冲洗。肉眼下仔细分离去除结缔组织和血管成分,使用无菌眼科剪剪碎组织,以每块组织大小约1mm3为宜。将组织小块移至5mL离心管。向离心管中加入0.1%I型胶原酶,消化60min。离心后向离心管中加入等体积PBS液,约5mL,以1300rpm离心5min,弃上清。将获得的细胞沉淀种植在装有条件培养基(LG-DMEM、10%FBS、100U/mL青霉素、100ng/mL链霉素)的无菌培养瓶中,于37℃、5%CO2、饱和湿度的孵箱内培养。24~48h后,观察细胞贴壁即可进行第一次换液,此后每隔3d换液,待细胞生长至融合后进行传代。将单细胞悬液移至离心管中,离心 (1000rpm,5min),弃上清,加入完全培养基,轻吹使之松散,按1∶2传代培养。选取P3代细胞,待培养瓶中细胞密度约90%时,胰酶消化离心,弃上清后加3mL培养基混匀;另取一支新的15mL无菌离心管,装入约9mL培养基,在3mL细胞悬液中取出1mL加入到离心管中,混匀,此时细胞浓度大约1×105个/mL。将细胞悬液制备好后,轻轻混匀。取5个96孔板,细胞孔设定为6孔,每孔加入100μL,边缘孔用无菌PBS填充,调零孔使用等体积培养基。每隔1d取出一块培养板,吸出培养液,PBS液洗2次,每孔各加入10μL MTT(5mg/mL,即0.5%MTT)溶液,37℃,5%CO2培养箱内温育4h后终止培养。小心吸弃孔内培养上清液,每孔加入150μL二甲基亚砜(DMSO),置摇床上低速振荡10min,使结晶物充分溶解。在酶联免疫检测仪OD490nm处测量各孔的吸光值。
通过胰酶消化将细胞从培养瓶壁上洗脱,制成细胞悬液,收集到离心管中,调整细胞浓度约1×105个/mL,以1000r/min,5min离心,弃上清;加1mL培养基重悬细胞制成单细胞悬液,各取100μL细胞悬液分别加入4支EP管,依次加入小鼠抗人单克隆抗体CD34、CD44、CD45、CD90(1∶100稀释)1μL,避光,冰上孵育30min;PBS液冲洗,确保去掉未结合的抗体。再次加100μL培养液重悬细胞;加入以FITC标记二抗(1∶50稀释)2μL,充分振荡,室温下避光培养1h;PBS液冲洗,离心弃上清,重复操作。加入200μL PBS溶液重悬,流式细胞仪检测。
2 结 果
细胞培养4d后,细胞呈圆形,部分贴壁。每次细胞换液之前,培养基中仍可见悬浮圆球状细胞,换液时将之去除。到第6d,镜下视野细胞贴壁数量明显增多,呈鱼群样生长。细胞由短梭形变为长梭形,细胞胞体狭长,排列有序,此后细胞生长较快,集落数目明显增多,逐渐融合成片状(图1,封二)。第8d细胞相互融合,有时可见满视野细胞密集生长(图2,封二)。
细胞传代之后生长速度变快,增殖迅速,镜下观察细胞背景干净,杂质少,细胞与成纤维细胞生长类似(图3、图4,封二)。3d后细胞数量呈对数增长,细胞融合,旋涡状生长,融合率达90%,传代时间3d左右,此后出现平台期,随着时间的增加,显微镜下可见细胞胞核内黑素增多,细胞体积变大,数量开始减少,第1~5代细胞生长稳定,第6代以后细胞增殖速度开始减慢,细胞质内出现色素沉着,细胞数量更少,培养基内出现杂质。
在不同的时间点(1d,2d,3d,4d,5d,6d,7d)观察P3代人脂肪源性干细胞增殖情况。MTT法检测细胞增殖生长曲线显示,ADSCs在第1、2d增长缓慢,第3d细胞对数生长,随着时间增加而增殖。第6、7d细胞增长处于平台期。整体来看,细胞生长曲线呈现“S”型(图5)。

图5 在不同的时间点观察P3代人脂肪源性干细胞增殖情况
流式细胞仪检测表面标志物CD34,CD45表达阴性,比例分别为4.70%和4.90%;CD44,CD90表达阳性,比例分别为12.47%和84.72%(图6)。表明ADSCs有向其它细胞系分化潜能。
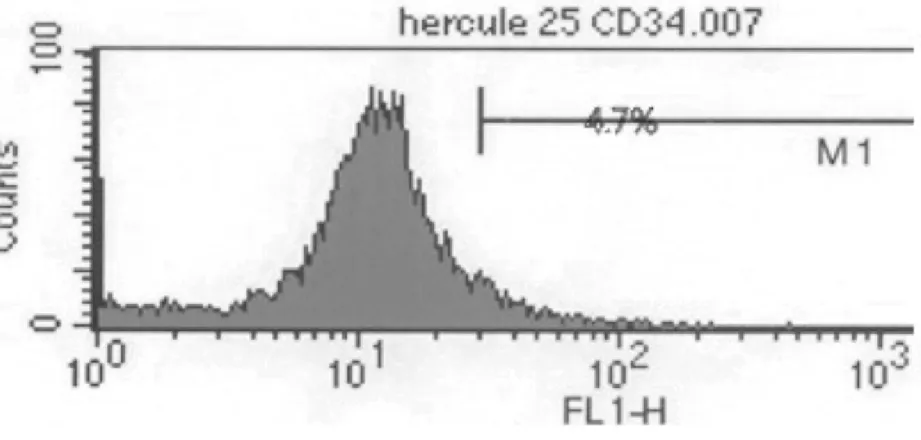

图6 流式细胞仪检测P3代ADSCs表面标记物
3 讨 论
胚胎干细胞(embryonic stem cells,ESCs)来源于胚胎早期或原始性腺,能够分化的细胞系范围广泛,几乎能分化为所有的细胞类型。以目前的技术水平,我们已经能将人的胚胎干细胞成功分离出来。从脂肪组织中获取成体干细胞有它自身的优势:①取材方便,损伤小;②培养后可以行自体移植(因为来自自体可以排除移植后免疫排斥反应);③不受道德伦理学的限制[6-7]。
脂肪源性干细胞分布在血管周围并附着于细胞基质中,有研究报道[4]它们为脂肪细胞和血管的生长提供相关信号,同时也可能参与损伤修复,每年平均大约超过10%的成熟脂肪细胞更替来满足机体组织修复。在体外环境下它表现出更多的功能,人们相信脂肪源性干细胞同样具备向不同细胞系分化的能力。吴尉等[8]通过研究发现人脂肪干细胞分别经过成脂和成骨诱导,可以形成成熟脂肪细胞和矿化结节,进一步证实了脂肪干细胞具有向成脂、成软骨、成骨分化等多向分化潜能。
ADSCs的原代培养生长缓慢,通常种植培养瓶48h后绝大部分细胞仍悬浮,本次实验在种植后60h才进行细胞第一次换液,贴壁细胞椭圆形居多,贴壁不牢靠,细胞生长稀疏。根据实验进展,在细胞P5代以后,显微镜观察细胞内色素沉着,增殖速度逐渐变慢,细胞出现不同程度老化现象。所以提示我们:一方面,实验设计应该同时选取几代细胞进行研究更为科学;另一方面,在应用ADSCs时应选取P5代之前细胞更有利。
本项实验检测的细胞表面标志分子CD34作为造血干细胞特异性表面标志物,流式细胞术检测CD34(-)排除了培养细胞中混有造血干细胞可能。CD45被认为是白细胞共同抗原;CD44介导细胞与细胞,细胞与基质间粘附作用,促进细胞粘附与迁移;CD90是细胞粘附分子免疫球蛋白超家族成员,也是与细胞粘附、分化、细胞间相互作用有关。本次实验结果CD44、CD90均阳性表达。实验中选取的抗体检测数量较少,而且在采用流式细胞术检测细胞表面标志物分子后,实验并没有对干细胞成脂、成骨、成软骨等分化能力进行鉴别。这是实验中的不足之处,希望在后续实验中能得到完善。虽然ADSCs表面标志物分子种类多,也没有特异性标志物,但是总体说来联合抗体检测也不失为好的鉴别ADSCs的方法。
通过本次实验体外培养出干细胞,并且经过鉴定为ADSCs,接下来我们需要研究ADSCs在医学领域发挥作用,怎样将之应用到临床实践中去,这也是后续实验研究方向。
[1]HARRIS C M,LAUGHLIN R.Reconstruction of hard and soft tissue maxillofacial defects[J].Atlas Oral Maxillofac Surg Clin North Am,2013,21(1):127
[2]TSUJI W,RUBIN J P,MARRA K G.Adipose-derived stem ceils:Implications in tissue regeneration[J].World J Stem Cells,2014,6(3):312
[3]PARK A,KIM W K,BAE K H.Distinction of white,beige and brown adipocytes derived from mesenchymal stem cells[J].World J Stem Cells,2014,6(1):33
[4]LEE S K,LEE S C,KIM S J.A novel cell-free strategy for promoting mouse liver regeneration:utilization of a conditioned medium from adipose-derived stem cells[J].Hepatol Int,2015,9(2):310
[5]陈犹白,陈聪慧,脂肪干细胞或脂分化的研究进展[J].中国美容医学,2016,25(4):86
[7]BOWENS K K.The legal status of embryos and implications for reproductive technologies and biotechnology research[J].J Biolaw Bus,2006,9(1):17
[8]吴尉,梁芳,宋小琴,等.人脂肪干细胞的提取和鉴定[J].中国组织工程研究,2015,19(28):4498
Culture and Identification of Human Adipose Tissue Derived Stem Cells in Vitro
WANG Na
(HubeiUniversityofScienceandTechnology,XianningHubei437100,China)
Objective To establish a method for isolation,culture and identification of human adipose-derived stem cell(ADSCs).Methods Abdominal adipose tissue was obtained from human through liposuction,washed with PBS,and then digested with type I collagenaseand cultured in vitro.The morphological characteristics of the cells were observed under a phase contrast microscope.MTT method was used to determine the growth curve and flow cytometry was adopted to detect the expression of surface antigens CD34,CD45,CD44 and CD90.Results The growth curve of human adipose-derived stem cells was opposite-like “S” shape.The stem cells showed strong positive expression of surface markers CD44,CD90 and negative expression of CD34,CD45.Conclusion Direct adherent culture in vitro can obtain adipose tissue-derived steme cells with stable growth and strong proliferation ability.
Adipose-derived stem cells;Primary culture;Flow cytometry
Q813.1
A
2095-4646(2016)06-0468-03
10.16751/j.cnki.2095-4646.2016.06.0468
2016-06-18)

