纳米材料比色分析传感器在食品检测中的应用进展
吕佳,张浩春,张冰,高文超,李兴,常宏宏,魏文珑
纳米材料比色分析传感器在食品检测中的应用进展
吕佳,张浩春,张冰,高文超,李兴,常宏宏,魏文珑
(太原理工大学化学化工学院,山西太原 030024)
近年来食品检测作为食品安全的重要保障而备受关注,特别是简便、灵敏、准确的食品检测手段和方法已成为研究热点。本文简述了食品分析的基本内容和检测方法,在阐述基于模拟酶纳米材料和纳米粒子的两类比色分析传感器构建原理的基础上,介绍了两类纳米材料比色分析传感器在食品添加剂和生物毒素、化学毒素等食品污染物检测中的应用,特别对金属离子、农/兽药残留和非法添加物等化学毒素的检测进行了回顾,最后对基于纳米材料比色分析传感器的发展趋势进行了展望。纳米比色分析传感器可通过溶液颜色变化直观地检测食品中的各类物质,具有灵敏度高、响应快速和易微型化等优点,未来该类传感器应加强与生物复合材料的结合,在实现检测快速化、精准化的同时提高传感器的稳定性。
金银纳米粒子;纳米材料模拟酶;比色分析传感器;食品检测
食品作为人类赖以生存和发展的物质基础,是一个多组分的复杂体系,包含了糖类、油脂、蛋白质、水和矿物质等天然成分,但因后期经历了生产、加工和贮藏等过程,故又会增加部分非天然成分。非天然成分主要包括食品添加剂、环境和加工过程中带入的污染物,因此,食品中除营养成分和一些能赋予食品应有的色、香、味等感官性状的成分外,还含有一些有害成分,当这些成分的含量超过一定限度后就会对人体健康产生危害,并威胁公共安全。据报道,食品导致的疾病是制约不发达国家经济发展的主要原因,食品安全同样也是发达国家最为重视的问题,世界卫生组织(WHO)将食品安全问题位列于优先考虑事项的第11位[1]。基于此,本文对基于纳米材料建立的比色分析传感器及其在检测食品添加剂和食品污染物方面的应用进行 综述。
1 食品分析及其检测方法
1.1 食品分析的内容
食品分析主要包括食品营养成分、食品污染物和食品添加剂等的分析。食品营养成分是赋予食品功能的主要保证。食品添加剂的适量添加有利于保持食品营养成分、改善食品感官、提高产品贮藏性能,但超过一定范围或使用不当则会导致人体出现过敏、慢性或急性中毒等症状。食品污染主要包括霉菌毒素等生物污染和来源于重金属离子、农药或兽药残留、非法添加物等导致的化学污染,其中黄曲霉素、赭曲霉素等生物毒素多存在于未煮熟或变质食品中,其分布广,毒性强,进入人体后会引起中毒并损害内脏、皮肤组织及神经组织等[2];工业或农业废水、敌敌畏或氯霉素等农药残留会致使食品中Cr2+、Cu2+、Hg2+、Pb2+等重金属离子蓄积,这些物质会对人体健康产造成严重危害[3-4]。食品中苏丹红、三聚氰胺等非法添加物的使用会严重影响人体新陈代谢,并导致癌症和大头娃娃等疾病[5]。
由此可见,食品中营养成分、污染物质和添加剂的检测在评价食品功效及毒害作用方面具有十分重要的意义。
1.2 食品分析的方法
目前食品分析的方法主要有感官鉴定法、化学分析法、仪器分析法、微生物分析法和酶检测法等,其中常用方法是仪器分析法。如检测农药残留量时常用气相色谱或气相色谱-质谱联用分析法,检测重金属离子常用原子吸收法,检测黄曲毒素常用薄层色谱法和高效液相色谱法等,此外质谱法和荧光光谱法也是常用的仪器分析法[6]。原子吸收法虽具有测量选择性强、灵敏度高、分析范围广等特点,但精密度低、分析复杂样品的干扰大,且样品前处理复杂;薄层色谱法不需要特殊设备和试剂,具有简便易行、快速、直观、灵活的特点,可同时用于分析多个样品,但灵敏度和准确度均较低;液相色谱、气相色谱及质谱分析法均具有很高的灵敏度,但需要专业技术人员和昂贵的设备作为支撑,难以满足现场快速检测的要求;酶检测法具有特异性强、灵敏度高、方便快捷、分析容量大的优点,但分析成本高、稳定性差,且对保存条件要求较高。鉴于上述原因,进一步研究开发灵敏度高、特异性强、稳定性好、操作简单、成本低的食品检测分析法具有重要的理论意义和实际应用价值,而基于纳米材料的新型比色传感器具有灵敏度高、操作简便等优点而倍受关注,并在食品检测中广泛应用。
2 纳米材料比色分析传感器的分类
以各种反应引起溶液的颜色变化为基础,通过裸眼观察或以分光光度计检测溶液吸光度变化对目标物进行定性定量分析的方法称为比色分析法,该法能够实现微量甚至痕量检测。纳米材料具有独特的光学、电学、磁学及化学性质,在传感技术中引入纳米技术为新型纳米比色传感器的发展提供了更为广阔的空间。
2.1 基于模拟酶纳米材料的比色传感器
基于模拟酶纳米材料构建的比色传感器中纳米材料自身并无光吸收特性,而是引入显色底物后,纳米材料作为催化剂催化底物反应触发光信号输出,从而放大信号提高传感器的灵敏度[7-8]。天然酶因具有专一性好、催化活性高和反应速率快等性质被广泛用于医学、生物、农产品以及食品检测等领域,而纳米材料具有的表面与界面效应、小尺寸和量子尺寸效应、宏观量子隧道效应等特性为模拟酶纳米材料的发展提供了极大的空间。自2007年GAO等[9]发现Fe3O4磁性纳米颗粒具有过氧化物模拟酶活性后,纳米材料的模拟酶催化活性被广泛研究。纳米材料模拟酶与天然酶相比,具有成本低、稳定性好、易制备和保存、结构组成易控制等特点,并且表现出极高的催化活性。目前研究报道的纳米材料模拟酶类型包括过氧化物酶、过氧化氢酶[10]、氧化酶[11]、葡萄糖酶[12]、超氧化物歧化酶[13]、亚硫酸氧化酶[14]、卤素过氧化物酶[15]等,其中过氧化物酶是研究最广泛的纳米材料模拟酶,具备过氧化物模拟酶的纳米材料可分为贵金属纳米材料、金属氧化物、硫化物、碳基材料及混合材料几大类。贵金属纳米粒子主要包括Au[16]、Ag[17]、Pt[18];金属氧化物包括Fe2O3[19]、CeO2[20]、Co3O4[21]、CuO[22]、MnO2[23]、MFe2O4(M = Co,Mn,Zn)[24-26]等;硫化物主要包括CdS[8]、CuS[27]等;碳基纳米材料包括碳纳米管[28]、石墨烯(GO)[29]及C3N4[30]等;混合材料有氧化石墨烯(rGO)-Fe3O4纳米混合物[31]、Au-Fe3O4混合物[32]等。纳米材料过氧化氢模拟酶的催化机理是纳米材料催化过氧化物产生不稳定自由基,自由基因易接收电子而具有强氧化性,极易氧化显色底物发生颜色变化。在比色分析传感器的构建中常用的显色底物主要有四甲基联苯胺(TMB)、邻苯二胺(OPD)和2,2'-联氮-双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS)。其中TMB[33]被氧化后生成蓝色的oxTMB,加入强酸终止液后由蓝色变为黄色,蓝色物质吸收峰的位置在370nm和620~650nm,黄色物质则在450nm左右;OPD被氧化后显橙色,吸光波长一般在492nm[34];ABTS氧化后显绿色,在410nm和650nm处有两个主要特征吸收峰,其空白值较低,但不如OPD和TMB敏感[35]。
2.2 基于纳米粒子的比色传感器
纳米生物复合材料是纳米技术与生物科学的有机融合。纳米材料与生物酶、抗原/抗体和全细胞等生物材料复合制备的生物传感器可利用生物酶的选择性抑制或催化目标物、抗原抗体的特异性结合及全细胞对毒性响应的数量变化等特性达到高灵敏度和专一性检测的目的[36-37],同时结合了纳米材料的高效信号转换和放大功能,表现出其他材料无法比拟的优良性能。贵金属纳米材料[38-39]、氧化石墨烯[40]等由于具有优异的光学和电学性质,良好的生物相容性和易于进行表面修饰等特点而成为应用最为广泛的纳米材料。基于纳米生物复合材料构建的比色传感器在食品领域主要用于噬菌体、病菌和蛋白质等的检测。
金、银等纳米粒子自身具有光吸收特性,会随着识别事件的发生聚合或分散而表现出不同的光学特征。以DNA、多肽、蛋白质等生物大分子修饰纳米金表面,通过交联剂与目标检测物的相互作用调控纳米金聚集状态,根据溶液颜色变化进行定性定量分析。最早报道的基于金属纳米粒子的比色检测是经寡聚核糖修饰的金纳米颗粒检测DNA[41],随之开发了大量针对不同目标物构建的纳米金复合比色分析传感器。LIU等[42]以DNA链修饰纳米金,使用DNA酶连接DNA得到聚合纳米金,而Pb2+通过特异性反应竞争结合DNA酶使纳米金分散,达到比色检测Pb2+的目的。利用类似的工作原理还实现了对汞离子、氢离子、脱氧核糖核酸、腺苷等物质的检测[43-47]。TSENG等[48]以人血清白蛋白修饰纳米金制得分散纳米金溶液,利用溶菌酶与人血清白蛋白之间强烈的静电作用使纳米金聚合的原理实现了对鸡蛋清中溶菌酶的检测。此外,还可先制得稳定、分散的纳米金颗粒,再利用目标物与纳米金颗粒之间的静电作用调控纳米金的聚集状态而实现比色检测,该法可实现DNA、蛋白质等大分子[49-51]和有机配体等小分子[52-53]的检测。另一类纳米金比色传感器主要是针对过氧化氢、抗氧化剂、病原体及糖类化合物等具有还原性的物质[54-57],这类目标物可直接还原氯金酸制备纳米金,使溶液由无色变为红色。
因纳米金比色传感器的成本较高,在应用中受到一定的限制,因此纳米银逐渐引起了关注。当尺寸相同时,银纳米颗粒比纳米金颗粒具有更高的消光系数,成本较低,且以纳米银构建的比色传感器同样表现出很高的灵敏度和选择性。SASTRY等[58]以生物素二硫化物修饰纳米银构建了检测亲和素的比色传感器。LEE等[59]利用寡核苷酸稳定纳米银粒子,当互补碱基序列与修饰纳米银的DNA结合时诱导纳米银颗粒聚合产生颜色变化进而实现对目标物的检测。虽然纳米银的比色传感器表现出良好的应用潜力,但纳米银材料表面易被氧化而出现化学降解等问题[60],因此,目前纳米金/银比色传感器的研发仍主要局限于实验研究阶段。
3 纳米材料比色传感器在食品检测中的应用
3.1 食品添加剂的检测
DELLAPELLE等[61]利用多酚氧化Au3+产生纳米金颗粒(AuNPs)使无色溶液变为红色的原理直接检测巧克力和橄榄油中的多酚。该法无需任何提取技术,检测限低且只需15~20min便可分析出产品的抗氧化性。
亚硫酸盐作为一种广泛使用的食品添加剂,大量食用会导致气喘甚至产生过敏症状。QIN等[62]建立了一种Co3O4-O2-TMB型比色传感器检测百合干、山楂卷及粉丝中的亚硫酸根离子。Co3O4氧化物模拟酶通过加速吸附在其纳米颗粒表面的氧气分子和显色底物TMB之间的电子传递促使TMB被氧化而发生显色反应,Co3O4材料在实现电子传递后又恢复到最初状态。当有亚硫酸根离子存在时,由于其空间位阻小于大分子TMB,会被优先吸附到Co3O4表面而阻止显色反应。该法的线性检测范围为0.2×10−6~1.6×10−5mol/L,最低检测限为5.3×10−8mol/L,在实际食品样品检测中的回收率为93.8%~101.6%。
乙酰胆碱是神经系统中的一种神经递质分子,既可以由人体自身合成也可以从食物中摄取。当人患有精神疾病或老年痴呆等疾病时,人体中乙酰胆碱的活力会下降甚至停止产生,所以为患有精神疾病的病人提供具有确切含量的功能性食品而实现补充乙酰胆碱具有非常重要的意义。QIAN等[63]利用乙酰胆碱酯酶氧化乙酰胆碱产生胆碱,再用胆碱氧化酶氧化胆碱产生过氧化氢,通过Fe3O4NPs/rGO催化过氧化氢氧化TMB显色检测牛奶中乙酰胆碱的含量(原理见图1)。该法检测实际牛奶样品的平均回收率为87.2%~115.2%,具有较高的可信度和实用性。
3.2 生物毒素的检测
赭曲霉素(OTA)是一种常见且非常稳定的霉菌毒素,一般的食品处理过程无法将其消除,欧洲委员会规定谷类食品中OTA的含量不得超过3μg/kg(7.1nmol/L)[64]。RHOUATI等[65]以可与赭曲霉素(OTA)特异性结合的适配体作为稳定介质修饰AuNPs制备稳定的红色金胶溶液。当有OTA存在时,其与适配体特异性结合并使OTA从金纳米颗粒表面脱落,加入NaCl溶液后产生的静电斥力促使AuNPs聚集,溶液颜色由红变蓝,该法检测限可达20nmol/L。WANG等[66]同样以适配体修饰AuNPs制备了更加便捷的比色分析试纸检测OTA,比色试纸条分为样品区、共轭连接区、检测区和吸附区4个部分。待测溶液的毛细作用使得适配体修饰的AuNPs在试纸上迁移,检测区内检测线上的DNA探针1与适配体连接发生颜色变化。控制线上的DNA探针2用于证明检测的有效性,无论检测样品中是否有检测物OTA都会显色。当检测样品中有OTA时,OTA与适配体特异性结合竞争抑制连接AuNPs的适配体与探针1上的DNA连接,OTA含量越高,则连接到控制线上的金纳米颗粒越少,控制线上的颜色也越浅,原理见图2。该法检测时间可控制在10min之内,操作简单,根据裸眼直接观察的半定量检测限可达0.18ng/mL,检测实际样品酒中OTA的回收率为96%~110%。这类试纸型的比色传感器能很好地满足现场快速测量的要求,具有良好的实际应用前景。
WANG等[67]以Au@Fe3O4纳米材料为模拟酶建立了检测谷物和豆类食品中OTA的比色传感器。该法用戊二醛交联剂将具有高亲和力和对OTA有强特异性结合能力的核酸适配体固定在玻璃珠(GB)上,再用戊二醛将DNA连接在Au@Fe3O4纳米球上,最后通过DNA与核酸适配体杂交得到GB-核酸适配体-DNA-Au@Fe3O4混合物。当检测物质中含有OTA时,OTA与核酸适配体特异性结合,而DNA-Au@Fe3O4被竞争下来,Au@Fe3O4纳米颗粒可利用外加磁场回收,而过氧化物模拟酶在过氧化氢存在下氧化TMB发生显色反应,通过测量竞争下来物质的量便可计算出检测物中OTA的含量,原理见图3。该法由于Au与Fe3O4的协同作用增加了模拟酶活性,所以检测限可以达到30pg/mL,运用该法检测花生和谷物中OTA的回收率分别为92%~97.2%、96%~108.1%。
3.3 化学毒素的检测
3.3.1金属离子的检测
WENG等[68]利用L-半胱氨酸包覆金纳米颗粒制备分散、稳定的金胶溶液,并用于检测自来水中的Cu2+。当Cu2+存在时会与L-半胱氨酸形成一种不溶性的硫醇盐而导致AuNPs聚合,溶液由红色变为蓝色,吸收峰由600nm红移至800nm,该法的线性检测范围为30~90μmol/L,检测限为2.23μmol/L。CHAIYO等[69]根据硫代硫酸根离子(S2O32–)刻蚀银纳米颗粒(AgNPs)的原理建立了试纸比色分析法检测西红柿和大米中的Cu2+。S2O32–离子与AgNPs反应时会迅速形成一层惰性物质Ag(S2O3)23–,从而抑制S2O32–离子的刻蚀作用,加入Cu2+检测样品时会形成Cu(S2O3)35–混合物进而加速刻蚀作用。随着AgNPs尺寸的减小,吸收峰发生蓝移,溶液的颜色会由紫红色逐渐变浅。该法具有较高的灵敏度和选择性,最低检测限为0.35ng/mL,检测西红柿和大米中Cu2+的回收率分别为97.76%~119.01%、92.60%~99.04%。ZHOU等[70]用4-巯基苯硼酸(MPBA)中硼酸基团的自脱水缩合诱导AuNPs聚集实现对Hg2+的检测。研究表明Hg2+可优先与MPBA的硫醇基结合,进而抑制MPBA与AuNPs的结合达到阻止AuNPs聚合目的,溶液颜色由蓝色变为红色(原理见图4)。该法检测的线性范围为0.01~5μmol/L,检测限为8nmol/L。
3.3.2农/兽药残留的检测
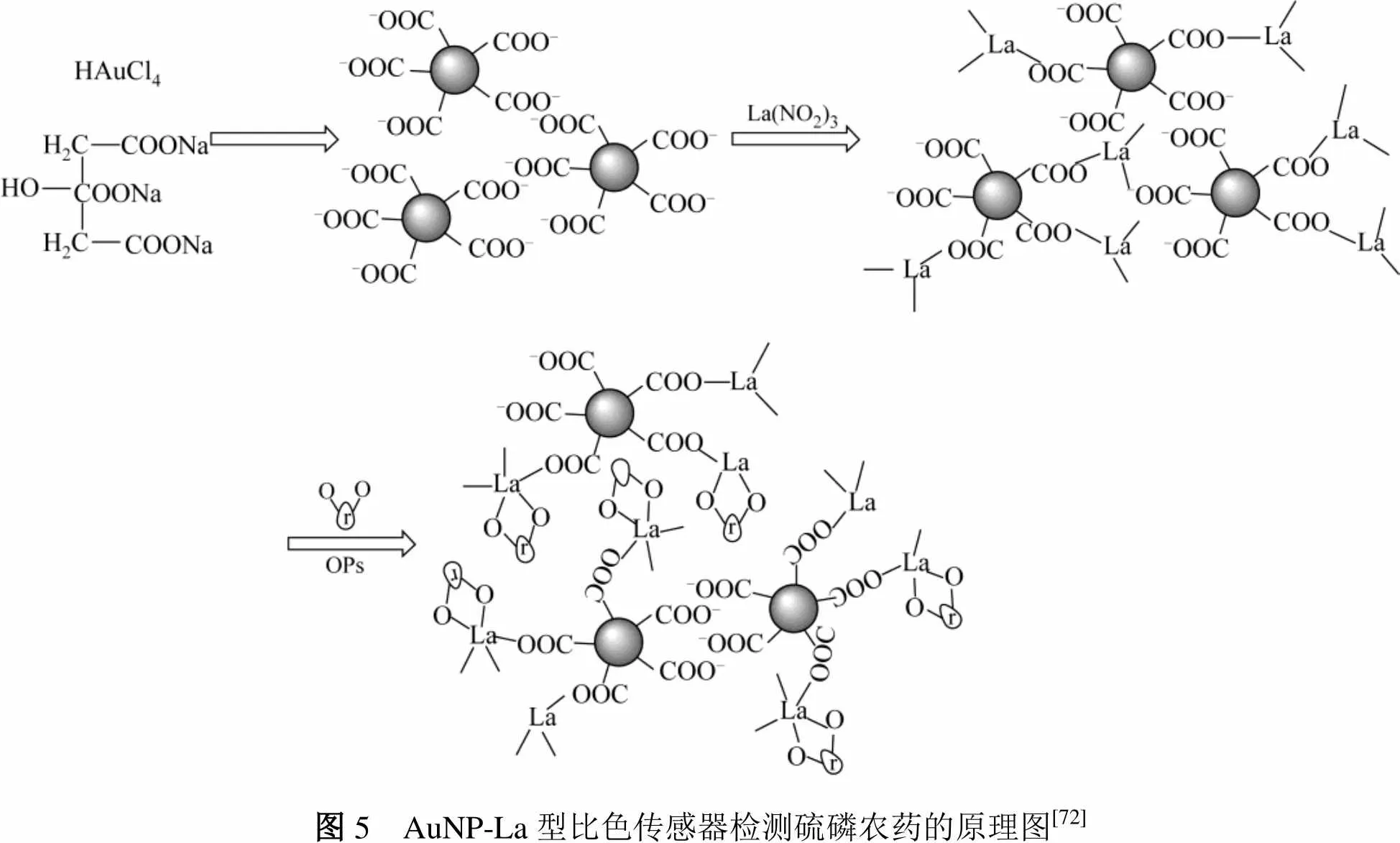
D′SOUZA等[71]建立了以抗坏血酸(AA)修饰AuNPs检测敌敌畏的比色传感器。当检测物中含有敌敌畏时,敌敌畏与AA之间以氢键作用结合导致AuNPs聚合,金胶溶液的颜色由红色变为蓝色,紫外吸收峰发生520nm到620nm的红移,最低检测限为42.94mmol/L,该检测传感器被成功应用于苹果和小麦中敌敌畏残留的检测。WANG等[72]以柠檬酸三钠还原氯金酸制备表面羧基化的AuNPs,加入硝酸镧后AuNPs表面的羧基与La3+结合制得镧离子官能团化的金纳米颗粒比色探针。该方法可检测甲基对硫磷农药的残留。当甲基对硫磷存在时可与La3+结合使金纳米颗粒聚合导致溶液由红色变为蓝色,最低检测限可达到0.1nmol/L,反应原理见图5。该传感器的稳定性好,构建简单,检测限低,具有较好的商业化前景。
XIONG等[73]以P-磺酸杯芳烃4(pSC4)修饰AgNPs制备pSC4-AgNPs型比色传感器检测水胺硫磷杀虫剂,其原理是pSC4有富电子循环腔及负电荷SO3–官能团,水胺硫磷的氨基酸残基在中性介质中质子化,二者之间通过静电作用和共轭效应结合使AgNPs聚沉后产生颜色变化。实验结果显示该法检测水胺硫磷的最低浓度为10–7mol/L。LIANG等[74]建立了Fe3O4MNPs-H2O2-TMB型比色传感器检测有机磷农药。原理是在乙酰胆碱酯酶和胆碱氧化酶催化作用下乙酰胆碱水解产生过氧化氢,过氧化氢在具备过氧化氢模拟酶催化活性Fe3O4MNPs的催化下氧化TMB显色。当目标检测物中含有机磷时,有机磷抑制乙酰胆碱酯酶催化乙酰胆碱产生过氧化氢,产生过氧化氢的量越少,TMB显色越浅。该法可检测到浓度为5μmon/L的高灭磷农药,且传感器的构建简单,但检测过程相对复杂。MIAO等[75]建立了一种信号放大的比色分析传感器检测鱼中的氯霉素(CAP),该传感器由两部分组成,第一部分由固定了硫醇化适配体(Apt)的Fe3O4@Au磁性纳米球构成,在适配体的另一端连接双链DNA(ds-DNA);第二部分为EV-AuNPs-HRP纳米检测器,以高分子聚合物(EV)为主体,AuNPs的作用是固定用于放大检测信号的辣根过氧化物酶(HRP),两部分通过第一部分上的DNA和第二部分上连接双链DNA抗体之间的特异性反应连接在一起。当有CAP存在时,CAP优先与适配体反应取代与其连接的双链DNA,从而使第二部分纳米检测器脱落并溶解到溶液中,而第一部分用磁性分离法便可回收;第二部分检测器中的HRP催化过氧化氢产生自由基氧化TMB显蓝色,最后用紫外分光光度法定量分析CAP的含量,CAP含量越高,反应颜色越深,吸光度值也越大。该法检测实际样品中氯霉素的回收率为85.95%~95.86%。
3.3.3非法添加物的检测
牛奶等奶制品中的三聚氰胺含量超出2563mg/kg时就会对人体健康产生不利影响。BORASE等[76]用一种树叶提取物作为还原剂和封闭剂制得稳定分散的AgNPs,当目标检测物中含有三聚氰胺时,由于三聚氰胺上富电子的氮原子与AgNPs缺电子的表面强烈反应以及三聚氰胺与树叶提取物的协同反应会导致AgNPs快速聚合,溶液由黄色变为红色,具体原理见图6。该法在检测三聚氰胺溶液和牛奶中三聚氰胺的检测限分别为2μmol/L和15μmol/L,远远低于食品要求的检测限。
DING等[77]基于Fe3O4磁性纳米颗粒的模拟酶活性建立了Fe3O4MNPs-H2O2-ABTS型比色分析传感器检测奶制品中的三聚氰胺。该法的原理是三聚氰胺优先与过氧化氢反应,使得在Fe3O4MNPs催化下氧化ABTS显色的过氧化氢量减少,通过检测损耗的过氧化氢量实现对三聚氰胺的定量检测(原理见图7)。在检测牛奶和奶粉中的三聚氰胺时,整个过程用时不超过1h,检测限为2.5mg/kg,在检测牛奶和奶粉中三聚氰胺样品中的回收率为98%~115%,且传感器构建的方法都十分简便。
4 结语
基于金/银纳米材料聚合或分散和模拟酶活性纳米材料建立的各类比色分析传感器被广泛用于检测食品添加剂以及各类食品污染物中,并表现出专一性强、灵敏度高、检测限低、裸眼观察便可得出结论等优点。因此,应加强纳米材料与生物复合材料的结合,同时进一步实现检测的快速化,提高传感器的稳定性,并研制相应的便携检测设备是今后纳米材料传感器的研究重点和发展方向。
[1] ORTIZ D,CALDER N J,BATRES L,et al. Overview of human health and chemical mixtures:problems facing developing countries[J]. Environ. HealthPerspect.,2002,110:901-909.
[2] PRANDINI A,TANSINI G,SIGOLO S,et al. On the occurrence of aflatoxin M1 in milk and dairy products[J]. Food. Chem. Toxicol. 2009,47(5):984-991.
[3] LUO Y,LI Z,YUAN Y,et al. Bioadsorption of patulin from Kiwi fruit juice onto a superior magnetic chitosan[J]. J. Alloys. Compd.,2016,667:101-109.
[4] RENZONI A,ZINO F,FRANCHI E. Mercury levels along the food chain and risk for exposed populations[J]. Environ. Res.,1998,77(2):68-72.
[5] WOLFE M F,SCHWARZBACH S,SULAIMAN R A. Effects of mercury on wildlife:a comprehensive review[J]. Environ. Toxicolo. Chem.,1998,17(2):146-160.
[6] ERDEMIR S,TABAKCI B,TABAKCI M. A highly selective fluorescent sensor based on calix[4] arene appended benzothiazole units for Cu2+,S2−and HSO4−ions in aqueous solution[J]. Sens. Actuators B,2016,228:109-116.
[7] HAYAT A,HAIDER W,RAZA Y,et al. Colorimetric cholesterol sensor based on peroxidase like activity of zinc oxide nanoparticles incorporated carbon nanotubes[J]. Talanta,2015,143:157-161.
[8] LIU Q,JIA Q,ZHU R,et al. 5,10,15,20-tetrakis(4-carboxyl phenyl)porphyrincds nanocomposites with intrinsic peroxidase-like activity for glucose colorimetric detection[J]. J. Mater. Sci. Eng. C,2014,42:177-184.
[9] GAO L,ZHUANG J,NIE L,et al. Intrinsic peroxidase-like activity of ferromagnetic nanoparticles[J]. Nat. Nano-technol.,2007,2(9):577-583.
[10] ASATI A,KAITTANIS C,SANTRA S,et al. pH-tunable oxidase-like activity of cerium oxide nanoparticles achieving sensitive fluorigenic detection of cancer biomarkers at neutral pH[J]. Anal. Chem.,2011,83(7):2547-2553.
[11] ZHANG X,HE S,CHEN Z,et al. CoFe2O4nanoparticles as oxidase mimic-mediated chemiluminescence of aqueous luminol for sulfite in white wines[J]. J. Agric. Food. Chem.,2013,61(4):840-847.
[12] HEX,TAN L,CHEN D,et al. Fe3O4–Au@mesoporous SiO2microspheres:an ideal artificial enzymatic cascade system[J]. Chem. Commun.,2013,49(41):4643-4645.
[13] LI Y,HE X,YIN J J,et al. Acquired superoxide-scavenging ability of ceria nanoparticles[J]. Angew. Chem. Int. Edit.,2015,54(6):1832-1835.
[14] RAGG R,NATALIO F,TAHIR M N,et al. Molybdenum trioxide nanoparticles with intrinsic sulfite oxidase activity[J]. ACS Nano,2014,8(5):5182-5189.
[15] NATALIO F,ANDR R,HARTOG A F,et al. Vanadium pentoxide nanoparticles mimic vanadium haloperoxidases and thwart biofilm formation[J]. Nat. Nano-technol.,2012,7(8):530-535.
[16] JV Y,LI B,CAO R. Positively-charged gold nanoparticles as peroxidiase mimic and their application in hydrogen peroxide and glucose detection[J]. Chem. Commun.,2010,46(42):8017-8019.
[17] JIANG H,CHEN Z,CAO H,et al. Peroxidase-like activity of chitosan stabilized silver nanoparticles for visual and colorimetric detection of glucose[J]. Analyst,2012,137(23):5560-5564.
[18] LI J,LIU W,WU X,et al. Mechanism of pH-switchable peroxidase and catalase-like activities of gold,silver,platinum and palladium[J]. Biomaterials,2015,48:37-44.
[19] MITRA K,GHOSH A B,SARKAR A,et al. Colorimetric estimation of human glucose level using γ-Fe2O3nanoparticles:an easily recoverable effective mimic peroxidase[J]. Biochem. Bioph. Res. Commun.,2014,451(1):30-35.
[20] ASATI A,SANTRA S,KAITTANIS C,et al. Oxidase-like activity of polymer-coated cerium oxide nanoparticles[J]. Angew. Chem. Int. Edit.,2009,48(13):2308-2312.
[21] YIN J,CAO H,LU Y. Self-assembly into magnetic CO3O4complex nanostructures as peroxidase[J]. J. Mater. Chem.,2012,22(2):527-534.
[22] CHEN W,CHEN J,FENG Y B,et al. Peroxidase-like activity of water-soluble cupric oxide nanoparticles and its analytical application for detection of hydrogen peroxide and glucose[J]. Analyst,2012,137(7):1706-1712.
[23] WAN Y,QI P,ZHANG D,et al. Manganese oxide nanowire-mediated enzyme-linked immunosorbent assay[J]. Biosens. Bioelectron.,2012,33(1):69-74.
[24] FAN Y,HUANG Y. The effective peroxidase-like activity of chitosan-functionalized CoFe2O4nanoparticles for chemiluminescence
sensing of hydrogen peroxide and glucose[J]. Analyst,2012,137(5):1225-1231.
[25] BHATTACHARYA D,BAKSI A,BANERJEE I,et al. Development of phosphonate modified Fe(1−x)MnFe2O4mixed ferrite nanoparticles:novel peroxidase mimetics in enzyme linked immunosorbent assay[J]. Talanta,2011,86:337-348.
[26] SU L,FENG J,ZHOU X,et al. Colorimetric detection of urine glucose based ZnFe2O4magnetic nanoparticles[J]. Anal. Chem.,2012,84(13):5753-5758.
[27] DUTTA A K,DAS S,SAMANTA S,et al. CuS nanoparticles as a mimic peroxidase for colorimetric estimation of human blood glucose level[J]. Talanta,2013,107:361-367.
[28] SONG Y,WANG X,ZHAO C,et al. Label-free colorimetric detection of single nucleotide polymorphism by using single-walled carbon nanotube intrinsic peroxidase-like activity[J]. Chem. Eur. J.,2010,16(12):3617-3621.
[29] SONG Y,QU K,ZHAO C,et al. Graphene oxide:intrinsic peroxidase catalytic activity and its application to glucose detection[J]. Adv. Mater.,2010,22(19):2206-2210.
[30] LIN T,ZHONG L,WANG J,et al. Graphite-like carbon nitrides as peroxidase mimetics and their applications to glucose detection[J]. Biosens. Bioelectron.,2014,59:89-93.
[31] QIAN J,YANG X,JIANG L,et al. Facile preparation of Fe3O4nanospheres/reduced graphene oxide nanocomposites with high peroxidase-like activity for sensitive and selective colorimetric detection of acetylcholine[J]. Sens. Actuators B,2014,201: 160-166.
[32] SHEN J,YANG Y,ZHANG Y,et al. Functionalized Au-Fe3O4nanocomposites as a magnetic and colorimetric bimodal sensor for melamine[J]. Sens. Actuators B,2016,226:512-517.
[33] FREY A,MECKELEIN B,EXTERNEST D,et al. A stable and highly sensitive 3,3′,5,5′-tetramethylbenzidine-based substrate reagent for enzyme-linked immunosorbent assays[J]. J. Immunol. Methods.,2000,233(1):47-56.
[34] JIAO K,SUN G,ZHANG S. Enzyme-catalyzed reaction of OPD-H2O2-HRP voltammetric enzyme-linked immunoassay system[J]. Sci. China. Ser. B,1998,41(4):345-352.
[35] CHEN C,ZHAO D,LU L,et al. A simple and rapid colorimetric sensor for sulfide anion detection based on redox reaction of abts with Au(Ⅲ)[J]. Sens. Actuators B,2015,220:1247-1253.
[36] 陈晨,李慧. 生物传感器在食品安全检测中的应用[J]. 现代食品,2016(7):68-69.
CHEN C,LI H. Application of biosensors in food safety inspection[J]. Mod. Food,2016(7):68-69.
[37] 李赟. 生物技术在食品检测方面的应用研究[J]. 现代食品,2016(7):97-98.
LI Y. Research on the application of biotechnology in food inspection[J]. Mod. Food,2016(7):97-98.
[38] WANG Z,HU J,JIN Y,et al.amplified chemiluminescent detection of DNA and immunoassay of IgG using special-shaped gold nanoparticles as label[J]. Clin. Chem.,2006,52(10):1958-1961.
[39] WANG M J,SUN C Y,WANG L Y,et.al Electrochemical detection of DNA immobilized on gold colloid particles modified self-assembled monolayer electrode with silver nanoparticle label[J]. Pharm. Biomed. Anal.,2002,33(5):1117-1125.
[40] CHEN D,FENG H B,Li J H. Graphene oxide:preparation,functionalization,and electrochemical applications[J]. Chem. Rev.,2012,112(11):6027-6053.
[41] MIRKIN C A,LETSINGER R L,MUCIC R C,et al. A DNA-based method for rationally assembling nanoparticles into macroscopic materials[J]. Nature,1996,382(6592):607-609.
[42] LIU J,LU Y. A colorimetric lead biosensor using dnazyme-directed assembly of gold nanoparticles[J]. J. Am. Chem. Soc.,2003,125(22):6642-6643.
[43] LIU C W,HSIEH Y T,HUANG C C,et al. Detection of mercury (Ⅱ)based on Hg2+–DNA complexes inducing the aggregation of gold nanoparticles[J]. Chem. Commun.,2008,19:2242-2244.
[44] SHARMA J,CHHABRA R,YAN H,et al. pH-driven conformational switch of “i-motif” DNA for the reversible assembly of gold nanoparticles[J]. Chem. Commun.,2007,5:477-479.
[45] PAVLOV V,XIAO Y,SHLYAHOVSKY B,et al. Aptamer-functionalized au nanoparticles for the amplified optical detection of thrombin[J]. J. Am. Chem. Soc.,2004,126(38):11768-11769.
[46] 田丹碧,张卫,汤燕,等. 纳米金生物共轭探针在酶活检测中的应用[J]. 化学进展,2014,27(2/3):267-274.
TIAN D B,ZHANG W,TANG Y,et al. Bioconjugate probe for enzyme activity based on gold nanopparrticles[J]. Prog. Chem.,2014,27(2/3):267-274.
[47] 郭建伟,刘雪刚,丁一刚,等. 金纳米制备及催化进展[J]. 化工进展,2010,29(11):2095-2102.
Guo J W,LIU X G,DING Y G,et al. Progress in nano-gold preparation and catalysis[J]. Chem. Ind. Eng. Prog.,2010,29(11):2095-2102.
[48] CHEN Y M,YU C J,CHENG T L,et al. Colorimetric detection of lysozyme based on electrostatic interaction with human serum albumin-modified gold nanoparticles[J]. Langmuir,2008,24(7):3654-3660.
[49] TAN Y N,SU X,LIU E T,et al. Gold-nanoparticle-based assay for instantaneous detection of nuclear hormone receptor response elements interactions[J]. Anal. Chem.,2010,82(7):2759-2765.
[50] LEE H,JOO S W,LEE S Y,et al. Colorimetric genotyping of single nucleotide polymorphism based on selective aggregation of unmodified gold nanoparticles[J]. Biosens. Bioelectron.,2010,26(2):730-735.
[51] WOO J R,LIM D K,NAM J M. Minimally stable nanoparticle‐based colorimetric assay for simple,rapid,and sensitive antibody structure and activity evaluation[J]. Small,2011,7(5):648-655.
[52] JEFFREY C. Simple and rapid colorimetric enzyme sensing assays using non-crosslinking gold nanoparticle aggregation[J]. Chem. Commun.,20007,36:3729-3731.
[53] JIANG T,LIU R,HUANG X,et al. Colorimetric screening of bacterial enzyme activity and inhibition based on the aggregation of gold nanoparticles[J]. Chem. Commun.,2009,15:1972-1974.
[54] ZAYATS M,BARON R,POPOV I,et al. Biocatalytic growth of au nanoparticles:from mechanistic aspects to biosensors design[J]. Nano Lett.,2005,5(1):21-25.
[55] SCAMPICCHIO M,WANG J,BLASCO A J,et al. Nanoparticle-based assays of antioxidant activity[J]. Anal. Chem.,2006,78(6):2060-2063.
[56] LI X X,CAO C,HAN S J,et al. Detection of pathogen based on the catalytic growth of gold nanocrystals[J]. Water Res.,2009,43(5):1425-1431.
[57] SCAMPICCHIO M,ARECCHI A,MANNINO S. Optical nanoprobes based on gold nanoparticles for sugar sensing[J]. Nanotechnology,2009,20:135501-135506.
[58] SASTRY M,LALA N,PATIL V,et al. Optical absorption study of the biotin-avidin interaction on colloidal silver and gold particles[J]. Langmuir,1998,14(15):4138-4142.
[59] LEE J S,LYTTONJEAN A K,HURST S J,et al. Silver nanoparticle-oligonucleotide conjugates based on DNA with triple cyclic disulfide moieties[J]. Nano Lett.,2007,7(7):2112-2115.
[60] WEI H,CHEN C,HAN B,et al. Enzyme colorimetric assay using unmodified silver nanoparticles[J]. Anal. Chem.,2008,80(18):7051-7055.
[61] DELLAPELLE F,GONZLEZ M C,SERGI M,et al. Gold nanoparticles-based extraction-free colorimetric assay in organic media:an optical index for determination of total polyphenols in fat-rich samples[J]. Anal. Chem.,2015,87(13):6905-6911.
[62] QIN W,SU L,YANG C,et al. Colorimetric detection of sulfite in foods by a TMB-O2-Co3O4nanoparticles detection system[J]. J. Agric. Food Chem.,2014,62(25):5827-5834.
[63] QIAN J,YANG X,JIANG L,et al. Facile preparation of Fe3O4nanospheres/reduced graphene oxide nanocomposites with high peroxidase-like activity for sensitive and selective colorimetric detection of acetylcholine[J]. Sens. Actuators B,2014,201:160-166.
[64] CASTILLO G,LAMBERTI I,MOSIELLO L,et al. Impedimetric DNA aptasensor for sensitive detection of ochratoxin a in food[J]. Electroanalysis,2012,24(3):512-520.
[65] RHOUATI A,YANG C,HAYAT A,et al. Aptamers:a promising tool for ochratoxin a detection in food analysis[J]. Toxins,2013,5(11):1988-2008.
[66] WANG L,MA W,CHEN W,et al. An aptamer-based chromatographic strip assay for sensitive toxin semi-quantitative detection[J]. Biosens. Bioelectro.,2011,26(6):3059-3062.
[67] WANG C,QIAN J,WANG K,et al. Colorimetric aptasensing of ochratoxin a using Au@Fe3O4nanoparticles as signal indicator and magnetic separator[J]. Biosens. Bioelectro.,2016,77:1183-1191.
[68] WENG Z,WANG H,VONGSVIVUT J,et al. Self-assembly of core-satellite gold nanoparticles for colorimetric detection of copper ions[J]. Anal. Chim. Acta.,2013,803:128-134.
[69] CHAIYO S,SIANGPROH W,APILUX A,et al. Highly selective and sensitive paper-based colorimetric sensor using thiosulfate catalytic etching of silver nanoplates for trace determination of copper ions[J]. Anal. Chim. Acta.,2015,866:75-83.
[70] ZHOU Y,DONG H,LIU L,et al. Selective and sensitive colorimetric sensor of mercury(Ⅱ)based on gold nanoparticles and 4-mercaptophenylboronic acid[J]. Sens. Actuators B,2014,196:106-111.
[71] D′SOUZA S L,PATI R K,KAILASA S K. Ascorbic acid functionalized gold nanoparticles as a probe for colorimetric and visual read-out determination of dichlorvos in environmental samples[J]. Anal. Methods,2014,6(22):9007-9014.
[72] WANG X D,YANG Y Y,DONG J,et al. Lanthanum-functionalized gold nanoparticles for coordination- bonding
recognition and colorimetric detection of methyl parathion with high sensitivity[J]. Sen. Actuators B,2014,204:119-124.
[73] XIONG D,LI H. Colorimetric detection of pesticides based on calixarene modified silver nanoparticles in water[J]. Nanotechnology,2008,19:465502-465507.
[74] LIANG M,FAN K,PAN Y,et al. Fe3O4magnetic nanoparticle peroxidase mimetic-based colorimetric assay for the rapid detection of organophosphorus pesticide and nerve agent[J]. Anal. Chem.,2012,85(1):308-312.
[75] MIAO Y,GAN N,LI T,et al. A colorimetric aptasensor for chloramphenicol in fish based on double-stranded DNA antibody labeled enzyme-linked polymer nanotracers for signal amplification[J]. Sen. Actuators B,2015,220:679-687.
[76] BORASE H P,PATIL C D,SALUNKHE R B,et al. Biofunctionalized silver nanoparticles as a novel colorimetric probe for melamine detection in raw milk[J]. Biotechnol. Appl. Biochem.,2015,62(5):652-662.
[77] DING N,YAN N,REN C,et al. Colorimetric determination of melamine in dairy products by Fe3O4magnetic nanoparticles-H2O2-abts detection system[J]. Anal. Chem.,2010,82(13):5897-5899.
Applicationof colorimetric sensor based nanomaterials in food detection
LÜ Jia,ZHANG Haochun,ZHANG Bing,GAO Wenchao,LI Xing,CHANG Honghong,WEI Wenlong
(College of Chemistry and Chemical Engineering,Taiyuan University of Technology,Taiyuan 030024,Shanxi,China)
Food testing as an important guarantee of food safety has attracted much attention in recent years. Especially,with simple,sensitive and accurate means and methods of food testing,it has been one of hot research topics. In this paper,basic content and testing method of food analysis were described. Furthermore,on the basis of introducing construction principle of two kinds of colorimetric sensor based on nanomaterials with enzyme activity and nanoparticles,the applications of those nanomaterials colorimetric sensors in food additives as well as biotoxin,chemical toxin and other contaminants detection were summarized,especially for metal ions,agricultural / veterinary drug residues and illegal additives and other chemical toxins. Finally,the development trends for colorimetric sensor in the future were prospected. Nano colorimetric sensors could visually detect various types of substances in food by the color changing of solution,which had high sensitivity,rapid response and amenable miniaturization advantages. In the future,these sensors should be strengthened in conjunction with such biocomposites and improved the stability,while achieved rapid and precision detection technology.
gold and silver nanoparticles;mimic enzyme nanomaterials;colorimetric sensors;food testing
O652
A
1000–6613(2017)01–0020–09
10.16085/j.issn.1000-6613.2017.01.003
2016-06-07;修改稿日期:2016-09-03。
太原理工大学青年基金(2015QN033)及国家自然科学基金青年基金(201605111)项目。
吕佳(1991—),女,硕士研究生,研究方向为电化学传感器的构建及应用。联系人:张冰,讲师,博士,主要研究领域为纳米传感器。E-mail:zhangbing01@tyut.edu.cn。

